Цитокиновый профиль у пациентов с гранулематозом с полиангиитом
Изучить связь экспрессии генов цитокинов в мононуклеарных клетках периферической крови (МПК) и содержания цитокинов в крови у больных гранулематозом с полиангиитом (ГПА) с течением и активностью заболевания.
В исследование были включены 60 больных ГПА, в том числе 21 мужчина и 39 женщин в возрасте от 18 до 80 лет (медиана – 50,5 лет). У 22 из них диагностирована локальная форма ГПА, у 38 – генерализованная. У 32 больных имелось обострение ГПА, у 28 – ремиссия заболевания. Экспрессию мРНК 11 цитокинов: интерферона (ИФН)-α, ИФН-γ, интерлейкина (ИЛ)-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-18, фактора некроза опухоли (ФНО)-α в МПК определяли методом ОТ-ПЦР у 57 больных ГПА и 40 здоровых доноров. У 40 из 60 больных ГПА определяли содержание ИФН-α, ИЛ-1β, ИЛ-8, ИЛ-18, ФНО-α в сыворотке крови методом иммуноферментного анализа.
У больных ГПА (как с локальной, так и с генерализованной формами) выявили статистически значимую (p<0,05) активацию синтеза мРНК ИФН-α, ИЛ-8 и подавление синтеза на уровне транскрипции ИЛ-12 и ФНО-α по сравнению со здоровыми добровольцами. У пациентов с обострением и ремиссией ГПА выявлены идентичные изменения кспрессии генов цитокинов в МПК. У больных с обострением ГПА определялась активация экспрессии гена ИЛ-18 по сравнению с таковой у здоровых добровольцев. У больных с обострением ГПА концентрация ИЛ-8 в сыворотке крови была достоверно выше (p<0,01), чем у пациентов с ремиссией заболевания. У больных с генерализованной формой заболевания уровень ИЛ-18 был достоверно выше, чем у пациентов с локальной формой заболевания.
ИЛ-8, по-видимому, играет роль в развитии обострения ГПА, однако определение ИЛ-8 в сыворотке больных нельзя использовать для оценки активности, учитывая невысокие чувствительность и специфичность данного показателя. Продукция ИЛ-18 была повышена почти у половины обследованных больных и ассоциировалась с генерализацией заболевания.
Гранулематоз с полиангиитом (ГПА) – это системный васкулит, характеризующийся развитием гранулематозного воспаления и некротизирующего васкулита мелких сосудов с преимущественным поражением верхних дыхательных путей, легких и почек [1]. В сыворотке крови больных обнаруживают антитела к цитоплазме нейтрофилов (АНЦА), реагирующие с несколькими лизосомальными ферментами нейтрофилов и лейкоцитов (особенно с протеиназой 3) [2]. Выделяют локальный (поражение верхних дыхательных путей, органа зрения и слуха) и генерализованный (поражение верхних дыхательных путей, органа зрения и слуха в сочетании с поражением легких и/или почек, а также желудочно-кишечного тракта, нервной системы, кожи) варианты ГПА [3]. В последние годы отмечается тенденция к увеличению числа больных ГПА, что может отражать не только улучшение долгосрочного прогноза в результате иммуносупрессивной терапии, но и истинный рост заболеваемости [4,5].
В основе развития ГПА лежат разнообразные нарушения клеточного и гуморального иммунитета [1]. Клинические и экспериментальные данные свидетельствуют о том, что АНЦА играют важную роль в патогенезе системных васкулитов. Они связываются с антигенами, экспрессирующимися нейтрофилами (и моноцитами), вызывают их активацию и воспалительный ответ, который в конечном итоге приводит к некротическим изменениям стенки сосудов и окружающих тканей. Определение роли цитокинов в патогенезе иммунопатологического процесса у больных ГПА представляет особый интерес в связи с возможностью применения генно-инженерных биологических препаратов для индукционной и поддерживающей терапии.
Целью исследования было изучение экспрессии генов цитокинов в мононуклеарных клетках периферической крови и содержания цитокинов в крови у больных ГПА и их связи с течением и активностью заболевания.
| Показатель | Значение |
|---|---|
| Примечание: СКФ – скорость клубочковой фильтрации, СРБ – С-реактивный белок | |
| Биопсия, n (%) | 46 (76,7) |
| АНЦА +, n (%) | 36 (60,0) |
| АНЦА к протеиназе 3, n (%) | 10 (16,7) |
| АНЦА к миелопероксидазе, n (%) | 9,84±20,12 |
| Титр АНЦА, ед/л | 33 (55,0) |
| Поражение органа зрения, n (%) | 29 (48,33) |
| Поражение органа слуха, n (%) | 57 (95,0) |
| Поражение носа и придаточных пазух, n (%) | 35 (58,3) |
| Поражение легких, n (%) | 28 (46,7) |
| Поражение почек, n (%) | 25 (41,7) |
| СКФ менее 60 мл/мин/1,73 м 2 , n (%) | 10 (16,7) |
| Протеинурия более 0,5 г/сут, n (%) | 1,29±1,06 |
| Сывороточный креатинин, мг/дл | 14 (23,3) |
| Гематурия, n (%) | 23 (38,3) |
| Протеинурия, n (%) | 29 (48,3) |
| Повышение COЭ, n (%) | 18,02±16,84 |
| СОЭ, мм/ч | 18,02±16,84 |
| Повышение содержания СРБ, n (%) 40 (66,7) | 13 (21,7) |
Материал и методы
В исследование включали пациентов с ГПА, установленным в соответствии с критериями Американской коллегии ревматологов 1990 года и номенклатурой, принятой в 2012 году на конференции в Чапел-Хилл (США). Для оценки активности использовали шкалу BVAS (Бермингемский индекс активности васкулита). Ремиссией заболевания считали наличие 1 и менее баллов по шкале BVAS, обострением ГПА – 2 и более баллов. У всех больных оценивали тяжесть необратимого поражения внутренних органов и тканей с помощью индекса VDI (Vasculitis Damage Index).
Экспрессию мРНК цитокинов, в том числе интерферона (ИФН)-α, ИФН-γ, интерлейкина (ИЛ)-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-18, фактора некроза опухоли (ФНО)-α, в мононуклеарных клетках периферической крови определяли с помощью методов обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР). РНК выделяли методом кислой гуанидин тиоцианат-фенол-хлороформной экстракции [6]. Обратная транскрипция и ПЦР-амплификация были выполнены в соответствии с методикой, предложенной С. Gelder [7]. В качестве положительного контроля использовали β-актин. Регистрацию результатов ПЦР осуществляли электрофоретически в 1% агарозном геле, окрашенным бромистым этидием. Для идентификации нуклеотидных последовательностей использовали маркер для электрофореза фирмы Promega (G 1758) [8].
Содержание цитокинов в крови определяли методом иммуноферментного анализа (ИФА) с использованием тест-систем ООО “Вектор-Бест Европа”, Москва.
Статистический анализ проводили с использованием программы Statistica версии 10.0. Учитывая, что результаты исследования с использованием метода ОТ-ПЦР представляют собой качественные показатели, оценку значимости различий в группах проводили с использованием непараметрического критерия Манна-Уитни. Для обработки результатов определения цитокинов с помощью ИФА применяли непараметрические методы статистического анализа, а именно критерий Вальда-Вольфовица и критерий Колмогорова-Смирнова. Различия средних величин считали статистически значимыми при р<0,05.
Результаты
В исследование были включены 60 больных, в том числе 21 мужчина и 39 женщин в возрасте от 18 до 80 лет (медиана – 50,5 лет), с диагнозом ГПА. У 22 из них диагностирована локальная форма ГПА, у 38 – генерализованная. Индекс VDI составил 11,35±5,06. На основании шкалы BVAS у 32 больных диагностировано обострение ГПА, у 28 – ремиссия заболевания. Все пациенты на момент исследования получали иммуносупрессивную терапию, в том числе глюкокортикостероидами – 56 (93,3%), циклофосфамидом – 24 (40,0%), метотрексатом – 11 (18,3%), азатиоприном – 9 (15,0%), микофенолата мофетилом – 1 (1,7%) или ритуксимабом – 3 (5%). Клинико-лабораторная характеристика представлена в табл. 1.
Исследование нарушений синтеза цитокинов на уровне транскрипции. Экспрессию мРНК цитокинов в мононуклеарных клетках периферической крови определяли методом ОТ-ПЦР у 57 больных ГПА и 40 здоровых доноров. У больных ГПА выявили статистически значимую (p<0,05) активацию синтеза мРНК ИФН-α, ИЛ-8 и подавление синтеза на уровне транскрипции ИЛ-12 и ФНО-α. Статистически значимые изменения экспрессии мРНК указанных цитокинов по сравнению с контролем определялись у пациентов как с локальным, так и генерализованным вариантами ГПА, в то время как достоверная разница цитокинового профиля между двумя группами больных отсутствовала (табл. 2).
| Цитокин | Все больные (n=57) | Локальный ГПА (n=22) | Генерализованный ГПА (n=35) | Обострение ГПА (n=29) | Ремиссия ГПА (n=28) | Контроль (n=40) |
|---|---|---|---|---|---|---|
| Примечание: *p<0,05, **p<0,01, ***p<0,001 по сравнению с контролем (метод Манна-Уитни) | ||||||
| ИФН-α | 23 (40,35)* | 8 (36,36)* | 15 (42,85)** | 14 (48,27)** | 9 (32,14)* | 1 (2,5) |
| ИФН-γ | 10 (17,54) | 2 (9,09) | 8 (22,85) | 5 (17,24) | 5 (17,85) | 12 (30,0) |
| ИЛ-1β | 27 (47,36) | 11 (50,0) | 16 (45,71) | 13 (44,82 | 14 (50,0) | 14 (35,0) |
| ИЛ-2 | 8 (14,03) | 2 (9,09) | 6 (17,14) | 4 (13,79) | 4 (14,28) | 0 |
| ИЛ-4 | 3 (5,26) | 1 (4,54) | 2 (5,71) | 1 (3,44) | 2 (7,14) | 0 |
| ИЛ-6 | 17 (29,82) | 4 (18,18) | 13 (37,14) | 9 (31,03) | 8 (28,57) | 8 (20,0) |
| ИЛ-8 | 25 (43,85)* | 11 (50,0)** | 14 (40,0)* | 14 (48,27)** | 11 (39,28)* | 4 (10,0) |
| ИЛ-10 | 14 (24,56) | 7 (31,81) | 7 (20,0) | 7 (24,13) | 7 (25,0) | 8 (20,0) |
| ИЛ-12 | 3 (5,26)** | 2 (9,09)*** | 1 (2,85)*** | 2 (6,89)*** | 1 (3,57)*** | 28 (70,0) |
| ИЛ-18 | 30 (52,63) | 12 (54,54) | 18 (51,42) | 19 (65,51)* | 11 (39,28) | 12 (30,0) |
| ФНО-α | 17 (29,82)** | 5 (22,72)*** | 12 (34,28)** | 10 (34,48)** | 7 (25,0)*** | 30 (75,0) |
Исследование нарушений продукции цитокинов. У 40 из 60 больных ГПА определяли содержание 5 цитокинов в сыворотке крови методом ИФА. Содержание ИЛ-1β было повышено у 50% пациентов, ИЛ-18 – у 45%, ИЛ- 8 – у 35%, ФНО-α – у 15% и ИФН-α – у 17,5%. Средние концентрации ИФН-α, ИЛ-1β, ИЛ-8 и ИЛ-18 в крови пациентов с ГПА превышали референсные значения указанных цитокинов (табл. 3). У больных с обострением ГПА концентрация ИЛ-8 в сыворотке крови была достоверно выше (p<0,01), чем у пациентов с ремиссией заболевания (табл. 4).
| Цитокин | Повышение содержания, n (%) | М±SD, пг/мл | Референсные значения |
|---|---|---|---|
| ИФН-α | 7 (17,5) | 9,59±11,58 | ≤5 |
| ИЛ-1β | 20 (50,0) | 58,56±89,58 | 1-11 |
| ИЛ-8 | 14 (35,0) | 14,15±32,23 | 2-10 |
| ИЛ-18 | 18 (45,0) | 335,7±270,82 | 90-260 |
| ФНО-α | 6 (15,0) | 6,86±18,28 | 1-6 |
Для определения возможности использования ИЛ-8 в качестве маркера обострения ГПА, была определена специфичность и чувствительность данного цитокина с помощью ROC анализа. При концентрации данного биомаркера более 6,3 пг/мл оптимальные значения чувствительности и специфичности составили 65,2% и 64,7%, соответственно, а площадь под ROC-кривой – 0,54 (рис. 1).
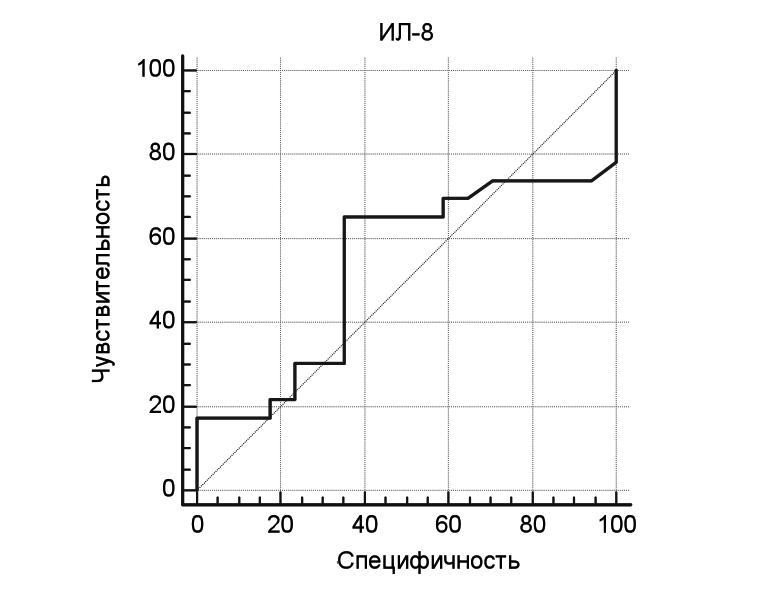
| ИЛ-8, пг/мл | Чувствительность, % | Специфичность, % |
|---|---|---|
| >5,7 | 65,22 | 41,18 |
| >6,3 | 65,22 | 64,71 |
| >9,4 | 30,43 | 64,71 |
| >11,3 | 30,43 | 76,47 |
У больных с генерализованной формой заболевания уровень ИЛ-18 был достоверно выше, чем у пациентов с локальной формой заболевания (табл. 4). Чувствитель ность и специфичность ИЛ-18 как маркера генерализации заболевания у больных с ГПА также определяли с помощью ROC-анализа. При концентрации данного биомаркера более 258,5 пг/мл оптимальные значения чувствительности и специфичности составили 60,9% и 82,4%, соответственно, площадь под ROC-кривой – 0,627 (рис. 2)
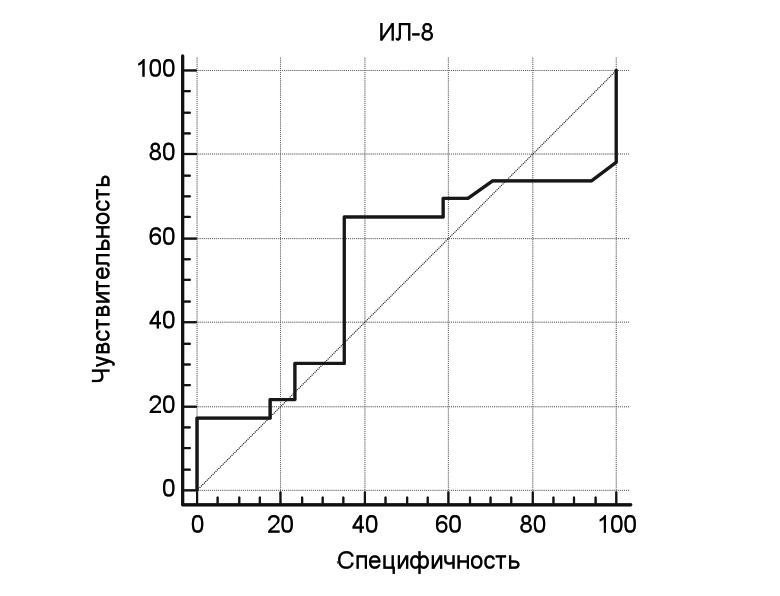
| ИЛ-8, пг/мл | Чувствительность, % | Специфичность, % |
|---|---|---|
| >172,1 | 60,87 | 41,18 |
| >258,5 | 60,87 | 82,35 |
| >298,8 | 43,48 | 82,35 |
| >331,2 | 43,48 | 88,24 |
| Цитокины | Обострение ГПА (n=23) | Ремиссия ГПА (n=17) | Локальный ГПА (n=17) | Генерализованный ГПА (n=23) |
|---|---|---|---|---|
| Примечание: *p<0,05 между группами пациентов с обострением и ремиссией ГПА (метод Вальда-Вольфовитца). ** (p<0,05) между груп- пами пациентов с локальным и генерализованным ГПА (метод Колмогорова-Смирнова). | ||||
| ИФН-α | 11,03±12,14 | 7,63±10,84 | 8,08±6,87 | 10,7±14,16 |
| ИЛ-1β | 74,84±104,01 | 36,54±61,53 | 49,22±77,2 | 65,47±98,85 |
| ИЛ-8 | 18,53±42,2* | 8,24±4,22* | 8,08±3,79 | 18,64±42,20 |
| ИЛ-18 | 359,24±293,66 | 303,86±241,52 | 237,75±142,75** | 408,09±319,86 |
| ФНО-α | 11,2±23,5 | 1,0±0,0 | 1,24±0,99 | 11,02±23,56 |
Обсуждение
При изучении экспрессии мРНК цитокинов в мононуклеарных клетках периферической крови у больных ГПА выявили статистически значимые изменения транскрипции генов ИФН-α, ИЛ-8, ФНО-α и ИЛ-12. Качественное определение мРНК с использованием ОТ-ПЦР представляет собой скрининговый метод, который позволяет изучить изменение транскрипции достаточно широкого спектра цитокинов, поэтому на следующем этапе определяли содержание в сыворотке крови ИФН-α, ИЛ-8 и ФНО-α методом ИФА. Дополнительно оценивали продукцию ИЛ-1β – главного медиатора местной воспалительной реакции и остро- фазового ответа, а также ИЛ-18. D. Novick и соавт. показали, что ИЛ-18 играет важную роль в патогенезе ГПА [9]. Этот провоспалительный цитокин, обладаю- щий плейотропными эффектами, участвует в процессе инфильтрации тканей иммунокомпетентными клетками, стимулируя экспрессию молекул адгезии [10-11].
Имеются данные о повышении его концентрации у больных с обострением ГПА [12].
ИФН-α обладает неспецифической противовирусной активностью [13] и может активировать естественные киллеры и цитотоксические Т-лимфоциты [14]. При выраженной стимуляции синтеза ИФН-α отмечается снижение продукции ИЛ-12 и ИФН-γ естественными киллерными (NK) клетками [15]. При анализе экспрессии генов цитокинов в периферических мононуклеарах, в состав которых входят моноциты и лимфоциты, в том числе NK-клетки, у больных ГПА было выявлено угнетение синтеза мРНК ИЛ-12 и ИФН-γ. Это позволяло предположить непосредственное участие периферических мононуклеаров в патогенезе ГПА за счет развития цитотоксичности, которая осуществляется как цитотоксическими Т-лимфоцитами, так и NK-клетками. Цитотоксические Т-лимфоциты специфически распознают определенный антиген и могут связываться только с теми клетками, в которых имеется главный комплекс гистосовместимости (MHC). NK-клетки могут связываться с клеткой даже при отсутствии MHC. Таким образом, эффекты клеток двух типов дополняют друг друга. Однако доля больных ГПА с повышенным содержанием ИФН-α в сыворотке крови была невысокой (17,5%), что не подтверждало данный тип иммунного реагированиия.
В экспериментальном исследовании ФНО-α индуцировал экспрессию протеиназы 3 на поверхности полиморфноядерных лейкоцитов у больных ГПА [16]. Однако ингибиторы ФНО оказались неэффективными в лечении ГПА [17]. В нашем исследовании экспрессия мРНК ФНО-α в периферических мононуклеарах больных ГПА была достоверно снижена по сравнению с 42 таковой у здоровых добровольцев, а повышение продукции этого цитокина определялось только у 6 (15%) больных. Таким образом, роль ФНО-α в патогенеза ГПА требует дальнейшего изучения.
ИЛ-8 способен повышать адгезивность нейтрофилов и вызывать повышение экспресии молекулы адгезии-1. ИЛ-8 стимулирует транслокацию протеиназы 3 на поверхность нейтрофилов, тем самым обеспечивая большую вероятность связывания протеиназы 3 с АНЦА [18,19]. Известно, что АНЦА стимулируют выработку ИЛ-8 как моноцитами, так и нейтрофилами [20,21]. Выявленное нами достоверное повышение экспрессии гена ИЛ-8 по сравнению с таковой у здоровых добровольцев подтверждает, что у больных ГПА стимулирована выработка данного цитокина в перифериче- ских мононуклеарах. У 14 (35%) обследованных больных определяется повышенная концентрация ИЛ-8 в сыворотки крови. В предыдущих исследованиях также отмечено повышение уровня хемокинов, вызывающих увеличение относительного содержания нейтрофилов в крови [22,23], в сыворотке больных ГПА и повышение хемокинового лиганда (CXCL8) в клубочках почек больных с обострением ГПА [24,20]. Концентрация ИЛ-8 коррелировала с активностью заболевания [25], хотя данный цитокин обнаруживали в повышенных концентрациях у больных как с обострением, так и с ремиссией ГПА [26]. У обследованных нами больных с обострением ГПА концентрация ИЛ-8 была достоверно выше (p<0,01), чем у пациентов с ремиссией заболевания. Можно предположить, что ИЛ-8 является важным участником патогенеза ГПА, а также играет роль в развитии обострения данного заболевания. Однако ROC- анализ показал невысокие чувствительность и специфичность определения концентрации ИЛ-8 в сыворотке крови в качестве маркера обострения ГПА.
ИЛ-1β, выделяющийся моноцитами, макрофагами, дендритными клетками, астроцитами, фибробластами, NK-клетками, кератиноцитами и эндотелиальными клетками, является главным медиатором развития местной воспалительной реакции и острофазового ответа [15]. Повышение концентрации этого цитокина у половины пациентов с ГПА может указывать на его участие в патогенезе заболевания. За счет конститутивной экспрессии своих рецепторов ИЛ-1β очень быстро активирует практически все типы клеток, участвующих в формировании локальной воспалительной реакции, включая фибробласты, эндотелиальные клетки, резидентные макрофаги и все типы лейкоцитов крови. ИЛ- 1β участвует в регуляции функций эндотелия и системы свертывания крови, индуцируя прокоагулянтную активность [15], усиливает функцию нейтрофилов и NK-клеток [27]. S. Borgmann и соавт. показали, что у пациентов с АНЦА-ассоциированным васкулитом с поражением почек повышен риск развития терминальной хронической почечной недостаточности при наличии высокой секреции ИЛ-1β и низкой экспрессии антагониста рецептора ИЛ-1β [28].
ИЛ-18 представляет собой провоспалительный цитокин, который относится к семейству ИЛ-1. Он обладает плейотропными эффектами в отношении многих типов клеток и влияет на секрецию различных медиаторов. Имеются данные как о провоспалительной, так и противовоспалительной активности ИЛ-18, который сдвигает баланс цитокинов в пользу клеточного иммунитета, стимулируя продукцию ИФН-γ, ФНО-α и ИЛ-2 [29]. Кроме того, ИЛ-18 индуцирует созревание наивных CD4+ лимфоцитов в ИЛ-4 продуцирующие клетки in vitro [30]. ИЛ-18 вырабатывается макрофагами, поэтому повышение его содержания может говорить об активации макрофагального звена иммунитета [29]. По мнению D. Novick и соавт. повышение уровня ИЛ-18 и ИЛ-18 связывающего белка у больных с обострением ГПА может указывать на определенную роль данных маркеров в патогенезе ГПА [31]. В нашем исследовании у больных с обострением ГПА экспрессия гена ИЛ-18 была достоверно повышена по сравнению с таковой у здоровых добровольцев. Продукция ИЛ-18, которую определяли методом ИФА, была повышена у 18 (45%) больных ГПА. У пациентов с генерализованной форму ГПА она была достоверно выше, чем у пациентов с локальной формой заболевания. Для оценки возмож - ности использования ИЛ-18 в качестве биомаркера генерализации ГПА был проведен ROC-анализ. Оптимальные значения чувствительности и специфичности метода установлены при концентрации ИЛ-18 более 258,5 пг/мл и составили 60,9% и 82,4%, соответственно. Площадь под ROC-кривой равнялась 0,627. Таким образом, повышение концентрации ИЛ-18 характеризовалось приемлемой чувствительностью и высокой специфичностью в оценке генерализации ГПА.
Преимуществом нашего исследования было определение экспрессии генов и продукции широкого спектра цитокинов у пациентов с локальным и генерализованным вариантами ГПА, в том числе с обострением и ремиссией заболевания. Однако число обследованных пациентов было относительно небольшим, поэтому для подтверждения полученных данных необходимы дополнительные исследования. Следует учитывать, что все пациенты получали иммуносупрессивную терапию, которая могла отразиться на результатах анализа цитокинового профиля. Представляет также интерес определение продукции цитокинов в динамике, например, после индукционной терапии у пациентов с обострением ГПА.
Заключение
В мононуклеарных клетках периферической крови больных ГПА по сравнению со здоровыми добровольцами активируется экспрессия гена ИЛ-8, ответствен- ного за хемотаксис нейтрофилов, а также ИФН-α, осуществляющего неспецифическую противовирусную защиту. При обострении ГПА в мононуклеарных клетках происходит активация синтеза мРНК ИЛ-18 – цитокина, обладающего плейотропными эффектами и участвующего в развитии клеточного, гуморального и макрофагального звеньев иммунитета. У половины больных ГПА была повышена продукция ИЛ-1β, которая отражает развитие местной воспалительной реакции и острофазового ответа. Показано, что ИЛ-8 является важным участником патогенеза ГПА, а также играет роль в развитии обострения данного заболевания. Однако определение ИЛ-8 в сыворотке больных нельзя использовать для оценки активности ГПА, учитывая невысокие чувствительность и специфичность данного показателя. Продукция ИЛ-18 также была повышена почти у половины обследованных больных и ассоциировалась с генерализацией заболевания.
Используемые источники
- Семенкова Е.Н. Системные некротизирующие васкулиты. Издательский дом “Русский врач” 2001:48-49
- Новиков П.И., Семенкова Е.Н., Моисеев С.В. Современная номенклатура системных васкулитов. Клин фармакол тер 2013;22(1):70-4
- Моисеев С.В., Новиков П.И., Мешков А.Д., Иваницкий Л.В. АНЦА-ассо- циированные васкулиты: спорные вопросы классификации, диагностики и оценки активности и современные подходы к лечению. Клин фармакол тер 2014;(23)1:44-50.
- Scott DG, Watts RA. Epidemiology and clinical features of systemic vasculitis. Clin Exp Nephrol 2013;17(5):607-10.
- Herlyn K, Buckert F, Gross WL, Reinold-Keller E. Doubled prevalence rates of ANCA-associated vasculitides and giant cell arteritis between 1994 and 2006 in northern Germany. Rheumatology (Oxford) 2014;53(5):882-9.
- Chomczynski P, Cacchi N. Single-step method of RNA isolation by acid guani- dinium thiocyanate-phenol-chloroform extraction. Analit Biochem 1987;162: 156-9.
- Gelder C, Thomas P, Yates D, et al. Cytokine expression in normal, atopic, and asthmatic subjects using the combination of sputum induction and the polymerase chain reaction. Thorax 1995;50:1033-7.
- Ершов Ф.И., Мезенцева М.В., Васильев А.Н. и др. Методические указания по проведению доклинических исследований цитокин-индуцирующей активности антивирусных препаратов. Ведомости научного центра экспер- тизы и государственного контроля лекарственных средств 2002;1(9):2629.
- Novick D, Elbirt D, Dinarello CA, et al. Interleukin-18 binding protein in the sera of patients with Wegener's granulomatosis. J Clin Immunol 2009;29(1):38-45.
- Merendino RA, Di Pasquale G, Sturniolo GC, et al. Relationship between IL 18 and sICAM 1 serum levels in patients affected by coeliac disease: preliminary con- siderations. Immunol Lett 2003;85:257-60.
- Morel JC, Park CC, Zhu K, et al. Signal transduction pathways involved in rheumatoid arthritis synovial fibroblast interleukin 18 induced vascular cell adhe- sion molecule 1 expression. J Biol Chem 2002;277:34679-91.
- Якушенко Е.В., Лопатникова Ю.А., Сенников С.В. Интерлейкин 18 и его роль в иммунном ответе. Мед иммунология 2005;7(4):355-364.
- Иммунология. Под редакцией Р.М. Хаитова. ГЭОТАР-Медиа 2009: 320 стр.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). ГЭОТАР-Медиа 2005: 42.
- Кетлинский С.А., Симбирцев А.С. Цитокины. ООО “Издательство Фо - лиант” 2008: 552 стр.
- Hattar K, Oppermann S, Ankele C, et al. c-ANCA-induced neutrophil-mediated lung injury: a model of acute Wegener's granulomatosis. Eur Respir J 2010; 36(1):187-195.
- Wegener's Granulomatosis Etanercept Trial (WGET) Research Group. Etanercept plus standard therapy for Wegener's granulomatosis. N Engl J Med 2005;352(4): 351-61.
- Schmekel B, Karlsson SE, Linden M, et al. Myeloperoxidase in human lung lavage. I. A marker of local neutrophil activity. Inflammation 1990;14:447–54.
- Kettritz R, Jennette JC, Falk RJ. Crosslinking of ANCA-antigens stimulates superoxide release by human neutrophils. J Am Soc Nephrol 1997;8:386–94.
- Cockwell P, Brooks CJ, Adu D, et al. Interleukin-8: a pathogenetic role in anti- neutrophil cytoplasmic autoantibody-associated glomerulonephritis. Kidney Int 1999;55:852–63.
- Borregaard N, Cowland JB. Granules of the human neutrophilic polymorphonu- clear leukocyte. Blood 1997;89:3503–21.
- Torheim EA, Yndestad A, Bjerkeli V, et al. Increased expression of chemokines in patients with Wegener’s granulomatosis – modulating effects of methylpred- nisolone in vitro. Clin Exp Immunol 2005;140:376–83.
- Ohta N, Fukase S, Aoyagi M. Serum levels of soluble adhesion molecules ICAM- 1, VCAM-1 and E-selectin in patients with Wegener’s granulomatosis. Auris Nasus Larynx 2001;28:311–4.
- Новиков П.И., Кривошеев О.Г., Семенкова Е.Н. Опыт использования моноклональных антител к рецепторам CD20 В-лимфоцитов (ритуксимаба) у больных с поражением почек при гранулематозе Вегенера. Тер архив 2011;83(11):70-6.
- Tomasson G, Lavalley M, Tanriverdi K, et al. Wegener’s Granulomatosis Eta ner - cept Trial (WGET) Research Group. Relationship between markers of platelet activation and inflammation with disease activity in Wegener's granulomatosis. J Rheumatol 2011;38(6):1048-54.
- Richter AG, Perkins GD, Chavda A, et al. Neutrophil chemotaxis in granulo- matosis with polyangiitis (Wegener's) and idiopathic pulmonary fibrosis. Eur Respir J 2011;38(5):1081-8.
- Воробьев А.А., Быков А.С., Караулов А.В. Иммунология и аллергология. Цветной атлас. Москва 2006: 52.
- Borgmann S, Endisch G, Hacker UT, et al. Proinflammatory genotype of interleukin-1 and interleukin-1 receptor antagonist is associated with ESRD in pro- teinase 3-ANCA vasculitis patients. Am J Kidney Dis 2003;41(5):933-42.
- Якушенко Е.В., Лопатникова Ю.А., Сенников С.В. Интерлейкин 18 и его роль в иммунном ответе. Медицинская иммунология 2005; 7(4): 355-364. ПОВТОР
- Hoshino T, Wiltrout RH, Young HA. IL 18 is a potent coinducer of IL 13 in NK and T cells: a new potential role for IL 18 in modulating the immune response. J Immunol 1999;162:5070-7.
- Novick D, Elbirt D, Dinarello CA, et al. Interleukin-18 binding protein in the sera of patients with Wegener's granulomatosis. J Clin Immunol 2009;29(1):38-45.
