Радикал-продуцирующая функция нейтрофилов у пациентов с АНЦА-ассоциированными васкулитами
Изучить нарушения радикал-продуцирующей функции нейтрофилов у пациентов с АНЦА-ассоциированными васкулитами.
У 40 пациентов с АНЦА-ассоциированными васкулитами определяли показатели ради калпродуцирующей функции нейтрофилов методом кинетической хемилюминесценции с математической обработкой кривой. Контрольную группу составила 50 практически здоровых доноров.
У пациентов с АНЦА-ассоциированным васкулитом выявлено увеличение внеклеточной и снижение внутриклеточной радикал-продуцирующей способности нейтрофилов. Величина показателей свободнорадикального дисбаланса и форма кривых отличались в зависимости от тяжести и течения заболевания.
У пациентов с АНЦА-ассоциированными васкулитами наблюдаются нарушения радикал-продуцирующей функции нейтрофилов, которые могут иметь значение для прогнозирования течения заболевания
Вгруппу системных васкулитов, ассоциированных с антителами к цитоплазме нейтрофилов (АНЦА), входят гранулематоз с полиангиитом (Вегенера; ГПА), микроскопический полиангиит (МПА), эозинофильный гранулематоз с полиангиитом (ЭГПА) [1,2]. АНЦА-ассоциированные системные васкулиты характеризуются тяжелым течением, неблагоприятным прогнозом и высокой смертностью. В последнее время в структуре смертности, наряду с агрессивным течением васкулита, отмечается тенденция к увеличению доли инфекционных осложнений [3].
Главная мишень аутоиммунного ответа при АНЦАассоциированных васкулитах – нейтрофилы, в результате чего страдает их радикал-продуцирующая функция [4,5]. Одним из надежных методов ее оценки является хемилюминесценция, активированная различными стимулами. Ранее был предложен метод, предполагающий двухэтапную стимуляцию фагоцитов крови и оценку различных параметров радикал-продуцирующей функции в том числе интенсивности спонтанного ответа, праймированного ответа, стимулированного ответа, коэффициентов активации и затухания [6]. Альтернативой этому методу может служить кинетическая хемилюминесценция с математической обработкой кривой, позволяющей объективизировать анализ полученных данных и выявить новые параметры, описывающие этот сложный процесс.
Целью исследования было изучение нарушений радикал-продуцирующей функции нейтрофилов у па циентов с АНЦА-ассоциированными васкулитами.
Материал и методы
В проспективное исследование включали пациентов с АНЦА-ассоциированным васкулитом, соответствовавшим критериям Американской коллегии ревматологов и рекомендациям конференции в Чапел-Хилле (2012). Все пациенты подписали информированное согласие на участие в исследовании. Группу сравнения составили 50 практически здоровых доноров.
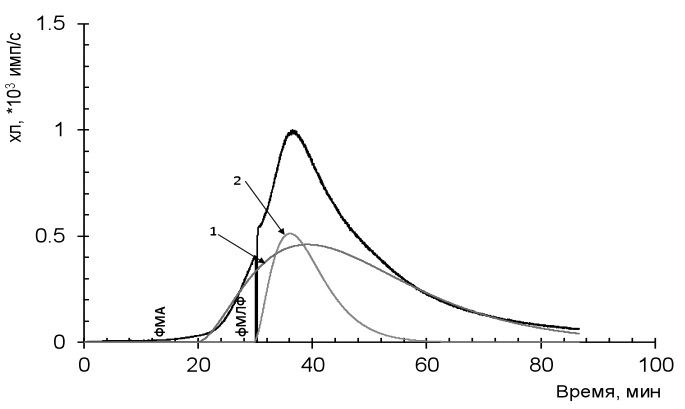
Оценку функциональной активности нейтрофильного звена лейкоцитов проводили методом хемилюминесценции с двойной последовательной стимуляцией. Этот подход основан на регистрации динамики свечения нейтрофилов, последовательно стимулированных двумя веществами с разным механизмом действия [7]. На первом этапе нейтрофилы стимулировали форбол-12-миристат-13-ацетатом (ФМА) с внутриклеточным механизмом действия, на втором этапе проводили стимуляцию формил-метионил-лейцил-фенилаланином (фМЛФ), который обладает внеклеточным механизмом действия. Двойная стимуляция приводит к максимально полному ответу нейтрофилов и, следовательно, к улучшению чувствительности и точности получаемых результатов (рис. 1). Определяли удельную базальную активность нейтрофила, коэффициент затухания (A2/A1) и величину ответа на стимул по площади за 30 минут после добавления фМЛФ. Полученные данные сравнивали с контролем [8].
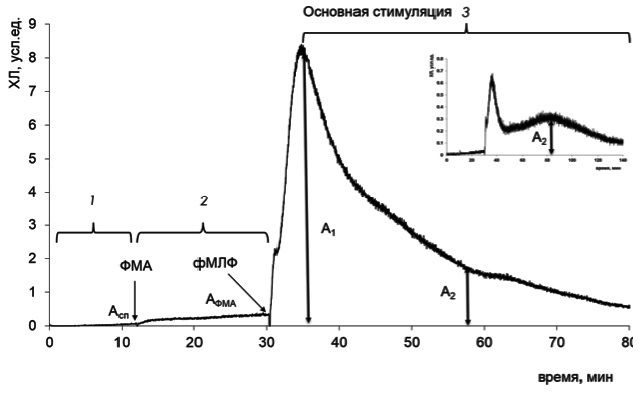
С целью уточнения способности нейтрофилов к внутрии внеклеточной продукции активных форм кислорода (АФК) использовали метод математического моделирования кривой кинетической хемилюминесценции с помощью программного модуля на базе платформы LabView (разработчик А.Ю. Рябов), который позволяет разложить итоговый контур на экспоненциально-квадратичные состав ляющие.
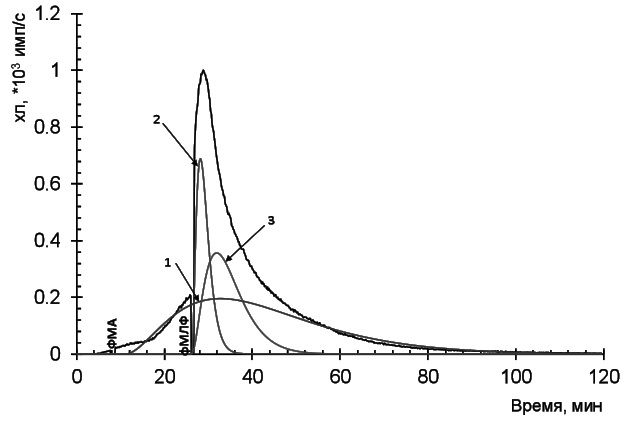
Кинетическую кривую раскладывали на три контура (рис. 2):- ФМА-индуцированная продукция АФК (1),
- "быстрая" вспышка фМЛФ-индуцированной кривой, возможно, вызванная продукцией АФК цитоплазматической НАДФН-оксидазой (2),
- "медленная" вспышка, возможно, обусловленная внутриклеточной продукцией АФК (3). Для каждой составляющей рассчитывали светосумму за 3000 секунд (S1, S2, S3). Метод наглядно демонстрирует вклад различных источников продукции АФК в нейтрофилах.
Статистическую обработку данных проводили с помощью программного пакета GraphPad Prisma 5.0. Результаты представлены в виде медианы и интерквартильного размаха. Для проверки гипотезы о нормальности распределения данных использовали критерий Шапиро-Уилка (p>0,05). Для изучения связи между данными применяли коэффициент ранговой корреляции Спирмена. Коэффициент корреляции считали достоверным при p<0,05. Достоверность различия между группами определяли с помощью критерия Манна-Уитни. Различия считали статистически достоверными при уровне значимости p<0,05.
Результаты
В проспективное исследование были включены 40 больных с АНЦА-ассоциированными системными васкулитами. Среди них было 30 мужчин и 10 женщин в возрасте 18–80 лет. Гранулематоз с полиангиитом (ГПА) диагностировали у 27 пациентов, микроскопический полиангиит (МПА) – у 5, эозинофильный гранулематоз с полиангиитом (ЭГПА) – у 4. Все больные наблюдались в Клинике нефрологии, внутренних и профессиональных заболеваний имени Е.М. Тареева с 2012 по 2015 гг. На момент исследования у 9 больных определялась высокая активность системного васкулита (индекс BVAS 11–21), у 18 – умеренная (индекс BVAS 3–10), у 13 – ремиссия (индекс BVAS 0–2). Тридцать пять больных получали индукционную или поддерживающую иммуносупрессивную терапию, а 5 пациентов были обследованы до начала лечения.
Изменения радикал-продуцирующей способности нейтрофилов не зависели от нозологической формы васкулита (ГПА, МПА, ЭГПА), поэтому ее анализировали во всей выборке пациентов.
У больных с АНЦА-ассоциированными васкулитами по сравнению с контролем было отмечено повышение удельной пиковой активности нейтрофила (р=0,01), удельной интегральной активности нейтрофила (р=0,02), базальной радикал-продуцирующей активности (р=0,006) и достоверное снижение коэффициента затухания респираторного взрыва (р=0,01) (табл. 1).
У больных с АНЦА-ассоциированными васкулитами по сравнению с контролем было отмечено повышение удельной пиковой активности нейтрофила (р=0,01), удельной интегральной активности нейтрофила (р=0,02), базальной радикал-продуцирующей активности (р=0,006) и достоверное снижение коэффициента затухания респираторного взрыва (р=0,01) (табл. 1).
| Показатель | Доноры | Пациенты с васкулитом | P |
|---|---|---|---|
| Примечание: приведены медианы и интерквартильный размах | |||
| Удельная пиковая активность нейтрофила, ×10-2 имп/(с×кл) | 2,4 (1,7;4,1) | 4,9 (2,5;7,0) | 0,01 |
| Удельная интегральная активность нейтрофила, имп/кл | 2374 (1728;3790) | 4148 (3001-6442) | 0,001 |
| Коэффициент затухания респираторного взрыва | 0,38 (0,32;0,42) | 0,30 (0,18;0,46) | 0,01 |
| Базальная радикал-продуцирующая активность, ×10-2 имп/(с×кл) | 0,27 (0,17;0,32) | 0,42 (0,22;0,51) | 0,006 |
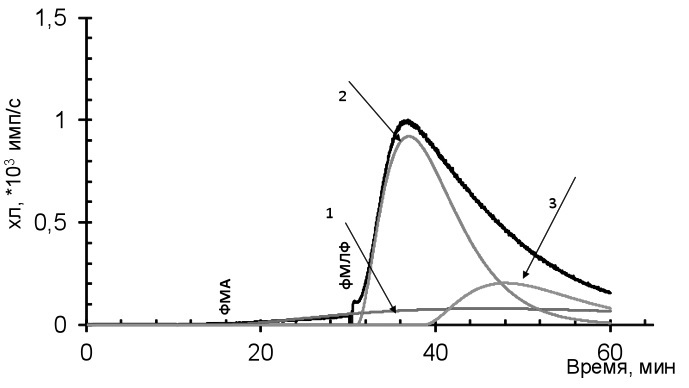
Первую группу составили 9 пациентов с активным АНЦА-ассоциированным васкулитом с поражением легких (у 6), длительностью болезни до 2 лет и индексом VDI<3. У 3 пациентов во время госпитализации наблюдали развитие вторичной инфекции. На кинетической кривой продукции свободных радикалов присутствовали все три составляющие, как и у доноров (рис. 3).
Во вторую группу вошли 7 пациентов с разной степенью активности системного васкулита, поражением не только легких, но и почек (у 3), длительностью болезни от 1 до 6 лет и индексом VDI от 2–4. В оричная инфекция развилась у 1 больного. На кинетической кривой продукции свободных радикалов отсутствовала "медленная" вспышка при нормальной ФМА-индуцированной вспышке (рис. 4).
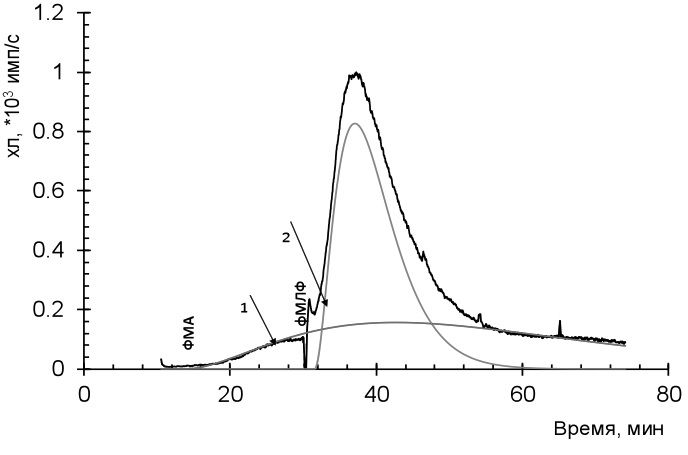
Третью группу составили 10 пациентов с умеренной активностью и ремиссией системного васкулита, поражением почек и легких (у 7), длительность болезни 2–23 лет, индексом VDI 4–8. Развитие вторичной инфекции во время госпитализации отметили у 6 пациентов. На кинетической кривой продукции свободных радикалов отсутствовала "медленная" вспышка в сочетании с выраженной ФМА-индуцированной хемилюминсценацией (рис. 5).
Площадь (S1) ФМА-индуцированного ответа у здоровых доноров была значительно ниже, чем у пациентов с АНЦА-ассоциированными васкулитами, а площадь "быстрой" (S2) и "медленной" (S1) вспышек фМЛФиндуцированного ответа – достоверно выше (табл. 2).
| Показатель | Доноры | Пациенты с васкулитом | P |
|---|---|---|---|
| Примечание: приведены медианы и интерквартильный размах | |||
| Площадь ФМА-индуцированного ответа (S1) | 135 (133;138) | 391 (252;525) | 0,0001 |
| Площадь "быстрой" вспышки фМЛФ-индуцированного ответа (S2) | 416 (415;423) | 360 (312;417) | 0,03 |
| Площадь "медленной" вспышки фМЛФ-индуцированного ответа (S3) | 776 (764;817) | 317 (190;378) | 0,0001 |
У больных 3-й группы площадь (S1) ФМА-индуцированного ответа достоверно превышала таковую у больных 1-й группы (р=0,002) и 2-й группы (р=0,01); различия между 1-й и-2-й группами были недостоверными (p=0,2). Площадь "быстрой" вспышки (S2) по фМЛФ-индуцированному ответу у пациентов трех группах не отличалась (табл. 3). При корреляционном анализе выявлена прямая зависимость между площадью (S1) ФМА-индуцированного ответа и VDI (r=0,42; p<0,05).
| Показатель | 1-я группа | 2-я группа | 3-я группа |
|---|---|---|---|
| Примечание: S1 у пациентов 3-й группы достоверно выше, чем у пациентов 1-й группы (р=0,002) и 2-й группы (р=0,01). S2 у пациентов трех групп достоверно не отличалась | |||
| Площадь ФМА-индуцированного ответа (S1) | 271,3±0,42 | 346,2±0,40 | 595,5±0,71 |
| Площадь "быстрой" вспышки фМЛФ-индуцированного ответа (S2) | 386±0,39 | 423,3±0,45 | 359,5±0,33 |
Обсуждение
Одну из ключевых ролей в патогенезе АНЦА-ассоциированных васкулитов играет нарушение радикал-продуцирующей способности нейтрофилов, детальное изучение которой может помочь для оценки течения заболевания. В данной работе был применен новый подход к анализу продукции свободных радикалов нейтрофилами методом кинетической активированной хемилюминесценции с применением математической деконволюции.
Радикал-продуцирующая способность нейтрофилов у больных АНЦА-ассоциированными васкулитами была повышена по сравнению с контролем за счет усиления базальной и стимулированной ФМА и фМЛФ продукции свободных радикалов нейтрофилами. В то же время радикал-продуцирующая функция нейтрофилов при АНЦА-ассоциированных васкулитах является дефицитной, о чем свидетельствует значительное снижение коэффициента затухания стимулированной продукции свободных радикалов и отсутствие внутриклеточной составляющей продукции свободных радикалов нейтрофилами.
Параметры, полученные при деконволюции радикалпродуцирующей кинетической кривой нейтрофилов, могут иметь диагностическое и прогностическое значение. Наличие всех трех кривых, последовательно отражающих окислительный баланс нейтрофилов, возможно, указывает на более благоприятное течение заболевания, в то время как отсутствие кривой, соответствующей "медленной" вспышке, отмечается при поражении легких и почек и ассоциируется с тенденцией к увеличению риска инфекционных осложнений, отсутствие "медленной" вспышки при повышенном ответе на ФМА свидетельствует о нарастании тяжести заболевания, при этом ответ на ФМА коррелирует с тяжестью необратимых поражении (индекс VDI).
Заключение
У пациентов с АНЦА-ассоциированными васкулитами наблюдаются нарушения радикал-продуцирующей функции нейтрофилов, которые могут иметь значение для прогнозирования течения заболевания, однако этот вопрос нуждается в изучении в дополнительных более крупных исследованиях.
Используемые источники
- Моисеев С.В., Новиков П.И., Мешков А.Д., Иваницкий Л.В. АНЦА-ассоциированные васкулиты: спорные вопросы классификации, диагностики и оценки активности и современные подходы к лечению. Клин фармако тер 2014;23:44-50.
- Бекетова Т.В., Насонов Е.Л. Современные представления о классификации и лечении системных васкулитов, ассоциированных с антинейтрофильными цитоплазматическими антителами: итоги 2011 г. Терапевтический архив 2012;5,68–74.
- Новиков П.И. Клиническая оценка вариантов течения и прогноза гранулематоза с полиангиитом (Вегенера). Дисс. ... канд. мед. наук. М, 2015.
- Falk RJ, Terrell RS, Charles LA, Jennette JC. Anti-neutrophil cytoplasmic autoantibodies induce neutrophils to degranulate and produce oxygen radicals in vitro. Proc Natl Acad Sci U S A 1990;87:4115-9.
- Jennette JC, Falk RJ. Pathogenesis of antineutrophil cytoplasmic autoantibodymediated disease. Nat Rev Rheumatol 2014;10:463-73.
- Проскурнина Е.В., Шеримова А.Е., Полимова А.М. и др. Новые люминесцентные методы оценки окислительного стресса у больных с системными васкулитами. Технологии живых систем 2016;13:26-36.
- Образцов И.В., Годков М.А., Полимова А.М. и др. Оценка функциональной активности нейтрофилов цельной крови методом двухстадийной стимуляции: новый подход к хемилюминесцентному анализу. Российский иммунологический журнал 2015;9:418-25.
- Образцов И.В., Годков М.А., Кулабухов В.В., и др. Ранняя диагностика ожогового сепсиса: опыт применения нового хемилюминесцентного метода анализа функциональной активности нейтрофилов с двухстадийной стимуляцией. Общая реаниматология 2017;40-51.
