Теноксикам
Теноксикам – эффективный, надежный, проверенный временем представитель группы нестероидных противовоспалительных препаратов (НПВП), который активно используется в мировой медицинской практике уже более 35 лет. С момента своего появления на фармакологическом рынке теноксикам прошел жесткую проверку в многочисленных сравнительных клинических исследованиях, выполненных по всем требованиям медицины, основанной на доказательствах, а также оценку длительного применения в реальной клинической практике в ходе серии национальных наблюдательных исследований. Его лечебный потенциал доказан при широком спектре ревматических заболеваний – остеоартрите, ревматоидном артрите, анкилозирующем спондилите, подагре, неспецифической боли в спине. Он также с успехом используется в хирургической практике для контроля послеоперационной боли и как компонент мультимодальной периоперационной анальгезии. Удобство применения (один раз в день), наличие различных лекарственных форм и хорошая переносимость (по сравнению с другими традиционными НПВП) делают теноксикам удачным инструментом обезболивающей терапии в самых разных отраслях медицины.
Нестероидные противовоспалительные препараты (НПВП) были и остаются незаменимым инструментом анальгетической и противовоспалительной терапии, востребованным в самых разных областях медицины. Лечение заболеваний суставов и позвоночника, купирование головной боли напряжения и мигрени, острой висцеральной боли ("колики"), контроль болевого синдрома после травм и оперативных вмешательств, комплексная симптоматическая терапия онкологических больных и многое другое – области успешного использования этого класса фармакологических средств [1,3]. Это одна из наиболее обширных фармакологических групп: сегодня спектр НПВП, доступных российскому врачу, насчитывает более 20 международных непатентованных наименований, а число коммерческих препаратов (за счет генериков) превышает две сотни.
Такое разнообразие ставит врача перед непростым выбором – какой препарат назначить конкретному пациенту в той или иной клинической ситуации?
Формально, все НПВП обладают сходным обезболивающим и противовоспалительным потенциалом, разумеется, при условии, что они используются в максимальных терапевтических дозах в течение достаточно длительного времени. Это положение подтверждается обширным опытом "правильно организованных" с точки зрения медицины, основанной на доказательствах, рандомизированных контролируемых исследований (РКИ) [1,2]. Однако в реальной клинической практике на результат применения лекарства влияет множество факторов, связанных с характером заболевания, индивидуальной чувствительностью пациента и наличием коморбидной патологии. И, конечно, огромное значение имеют фармакологические особенности препарата, определяющие его быстродействие, стойкость эффекта и риск развития нежелательных реакций (НР) [3].
Одним из наиболее интересных биохимических семейств НПВП являются оксикамы. Они представляют собой производные эноликовой кислоты, которые, в отличие от большинства других НПВП, не содержат в своей структуре карбоксильную группу [4].
Общеизвестно, что главной фармакологической мишенью всех НПВП, независимо от химической структуры, является индуцируемый (т.е. появляющийся под воздействием провоспалительных цитокинов) фермент циклооксигеназа (ЦОГ)-2. Подавление активности этого фермента блокирует синтез простагландина (ПГ) Н2, который представляет собой субстрат для образования ПГЕ2, одного из наиболее важных медиаторов боли и воспаления [5,6]. ЦОГ – это последовательный гомодимер, белковая структура, объединяющая две взаимосвязанные зеркальные субъединицы, образующие при соприкосновении тонкий извитой гидрофобный канал, по которому происходит перемещение субстрата (полиненасыщенных жирных кислот, ПЖК) и где проходит его биохимическая трансформация. Оба мономера ЦОГ содержат N-терминальную зону (фактор роста подобную зону) – четырехспиральный участок, связанный с клеточной мембраной, и энзимный участок. В данной области ЦОГ имеются два участка: циклооксигеназный, где осуществляется окисление ПЖК и "замыкание" типичного для простаноидов циклопентанового кольца, и область пероксидазы, которая катализирует присоединение дополнительной OH- группы. Действие всех НПВП – от аспирина до коксибов, заключается в связывании циклооксигеназной области активной зоны ЦОГ, что нарушает ее взаимодействие с субстратом. Но пероксидазная активность фермента при этом не меняется [6,7].
Хотя все НПВП имеют общий механизм действия, разная биохимическая структура этих препаратов определяет важные отличия в их взаимодействии с ЦОГ. От этого зависит длительность их фармакологического эффекта и селективность в отношении ЦОГ-1/ЦОГ-2. Последнее имеет принципиальное значение: ведь именно с подавлением активности ЦОГ-2 связано анальгетическое, противовоспалительное и жаропонижающее действие НПВП. А неизбирательная блокада биохимического "двойника" этого фермента – ЦОГ-1, который постоянно присутствует в тканях организма и отвечает за синтез цитопротективных ПГ, приводит к развитию многих НР, таких как повреждение слизистой желудочно-кишечного тракта (ЖКТ) [4].
В чем особенность действия оксикамов? Они связываются с активной зоной ферментативного канала ЦОГ, образуя множественные гидрофобные связи и единственную непосредственную водородную связь между 4-гидроксильной группой молекулы препарата и аминокислотой Ser-530 ЦОГ. Фиксация двух молекул Н2О в активной зоне фермента обеспечивает дополнительные полярные связи между действующим веществом и структурами ЦОГ в каталитической вершине и области сужения ферментативного канала. Связь боковой цепи оксикама с аминокислотой Leu-531 ЦОГ формирует особую пространственную конформацию комплекса и появление гидрофобного "кармана", представленного 8 аминокислотными остатками фермента: Met-113, Val116, Leu-117, Ile-345, Val-349, Leu-531, Leu-534 и Me535. Согласно компьютерной модели взаимодействия оксикамов и ЦОГ, именно образование данной структуры определяет большую селективность в отношении ЦОГ-2 и более длительный противовоспалительный эффект этих препаратов [4].
Ценным свойством оксикамов представляется их способность влиять не только на активность ЦОГ-2, но и на матриксную ПГЕ2-синтетазу – фермент, благодаря которому происходит конечный синтез основного медиатора воспаления – ПГЕ2. Матриксная ПГЕ2-синтетаза является очень перспективной "мишенью" для противовоспалительной терапии, однако разработать пригодный для клинического применения ингибитор этого фермента ("супер-НПВП") пока не удалось. В то же время оксикамы обладают структурным сходством с бензотиопиран S-диоксидами, а эти соединения могут связывать матриксную ПГЕ2-синтетазу и стали основой для создания экспериментального препарата PF-9184, показавшего свойство селективного ингибитора фермента [4].
Теноксикам – это надежный, проверенный временем лекарственный препарат, который широко используется во многих странах мира [8]. Впервые на фармакологическом рынке он появился в 1982 г. во Франции под торговым наименованием Тилкотил. В настоящее время, по данным сайта www.drugs.com, на глобальном фармакологическом рынке, кроме оригинального препарата, представлены еще 83 генерика теноксикама [9]. На 2016 г. теноксикам зарегистрирован и используется в 14 странах Евросоюза, таких как Бельгия, Болгария, Великобритания, Греция, Дания, Исландия, Испания, Италия, Кипр, Люксембург, Португалия, Румыния, Франция и Швеция [10].
Теноксикам относится к "традиционным" НПВП – неселективным ингибиторам ЦОГ-2. Соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 для него составляет 1,34 (для примера, для индометацина – более 10) [11]. Имеются данные, что теноксикам, помимо своего основного фармакологического действия (блокада ЦОГ-2), способен проявлять свойства антиоксиданта, подавляя образование реактивных форм кислорода, супероксид-анионов, а также снижать синтез окиси азота [12-14].
Теноксикам обладает устойчивой стабильной фармакодинамикой. Он практически полностью всасывается из ЖКТ (биодоступность составляет 99%) и обнаруживается в крови уже через 30 мин после перорального приема. Достаточно быстро – в среднем через 1,9 ч (1,0-5,0 ч) после приема 20 мг теноксикама достигается пиковая концентрация препарата в плазме – 2,7 мг/л (2,3-3,0 мг/л). Теноксикам практически полностью связывается белками плазмы (на 99%), при этом, за счет низкой липофильности и высокой ионизации, его проникновение в ткани происходит плавно и постепенно: пиковая концентрация в синовиальной жидкости составляет 1/3 от содержания в плазме и достигается примерно через 20 ч. Препарат метаболизируется в печени с образованием 5'-гидрокси- и 6-O-глюкуронированной формы, которые выводятся с мочой и желчью. Особенностью теноксикама является линейная фармакодинамика (которая отмечается при использовании в дозах от 10 до 100 мг) и весьма медленная элиминация. Период полувыведения этого лекарства составляет 67 ч (49-81 ч) [8].
Теноксикам при хронических заболеваниях суставов и позвоночника
С момента появления на фармакологическом рынке теноксикам проходил жесткую проверку, прежде всего, как препарат, предназначенный для длительного использования у больных с хроническими ревматическими заболеваниями, такими как остеоартрит (ОА), ревматоидный артрит (РА) и анкилозирующий спондилит.
С целью изучения эффективности и безопасности теноксикама была проведена серия масштабных и хорошо организованных РКИ. Так, в 12-недельной работе британских ученых теноксикам 20 мг/сут сравнивали с пироксикамом 20 мг/сут у 1328 больных ОА и РА [15]. Параллельно в Швейцарии было проведено РКИ, в котором оценивали действие теноксикама 20 мг/сут, пироксикама 20 мг/сут и диклофенака 100 мг/сут у пациентов с ОА и ревматической патологией околосуставных мягких тканей [16]. Третьей работой со сходным планом было 12-недельное РКИ датских исследователей, которые сопоставляли эффект теноксикама 20 мг/сут и кетопрофена 200 мг/сут у 307 больных ОА [17]. Во всех трех исследованиях был получен сходный результат: анальгетическое и противовоспалительное действие теноксикама не уступало препаратам контроля, но при этом суммарная частота НР, особенно со стороны ЖКТ, была ниже. Например, при сравнении теноксикама с кетопрофеном суммарная частота НР составила 29,0% и 47,3%, соответственно (p<0,05). Показательны данные N. Bellamy и соавт., которые сравнили результаты использования теноксикама 20 мг/сут и диклофенака 150 мг/сут у 98 больных ОА. Через 12 недель терапии не было отмечено существенного различия в динамике индекса WOMAC. Однако переносимость теноксикама была достоверно лучше таковой диклофенака: суммарная частота НР составила 43,8% и 66,0%, соответственно (p<0,05) [18].
Р. Riedemann и соавт. провели мета-анализ 18 РКИ, в 12 из которых теноксикам сравнивали с его ближайшим "родственником" пироксикамом, в 3 – с диклофенаком и в 2 – с индометацином. Согласно полученным данным, теноксикам был более эффективен и лучше переносился, чем пироксикам; он не уступал индометацину по эффективности и вызывал меньше НР; не отличался по лечебному потенциалу от диклофенака, но реже вызывал НР [19].
Для оценки клинических достоинств теноксикама, помимо РКИ, была проведена серия национальных наблюдательных исследований, в которых этот препарат изучали в реальной клинической практике. Например, в работе британских исследователей теноксикам применяли в течение 12 недель у 2963 больных ОА и РА. Препарат позволил успешно контролировать основные симптомы артрита (рис. 1). При этом около 60% пациентов продолжили использовать теноксикам более 3 мес, а 31% продлили его прием до 1 года [20].
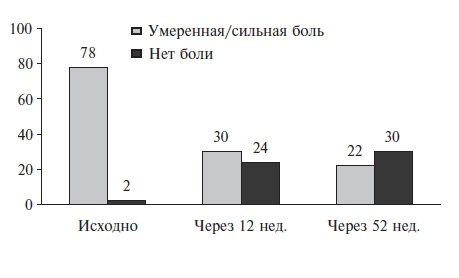
Канадские ученые G. Kraag и соавт. провели масштабное наблюдательное исследование, в котором оценивали результаты использования теноксикама у 1809 амбулаторных больных с заболеваниями суставов и позвоночника, из которых большинство (84,3%) страдали ОА. Средний курс терапии составил 4 недели. Теноксикам оказался эффективным и относительно безопасным лекарством. Так, 81,1% пациентов сообщили о существенном улучшении состояния после курса терапии, при этом лишь у 12,6% были отмечены те или иные НР [21].
Итальянские ученые R. Marcolongo и A. Fioravanti оценили результаты применения теноксикама 20 мг/сут, диклофенака 100 мг/сут и пироксикама 20 мг/сут у 625 больных с ОА и ревматической патологией околосуставных мягких тканей. Теноксикам не уступал препаратам контроля по эффективности, но превосходил по переносимости – частота НР при его применении оказалось самой низкой (7,4%) [22].
K. Ibrahima и соавт. изучали эффективность теноксикама 20 мг/сут (от 15 до 30 дней) у 736 африканских пациентов с ревматическими заболеваниями. Пода вляющее большинство больных (более 90%) оценили результат лечения как хороший или отличный [23].
Эффективность, хорошая переносимость и удобство применения сделали теноксикам удачным средством для длительного лечения больных с ревматическими заболеваниями. Это подтверждает опыт нескольких исследований, в которых лечебное действие теноксикама оценивали в течение продолжительного периода времени. В частности, О. Nived и соавт. сравнивали теноксикам с напроксеном в течение 6 месяцев [24], а В. Lund и соавт. применяли теноксикам и пироксикам у больных ОА в течение 12 месяцев [25]. А в небольшом исследовании J. Lalos и соавт. успешно использовали теноксикам в течение 4 лет (!) у 20 больных РА. При этом переносимость препарата была оценена как хорошая или отличная [26].
В плане оценки безопасности теноксикама очень важны результаты его сравнения с ацеклофенаком, который характеризуется хорошей переносимостью и низким риском серьезных НР. Испанские ученые провели два таких исследования. В работе F. Perez-Ruiz и соавт. 292 больных РА получали теноксикам 20 мг/сут или ацеклофенак 200 мг/сут в течение 3 мес. Эффективность препаратов через 2 недели и в конце исследования не различалась. Частота НР также была практически равной: 4,1% – в группе ацеклофенака и 6,2% – в группе теноксикама. Число осложнений со стороны ЖКТ также достоверно не отличалось [27]. L. Villa Alcаzar и соавт. оценивали эффективность этих препаратов в аналогичных дозах при анкилозирующем спондилите (n=273). Через 3 мес лечения эффект препаратов не отличался ни в отношении боли, ни в отношении улучшения функции позвоночника. При этом частота НР при лечении ацеклофенаком была несколько выше, чем при приеме теноксикама: они развились у 42 и 37 больных, соответственно. Частота отмены двух препаратов из-за НР составила 2,2% и 1,4%, соответственно. Таким образом, в обоих исследованиях теноксикам не уступал по переносимости ацеклофенаку [28].
Эффективность теноксикама для купирования острой боли
Теноксикам представляет собой эффективное и удобное средство для длительного контроля основных симптомов при наиболее распространенных хронических заболеваниях суставов и позвоночника. Однако он может использоваться не только в этой ситуации. Теноксикам оказался весьма удачным препаратом и для купирования острой боли при самой различной ургентной патологии.
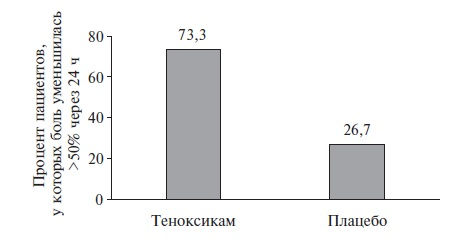
Так, имеется успешный опыт применения теноксикама для лечения острого подагрического артрита [29,30]. Любопытно отметить, что теноксикам, согласно анализу Cochrane Collaboration, стал единственным НПВП, который сравнивали с плацебо для купирования острого приступа подагры (de la Torre G., 1987). В этом РКИ 30 больных (по 15 в каждой группе) получали теноксикам 40 мг/сут или плацебо. По эффективности теноксикам значительно превосходил плацебо (рис.2). Очень важно, что в группе теноксикама не было зафиксировано ни одной НР, в то время как в группе плацебо было 2 осложнения [31].
Теноксикам показал себя действенным средством для лечения острой неспецифической боли в спине. В работе бельгийских ученых М. Szpalski и J. Hayez 2-недельный курс лечения теноксикамом в дозе 20 мг у 78 пациентов с этой патологией привел к существенному уменьшению боли и улучшению функции позвоночника [32].
Классической моделью для проверки терапевтического потенциала анальгетиков в ургентных ситуациях служит купирование острой боли после удаления зуба. Такую проверку прошел и теноксикам, причем очень успешно. Была проведена серия исследований, показавших его эффективность в данной клинической ситуации [33-35]. При этом по уровню обезболивающего действия он не уступал большим дозам глюкокортикоидов [36] и превосходил мягкие опиоидные препараты (в частности, комбинацию парацетамола 500 мг и кодеина 8 мг) [37].
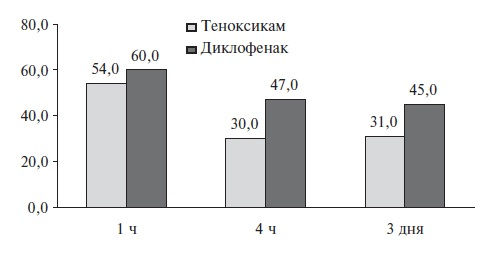
В качестве примера удачного использования теноксикама в стоматологической практике можно привести РКИ J. Roelofse и соавт., в которое были включены 35 пациентов, перенесших удаление 3-го моляра. Теноксикам сравнивали с диклофенаком: оба препарата вводили непосредственно перед операцией (теноксикам 40 мг внутривенно, диклофенак 75 мг внутримышечно), а затем назначали внутрь (теноксикам 20 мг один раз в день, диклофенак 50 мг три раза в день) на 7 дней. Эффективность теноксикама оказалась достоверно выше как в первые послеоперационные часы, так и через 3 дня (рис. 3) [38].
Эффективность теноксикама для купирования боли после экстракции зуба подтверждает также недавнее исследование V. Kaplan и соавт. у 90 больных, перенесших удаление зуба мудрости. В качестве анальгетика они в течение 7 дней получали теноксикам 20 мг, флурбипрофен 200 мг или диклофенак 100 мг, причем первую доза каждого препарата назначали за 2 ч до операции. Теноксикам оказывал более выраженное обезболивающее действие по сравнению с препаратами сравнения как в первые послеоперационные часы, так и последующие дни наблюдения [39].
Важнейшая область ургентного применения НПВП – купирование острой почечной и билиарной колики. Здесь теноксикам также показал себя эффективным препаратом: внутривенное или внутримышечное введение препарата быстро и существенно снижало выраженность болевых ощущений и частоту осложнений, связанных с этой патологией [40-44].
Теноксикам применяется в анестезиологической практике как элемент мультимодального обезболивания при "больших" хирургических операциях. Его эффективность была подтверждена результатами серии РКИ. Так, в работе W. Chang и соавт. предоперационное введение этого препарата обеспечивало снижение потребности в применении опиоидов в послеоперационном периоде у больных, перенесших хирургическое вмешательство на позвоночнике [45]. Очень важные данные были получены I. Gunusen и соавт., которые сравнили выраженность боли и потребность в морфине у 120 больных, которые после абдоминальной гистерэктомии получали внутривенно теноксикам 20 мг, парацетамол 1 г или плацебо. В группе теноксикама послеоперационная боль была достоверно менее выражена, а суммарная потребность в морфине в трех группах составила 44,8±17,4 мг, 64,6±19,6 мг и 69,2±22,1 мг, соответственно (p<0,05) [46]. Снижение потребности в морфине при использовании теноксикама после холецистэктомии было также показано в исследовании F. Munro и соавт [47].
T. Akca и соавт. сравнили эффекты предоперационного введения 20 мг теноксикама или физиологического раствора у 80 больных, которым была проведена лапароскопическая холецистэктомия или пластика паховой грыжи. В группе теноксикама выраженность боли через 4 и 8 ч после операции, а также потребность в дополнительных анальгетиках оказалась достоверно ниже, чем в контрольной группе [48].
А. Merry и соавт. оценивали влияние интраоперационного внутривенного введения теноксикама 20 и 40 мг или плацебо на выраженность послеоперационной боли у 45 больных, перенесших торакотомию. Выраженность боли оказалась достоверно меньше при использовании обеих доз теноксикама: 17,4±14,8, 16,5±13,3 и 25,8±12,5 мм по визуальной аналоговой шкале, соответственно (p<0,05) [49].
Нельзя обойти вниманием еще одну область клинического применения теноксикама – его локальное внутри- и околосуставное введение при патологии суставов или околосуставных мягких тканей. Хотя такое применение теноксикама не зарегистрировано, тем не менее, оно активно практикуется в ряде стран мира [50]. Так, Z. Unlu и соавт. сравнили эффект внутрисуставного введения теноксикама 20 мг (три еженедельные инъекции) и постоянного перорального приеме этого препарата в течение 3 недель у 69 больных ОА коленного сустава. Оба метода применения позволили добиться существенного улучшения состояния больных, причем выраженность боли в обеих группах достоверно не различалась через 1, 3 и 6 мес [51]. Недавно были представлены данные аналогичного по плану исследования, выполненного М. Erbas и соавт. В нем также сравнивали результаты 3-недельного внутрисуставного и перорального применения теноксикама у 60 больных ОА. Как и в предыдущем исследовании, эффективность лечения не отличалась [52].
В исследовании Н. Çift и соавт. 40 больных с тендинитом ротаторов плеча и/или субакромиальным бурситом получали внутрисуставные инъекции метилпреднизолона 40 мг (однократно) или теноксикама 20 мг (3 инъекции еженедельно). Эффект двух препаратов был сходным: через 6 недель в группе метилпреднизолона интенсивность боли снизилась с 6,2 до 3,6 см (по визуальной аналоговой шкале длиной 10 см), в группе теноксикама – с 7,8 до 2,6 см [53].
S. Guner и соавт. сравнили результаты локального введения теноксикама 20 мг и метилпреднизолона 40 мг (оба препарата в комбинации с 2% лидокаином) у 61 пациента с плантарным фасциитом. Оба препарата были эффективными и вызывали сопоставимое уменьшение боли через 6 и 12 ч после инъекции [54]. С другой стороны, в работе S. Karthikeyan и соавт. было показано преимущество однократной субакромиальной инъекции метилпреднизолона перед однократным субакромиальным введением теноксикама 20 мг при синдроме столкновения ротаторов плеча [55].
Некоторые хирурги-ортопеды активно практикуют внутрисуставное введение теноксикама с опиоидами и локальными анестетиками после артроскопических вмешательств на суставах (например, после менискэктомии). Имеются четкие данные, что использование теноксикама в этой ситуации позволяет существенно уменьшить послеоперационную боль [56-58]. Напри мер, R. Jawish и соавт. выявлили значительное уменьшение воспалительного отека и боли у 134 больных, которым в конце артроскопии коленного сустава внутрисуставно вводили теноксикам 20 мг [59].
Очень интересные данные были получены S. Sanel и соавт. в ходе двойного слепого РКИ, в котором были сопоставлены эффекты теноксикама 20 мг и морфина (оба препарата применяли в комбинации с 0,5% бупивокаином) у 240 больных, перенесших артроскопическое вмешательство на коленном суставе. Применение теноксикама позволило добиться меньшего уровня послеоперационной боли и снижения потребности в дополнительных анальгетиках по сравнению с применением опиоида [60].
Безопасность
Как было отмечено выше, теноксикам относится к "традиционным" НПВП, т.е. неселективным ингибиторам ЦОГ-2, поэтому на фоне приема этого препарата могут отмечаться НР, свойственные всем другим представителям этой лекарственной группы. Прежде всего, речь идет о возможности развития осложнений со стороны ЖКТ [61]. Тем не менее, согласно данным многочисленных РКИ и наблюдательных исследований, приведенных выше, по переносимости он в целом превосходит многие другие популярные НПВП [19].
Было проведено несколько исследований, в которых изучалось действие теноксикама на слизистую оболочку верхних отделов ЖКТ. Так, Р. Müller и соавт. сравнили частоту эндоскопических изменений после 14-дневного приема теноксикама 20 мг/сут и диклофенака 100 мг/сут у 36 здоровых добровольцев. Теноксикам достоверно реже вызывал повреждения слизистой оболочки. Так, счет Lanza, отражающий выраженность изменений, составил 1,3±0,7 и 2,2±1,1 в двух группах, соответственно (р=0,014) [62]. А. al-Quorain и соавт. сравнивали частоту изменений слизистой оболочки желудка у 36 больных, получавших теноксикам 20 мг и диклофенак 100 мг в течение 4 недель. Повреждение слизистой оболочки было отмечено у 21% и 41% больных, соответственно. При этом множественные геморрагии и эрозии (>10) были выявлены лишь у 5% больных, получавших теноксикам, и 18% пациентов группы диклофенака [63].
G. Perpignano и соавт. оценили частоту и характер эндоскопических изменений ЖКТ у 60 больных ОА, которые в течение 8 недель получали теноксикам 20 мг/сут или умеренно селективный НПВП с хорошей переносимостью этодолак 600 мг/сут. Частота минимальных изменений слизистой желудка оказалась выше в группе теноксикама, однако язвы желудка встречались с одинаковой частотой (по 2 в каждой группе) [64].
Важные данные о сравнительной частоте НР при использовании теноксикама в реальной клинической практике были получены специалистами французской системы фармаконадзора, которые оценили 42389 спонтанных сообщений о серьезных НР, зарегистрированных за период с 2002 по 2006, и построили "рейтинг" для наиболее популярных НПВП в зависимости от частоты лекарственных осложнений. При лечении теноксимамом частота НР была низкой (0,42 случая на 1 млн принятых доз), сопоставимой с таковой при применении мелоксикама (0,41) и существенно ниже, чем при лечении диклофенаком (0,58) и особенно кетопрофеном (0,78) [65].
Данные по осложнениям со стороны сердечнососудистой системы при применении теноксикама ограничены, однако другие представители семейства оксикамов (мелоксикам и пироксикам) характеризуются средним риском их развития [66,67]. Недавно А. Arfе и соавт. провели анализ взаимосвязи между приемом НПВП и развитием сердечной недостаточности у 92163 больных, госпитализированных в связи с этой патологией в Нидерландах, Германии, Велико британии и Италии за период с 2000 по 2010 гг. Соответствующую по полу и возрасту контрольную группу составили 8 246 403 пациента без сердечной недостаточности. В среднем, прием НПВП ассоциировался с умеренным нарастанием риска сердечной недостаточности: показатель относительного риска (ОР) составил 1,19 (95% доверительный интервал [ДИ] 1,17-1,22). Теноксикам практически не повышал риск развития сердечной недостаточности (ОР 1,06; 95% ДИ 0,80-1,41). Для диклофенака этот показатель составил 1,19 (95% ДИ 1,151,24) [67].
Разумеется, при использовании теноксикама следует учитывать все противопоказания и тщательно оценивать наличие факторов риска класс-специфических осложнений, свойственных НПВП.
Заключение
Теноксикам – универсальный НПВП, который может использоваться как для купирования острой боли (в том числе в хирургической практике), так и и для длительного контроля болевых ощущений при хронических заболеваниях суставов и позвоночника. Имеется обширная доказательная база, основанная на данных хорошо организованных клинических испытаний и многолетнем опыте реальной практической работы, подтверждающая эффективность и хорошую переносимость этого препарата. Он удобен в применении (назначают один раз в день) и имеет различные лекарственные формы, в том числе для парентерального введения. Эти достоинства определяют целесообразность активного использования теноксикама в российской медицинской практике.
Используемые источники
- Brune K, Patrignani P. New insights into the use of currently available nonsteroidal anti-inflammatory drugs. J Pain Res 2015;8:105-18.
- Conaghan PG. A turbulent decade for NSAIDs: update on current concepts of classification, epidemiology, comparative efficacy, and toxicity. Rheumatol Int 2012;32(6):1491-502.
- Hunter TS, Robison C, Gerbino PP. Emerging evidence in NSAID pharmacology: important considerations for product selection. Am J Manag Care 2015;21(7 Suppl):S139-47.
- Xu S, Rouzer CA, Marnett LJ. Oxicams, a class of nonsteroidal anti-inflammatory drugs and beyond. IUBMB Life 2014;66(12):803-11.
- Díaz-González F, Sаnchez-Madrid F. NSAIDs: learning new tricks from old drugs. Eur J Immunol 2015;45(3):679-86.
- Vecchio AJ, Malkowski MG. The structural basis of endocannabinoid oxygenation by cyclooxygenase-2. J Biol Chem 2011;286(23):20736-45.
- Vecchio AJ, Simmons DM, Malkowski MG. Structural basis of fatty acid substrate binding to cyclooxygenase-2. J Biol Chem 2010;285(29):22152-63.
- Nilsen OG. Clinical pharmacokinetics of tenoxicam. Clin Pharmacokinet 1994;26(1):16-43.
- https://www.drugs.com/international/tenoxicam.html.
- http://www.ema.europa.eu/docs/en_GB/document_library/Periodic_safety_update_single_assessment/2016/10/WC500214741.pdf.
- Lora M, Morisset S, Mеnard HA, et al. Expression of recombinant human cyclooxygenase isoenzymes in transfected COS-7 cells in vitro and inhibition by tenoxicam, indomethacin and aspirin. Prostaglandins Leukot Essent Fatty Acids 199;56(5):361-7.
- Van Antwerpen P, N ève J. In vitro comparative assessment of the scavenging activity against three reactive oxygen species of non-steroidal anti-inflammatory drugs from the oxicam and sulfoanilide families. Eur J Pharmacol 2004;496(13):55-61.
- Ferrari GV, Natera J, Paulina Monta ña M Scavenging of photogenerated ROS by Oxicams. Possible biological and environmental implications. J Photochem Photobiol B 2015;153:233-9.
- Ozgocmen S, Ardicoglu O, Erdogan H, et al. In vivo effect of celecoxib and tenoxicam on oxidant/ anti-oxidant status of patients with knee osteoarthritis. Ann Clin Lab Sci 2005;35(2):137-43.
- Simpson J, Golding DN, Freeman AM, et al. A large multicentre, parallel group, double-blind study comparing tenoxicam and piroxicam in the treatment of osteoarthritis and rheumatoid arthritis. Br J Clin Pract 1989;43(9):328-33.
- Moser U, Waldburger H, Schwarz HA, Gobelet CA. A double-blind randomised multicentre study with tenoxicam, piroxicam and diclofenac sodium retard in the treatment of ambulant patients with osteoarthritis and extra-articular rheumatism. Scand J Rheumatol Suppl 1989;80:71-80.
- Ejstrup L, Knudsen JV, Petersen L. A randomised double-blind multicentre trial comparing tenoxicam and ketoprofen in osteoarthritis. Scand J Rheumatol Suppl 1989;80:48-53.
- Bellamy N, Buchanan WW, Chalmers A, et al. A multicenter study of tenoxicam and diclofenac in patients with osteoarthritis of the knee. J Rheumatol 1993;20(6):999-1004.
- Riedemann PJ, Bersinic S, Cuddy LJ, et al. A study to determine the efficacy and safety of tenoxicam versus piroxicam, diclofenac and indomethacin in patients with osteoarthritis: a meta-analysis. J Rheumatol 1993;20(12):2095-103.
- Langdon CG, Moran DG, Jamieson V, et al. A multicentre study of tenoxicam review5_Layout 1 18.11.17 19:47 Page 49
- Kraag GR, Gordon DA, M énard HA, et al. Patient compliance with tenoxicam in family practice. Clin Ther 1994;16(3):581-93.
- Marcolongo R, Fioravanti A. Clinical experiences with tenoxicam. Preliminary results of a multicenter study. Recenti Prog Med 1991;82(4):242-9.
- Ibrahima K, Kodjo G, Issa S, et al. Clinical efficacy and tolerability of tenoxicam in African patients with osteoarthritis, rheumatoid arthritis, tendinitis and/or bursitis: an open study. Curr Med Res Opin 1991;12(7):471-8.
- Nived O, Sturfelt G, Eckern äs SA, Singer P. A comparison of 6 months' compliance of patients with rheumatoid arthritis treated with tenoxicam and naproxen. Use of patient computer data to assess response to treatment. J Rheumatol 1994;21(8):1537-41.
- Lund B, Andersen RB, Fossgreen J, et al. A long-term randomised trial on tenoxicam and piroxicam in osteoarthritis of the hip or knee: a 24-month interim report focusing on the 12-24 month interval. Eur J Rheumatol Inflamm 1987;9(2):58-67.
- Lalos J, Tsachalos P, Gallis L. Long-term (four year) clinical trial with tenoxicam and basis therapy in patients suffering from rheumatoid arthritis. Scand J Rheumatol Suppl 1989;80:67-70.
- Perez-Ruiz F, Alonso-Ruiz A, Ansoleaga JJ. Comparative study of the efficacy and safety of aceclofenac and tenoxicam in rheumatoid arthritis. Clin Rheumatol 1996;15(5):473-7.
- Villa Alc ázar LF, de Buergo M, Rico Lenza H, Montull Fruit ós E. Aceclofenac is as safe and effective as tenoxicam in the treatment of ankylosing spondylitis: a 3 month multicenter comparative trial. Spanish Study Group on Aceclofenac in Ankylosing Spondylitis. J Rheumatol 1996;23(7):1194-9.
- Vald és EF. Use of tenoxicam in patients with acute gouty arthritis. Eur J Rheumatol Inflamm 1987;9(2):133-6.
- Waterworth RF, Waterworth SM. An open assessment of tenoxicam (Tilcotil) in the treatment of acute gout in general practice. N Z Med J 1987;100(837):744-5.
- van Durme CM, Wechalekar MD, Buchbinder R, et al. Non-steroidal antiinflammatory drugs for acute gout. Cochrane Database Syst Rev 2014;(9):CD010120.
- Szpalski M, Hayez JP. Objective functional assessment of the efficacy of tenoxicam in the treatment of acute low back pain. A double-blind placebo-controlled study. Br J Rheumatol 1994;33(1):74-8.
- Cheung LK, Rodrigo C. Tenoxicam for pain relief following third molar surgery. Anesth Pain Control Dent 1992;1(4):229-33.
- Zacharias M, De Silva RK, Herbison P, Templer P. A randomized crossover trial of tenoxicam compared with rofecoxib for postoperative dental pain control. Anaesth Intensive Care 2004;32(6):770-4.
- Arslan H, Topcuoglu HS, Aladag H. Effectiveness of tenoxicam and ibuprofen for pain prevention following endodontic therapy in comparison to placebo: a randomized double-blind clinical trial. J Oral Sci 2011;53(2):157-61.
- Ilhan O, Agacayak KS, Gulsun B, et al. A comparison of the effects of methylprednisolone and tenoxicam on pain, edema, and trismus after impacted lower third molar extraction. Med Sci Monit 2014;20:147-52.
- Merry AF, Swinburn PF, Middleton NG, et al. Tenoxicam and paracetamolcodeine combination after oral surgery: a prospective, randomized, double-blind, placebo-controlled study. Br J Anaesth 1998;81(6):875-80.
- Roelofse JA, Van der Bijl P, Joubert JJ. Analgesic and anti-inflammatory efficacy of tenoxicam and diclofenac sodium after third molar surgery. Anesth Prog 1996;43(4):103-7.
- Kaplan V, Ero ğlu CN. Comparison of the effects of daily single-dose use of flurbiprofen, diclofenac sodium, and tenoxicam on postoperative pain, swelling, and trismus: a randomized double-blind study. J Oral Maxillofac Surg 2016;74(10):1946.e1-6.
- Cevik E, Cinar O, Salman N, et al. Comparing the efficacy of intravenous tenoxicam, lornoxicam, and dexketoprofen trometamol for the treatment of renal colic. Am J Emerg Med 2012;30(8):1486-90.
- Keke çZ, Yilmaz U, S özüer E. The effectiveness of tenoxicam vs isosorbide dinitrate plus tenoxicam in the treatment of acute renal colic. BJU Int 2000;85(7):783-5.
- al-Waili NS, Saloom KY. Intravenous tenoxicam to treat acute renal colic: comparison with buscopan compositum. J Pak Med Assoc 1998;48(12):370-2.
- Al-Waili NS. Intramuscular tenoxicam to treat acute renal colic. Br J Urol 1996;77(1):15-6.
- Masudi T, Capitelli-McMahon H, Anwar S. Acute pain management in symptomatic cholelithiasis. World J Gastrointest Surg 2016;8(10):713-8.
- Chang WK, Wu HL, Yang CS, et al. Effect on pain relief and inflammatory response following addition of tenoxicam to intravenous patient-controlled morphine analgesia: a double-blind, randomized, controlled study in patients undergoing spine fusion surgery. Pain Med 2013;14(5):736-48.
- Gunusen I, Karaman S, Acar A, et al. The efficacy of paracetamol versus tenoxicam on postoperative pain and morphine consumption after abdominal hysterectomy: a placebo-controlled, randomized study. Clin Exp Obstet Gynecol 2012;39(1):49-52.
- Munro FJ, Young SJ, Broome IJ, et al. Intravenous tenoxicam for analgesia following laparoscopic cholecystectomy. Anaesth Intensive Care 1998;26(1):56-60.
- Akca T, Colak T, Kanik A, et al. The effect of preoperative intravenous use of tenoxicam: a prospective, double-blind, placebo-controlled study. J Invest Surg 2004;17(6):333-8.
- Merry AF, Sidebotham DA, Middleton NG, et al. Tenoxicam 20 mg or 40 mg after thoracotomy: a prospective, randomized, double-blind, placebo-controlled study. Anaesth Intensive Care 2002;30(2):160-6.
- Papathanassiou NP. Intra-articular use of tenoxicam in degenerative osteoarthritis of the knee joint. J Int Med Res 1994;22(6):332-7.
- Unlu Z, Ay K, Tuzun C. Comparison of intra-articular tenoxicam and oral tenoxicam for pain and physical functioning in osteoarthritis of the knee. Clin Rheumatol 2006;25(1):54-61.
- Erbas M, Simsek T, Kiraz HA et al. Comparison of the effectivity of oral and intra-articular administration of tenoxicam in patients with knee osteoarthritis. Braz J Anesthesiol 2015;65(5):333-7.
- Çift H, Özkan F Ü, Tolu S, et al. Comparison of subacromial tenoxicam and steroid injections in the treatment of impingement syndrome. Eklem Hastalik Cerrahisi 2015;26(1):16-20.
- Guner S, Onder H, Guner SI et al. Effectiveness of local tenoxicam versus corticosteroid injection for plantar fasciitis treatment. Orthopedics 2013;36:e1322-6.
- Karthikeyan S, Kwong HT, Upadhyay PK, et al. A double-blind randomised controlled study comparing subacromial injection of tenoxicam or methylprednisolone in patients with subacromial impingement. J Bone Joint Surg Br 2010;92(1):77-82.
- Cook TM, Tuckey JP, Nolan JP. Analgesia after day-case knee arthroscopy: double-blind study of intra-articular tenoxicam, intra-articular bupivacaine and placebo. Br J Anaesth 1997;78(2):163-8.
- Talu GK, Ozyal çin S, Koltka K, et al. Comparison of efficacy of intraarticular application of tenoxicam, bupivacaine and tenoxicam: bupivacaine combination in arthroscopic knee surgery. Knee Surg Sports Traumatol Arthrosc 2002;10:355-60.
- Oral EG, Hanci A, Ulufer Sivrikaya G et al. The analgesic effects of morphine and tramadol added to intra-articular levobupivacaine-tenoxicam combination for arthroscopic knee surgery on postoperative pain; a randomized clinical trial. Anesth Pain Med 2015;5(3):e24047.
- Jawish R, Najdi H, Abi Safi C, Chameseddine A. The effect of intra-articular Tenoxicam on knee effusion after arthroscopy. Int Orthop 2015;39(7):1423-6.
- Sanel S, Arpaz O, Unay K, et al. Comparison of intra-articular bupivacaine-morphine with bupivacaine-tenoxicam combinations on post-operative analgesia in patients with arthroscopic meniscectomy: a prospective, randomised study. Int Orthop 2016;40(3):601-5.
- Castellsague J, Riera-Guardia N, Calingaert B, et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project). Drug Saf 2012;35(12):1127-46.
- Müller P, Dammann HG, Marinis E, Simon B. Gastroduodenal tolerance of tenoxicam versus diclofenac-Na: an endoscopy double-blind controlled study in healthy probands. Z Rheumatol 1989;48(5):243-5.
- al-Quorain AA1, Satti MB, Marwah S, et al. Non-steroidal anti-inflammatory drug-induced gastropathy: a comparative endoscopic and histopathological evaluation of the effects of tenoxicam and diclofenac. J Int Med Res 1993;21(2):89-97.
- Perpignano G, Bogliolo A, Puccetti L. Double-blind comparison of the efficacy and safety of etodolac SR 600 mg u.i.d. and of tenoxicam 20 mg u.i.d. in elderly patients with osteoarthritis of the hip and of the knee. Int J Clin Pharmacol Res 1994;14(5-6):203-16.
- Lapeyre-Mestre M, Grolleau S, Montastruc JL. Adverse drug reactions associated with the use of NSAIDs: a case/noncase analysis of spontaneous reports from the French pharmacovigilance database 2002-2006. Fundam Clin Pharmacol 2013; 27(2):223-30.
- McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA 2006;296(13):1633-44.
- Varas-Lorenzo С, Riera-Guardia N, Calingaert B, et al. Myocardial infarction and individual nonsteroidal anti-inflammatory drugs meta-analysis of observational studies. Pharmacoepidemiol Drug Saf 2013;22:559–70.
- Arfe A, Scotti L, Varas-Lorenzo C, et al. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ 2016;354:i4857
