Патогенетическая реконструкция головокружения при дисциркуляторной энцефалопатии как основа формирования эффективной терапевтической стратегии
Головокружение является одной из самых частых жалоб у пациентов с диагнозом “дисциркуляторная энцефалопатия” и, что немаловажно, служит предиктором спонтанных падений, ассоциированных с увеличением риска переломов костей верхних и нижних конечностей. Патогенетической основой головокружения у таких пациентов является уменьшение количества нейрональных связей (асинапсия) в системе поддержания равновесия в покое и при ходьбе, а морфологическим субстратом – главным образом, перивентрикулярный лейкоареоз, верифицируе- мый при магнитно-резонансной томографии головного мозга. Лечение пациентов с нарушением равновесия, вызванным дисциркуляторной энцефалопатией, включает в себя воздействие на модифицируемые факторы риска инсульта, а также индукцию нейропластичности, реализуемую путем регулярного выполнения упражнений вестибулярной реабилитации и применения фармакологических средств, модулирующих активность ряда нейротрофических факторов в головном мозге, в частности мозгового нейротрофического фактора (BDNF).
Головокружение – один из наиболее трудно интерпретируемых в клинической практике симптомов. Пациенты описывают головокружение как ощущение падения, иллюзорного вращения предметов перед глазами (т.н. системное головокружение или вертиго), нарушение пространственной ориентации, неустойчивость, "туман" в голове (несистемное головокружение). Частота разных "фенотипов" головокружения у пациентов в возрасте до 60 лет составляет 30%, а старше 85 лет – около 80% [1]. При этом около 90% больных, которые наблюдаются с диагнозом "дисциркуляторная энцефалопатия" (ДЭ), жалуются на головокружение, являющееся предиктором спонтанных падений, ассоциированных с увеличением риска переломов бедренной кости и костей запястья [1,2]. Спровоцированный головокружением бытовой травматизм приводит к снижению двигательной активности пациентов и огра ни чивает их способность к самообслуживанию, а также служит ведущей причиной случайной смертности людей старше 65 лет, страдающих ДЭ [3].
Этиология и патогенез
Еще недавно считалось, что причиной головокружения у пациентов с ДЭ является хроническая ишемия мозговых структур, кровоснабжаемых из ветвей позвоночных и основной артерий [4]. В определенные моменты у таких пациентов, как полагали, возникают состояния "декомпенсации" вследствие лабильности артериального давления или экстравазального воздействия (компрессия позвоночной артерии на уровне шейного отдела позвоночника) и других факторов, которые обусловливают развитие мозжечково-стволовой дисфункции, поскольку именно эти структуры головного мозга оказываются наиболее чувствительными к ишемии. К числу других причин головокружения у пациентов с ДЭ относили патологические извитости, врожденные нарушения развития в виде гипо- и аплазии позвоночной артерии, аномалии Киммерли, шейных ребер и др.
Однако в настоящее время представления о патогенезе хронических форм цереброваскулярных заболеваний постепенно меняются. Как известно, в МКБ-10 термин "дисциркуляторная энцефалопатия" отсутствует, что, на наш взгляд, правильно. Широкое распространение этого диагноза в нашей стране можно объяснить лишь его универсальностью (наличием ДЭ можно объяснить любую жалобу у пациентов старшего возраста), во многом отсутствием возможности проведения тщательного обследования пациентов с теми или иными симптомами и, что немало важно, глубоким проникновением термина "ДЭ" во многие приказы, инструкции и руководства, применяемые в клинической практике. В настоящее время отказаться от этого диагноза не представляется возможным, поэтому принципиальное значение приобретает понимание пато генетических основ развития статодинамических нарушений у пациентов с диагнозом "ДЭ".
Все многообразие патофизиологических процессов в головном мозге, которые приводят к появлению жалоб на головокружение при ДЭ, можно объяснить следующими причинами:
1.Мультиинфарктное состояние ("немые" инсульты) с дисфункцией стратегически важных зон – лобной и височной доли (в особенности островка), гиппокампа, мозжечка, разобщением лобно-стволовых путей при диффузном поражении белого вещества больших полушарий мозга (перивентрикулярные очаги). В настоящее время установлено свыше 300 факторов риска инсульта, которые сведены в четыре категории [5]:
- основные модифицируемые факторы риска (высокое АД, атеросклероз, курение, гиподинамия, ожирение, нездоровая диета, сахарный диабет, фибрилляция предсердий);
- другие модифицируемые факторы риска (социальный статус, психические расстройства, эмоциональное перенапряжение, абузус);
- немодифицируемые факторы риска (возраст, наследственность, национальность, пол, низкая масса тела при рождении);
- "новые" факторы риска (гипергомоцистеинемия, системные васкулиты, нарушение свертывания крови).
2.Токсическое действие ряда веществ на головной мозг и сенсорные органы, участвующие в поддержании равновесия. Поскольку злоупотребление алкоголем относят к "другим модифицируемым факторам риска инсульта", то в данную группу патологических факторов входят, главным образом, фармакологические препараты, оказывающие угнетающее действие на головной мозг и сенсорные системы организма, в том числе лекарственные средства, используемые для лечения онкологических заболеваний, некоторые антибиотики (например, гентамицин), антиконвульсанты, антидепрессанты (амитриптилин), амиодарон и др.
3.Прогрессирующие мультимодальные сенсорные нарушения (множественный сенсорный дефицит) и снижение нейропластического потенциала головного мозга – ассоциированное с возрастом угнетение центральной интеграции всех чувствительных стимулов, необходимых для поддержания равновесия. Патоморфологической составляющей вышеуказанных нарушений являются дегенеративные процессы, которые неизбежно затрагивают структуры, регулирующие процесс поддержания равновесия тела (мозжечок, подкорковые центры, ответственные за зрительный и проприоцептивный контроль движений, рецепторы вестибулярного аппарата, нейроны вестибулярных ядер), и ассоциированные с ними "нейрональные ансамбли" в проекционных зонах коры головного мозга. В частности, снижение количества волосковых клеток в лабиринте сочетается с уменьшением числа волокон в вестибулярных нервах; при этом наиболее выраженные изменения происходят в полукружных каналах, менее значимые – в саккулусе и совсем незначительные – в утрикулусе [6]. Это под твер ждается клиническими тестами: у больных с ДЭ от мечают четкое асимметричное снижение чувстви тельности к угловым ускорениям по данным теста импульсного движения головы, оценивающего вестибулоокулярный рефлекс, уменьшение динамической остроты зрения вследствие нарушения согласованных движений глазных яблок и головы, что приводит к неустойчивости, неуверенности при ходьбе, в особенности при необходимости совершать резкие повороты, и формирует пассивное поведение, направленное на избегание двигательной активности в целом [7,8].
Снижение нейропластического потенциала головного мозга отражается в низкой способности нейрональных центров к реорганизации системы контроля равновесия тела после, например, приступа доброкачественного пароксизмального позиционного головокружения (ДППГ) или острого нарушения мозгового кровообращения, а также в ситуациях, требующих адаптации к передвижению в сложных условиях (например, ходьба по скользкой дороге или в условиях плохой видимости). Ключевыми элементами данного феномена являются снижение плотности нейронов в медиальном вестибулярном ядре, играющем важную роль в компенсации вестибулярных нарушений за счет активизации комиссуральных волокон; уменьшение количества клеток Пуркинье в мозжечке человека примерно на 2,5% каждые 10 лет в течение жизни; "старение" системы визуального контроля – нарушение аккомодации, стереоскопического зрения, способности подавлять нистагм фиксацией взора на фоне увеличения латентности саккад и снижения скорости следящих движений глазных яблок [9,10].
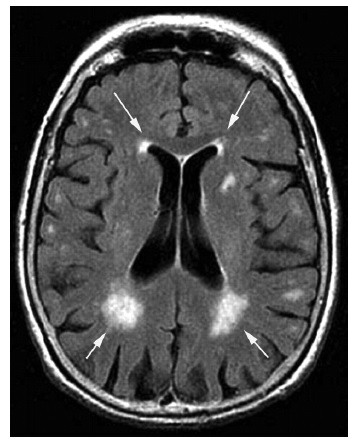
Таким образом, патогенетической основой развития головокружения у пациентов с диагнозом "дисциркуляторная энцефалопатия" является уменьшение количества нейрональных связей (асинапсия) в системе поддержания равновесия в покое и при ходьбе, а морфологическим субстратом – главным образом, перивентрикулярный лейкоареоз. Последнему феномену уделяют особое внимание специалисты, занимающиеся проблемами головокружения. В настоящее время четко установлено, что перивентрикулярный лейкоареоз ассоциирован с нарушением функций головного мозга, требующих сложного взаимодействия между различными его областями – памяти, мышления, поддержания равновесия и нормальной походки [11]. В основе развития лейкоареоза лежат деструкция волокон белого вещества с утратой миелина (демиелинизация), постинсультные очаги (с частичной или полной демиелинизацией и избирательной утратой клеточных элементов или аксонов, но без четко отграниченной зоны некроза), отек ткани головного мозга, расширение внеклеточных пространств, образование кист, ангиоэктазии, расширение периваскулярных пространств (рис. 1). Очаги лейко ареоза располагаются в зонах конечного кровообра щения перфорирующих артерий и артерий микроциркуляторного русла, которые практически не имеют коллатерального кровообращения. Эти участки крайне уязвимы в условиях нестабильной циркуляции крови, например, при лабильности артериального давления (инсульт "водораздела"). Выраженность перивентрикулярного лейкоареоза коррелирует с частотой падений [12].
Клинические проявления
При клиническом обследовании пациентов с ДЭ, предъявляющих жалобы на головокружение, выявляют нарушение походки и страх падения. Нарушения ходьбы при ДЭ могут быть представлены следующими проявлениями:
- уменьшение длины шага;
- ослабление содружественных движений рук при ходьбе;
- затруднение инициации ходьбы;
- шарканье (походка "лыжника" или "магнетическая походка");
- избыточный наклон туловища вперед во время ходьбы.
По мере прогрессирования заболевания к общему паттерну изменения ходьбы при ДЭ присоединяются более сложные расстройства в виде нарушения инициации ходьбы, неустойчивости при поворотах и связанные с ними падения. Такое нарушение походки можно отнести к расстройствам высшего уровня – интегративным нарушениям двигательного контроля. Они связаны с поражением лобных долей, а также их связей и вызваны нарушением процессов выбора и инициации локомоторных и постуральных программ, а не их реализацией, и не зависят от какой-либо другой неврологической патологии (например, нарушения чувствительности или парезов). Такой статодинамический дефект особенно грубо проявляется в "переходных" ситуациях при поворотах, ходьбе в незнакомых условиях и т.п. (когда одна двигательная программа должна смениться другой) и, следовательно, отражает дефект планирования.
Нарушение автоматизированной регуляции ходьбы требует значительного напряжения механизмов произвольного контроля, включающих, в том числе, и когнитивные функции, прежде всего внимание. Однако и этот ресурс компенсации у больных с нарушениями высшего уровня существенно ограничен вследствие сопутствующего поражения лобно-подкорковых связей, участвующих в регуляции когнитивных функций. Соответственно, любая дополнительная нагрузка на когнитивную сферу во время ходьбы (например, счет или просто отвлечение внимания на новый стимул) может привести к несоразмерно тяжелому ухудшению функции ходьбы; тот же эффект может давать неожиданная эмоциональная реакция.
Кроме того, считается, что разрыв лобно-теменных и лобно-подкорковых связей нарушает нормальное функционирование как афферентных, так и эфферентных постуральных рефлексов. Иннервация статических мышц, необходимых для поддержания устойчивости, двусторонняя, поэтому развитие статодинамических нарушений у пациентов с ДЭ возникает только вследствие билатерального поражения перивентрикулярного белого вещества [13]. При односторонних процессах любые клинические проявления ДЭ будут несущественными или достаточно хорошо компенсированными.
В большинстве тяжелых случаев ДЭ нарушению походки сопутствуют нарушение мочеиспускания по центральному типу и подкорковая деменция (что требует исключения нормотензивной гидроцефалии).
Диагностика
При неврологическом обследовании пациентов с жалобами на головокружения в рамках ДЭ в протокол общепринятого осмотра необходимо ввести следующие клинические тесты [14]:
- Проба Дикса-Холлпайка и по показаниям другие тесты для исключения ДППГ, поскольку у пациентов пожилого возраста отмечается высокий риск развития отолитового головокружения. Особенностью течения данного заболевания у людей в возрасте старше 60 лет является меньшая выраженность собственно приступов вертиго. Поэтому больные могут предъявлять жалобы не на приступообразное головокружение, возникающее при изменении положения головы, а на постоянное ощущение неустойчивости и нарушение походки. Кроме того, у пациентов с ДЭ значительно снижен нейропластический потенциал, необходимый для реорганизации системы контроля равновесия тела после приступа ДППГ.
- Проба Уемуры – стояние на одной ноге с открытыми глазами. Установлено, что существует обратная корреляционная взаимосвязь между временем стояния в данной пробе и выраженностью перивентрикулярного лейкоареоза по данным МРТ, а также с количеством падений в предшествующем осмотру году [12].
- Оценка походки (во всех трех тестах оцениваются качественные особенности походки больного и его способность сохранять равновесие): обычная ходьба; ходьба по одной линии (тандемная); тест "поворот": пациенту предлагают пройти по коридору обычным шагом, а затем по команде врача "поворот" резко развернуться на 180° и пойти в противоположную сторону.
- Тест "встать и пойти" ("up and go") с высокой степенью надежности и специфичности применяется для количественной оценки базовой функциональной мобильности у людей пожилого возраста. Пациента просят из положения сидя встать со стула, пройти 3 метра до искусственного препятствия (бутылка, конус и т.п.), обойти его, вернуться к стулу и сесть обратно. Оценка теста производится следующим образом: 10 с и менее – норма; 11-20 с – пограничное значение, решение принимается индивидуально (норма для пациентов старческого возраста); более 20 с – пациент нуждается в использовании дополнительной опоры (трость); необ ходимо проведение дообследования с целью выявления причины такого состояния; более 30 с – крайне высокий риск падения; нуждается в использовании надежной опоры (ходунки), исключение актуальной патологии, в первую очередь, нормотензивной гидроцефалии.
- Оценка болевой и глубокой чувствительности, в том числе с применением специальной калиброванной кисти и монофиламента.
- Тест ретропульсии, или тест Тевенара, считается золотым стандартом для оценки постуральной неустойчивости и, соответственно, является неотъемлемой частью неврологического осмотра пациента не только с паркинсонизмом, но и с любыми другими нарушениями походки. Методика проведения теста Тевенара заключается в оценке баланса после быстрой перемены направления движения на обратное, а подсчет количества шагов для коррекции баланса (или их полное отсутствие) используется для оценки степени выраженности постуральной неустойчивости. Здоровые люди восстанавливают равновесие с помощью одного или двух больших шагов или увеличивают нагрузку на бедра, размахивая руками вперед, в качестве противовеса или не совершают шагов назад вовсе. В случае выполнения 3 и более шагов или падения пациента тест оценивается как положительный.
Инструментальная диагностика у пациентов с нарушением равновесия в рамках предполагаемой ДЭ должна включать:
- МРТ головы (желательно на высокопольном томографе);
- оценка факторов риска инсульта (суточное мониторирование ЭКГ и АД, ультразвуковое дуплексное сканирование брахиоцефальных артерий, эхокардиография и др.);
- электронейромиография нижних конечностей при подозрении на наличие полиневропатии. В лабораторное обследование данной группы больных непременно следует включить:
- липидный профиль, коагулограмма, параметры углеводного обмена;
- уровни тиреотропного гормона, витамина В12 и фолиевой кислоты.
Пациентов с нарушением равновесия и диагнозом ДЭ необходимо также направлять на консультацию офтальмолога, поскольку нарушение остроты зрения может оказывать "драматическое" влияние на возможность сохранения равновесия у данной категории больных. Кроме того, желательно исключить остеопороз/остеопению, так как, с одной стороны, риск падений у пациентов пожилого возраста увеличивает риск переломов [15], а, с другой стороны, уменьшение костной (остеопороз/остеопения) и мышечной массы (саркопения) ассоциированы с нарушением походки и страхом падений.
Также важно провести "ревизию" препаратов, ис поль зуемых больным, с целью выявления лекарственных средств, способных вызвать нарушение походки и головокружение у пожилых пациентов (антиконвульсанты, сартаны, акатинол и др.).
Лечение
Современная парадигма лечения головокружения у пациентов с ДЭ в основном сводится к поиску новых лекарственных препаратов, позволяющих активизировать церебральный кровоток и/или метаболические процессы в головном мозге. Однако такой подход оправдан лишь отчасти. Основу лечения пациентов с ДЭ и нарушением равновесия составляет воздействие на модифицируемые факторы риска инсульта. Этой стратегии посвящено множество исследований и публикаций [16,17]. И здесь следует отметить тот факт, что в последние десятилетия акцент первичной профилактики инсульта все более и более смещается в сторону нефармакологического лечения (отказ от курения, борьба с избыточной массой тела, гиподинамией и др.). Одним из наглядных примеров этому служит пересмотр порядка применения аспирина для профилактики инсульта у пациентов без острых цереброваскулярных катастроф в анамнезе [18].
Во-первых, было установлено, что использование аспирина достоверно снижает риск инсульта у пациентов в возрасте 50-69 лет, у которых риск его развития повышен по крайней мере на 10% (расчет риска производится с помощью специального калькулятора, учитывающего пол, возраст, расу, уровень липидов в крови, АД, наличие сахарного диабета, курение [19]). Выраженность положительного эффекта аспирина зависела от возраста и степени риска развития инсульта, при этом достоверные результаты были получены при длительности непрерывного приема аспирина 5-10 лет.
Во-вторых, было показано, что применение аспирина у пациентов моложе 50 и старше 69 лет достоверно не влияет на риск развития инсульта (даже при наличии повышенного риска).
В третьих, последние данные свидетельствуют о том, что положительный эффект аспирина в дозе 75 мг сопо ставим с таковым при использовании более высоких доз препарата. При этом чем выше доза, тем выше риск развития кровотечения.
Таким образом, современные рекомендации по первичной профилактике инсульта с помощью аспирина выглядит следующим образом:
Лица в возрасте 50-59 лет, имеющие 10-летний риск развития инсульта ≥10%: показан прием низких доз аспирина (≤100 мг/сут), если ожидаемая продолжительность жизни составляет 10 лет и более, а пациент готов регулярно принимать аспирин в течение не менее 10 лет. В этой группе ожидаемый положительный эффект от приема аспирина для профилактики инсульта максимален.
Лица в возрасте 60-69 лет, имеющие 10-летний риск развития инсульта ≥10%: индивидуальный подход. Если риск кровотечения низкий, ожидаемая продолжительностью жизни составляет 10 лет и более, а пациент готов регулярно ежедневно принимать аспирин в течение не менее 10 лет, то препарат может быть назначен в низких дозах (≤100 мг/сут). У таких пациентов повышен риск развития кровотечения на фоне приема аспирина.
Лица моложе 50 лет: нет достоверных данных, свидетельствующих о пользе или вреде применения аспирина для профилактики инсульта.
Лица в возрасте 70 лет и старше: нет достоверных данных, свидетельствующих о пользе или вреде применения аспирина для профилактики инсульта.
Другим важным направлением в лечении нарушений равновесия у пациентов с ДЭ является стимуляция нейропластичности, которая позволит решительно изменить функционирование нейросетей, ответственных за поддержание равновесия тела, и создать тем самым основу для эффективного саногенеза. Действительно, для осуществления эффективного контроля равновесия тела головной мозг использует всю поступающую сенсорную информацию: зрительную, вестибулярную, проприоцептивную и даже слуховую. Полученные данные анализируются в нейрональных центрах различной подчиненности, что позволяет сформировать адекватный двигательный ответ. В случае необходимости головной мозг способен осуществлять быструю "переключаемость внимания" с одного сенсорного потока на другой: например, при переходе с освещенной стороны улицы на более темную происходит мгновенная дополнительная активация нейрональных сетей, ответственных за анализ проприоцептивных стимулов от нижних конечностей, благодаря чему сохраняется четкий контроль над равновесием. У пациентов, страдающих ДЭ, имеет место мозаичное поражение всех систем, регулирующих координацию движений. Поэтому идеальная схема ведения пациентов с головокружением на фоне ДЭ помимо "агрессивной" коррекции факторов риска инсульта должна состоять из комбинации упражнений вестибулярной реабилитации, целью которых является таргетная активизация нейропластических процессов в стратегически важных зонах головного мозга, и фармакологической стимуляции экспрессии нейротрофических факторов с помощью индукторов нейропластичности.
Упражнения вестибулярной реабилитации являются мощным активатором адаптивной нейропластичности, позволяющим формировать и поддерживать функциональные системы, которые обеспечивают максимально эффективную компенсацию статических нарушений на основе следующих трех принципов: адаптация (ремоделирование нейрональных связей), замещение (усиление роли "невестибулярных" сенсорных сигналов в сохранении статического контроля) и привыкание (увеличение порога для сенсорных раздражителей). Анализ результатов выполнения упражнений вестибулярной реабилитации демонстрирует высокую их эффективность у пациентов с хроническим головокружением. В особенности это касается таких ситуаций, как способность к самообслуживанию и улучшение качества жизни. При этом наиболее эффективна индивидуальная программа вестибулярной реабилитации на основе комплексного обследования. Например, если у пациента с головокружением присутствует слабость в мышцах нижних конечностей, помимо выполнения "классических" упражнений вестибулярной реабилитации необходимо уделить внимание увеличению мышечной силы (ЛФК, магнитная стимуляция и др.).
Среди фармакологических агентов, способных индуцировать нейропластические процессы в головном мозга, следует выделить винпоцетин (Кавинтон). Действующим веществом препарата является этиловый эфир аповинкаминовой кислоты – синтетическое производное винкамина, алкалоида барвинка малого. В основе клинического эффекта винпоцетина лежит ингибирование фосфодиэстеразы (Са/кальмодулинзависимой 1-го типа) и потенциалзависимых Na+-каналов, что позволяет ему оказывать непосредственное действие на глутаматные рецепторы, ингибировать перекисное окисление липидов, вызывать вазодилатацию, тормозить агрегацию тромбоцитов и увеличивать деформируемость эритроцитов [20]. При этом препарат оказывает нормализующее действие на артерии головного мозга как с повышенным, так и пониженным тонусом, восстанавливая способность к ауторегуляции церебрального кровообращения и предотвращая развитие вазоконстрикторных реакций. Кроме того, Кавин тон препятствует нейрональной гибели в области гиппокампа, стимулирует норадренергическую систему восходящей ретикулярной формации [21] и оказывает модулирующее влияние на нейропластичность (увеличивает рост дендритных шипиков) [22].
В открытом клиническом исследовании 2016 г. мы оценивали эффективность Кавинтона Комфорте (новойдиспергируемой формы) в комплексной терапии (включающей выполнение упражнений вестибулярной реабилитации) хронического головокружения у пациентов с ДЭ [23]. У пациентов основной группы, получавших винпоцетин, через 3 месяца от начала лечения отмечались статистически значимые позитивные изменения по данным всех исследуемых параметров – длительность и выраженность головокружения (визуальная аналоговая шкала), расширение двигательной активности пациентов в течение дня (шкала оценки влияния головокружения на повседневную активность – Dizzi ness Handicap Inventory), повышение приверженности к лечению (Drug Attitude Inventory). Важно, что уровень нейротрофического фактора мозга (BDNF) в плазме крови у пациентов этой группы повысился практически в 3 раза по сравнению с исходным значением. Этот факт свидетельствует о том, что в основе терапевтического эффекта Кавинтона Комфорте лежит модуляция нейропластичности головного мозга.
Как известно, маркерами и регуляторами нейропластичности являются нейротрофические ростовые факторы (НРФ), которые относятся к физиологически активным полипептидам, регулирующим рост и дифференцировку нейронов в процессе филогенеза, а также способствующим формированию новых синаптических связей в постнатальном периоде [24]. В связи с этим НРФ играют решающую роль в патогенезе нейродегенеративных заболеваний, а также в восстановлении функций при сосудистых и травматических поражениях нервной системы [25]. BDNF занимает особое положение среди НРФ, так как он участвует в дифференцировке нейронов и модулирует активность разных типов клеток в центральной нервной системе, способствует функциональной матурации нейронов, участвует в образовании новых синапсов и арборизации дендритов, поддерживает рост спинальных сенсорных и моторных нервных клеток, а также дофаминергических нейронов черной субстанции, холинергических и ГАМК-ергических нейронов коры головного мозга [26].
Экспрессия BDNF происходит либо конститутивно (возрастание уровня BDNF совпадает с периодом, когда лобная кора созревает структурно и функционально), либо в ответ на внешние стимулы (исключительная особенность BDNF, поскольку высвобождение ни одного из известных в настоящее время нейротрофинов или ростовых факторов не имеет прямой зависимости от внешних факторов). В связи с этим пик концентрации BDNF в головном мозге приходится на молодые годы, а относительно постоянные его уровни определяются в зрелом и старческом возрасте [27]. Важно отметить, что концентрация BDNF в периферической крови может отражать уровень его экспрессии в ЦНС, также как это в настоящее время доказано для серотонина [28]. Снижение экспрессии BDNF наблюдается при болезни Альцгеймера и других формах деменции, болезни Паркинсона, хорее Гентингтона и ряде психиатрических заболеваний [25,29]. BDNF участвует в регуляции энергетического гомеостаза организма, поэтому нарушение его экспрессии играет важную роль в развитии сахарного диабета 2 типа, ожирения и метаболического синдрома [30]. Физические упражнения способствуют повышению образования BDNF в головном мозге, а экзогенное введение BDNF может пред отвращать гибель нейронов и снижать их чувствительность к глутаматной эксайтотоксичности [31].
Таким образом, результаты нашего исследования свидетельствуют о том, что сочетание фармакологического лечения (Кавинтон Комфорте) и упражнений вестибулярной реабилитации у пациентов с ДЭ, которых беспокоит головокружения, имеет крайне большое значение, поскольку позволяет уменьшить выраженность статических нарушений и снизить риск падений. Использование подобной комбинации обеспечивает значимое улучшение качества жизни больных в короткие сроки и приверженности к терапии. Данный эффект реализуется посредством индукции нейропластических процессов в головном мозге, в частности, за счет стимуляции экспрессии BDNF. В связи с этим Кавинтон Комфорте можно применять для лечения не только цереброваскулярных, но и других неврологических заболеваний, требующих стимуляции нейропластичности (нейродегенеративных и посттравматических). Кроме того, на наш взгляд, у пациентов с нарушением равновесия в рамках ДЭ необходимо максимально ограничивать по времени использование препаратов, обладающих отрицательным воздействием на нейропластичность (например, бетагистина гидрохлорид, дименгидринат) [32,33], так как они замедляют развитие центральных компенсаторных процессов.
Используемые источники
- Barin KK, Dodson EE. Dizziness in the elderly. Otolaryngol Clin North Am 2011;44: 437-54.
- Ekvall Hansson E, Magnusson M. Vestibular asymmetry predicts falls among elderly patients with multi-sensory dizziness. BMC Geriatr 2013;13:77-8.
- Mueller M, Strobl R, Jahn K, et al. Burden of disability attributable to vertigo and dizziness in the aged: results from the KORA-Age study. Eur J Public Health 2014;24:802-7.
- Барулин А.Е., Курушина О.В., Пучков А.Е. Вертебро-базилярная недостаточность. Вестник Волгоградского государственного медицинского университета 2014;51(3):3-8.
- Guzik A, Bushnell C. Stroke epidemiology and risk factor management. Cerebro-vascular Disease. Continuum (Minneap Minn) 2017;23(1):15-39.
- Merchant SN, Velazquez-Villasenor L, Tsuji K, et al. Temporal bone studies of the human peripheral vestibular system. Normative vestibular hair cell data. Ann Otol Rhinol Laryngol Suppl 2000;181:3-13.
- Ishigaki H, Miyao M. Implications for dynamic visual acuity with changes in aged and sex. Percept Mot Skills 1994;78:363-9.
- Li C, Layman AJ, Geary R, et al. Epidemiology of vestibulo-ocular reflex function: data from the Baltimore longitudinal study of aging. Otol Neuroto 2015;36:267–72.
- Alvarez JC, Díaz C, Suárez C, et al. Neuronal loss in human medial vestibular nuc leus. Anat Rec 1998;251:431-8.
- Yesmin T, Ara S, Umar BU, et al. Numbers of Purkinje cell with increasing agea post mortem study. Faridpur Med Coll J 2011;6:92-4.
- Baszner H, et al. Association of gait and balance disorders with age-related white matter changes. The LADIS study. Neurology 2008;70:935-42.
- Blahak C, Baezner H, Pantoni L, et al. Deep frontal and periventricular age related white matter changes but not basal ganglia and infratentorial hyperintensities are associated with falls: cross sectional results from the LADIS study. J Neurol Neurosurg. Psychiat 2009;80:608-13.
- Freund HJ, Hummelsheim H. Lesions of premotor cortex in man. Brain 1985;108:697-733.
- Топическая диагностика заболеваний и травм нервной системы. Под ред. М.М.Одинака. СПб.: 2010, 310 c.
- Sözen T, Özışık L, Çalık N. An overview and management of osteoporosis. Eur J Rheumatol 2017;4(1):46-56.
- Одинак М.М., Янишевский С.Н., Цыган Н.В. и др. Применение сукцинатов для коррекции метаболических нарушений в зоне ишемической полутени у пациентов с инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова, приложение "Инсульт" 2013;12:55-60.
- Tolat A, Lippman N. Update on the non-pharmacological management of stroke prevention in patients with atrial fibrillation. J Clin Med 2018;12(7):32.
- Bibbins-Domingo K. Aspirin use for the primary prevention of cardiovascular disease and colorectal cancer: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 2016;164 (12):836-45.
- Goff DC, Lloyd-Jones DM, Bennett G, et al; American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. 2013 ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guide lines. J Am Coll Cardiol 2014;63:2935-59.
- Kiss B, Karpati E. Mechanism of action of vinpocetine. Acta Pharm Hung 1996;66(5):213-24.
- Gulyás B, Tóth M, Schain M, et al. Evolution of microglial activation ini schaemic core and peri-infarct regions after stroke: A PET study with the TSPO molecular imaging biomarker [11C]vinpocetine. J Neurol Sci 2012;320:110-7.
- Скоромец А.А, Алиев К.Т., Лалаян Т.В. и др. Когнитивные функции и лечение их нарушений при хронической недостаточности кровообращения в вертебрально-базилярной системе у пожилых. Журнал неврологии и психиатрии 2013;113(4):18-24.
- Живолупов С.А., Самарцев И.Н., Яковлев Е.В. и др. Эффективность винпоцетина (Кавинтона Комфорте) в лечении головокружения у пациентов с дисциркуляторной энцефалопатией и его влияние на концентрацию нейротрофического фактора мозга (BDNF) в плазме. Клин фармакол тер 2016; 25(1):48-53.
- Park H, Poo M. Neurotrophin regulation of neural circuit development and function. Nat Rev Neurosci 2013;14:7-23.
- Zuccato C, Cattaneo E. Brain-derived neurotrophic factor in neurodegenerative diseases. Nature Rev Neurol 2009;5(6):311-22.
- Robinson RC, Radziejewski C, Stuart DL, Jones EY. Structure of the brainderived neurotrophic factor/neurotrophin 3 heterodimer. Biochemistry 1995; 34:4139-46.
- Waterhouse EG, Xu B. New insights into the role of brain-derived neurotrophic factor in synaptic plasticity. Mol. Cell Neurosci 2009;42:81-9.
- Lesch KP, Bengel D, Heils A, et al. Association of anxiety-related traits with a polymorphism in the serotonin transporter gene regulatory region. Science 1996;274:1527–31.
- Литвиненко И.В. Болезнь Паркинсона. М.: Миклош. 2006, 216 c.
- He M, Wang J. Decreased serum brain-derived neurotrophic factor in Chinese patients with type 2 diabetes mellitus. Acta Biochim Biophys Sin (Shanghai) 2014; 46:426-7.
- Smith MA, Makino S, Kvetnansky R, Post RM. Stress and glucocorticoids affect the expression of brain-derived neurotrophic factor and neurotrophin-3 mRNAs in the hippocampus. J Neurosci 1995;15:1768-77.
- Lacour M, Sterkers O. Histamine and betahistine in the treatment of vertigo. Elucidation of mechanisms of action. CNS Drugs 2001;15(11):855-70.
- Strupp M, Brandt T. Vestibular neuritis. Semin Neurol 2009;29:55-60.
