Прогнозный экономический эффект применения алирокумаба у пациентов с гиперхолестеринемией и высоким сердечно-сосудистым риском
Оценка экономической целесообразности включения алирокумаба в государственные программы возмещения для льготных категорий граждан.
На основании результатов опубликованных исследований проведена сравнительная оценка влияния на бюджет медицинских технологий с добавлением алирокумаба к терапии статинами и эзетимибом и стандартной терапии статинами и эзетимибом для вторичной профилактики после острого коронарного синдрома (ОКС) с горизонтом времени 2 года. Использовали Марковское моделирование и расчет прямых медицинских затрат. Для проверки устойчивости результатов проведен анализ чувствительности в отношении изменения стоимости алирокумаба. Стоимость болезни рассчитывали как совокупность прямых медицинских затрат (препараты, лечение сердечно-сосудистых заболеваний, аферез) и непрямых затрат (потери валового внутреннего продукта вследствие временной нетрудоспособности, сердечно-сосудистого заболевания или смертельного исхода).
Включение алирокумаба в программу государственного возмещения позволяет уменьшить нагрузку на бюджет на 49,05% у больных высокого сердечно-сосудистого риска, в том числе у больных семейной гиперхолестеринемией и рефрактерностью к стандартной гиполипидемической терапии. Экономия возникает в том числе за счет меньшей потребности в аферезе липидов плазмы крови при применении алирокумаба. Уменьшение финансового бремени болезни более чем на 50% в расчете на трудоспособное население при использовании алирокумаба ожидается за 2 года. Анализ чувствительности подтвердил устойчивость полученных результатов при искусственном увеличении цены препарата в 2,84 раза. Применение алирокумаба позволяет снизить бремя заболевания на 56,49%, или 7,78 млрд руб., в год для целевой группы за 2 года терапии по сравнению с текущей практикой лечения (с учетом непрямых затрат).
Полученные результаты позволяют считать включение алирокумаба в программы государственного (страхового) возмещения для вторичной профилактики после перенесенного ОКС экономически оправданным.
Многочисленные популяционные исследования свидетельствуют о том, что при применении гиполипидемических препаратов в реальной клинической практике необходимый (безопасный) уровень липидов крови не достигается у большинства пациентов [1-3]. Особое внимание уделяется тому факту, что даже у пациентов группы самого высокого риска, у которых должна проводиться наиболее "жесткая" вторичная профилактика, например, после острого коронарного синдрома (ОКС), стандартная гиполипидемическая терапия часто не обеспечивает целевой уровень холестерина липопротеидов низкой плотности (ЛНП) [4]. Как подчеркивают исследователи, одной из причин неэффективности вторичной профилактики статинами является возможная непереносимость высоких доз этих препаратов. Так, в клинических исследованиях частота миопатии, вызванной статинами, достигала 5%, а в обычной клинической практике это осложнение при использовании оптимальных доз статинов встречалось еще чаще [5,6]. Снижению эффективности вторичной профилактики сердечнососудистых событий, включая преждевременную смерть, может способствовать невыполнение больными врачебных рекомендаций, касающихся терапии статинами [7]. Более половины пациентов, нуждающихся в статинах, в первую очередь для профилактики повторных событий, получают субоптимальные дозы или вообще не принимают эти препараты [8], а среди оставшихся велика доля пациентов с высоким риском сердечно-сосудистой смерти (SCORE>20%) и низкой приверженностью к терапии статинами [9].
Не лучше обстоят дела с приемом гиполипидемических препаратов и у больных, перенесших первый ОКС. Перед выпиской из стационара таким пациентам практически всегда рекомендуют лечение статинами, однако через несколько лет эти препараты продолжают принимать не более 41% больных, да и то в низких, а, следовательно, малоэффективных, суточных дозах [10]. В европейских странах в течение года после выписки из стационара 40–75% пациентов, перенесших ОКС, также перестают принимать статины [11]. На приверженность к лечению влияют различные факторы, среди которых центральную роль играет поведение больного, который, сталкиваясь с побочными эффектами статинов или опасаясь их потенциальной токсичности, прекращает лечение или самостоятельно снижает дозу препарата. Опрос врачей свидетельствует о том, что и специалисты подвержены определенной инерции в принятии решения о терапии и нередко рекомендуют дозы, явно недостаточные для достижения целевого уровня липидов [12].
Особое внимание следует уделять больным сахарным диабетом 2 типа (СД), у которых чаще развиваются тяжелые сердечно-сосудистые события [13]. Так, вероятность ишемической болезни сердца (ИБС) у больных СД 2 типа по сравнению с другими категориями пациентов повышена в 2,0-3,0 раза, инфаркта миокарда – в 2,4-3,3 раза, инсульта – в 2,0 раза, а сердечно-сосудистой смерти — в 1,14 раза [14-16]. Такие больные нуждаются в эффективной гиполипидемической терапии, но около трети из них самостоятельно отказываются от приема статинов в течение года после назначения [17]. Кроме того, больным СД 2 типа почти в 3 раза чаще требуется повторная реваскуляризация коронарных артерий, которая ассоциируется с более высоким риском тяжелых осложнений [18,19].
Принципиально новым подходом к лечению дислипидемии является применение моноклональных антител, блокирующих фермент PCSK9, который регулирует деградацию (разрушение) рецептора к ЛНП [20]. Одним из таких препаратов является алирокумаб [21]. В рандомизированных клинических исследованиях лечение алирокумабом в дополнение к статинам и эзетимибу или в качестве альтернативы другим гиполипидемическим средствам вызывало значительное снижение уровня ЛНП и позволяло достичь целевых значений липидов крови [22]. Приверженность к лечению в течение как минимум 71 недели была почти 100%. При этом отклонение от интервала введения (раз в две недели) на 3 дня не сказывалось на терапевтическом эффекте [23]. По данным мета-анализа, снижение риска сердечнососудистых событий при лечении ингибиторами PCSK9, добавленными к комбинированной терапии статинами и эзетимибом, составило 51%, а при стандартной терапии статинами и эзетимибом – только 6% [24]. Соответственно, при оценке технологий в здравоохранении с применением этих схем коэффициенты числа возможных событий в течение 2 лет после ОКС составили 0,94 при стандартной фармакотерапии и 0,49 при применении алирокумаба [25]. Два препарата этого класса – алирокумаб и эволокумаб – с 2018 г. включены в Перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) [26].
Существенное увеличение доступности препаратах этой группы в нашей стране возможно на условиях государственного (страхового) возмещения. Ранее проведенный анализ [25] показал экономическую целесообразность включения алирокумаба в Перечень ЖНВЛП. Целью данного исследования была оценка экономической целесообразности включения алирокумаба в Перечень лекарственных препаратов для льготных категорий граждан (Перечень ОНЛС) для лечения пациентов высокого сердечно-сосудистого риска.
Материал и методы
В качестве целевой группы выбраны пациенты с семейной гиперхолестеринемией, перенесшие ОКС и реваскуляризацию миокарда в течение последнего года, рефрактерные к применению статинов и эзетимиба в максимальных переносимых дозах и нуждающиеся в аферезе липидов [27]. Расчетные данные показывают, что такие больные составляют не менее 19,4% от общего числа больных, перенесших ОКС [9]. Отечественные данные об интенсификации липидснижающей терапии у пациентов высокого сердечнососудистого риска отсутствуют, поэтому для проведения расчетов использовали данные, полученные в США [27].
Горизонт анализа составил 2 года в соответствии с принятой методикой [28] и данными клинических исследований алирокумаба [27]. При определении прямых затрат учитывали режимы применения анализируемых препаратов, указанные в соответствующих исследованиях [29,30] и в официальных инструкциях по медицинскому применению (табл. 1) [31]. В качестве препарата сравнения при оценке затрат на стандартную гиполипидемическую терапию рассматривали аторвастатин в максимальной дозе 80 мг/сут (включенный в Перечень ОНЛС) [26] в комбинации с эзетимибом в дозе 10 мг в сутки (не включен в ЖНВЛП).
| Препарат | Режим применения | Стоимость упаковки с 10% НДС (руб.) |
|---|---|---|
| Алирокумаб (Пралуэнт) (раствор для подкожного введения 75 или 150 мг/мл №2) | 1 инъекция каждые 2 нед. | 29 260,81 |
| Эзетимиб (Эзетрол) (таблетки 10 мг № 28) | 10 мг/сут длительно | 1 784,94 |
| Аторвастатин (Липримар) (таблетки 80 мг №30 | 80 мг/сут длительно | 1 095,50 |
Средняя стоимость эзетимиба (Эзетрол) рассчитана с учетом оптовой цены за вычетом максимальной оптовой надбавки и с учетом НДС [32]. Стоимости алирокумаба (Пралуэнт) и аторвастатина (Липримар) определены на основании Регистра предельных отпускных цен с учетом НДС [33].
Анализ "влияние на бюджет". Анализ влияния на бюджет при включении алирокумаба в режимы фармакотерапии у пациентов целевой популяции проводили согласно утвержденным правилам [34] по сравнению с препаратами, уже включенными в Перечень ОНЛС. С использованием моделирования сравнивали две альтернативные медицинские технологии:
- текущий режим терапии с использованием статина в максимальных переносимых дозах и эзетемиба (целевых уровней ХС ЛНП достичь не удается);
- добавление к статинам и эзетимибу алирокумаба.
При недостаточной эффективности лечения показан аферез липидов плазмы крови, который проводится один раз в 2 недели. Модель Маркова, описывающая применение анализируемых технологий в рамках проводимого анализа, представлена на рис. 1.
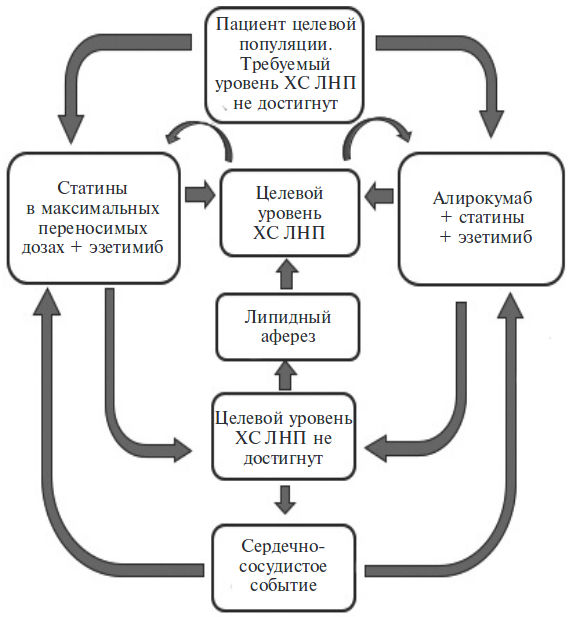
Для анализа влияния на бюджет учитывали прямые затраты на лекарственные препараты и аферез и прямые затраты на лечение сердечно-сосудистых событий.
В табл. 2. приведены данные о частоте применения афереза у пациентов, получающих алирокумаб и плацебо (т.е. только на фоне стандартной терапии) [35]. Согласно Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 г. [36] стоимость одного дня лечения аферезом липидов плазмы крови в условиях дневного стационара за счет средств ОМС составляет 14 619,50 руб. Согласно КСГ №34 "Лечение наследственных атерогенных нарушений липидного обмена с применением афереза (липидная фильтрация, афинная и иммуносорбция липопротеидов) в случае отсутствия эффективности базисной терапии" предусмотрен коэффициент затрат 5,07, что составляет в сумме 74 120,86 руб./1 сеанс [37].
| Процент выполненных процедур афереза от необходимого числа | Средневзвешенный процент пациентов, получающих аферез, принятый для расчета | Частота афе реза в группе алиро кумаба, % | Частота афе реза в группе сравнения (%) |
|---|---|---|---|
| Аферез не проводится | 0 | 63,4 | 0 |
| >0% - ≤25% | 12,5 | 17,1 | 0 |
| >25% - ≤50% | 37,5 | 12,2 | 14,3 |
| >50% - ≤75% | 62,5 | 2,4 | 23,8 |
| >75% - ≤100 | 87,5 | 2,4 | 33,3 |
| 100% | 100 | 2,4 | 28,6 |
При оценке частоты сердечно-сосудистых событий учитывали базовую вероятность их наступления в группе, экстраполированную на целевую группу с глобальной модели по оценке влияния на бюджет при включении препарата алирокумаб в схему лечения (табл. 3).
| Событие | Вероятность наступления в год, % | Стоимость законченного случая (руб.) |
|---|---|---|
| Примечание: *Среднее между осложненной и неосложненной формой.**Средняя стоимость при равной частоте осложнений: тромбоэмболии легочной артерии, фибрилляции предсердий (с оперативным пособием и без), сердечно-легочная недостаточность | ||
| Нефатальный инфаркт миокарда | 9 | 52 520,14* |
| Нестабильная стенокардия | 1 | 80 374,94** |
| Реваскуляризация миокарда | 36 | 207 418,08 |
| Нефатальный инсульт | 2 | 120 297,40 |
| Сердечно-сосудистая смерть | 4 | -- |
По данным мета-анализа М. Silverman и соавт. [38], снижение риска сердечно-сосудистых событий при использовании ингибиторов PCSK9 составляет 51%, а при лечении статином и эзетемибом – 6%. Эти показатели учитывали при расчете частоты сердечно-сосудистых событий в группах пациентов, получающих стандартную терапию и алирокумаб. Затраты на лечение сердечно-сосудистых событий рассчитывали, исходя из стоимости лечения одного законченного случая согласно тарифному соглашению ОМС по Москве 2017 г. (табл. 3) [39].
При расчете затрат на терапию учитывали смертность пациентов, в связи с которой они выбывали из исследования. Было сделано допущение, что число случаев смерти распределяется равномерно в течение года. Анализ чувствительности проводили для проверки устойчивости полученных результатов основного сценария к изменению входного параметра – стоимости препарата алирокумаб. Анализ "стоимости болезни" включал кроме вышеперечисленных затрат оценку непрямых расходов (недополучение валового внутреннего продукта – ВВП). Непрямые затраты в виде потери ВВП по причине смерти пациентов на период дожития до возраста завершения экономической активности (72 года) рассчитывали в соответствии с требованиями нормативных документов [40]. Расчет проводили для группы из 1000 пациентов с последующим перерасчетом на 1 пациента.
Размер недополученного ВВП рассчитывали путем деления годового ВВП страны на численность работоспособного населения и число рабочих дней в году. ВВП за 2016 г. составил 85 880,6 млрд руб, занятое население – 72 392 600 человек, число рабочих дней в году – 247. Для анализа были приняты следующие сроки временной нетрудоспособности при наступлении сердечно-сосудистых событий (согласно стандартам оказания медицинской помощи): нефатальный инфаркт миокарда – 80 дней, реваскуляризация миокарда – 30 дней, нефатальный инсульт – 80 дней [25]. Непрямые расходы, связанные с оплатой временной нетрудоспособности, получены умножением стоимости одного дня на соответствующее количество дней. Недополученный ВВП вследствие стойкой утраты трудоспособности или преждевременной смерти определен как отношение ВВП к трудоспособному населению. В 2016 г. он составил 488 782 руб. на человека трудоспособного возраста [41]. Эти показатели, как и соответствующий параметр при ОКС [42], отнесены к непрямым расходам.
Анализ минимизации затрат. Алирокумаб сравнивали с другим ингибитором PCSK9, зарегистрированным в России, – эволокумабом, применяющимся по сходным показаниям [43]. При отсутствии различий в эффекте должен применяться вариант анализа "затраты-эффект" – анализ минимизации затрат (CMA – Cost Minimization Analysis). Стоимость эволокумаба (Репата, Амджен Мэньюфэкчуринг Лимитед, Пуэрто-Рико, США), 140 мг/мл, шприцы 1 мл, рассчитана согласно методике определения предельной отпускной цены производителя [44], поскольку препарат включен в Перечень ЖНВЛП на 2018 г. (на момент анализа цена еще не была зарегистрирована). Минимальная цена определена в Словакии и составляет 386 евро за 2 шприца по 140 мг [45] или 579 евро в месяц (с учетом необходимости 3 шприцов), что по курсу ЦБ РФ на момент анализа (69,64 руб.) [46] соответствует 40 321,56 руб. С учетом таможенных сборов в 3,2% стоимость месяца лечения составляет 41 611,84 руб, а с учетом НДС (10%) – 45 773,03 руб.
Определяли показатель минимизации затрат CMR (Cost Minimization Ratio), показывающий, на сколько применение менее затратной медицинской технологии позволяет снизить затраты на лечение пациента [47]. Также оценивали показатель упущенных возможностей Q, характеризующий объем терапии, который мог бы быть обеспечен при использовании менее затратной медицинской технологии. Упомянутые показатели рассчитывали по формулам: CMR=DC2-DC1 и Q=CMR/DC1 × 100%,где CMR – показатель минимизации затрат; DC1 – прямые затраты при применении менее дорогой медицинской технологии; DC2 – прямые затраты при более дорогой медицинской технологии; Q – показатель упущенных возможностей.
Результаты
Определение целевой группы пациентов. В России ежегодно диагностируют в среднем 520 000 случаев ОКС [42]. Среди них расчетная доля больных с семейной гиперхолестеринемией составляет 19,4% (100 880 человек). ОКС с давностью 1 год и проведенной реваскуляризацией можно ожидать у 36% (на основании опроса врачей кардиологов), или 36 317 пациентов. Экстраполируя данные по частоте приема статинов пациентами с ОКС (88%) на эту группу пациентов, можно ее ограничить до 31 959 человек. Согласно данным модели интенсификации липидснижающей терапии у пациентов высокого сердечно-сосудистого риска [23], назначение алирокумаба потребуется примерно 14% из этих пациентов. Таким образом, размер целевой группы был ограничен 4 474 пациентами с семейной гиперхолестеринемией, перенесшими ОКС в течение последнего года и рефрактерными к терапии статинами. Частоту сердечнососудистых событий рассчитывали в целевой группе пациентов в рамках горизонта исследования 2 года. Результаты оценки прямых медицинских затрат на лечение пациентов целевой группы приведены в табл. 4.
| Показатели | Статин + эзетимиб | Алирокумаб + статин+эзетимиб |
|---|---|---|
| Первый год | ||
| Лекарственные затраты | 160,50 | 1 877,82 |
| Затраты на аферез | 6 463,67 | 1 848,94 |
| Затраты на лечение сердечнососудистых событий | 59,01 | 30,64 |
| Суммарно за первый год | 6 683,18 | 3 729,82 |
| Второй год | ||
| Лекарственные затраты | 154,52 | 1 812,93 |
| Затраты на аферез | 6 022,85 | 1 008,64 |
| Затраты на лечение сердечнососудистых событий | 57,00 | 30,15 |
| Суммарно за второй год | 6 234,37 | 2 851,72 |
| Суммарные затраты за 2 года | ||
| Прямые медицинские затраты | 12 917,55 | 6 581,54 |
| Разница (%) | -- | Разница (%) |
Результаты анализа влияния на бюджет свидетельствуют о снижении суммарных прямых затрат на лечение пациентов целевой группы при добавлении алирокумаба к липидснижающей терапии на 48,6%. Это обусловлено преимущественно снижением частоты назначения дорогостоящей процедуры афереза при включении алирокумаба в схему лечения. Результаты анализа показали, что включение алирокумаба в Перечень ОНЛС экономически обосновано.
Анализ чувствительности. Наибольший вклад в суммарные прямые затраты при стандартном варианте терапии вносят затраты на липидный аферез, в то время как затраты на лекарственную терапию не превышают 2,5% от общей суммы. При добавлении к терапии алирокумаба затраты на его применение также начинают вносить значимый вклад в общие затраты. Как было отмечено выше, стоимость процедуры липидного афереза регламентируется тарифным соглашением по программе ОМС на 2018 г. В связи с этим единственным входным параметром, способным значимо повлиять на результат, является цена алирокумаба. Кроме того, выше было показано, что добавление алирокумаба в схему терапии позволяет снизить затраты. В связи с этим анализ чувствительности проводили для проверки устойчивости полученных результатов основного сце нария к однонаправленному изменению входного параметра: повышению стоимости алирокумаба. Полу ченный результат оказался устойчивым к возрастанию цены на алирокумаб (табл. 5). Предлагаемый режим терапии с применением алирокумаба остается менее затратным при увеличении цены на алирокумаб в 2,84 раза (на 184%).
| Увеличение цены алирокумаба | Разница затрат при использовании алирокумаба по сравнению с текущим вариантом терапии | |
|---|---|---|
| млн руб. | % | |
| 0% | -6 278,2 | -48,61 |
| +50% | -4 579,58 | -35,45 |
| +100% | -2 880,35 | -22,30 |
| +150% | -1 181,11 | -9,14 |
| +184% | -25,63 | -0,20 |
Анализ стоимости болезни. Учитывали прямые и непрямые затраты. Как указано выше, размер недополученного ВВП при невыходе пациента на работу в 2016 г. равнялся 4 802,90 руб. Средний возраст пациентов в клинических исследованиях составил 60-62 года (61 год) [23]. При расчетах было сделано допущение, что только 20% пациентов целевой группы относились к занятым в данной возрастной категории. При оценке недополученного ВВП за период дожития до 72 лет рассчитывали потери ВВП по причине смерти пациентов в течение первого и второго года исследования, а также за период дожития, т.е. в течение 9 лет. Включение алирокумаба в схемы терапии пациентов целевой группы позволит снизить бремя заболевания на 7,73 млрд руб, или на 56,1%, за 2 года терапии (табл. 6).
| Показатели | Статин + эзетимиб | Алирокумаб + статин + эзетимиб |
|---|---|---|
| Первый год | ||
| Прямые медицинские затраты | 6 683,18 | 3 729,82 |
| Недополученный ВВП, в связи с временной потерей трудоспособност | 39,50 | 20,52 |
| Недополученный ВВП в результате смерти в рамках горизонта исследования | 19,61 | 9,99 |
| Второй год | ||
| Прямые медицинские затраты | 6 234,37 | 6 234,37 |
| Недополученный ВВП, в связи с временной потерей трудоспособности | 38,07 | 20,19 |
| Недополученный ВВП в результате смерти в рамках горизонта исследования | 58,46 | 30,48 |
| Потери ВВП за годы дожития | ||
| Недополученный ВВП за годы дожития до возраста потери экономической активности (72 года) | 702,54 | 369,42 |
| Суммарные затраты за 2 года | ||
| Стоимость болезни | 13 775,73 | 6 050,53 |
| Разница (%) | -- | -56,49 |
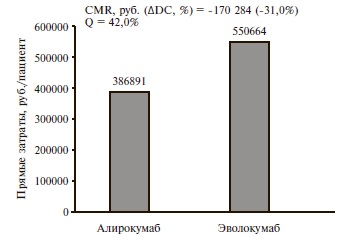
Анализ минимизации затрат. Исходя из обоснованного научного предположения об одинаковой эффективности (доля пациентов, достигающих целевых значений ХС ЛНП) алирокумаба и еще одного зарегистрированного в России препарата этого класса – эволокумаба – мы проводили анализ минимизации затрат. При этом стоимость статинов и эзетимиба не учитывали, поскольку считается, что дозировки и эффекты этих препаратов одинаковы в выделенных нами гипотетических группах алирокумаба и эволокумаба. Согласно официальным инструкциям у пациентов с семейной гиперхолестеринемией алирокумаб применяется в дозе 150-300 мг в месяц (2 инъекции), а эволокумаб – в дозе 280 мг (2 инъекции) или 420 мг в месяц (3 инъекции). Исходя из этого были рассчитаны лекарственные затраты на 52-недельную терапию сравниваемыми препаратами с последующим определением показателей минимизации затрат и упущенных возможностей. Результаты сравнения приведены в рис. 2. Расчетные данные показывают, что терапия алирокумабом по сравнению эволокумабом у пациентов рассматриваемой целевой группы позволит снизить затраты на 170 284 руб. на 1 пациента в год (-31,0%) или пролечить с тем же эффектом на 42,0% больше больных.
Обсуждение
При проведении анализа минимизации затрат сравнивали два ингибитора PCSK9, зарегистрированные в РФ: алирокумаб и эволокумаб. Этот вид анализа использовался потому, что нам не удалось обнаружить в доступной литературе результатов прямых сравнительных клинических исследований этих препаратов. Непрямое же сравнение не позволяет выявить достоверных различий между их клиническим эффектом, оцениваемым по доле пациентов, достигающих целевых уровней липидов крови. Опубликованный систематизированный обзор, показавший преимущество эволокумаба перед алирокумабом по степени снижения уровня холестерина ЛНП [48], не может быть использован для фармакоэкономического анализа, по нескольким причинам:
1. В мета-анализ не были включены некоторые исследования, в частности, RUTHERFORD и RUTHER FORD-2 [49,50], что могло исказить результат непрямого сравнения в пользу эволокумаба. В группе плацебо не наблюдалось значительного повышения уровня холестерина ЛНП, поэтому включение исследований RUTHERFORD в сетевой мета-анализ могло повлиять на оценку общей эффективности эволокумаба по сравнению с плацебо.
2. В анализе не учтено изменение эффективности при титровании дозы алирокумаба.
3. В группах плацебо в исследованиях эволокумаба, включенных в мета-анализ, отмечалось выраженное повышение содержания холестерина ЛНП (почти на 13%) [51], в то время как в исследованиях алирокумаба уровни холестерина ЛНП в группах плацебо были стабильными или менялись очень незначительно [52,53].
4. Выбор временных интервалов для оценки эффективности не позволяет сравнить эффективность алирокумаба в этом анализе. Так, в программе ODYSSEY эффективность алирокумаба оценивали через 24 недели терапии [51]. Поскольку все данные по эффективности эволокумаба приведены для периода 10-12 недель, он теоретически получает дополнительные преимущества перед алирокумабом, так как для него не учитывается эффективность на большем временном горизонте.
5. В рассматриваемых исследованиях пациенты получали различную базовую терапию и значительно отличались по клинико-демографическим характеристикам, что не позволяет достоверно судить о сравнительной эффективности анализируемых препаратов.
6. В мета-анализе изменения уровня холестерина ЛНП сравнивали с контролем, а не с исходным уровнем, как это было сделано при оценке первичных конечных точке в анализируемых исследованиях.
Выводы
1. Включение алирокумаба в Перечень ОНЛС экономически обосновано. За 2 года применение алирокумаба должно снизить нагрузку на бюджет на 49,05% при лечении пациентов высокого сердечно-сосудистого риска, в том числе с семейной гиперхолестеринемией и рефрактерностью к гиполипидемической терапии по сравнению с лечением статинами и эзетимибом.
2. Полученный результат является устойчивым к росту цены на алирокумаб на 184% (в 2,89 раза).
3. Применение алирокумаба позволяет снизить бремя заболевания на 56,49%, или 7,78 млрд руб, в целевой группе за 2 года терапии по сравнению с текущей практикой лечения.
4. Курсовая стоимость лечения алирокумабом на 31,0% ниже таковой эволокумабом, что может позволить снизить затраты на лечение 1 пациента на 170 284 руб. в год и пролечить дополнительно 42% пациентов.
Используемые источники
- Bongard V, Dallongeville J, Arveiler D. et al. Attainment of low-density lipoprotein cholesterol target in the French general population according to levels of cardiovascular risk: insights from the MONA LISA study. Arch Cardiovasc Dis 2013;106(2):93–102.
- Bruckert E, Ferrières J. Evidence supporting primary prevention of cardiovascular diseases with statins: gaps between updated clinical results and actual practice. Arch Cardiovasc Dis 2014;107(3):188–200.
- Antiochos P, Marques-Vidal P, Waeber G, Vollenweider P. Five year trends in dyslipidaemia prevalence and management in Switzerland: the CoLaus study. Nutr Metab Cardiovasc Dis 2015;25(11):1007–15.
- Yan AT, Yan RT, Tan M, et al. Contemporary management of dyslipidemia in high-risk patients: targets still not met. Am J Med 2006;119(8):676–83.
- Joy TR, Hegele R. A. Narrative review: statin-related myopathy. Ann Intern Med 2009;150(12):858–68.
- Fernandez G, Spatz E. S, Jablecki C, Phillips PS. Statin myopathy: a common dilemma not reflected in clinical trials. Cleve Clin J Med 2011;78(6):393–403.
- Nielsen SF, Nordestgaard BG. Negative statin-related news stories decrease statin persistence and increase myocardial infarction and cardiovascular mortality: a nationwide prospective cohort study. Eur Heart J 2016;37(11):908-16.
- Bittner V, Deng L, Rosenson RS, et al. Trends in the use of nonstatin lipid-lowering therapy among patients with coronary heart disease: a retrospective cohort study in the medicare population 2007 to 2011. J Am Coll Cardiol 2015;66(17): 1864–72.
- Gamboa CM, Safford MM, Levitan EB, et al. Statin underuse and low prevalence of LDL-C control among US adults at high risk of coronary heart disease. Am J Med Sci 2014;348(2):108–14.
- Толпыгина С.Н., Марцевич С.Ю. Изучение динамики частоты приема основных классов лекарственных препаратов, показанных при лечении пациентов с хронической ишемической болезнью сердца, с 2004 по 2014 г. данные регистра прогноз ИБС. Клиницист 2016;10(1): 29-35.
- Vonbank A, Agewall S, Kjeldsen KP, et al. Comprehensive efforts to increase adherence to statin therapy. Eur Heart . 2017 Jan 10. pii: ehw628.
- Krempf M, Simpson RJ, Ramey DR, et al. Patient and physician factors influence decision-making in hypercholesterolemia: a questionnaire-based survey. Lipids Health Dis 2015;14(1):45-7.
- Burggraaf B, Castro Cabezas M. Interventions in type 2 diabetes mellitus and cardiovascular mortality-An overview of clinical trials. Eur J Intern Med 2017;42:1-15.
- Дедов И.И., Александров А.A. Проблемы острого инфаркта миокарда у больных сахарным диабетом. Сахарный диабет 2008;1:4-10.
- Какорин С.В., Тулякова Э.В., Воронкова К.В., Мкртумян А.М. Острое нарушение мозгового кровообращения у больных сахарным диабетом 2 типа. Сахарный диабет 2013; (1):63–70.
- Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010;375:2215–22.
- Simpson SH, Lin M, Eurich DT. Community pharmacy-based inducement programs associated with better medication adherence: a cohort study. Ann Pharmacother 2017;51(8):630-9.
- Ярбеков Р.Р., Чигогидзе Н.А., Сигаев И.Ю., Керен М.А. Ближайшая и отдаленная эффективность чрескожного коронарного вмешательства у больных ИБС с многососудистым поражением коронарных артерий и сахарным диабетом II типа. Анналы хирургии 2014; 5:21-26.
- Голухова Е.З., Кузнецова Е.В. Реваскуляризация миокарда у больных ИБС в сочетании с сахарным диабетом 2 типа: обзор современных технологий. Сахарный диабет 2016; 19(5):406-13.
- Wong ND, Rosenblit PD, Greenfield RS. Advances in dyslipidemia management for prevention of atherosclerosis: PCSK9 monoclonal antibody therapy and beyond. Cardiovasc Diagn Ther 2017;7 (Suppl 1):S11-20.
- Robinson JG, Farnier M, Krempf M. et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):1489–99.
- El Shahawy M, Cannon CP, Blom DJ, et al. Efficacy and safety of Alirocumab versus ezetimibe over 2 years (from ODYSSEY COMBO II). Am J Cardiol 2017;17:31031-7.
- Farnier M, Colhoun HM, Sasiela WJ, et al. Long-term treatment adherence to the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab in 6 ODYSSEY Phase III clinical studies with treatment duration of 1 to 2 years. J Clin Lipidol 2017:S1933-2874.
- Silverman MG, Ference BA, Im K. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions. A systematic review and meta-analysis. JAMA 2016; 316(12):1289-97.
- Зырянов С.К., Дьяков И.Н. Клинико-экономическая экспертиза алирокумаба при рефрактерности к стандартной гиполипидемической терапии. Качественная клиническая практика 2016;4:4-13.
- Распоряжение Правительства Российской Федерации No2323-р от 23.10.2017.
- Farnier M, Gaudet D, Valcheva V, et al. Efficacy of alirocumab in high cardiovascular risk populations with or without heterozygous familial hypercholesterolemia: Pooled analysis of eight ODYSSEY Phase 3 clinical program trials. Intern J Cardiol 2016;223:750–7.
- Методические рекомендации по оценке влияния на бюджет в рамках реализации программы государственных гарантий бесплатного оказания гражданам медицинской помощи. М, ФГБУ “Центр экспертизы и контроля качества медицинской помощи”, 2016, 27С.
- Landmesser U, Chapman MJ, Farnier M, et al. on behalf of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). European Society of Cardiology/European Atherosclerosis Society Task Force consensus statement on proprotein convertase subtilisin/kexin type 9 inhibitors: practical guidance for use in patients at very high cardiovascular risk. Eur Heart J 2016;0:1–11. doi:10. 1093/eurheartj/ehw480.
- Nanchen D, Gencer B, Auer R. et al. Prevalence and management of familial hypercholesterolaemia in patients with acute coronary syndromes. Europ Heart J 2015;36:2438–45.
- Инструкция по медицинскому применению лекарственного препарата Пралуэнт.
- http://pharmindex. ru, дата обращения 13.12.2017.
- http://grls. rosminzdrav. ru, дата обращения к ресурсу 19.01.2018.
- Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи. Постановление Правительства РФ от 28.08.2014 N871.
- Moriarty PM, Parhofer KG, Babirak SP, et al. Alirocumab in patients with heterozygous familial hypercholesterolaemia undergoing lipoprotein apheresis: the ODYSSEY ESCAPE trial. Eur Heart J 2016;37(48):3588-95.
- О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 год и на плановый период 2019 и 2020 годов. Постановление Правительства РФ No1492 от 08.12.2017.
- Методические рекомендации по способам оплаты медицинской помощи за счет средств обязательного медицинского страхования. Минздрав России, Федеральный ФОМС. Утверждены на заседании рабочей группы МЗ РФ, протокол заседания No55/11/19 от 14.11.2017; http://www. ttfoms. tomsk. ru/document/ обращение к ресурсу 11.12.2017.
- Silverman MG, Ference BA, Im K, et al. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions: a systematic review and meta-analysis. JAMA 2016;316(12):1289-97.
- Тарифное соглашение на оплату медицинской помощи, оказываемой по территориальной программе обязательного медицинского страхования города Москвы на 2017 год от 29 декабря 2016 г.
- Приказ Минэкономразвития России No192, Минздравсоцразвития России No323н, Минфина России No 45н, Росстата No113 от 10. 04. 2012 "Об утверждении методологии расчета экономических потерь от смертности, заболеваемости и инвалидизации населения".
- Дедов И.И., Концевая А.В., Шестакова М.В. и др. Экономические затраты на сахарный диабет 2 типа и его основные сердечно-сосудистые осложнения в Российской Федерации. Сахарный диабет 2016;19(6):518-27.
- Концевая А.В., Калинина А.М., Колтунов И.Е., Оганов Р.Г. Социальноэкономический ущерб от острого коронарного синдрома в Pоссийской Федерации. РФК 2011;7(2):158-66.
- Инструкция по медицинскому применению лекарственного препарата Репата.
- Правила государственной регистрации и перерегистрации устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в Перечень ЖНВЛП. Утверждены Постановлением Правительства РФ No865 от 29.10.2010 в редакции Постановления No979 от 15.09.2015.
- http://www. health. gov. sk/Clanok?zuuc-201712-lieky; обращение к ресурсу 11.12.2017.
- http://www. cbr. ru/currency_base/daily. aspx?date_req=11.12.2017; обращение к ресурсу 11.12.2017.
- Фармакоэкономика и фармакоэпидемиология – практика примемлемых решений. Ред. В.Б.Герасимов, А.Л.Хохлов, О.И.Карпов. М.: Медицина, 2005, 352 с.
- Toth PP, Worthy G, Gandra SR, et al. Systematic review and network meta-analysis on the efficacy of evolocumab and other therapies for the management of lipid levels in hyperlipidemia. J Am Heart Assoc 2017;6(10).
- Raal F, Scott R, Somaratne R, et al. Low-density lipoprotein cholesterol-lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: the Reduction of LDL-C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) randomized trial. Circulation 2012;126:2408–17.
- Raal FJ, Stein EA, Dufour R, et al. RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet 2015;385:331–40.
- Robinson JG, Nedergaard BS, Rogers WJ, et al; for the LAPLACE-2 Investigators. Effect of evolocumab or ezetimibe added to moderateor high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia: the LAPLACE-2 randomized clinical trial. JAMA 2014;311:1870–82.
- Kereiakes DJ, Robinson JG, Cannon CP, et al. Efficacy and safety of the PCSK9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: the ODYSSEY COMBO I study. Am Heart J 2015;169: 906e915e13.
- Robinson JG, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):148
