Перспективы применения биомаркеров для диагностики внебольничной пневмонии на фоне хронической сердечной недостаточности
Оценить значение определения сывороточных биомаркеров воспаления [С-реактивного белка (С-РБ), прокальцитонина (ПКТ), интерлейкина-6 (ИЛ-6), фактора некроза опухолей α (ФНО α)] и кардиальной дисфункции (мозгового натрийуретического пептида (МНУП)) в алгоритме диагностики внебольничной пневмонии (ВП) у пациентов с хронической сердечной недостаточностью (ХСН).
В проспективное наблюдательное исследование включали госпитализированных взрослых пациентов с доказанной ХСН и предварительным клиническим диагнозом ВП. Окончательная верификация ВП проводилась с помощью мультиспиральной компьютерной томографии легких, на основании результатов которой больных распределяли на две группы: 1-я – с доказанной ВП, 2 – с неподтвержденной ВП, включая пациентов с другими инфекциями дыхательных путей. У всех пациентов при поступлении определяли сывороточные концентрации биомаркеров.
В исследование было включено 70 пациентов (по 35 в каждой группе). По большинству демографических и клинических показателей две группы не отличались. Уровни С-РБ, ПКТ и ИЛ-6 в 1-й группе были достоверно выше, чем во 2-й. По данным анализа ROC-кривых С-РБ, характеризовался отличной классифицирующей способностью как предиктор ВП у пациентов с ХСН (AUC=0,91, 95% доверительный интервал [ДИ] 0,83-0,98), а ПКТ и ИЛ-6 – очень хорошей (AUC=0,81, 95% ДИ 0,72-0,90, и AUC=0,81, 95% ДИ 0,71-0,91, соответственно). Однако низкая чувствительность определения ПКТ и ИЛ-6 при приемлемой специфичности нивелировала их диагностическую ценность. Уровень С-РБ >28,5 мг/л был признан оптимальным для диагностики ВП у пациентов с ХСН (чувствительность метода – 85,7%, специфичность – 91,4%, положительная прогностическая значимость – 90,9%, отрицательная прогностическая значимость – 86,4%).
Определение С-РБ (с пороговым значением >28,5 мг/л) может использоваться дополнительно к рутинному алгоритму с целью оптимизации дифференциальной диагностики ВП и других инфекций дыхательных путей в сочетании с ХСН. Приемлемая эффективность других биомаркеров (ПКТ, ИЛ-6, ФНО α, МНУП) не подтвердилась.
Диагностика внебольничной пневмонии (ВП) у пациентов с хронической сердечной недостаточностью (ХСН) сопряжена с объективными трудностями, которые связаны как с возрастными особенностями больных пожилого и старческого возраста, так и с влиянием механизмов развития недостаточности кровообращения на течение пневмонии. При этом сопутствующая ХСН зачастую маскирует клинические проявления ВП и тем самым затрудняет ее верификацию [1]. При использовании клинического алгоритма наиболее сложной задачей является дифференцирование кардиальных и респираторных причин одышки и кашля, что нередко сопровождается диагностическими ошибками [2,3]. Следует помнить, что типичные проявления недостаточности кровообращения (одышка, утомляемость, тахикардия, тахипноэ, хрипы в легких при аускультации, скопление жидкости в плевральной полости) могут быть обусловлены и развитием ВП [4].
Рентгенологическая диагностика пневмонии при ХСН недостаточно эффективна вследствие невысокой специфичности метода у пожилых пациентов, а также ограничений технического и методического характера, влияющих на информативность рентгенографии органов грудной клетки [5-7]. При этом картина кардиогенного застоя крови в малом круге кровообращения может "маскировать" пневмоническую инфильтрацию или способствовать гипердиагностике ВП, особенно при наличии двусторонних изменений в паренхиме легких [8].
Системный воспалительный ответ у пациентов старших возрастных групп с различными сопутствующими заболеваниями также не является надежным диагностическим критерием ВП. В частности, лейкоцитоз и сдвиг лейкоцитарной формулы влево могут быть невыраженными или отсутствовать [9,10]. Кроме того, данные показатели характеризуются значительной межиндивидуальной вариабельностью [11].
Для улучшения диагностики ВП и ХСН во многих субпопуляциях больных предлагают определять различные биомаркеры. В частности, у пациентов с ВП отмечают увеличение содержания биомаркеров воспаления, в том числе С-реактивного белка (С-РБ), прокальцитонина (ПКТ), фактора некроза опухолей α (ФНОα) и интерлейкина-6 (ИЛ-6)) [12-17], в то время как развитие и прогрессирование ХСН связано с биомаркерами кардиальной дисфункции, такими как аргинин-вазопрессин, копептин, проадреномедуллин, тропонины, предсердный и мозговой (МНУП) натрийуретические пептиды [18-23]. Параллельное определение биомаркеров различного профиля может быть полезным для дифференциальной диагностики инфекций дыхательных путей и декомпенсации ХСН [11,24,25].
Целью исследования было изучение значения сывороточных биомаркеров воспаления (С-РБ, ПКТ, ИЛ-6, ФНОα) и кардиальной дисфункции (МНУП) в диагностике ВП у пациентов с ХСН.
Материал и методы
В проспективном наблюдательном исследовании принимали участие взрослые пациенты (18 лет и старше) с ХСН IIIV функционального класса (ФК), госпитализированные в лечебно-профилактические учреждения (ЛПУ) г. Смо лен ска в 2013-2014 гг. с предварительным клиническим диагнозом ВП. ХСН диагностировали в соответствии с национальными рекомендациями [26]. Диагноз ВП подтверждали с помощью мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки, на основании которой пациентов распределяли на две группы: 1-я – с верифицированной ВП, 2-я – без ВП, с симптомами и признаками других инфекций дыхательных путей.
Протокол исследования был одобрен локальным Эти чес ким комитетом Смоленской областной клинической больницы. Все больные дали письменное информированное согласие на участие в нем.
У всех больных при поступлении определяли сывороточные концентрации С-РБ, ПКТ, ИЛ-6, ФНОα и МНУП. Дальнейшее обследование, а также лечение ХСН и ВП проводились в соответствии со стандартам, принятыми в каждом ЛПУ.
Анализ С-РБ проводился в лаборатории Центра клинических исследований диагностических и лекарственных средств НИИ антимикробной химиотерапии (НИИАХ) методом фотометрической иммунотурбидиметрии на полуавтоматическом анализаторе Humalyzer 2000 (HUMAN, GmbH, Германия) с использованием диагностических наборов HUMAN (Германия). Референсные значения С-РБ составили 0-8 мг/л.
Исследование остальных биомаркеров выполнялось на базе клинико-диагностического центра г. Екатеринбурга. Уровень ПКТ определяли методом хемилюминесценции на автоматическом анализаторе mini-VIDAS (BioMerieux, Франция) с использованием диагностических наборов BioMerieux (VIDAS BRAHMS, Франция). Стандартизация исследований осуществлялась для каждого набора с применением контрольных образцов и калибровочной карты (VIDAS BRAHMS, Франция). Референсные значения биомаркера составили <0,1 нг/мл.
Сывороточные концентрации ИЛ-6 и ФНОα измеряли методом твердофазного "сэндвич" варианта иммуноферментного анализа с использованием наборов Интерлейкин6-ИФА-Бест и альфа-ФНО-ИФА-Бест ЗАО "Вектор-Бест" (Россия) на ИФА-ридере Multiscan EX ("Thermo Lab sys tems", Китай). Референсные значения биомаркеров составили для ИЛ-6 – 0-10 пг/мл, для ФНОα – 0-6 пг/мл.
Анализ МНУП выполнялся методом хемилюминесценции на автоматическом анализаторе ADVIA Centaur XP (Siemens, США) с использованием диагностических наборов Siemens (закрытая система) и аттестованных контрольных материалов BIO-RAD (США). Референсные значения биомаркера составили 0-80 пг/мл для лиц в возрасте до 60 лет и 0-100 пг/мл для лиц в возрасте старше 60 лет.
Статистический анализ данных проводился с использованием свободной программной среды для статистических расчетов и графиков R v.3.3.2 (The R Foundation for Statistical Computing, Вена, Австрия). С учетом размера выборок распределение считали не соответствующим нормальному закону. Сводные статистические данные были представлены количеством единиц наблюдений, медианой и интерквартильным размахом (первым и третьим квар тилями). Для сравнительного анализа применяли непараметрические методы. Для межгрупповых сравнений непрерывных переменных использовали критерий МаннаУитни. Сводные статистические данные по категориальным переменным были представлены абсолютными и относительными частотами. Сравнение частот проводилось с использованием точного критерия Фишера. Для определения статистической значимости биомаркеров в диагностике ВП выполняли анализ на основе логистической регрессии. Оценка эффективности каждого биомаркера проводилась независимо от остальных. Таким образом, было построено пять отдельных моделей с одной переменной-предиктором в каждой. Классифицирующая способность статистически значимых биомаркеров оценивалась методом анализа ROCкривых (Receiver Operation Characteristic curves). Для количественной интерпретации результата ROC-анализа использовался показатель AUC (area under ROC curve) – площадь под ROC-кривой (с расчетом 95% доверительного интервала (ДИ)). Все статистические исследования проводились для двусторонней гипотезы на уровне значимости 0,05 (различия считали достоверными при р<0,05).
Результаты
В исследование были последовательно включены 70 пациентов в возрасте от 50 до 90 лет, в том числе 46 (65,6%) женщин, которых распределили на две группы в зависимости от наличия ВП, подтвержденной с помощью МСКТ (табл. 1). За исключением температуры тела, которая была незначительно повышена у больных с доказанной ВП, различия по всем исходным показателям оказались статистически незначимыми. У большей части пациентов 2-й группы, наряду с ИДП, присутствовали симптомы и признаки декомпенсации кровообращения.
| Группа 1 (n=35) | Группа 2 (n=35) | p | |
|---|---|---|---|
| Женщины, n (%) | 24(68,6) | 22(62,9) | - |
| Возраст, годы | 73,89±11,36 | 75,14±8,66 | >0,05 |
| Длительность ХСН, мес | 91,54±65,97 | 86,46±58,01 | >0,05 |
| Количество эпизодов декомпенсации ХСН в течение последнего года | 1,62±1,07 | 1,58±1,06 | >0,05 |
| Функциональный класс ХСН, n (%) | |||
| II | 21 (60,0) | 17 (48,6) | >0,05 |
| III | 12 (34,3) | 17 (48,6) | |
| IV | 2 (5,7) | 1 (2,8) | |
| Наличие других эпизодов ВП в течение последнего года, n (%) | |||
| Да | 6 (17,1) | 9 (25,7) | >0,05 |
| Нет | 26 (74,3) | 26 (74,3) | |
| Нет данных | 3 (8,6) | 0 (0) | |
| Стаж курения, годы | 3 (8,6) | 0 (0) | |
| Индекс курящего человека, пачка-годы | 33,00±11,03 | 29,80±10,03 | >0,05 |
| Продолжительность госпитализации, сутки | 12,37±4,37 | 11,49±5,05 | >0,05 |
| Кашель, n (%) | 33 (94,3) | 31 (88,6) | >0,05 |
| Одышка, n (%) | 35 (100) | 35 (100) | >0,05 |
| Температура тела, °С | 37,0±0,6 | 36,6±0,5 | 0,0005 |
| Крепитация/влажные хрипы при аускультации, n (%) | 33 (94,3) | 30 (85,7) | >0,05 |
| Инфильтрация в легких, n (%) | 28 (80) | 32 (91) | >0,05 |
| Плевральный выпот, n (%) | 23 (65,7) | 15 (42,9) | >0,05 |
| Лейкоциты периферической крови (×109/л) | 10,0±5,6 | 8,2±1,9 | >0,05 |
У больных ВП отмечалось достоверное повышение уровня большинства биомаркеров воспаления по сравнении с пациентами, у которых данный диагноз не подтвердился (рис. 1). Средние концентрации С-РБ в двух группах составили 74,34±55,93 и 17,57±11,79 мг/л, соответственно (р<0,0001), ПКТ – 2,48±6,97 и 0,05± 0,01 нг/мл (р<0,0001), ИЛ-6 – 94,23±97,44 и 19,57± 14,83 пг/мл (р<0,0001). Сывороточные концентрации ФНОα у больных с ХСН не выходили за пределы референсного интервала и не зависели от наличия ВП:3,29±5,89 и 1,42±1,97 пг/мл, соответственно (р=0,122). Содержание МНУП также оказалось сопоставимым в двух группах (261,75±306,84 и 200,42±221,93 пг/мл, соответственно, р=0,593), но превышало референсные значения.
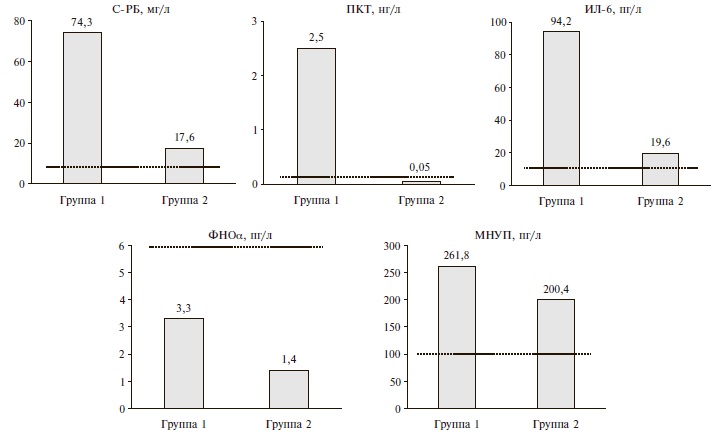
По данным регрессионного анализа с созданием пяти независимых моделей, включавших по одному предиктору, диагностическая значимость каждого биомаркера соответствовала: С-РБ – р=0,0001, ПКТ – р=0,042, ИЛ-6 – р=0,003, ФНОα – р=0,092 и МНУП – р=0,339.
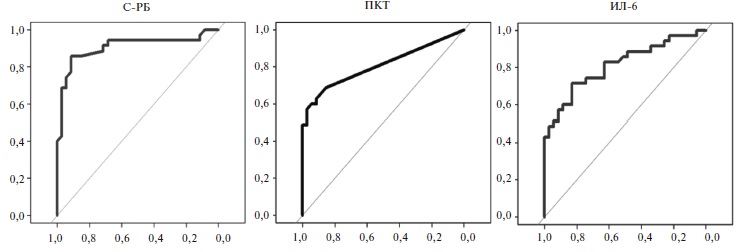
На рис. 2 представлены ROC-кривые, отражающие классифицирующую способность биомаркеров, которые потенциально заслуживают дальнейшего изучения (С-РБ, ПКТ, ИЛ-6). При количественной интерпретации данного показателя по каждому рассматриваемому параметру были получены следующие результаты: для С-РБ – AUC=0,91 (95% ДИ 0,83-0,98), для ПКТ – AUC=0,81 (95% ДИ 0,72-0,90), для ИЛ-6 – AUC=0,81 (95% ДИ 0,71-0,91). Таким образом, классифицирующая способность С-РБ оценивалась как отличная (AUC≥0,90), а ПКТ и ИЛ-6 – как очень хорошая (AUC≥0,80).
| С-РБ | ПКТ | ИЛ-6 | ||||||
|---|---|---|---|---|---|---|---|---|
| Ч (%) | С (%) | ПЗ (мг/л) | Ч (%) | С (%) | ПЗ (мг/л) | Ч (%) | С (%) | ПЗ (мг/л) |
| Примечание: Ч – чувствительность, С – специфичность, ПЗ – пороговое значение | ||||||||
| 100 | 8,6 | 3,5 | 68,6 | 85,7 | 0,050 | 88,6 | 48,6 | 13,3 |
| 97,1 | 11,4 | 5,0 | 62,9 | 91,4 | 0,055 | 85,6 | 48,6 | 13,5 |
| 94,3 | 11,4 | 7,0 | 60,0 | 91,4 | 0,065 | 85,7 | 51,4 | 13,9 |
| 94,3 | 25,7 | 9,5 | 60,0 | 94,3 | 0,075 | 82,9 | 54,3 | 14,4 |
| 94,3 | 34,3 | 11,5 | 57,1 | 97,1 | 0,085 | 82,9 | 57,1 | 15,1 |
| 94,3 | 48,6 | 14,5 | 54,3 | 97,1 | 0,095 | 82,9 | 60,0 | 15,9 |
| 94,3 | 57,1 | 17,5 | 48,6 | 97,1 | 0,115 | 80,0 | 62,9 | 18,7 |
| 94,3 | 68,6 | 21,0 | 48,6 | 100 | 0,145 | 74,3 | 65,7 | 20,2 |
| 91,4 | 71,4 | 23,5 | 45,7 | 100 | 0,185 | 74,3 | 68,6 | 21,5 |
| 88,6 | 71,4 | 24,5 | 42,9 | 100 | 0,220 | 74,3 | 74,3 | 23,9 |
| 85,7 | 85,7 | 25,5 | 40,0 | 100 | 0,235 | 71,4 | 77,1 | 26,3 |
| 85,7 | 88,6 | 26,5 | 37,1 | 100 | 0,265 | 71,4 | 82,9 | 27,6 |
| 85,7 | 91,4 | 28,5 | 34,3 | 100 | 0,335 | 65,7 | 82,9 | 28,4 |
| 80,0 | 91,4 | 31,5 | 31,4 | 100 | 0,395 | 60,0 | 82,9 | 31,9 |
| 77,1 | 91,4 | 33,5 | 28,6 | 100 | 0,460 | 60,0 | 85,7 | 35,7 |
| 74,3 | 94,3 | 35,5 | 25,7 | 100 | 0,545 | 57,1 | 88,6 | 39,3 |
| 71,4 | 94,3 | 38,0 | 22,6 | 100 | 0,945 | 54,3 | 91,4 | 42,5 |
| 68,6 | 97,1 | 40,5 | 20,0 | 100 | 1,355 | 51,4 | 91,4 | 44,3 |
| 62,9 | 97,1 | 45,0 | 17,1 | 100 | 2,255 | 48,6 | 94,3 | 49,9 |
| 60,0 | 97,1 | 48,0 | 14,3 | 100 | 3,845 | 48,6 | 97,1 | 58,5 |
| 45,7 | 97,1 | 54,0 | 11,4 | 100 | 5,855 | 42,9 | 97,1 | 67,7 |
| 42,9 | 97,1 | 60,0 | 8,6 | 100 | 8,665 | 42,9 | 100 | 78,8 |
| 40,0 | 100 | 64,0 | 5,7 | 100 | 14,435 | 40,0 | 100 | 87,3 |
| 37,1 | 100 | 67,0 | 2,9 | 100 | 27,555 | 37,1 | 100 | 88,9 |
Финальным этапом нашего исследования было определение оптимальных пороговых значений наиболее перспективных биомаркеров, позволяющих с достаточной степенью чувствительности и специфичности подтвердить/исключить ВП у больных с ХСН. В табл. 2 выборочно представлены сывороточные концентрации каждого предиктора с указанием соответствующих показателей эффективности метода.
Обсуждение
ВП у пожилых пациентов часто развивается на фоне ХСН, а сочетание этих заболеваний ассоциировано с более тяжелым течением каждого из них и, как правило, менее благоприятным прогнозом [27-30]. Трудности диагностики ВП у пациентов с ХСН в первую очередь обусловлены неэффективностью интерпретации типичных симптомов, которые с равной степенью вероятности могут указывать на любое из двух состояний [1,2]. Данный факт нашел подтверждение и в нашем исследовании: частота наиболее распространенных жалоб (кашель, одышка) и аускультативных феноменов (влажные хрипы, крепитация) была сопоставима в двух группах пациентов. Из рассматриваемых клинических признаков достоверные различия были получены лишь при анализе температуры тела. Однако ее повышение у пациентов с ВП было незначительным и не имело диагностической ценности.
Несмотря на информативность стандартной рентгенографии органов грудной клетки, вероятность диагностических ошибок при верификации возможной ВП у взрослых пациентов может достигать почти 30% и увеличивается с возрастом [1,5,6]. В проведенном нами исследовании частота пневмонической инфильтрации у пациентов с изолированной ХСН была сопоставимой с таковой при доказанной ВП, что соответствует данным других авторов, и, вероятно, объясняется эффектом наслоения теней при кардиогенном застое крови в малом круге кровообращения [8]. Совпадение диагноза ВП, установленного с помощью рентгенографии и МСКТ органов грудной клетки, было зарегистрировано в 44,3% случаев, расхождение – в 55,7%, причем у большинства пациентов отмечалась гипердиагностика заболевания (45,7% случаев). Представленные данные свидетельствуют о недостаточно высокой специфичности стандартной рентгенографии органов грудной клетки в диагностике ВП на фоне ХСН.
Стандартная лабораторная диагностика пневмонии, ассоциированной с недостаточностью кровообращения, также не всегда эффективна, так как выраженность системного воспалительного ответа у пожилых пациентов вариабельна [8,9,11]. Так, в нашем исследовании у больных с ВП среднее количество лейкоцитов в периферической крови не достигало 12×109/л, т.е. у большинства из них системный воспалительный ответ не определялся. Аналогичные результаты были получены T. Maruyama и соавт. у пациентов старческого возраста с диагнозом ВП, подтвержденным при МСКТ [10].
В качестве дополнительного метода верификации пневмонии, особенно в случаях сомнительного или неопределенного диагноза, рядом авторов было предложено определение различных сывороточных биомаркеров. Для отдельных субпопуляций пациентов были разработаны и валидированы алгоритмы, основанные на мономерных и многомерных моделях, достоверно повышающие эффективность рутинной диагностики заболевания [2,3,8,11,24,25]. В проведенном нами исследовании в качестве потенциальных предикторов ВП у пациентов с ХСН рассматривались С-РБ, ПКТ, ИЛ-6, ФНОα и МНУП.
С-РБ относится к "эталонным" биомаркерам бактериального воспаления, гиперпродукция которого типична для пневмонии [31]. Однако его секреция может активироваться и при других заболеваниях, не ассоциированных напрямую с инфекционным процессом. В частности, некоторыми авторам было отмечено повышение уровня биомаркера у пациентов с ХСН [3234]. Возможно, это обусловлено индукцией синтеза данного белка в печени цитокинами, сывороточные концентрации которых нарастают при кардиальной дисфункции [35].
Описанные выше закономерности подтвердились и в нашем исследовании: повышенная секреция С-РБ регистрировалась у больных как с ВП, так и с декомпенсацией ХСН без ВП. Следует, однако, отметить, что значение показателя при изолированной недостаточности кровообращения (17,57±11,79 мг/л) соответствовало диапазону средних концентраций биомаркера, полученных в данной субпопуляции больных другими авторами (1–28,5 мг/л) [34,36]. В то же время уровень С-РБ у пациентов с ВП (74,34±55,93 мг/л) не достигал "классического порога" системной бактериальной инфекции (100 мг/л) [31]. Данный феномен может объясняться дисрегуляцией медиаторов воспаления и, как следствие, нарушением синтеза биомаркера в печени у лиц старших возрастных групп. Хотя содержание С-РБ превышало референсные значения в обеих группах, тем не менее различия между ними оказались статистически достоверными, что указывает на возможные перспективы использования С-РБ для подтверждения диагноза пневмонии при сопутствующей ХСН.
Аналогичные результаты были получены и другими авторами [8,11]. Так, в ретроспективном исследовании Y.J. Lee и соавт. данный биомаркер тестировался в алгоритме дифференциальной диагностики кардио генных (ассоциированных с декомпенсацией недо статочности кровообращения) и некардиогенных (преимущественно обусловленных ВП) причин двусторонней инфильтрации, выявленной при рентгенографии органов грудной клетки. Исходный уровень С-РБ у больных с кардиогенным застоем крови в легких составил 12 (0,4-247,4) мг/л, а у пациентов с респираторным генезом соответствующих изменений – 103 (0,2-464,9) мг/л (p=0,001) [8].
Проведенный нами регрессионный анализ подтвердил диагностическую ценность уровня С-РБ, который позволял предсказать наличие ВП у пациентов с ХСН (р=0,0001) с отличной классифицирующей способностью признака (AUC=0,91; 95% ДИ 0,83-0,98). Полученные результаты соответствовали данным, полученным другими авторами [8,11,37-41]. В большинстве представленных исследований изучаемый биомаркер отличался приемлемой классифицирующей способностью в алгоритме верификации пневмонии и ее дифференциальной диагностики с другими респираторными и нереспираторными заболеваниями, при этом показатель AUC в различных моделях варьировался от 0,76 до 0,97. В частности, при сопоставлении эффективности дополнительного определения С-РБ сыворотки крови и рутинной клинической оценки вероятности ВП значение AUC составляло от 0,76 (95% ДИ 0,69-0,83) до 0,90 (95% ДИ 0,87-0,93) [37,40]. При использовании биомаркера для дифференциальной диагностики пневмонии с туберкулезом легких AUC равнялась 0,86 (95% ДИ 0,78-0,94), неконтролируемым течением бронхиальной астмы – 0,96 (95% ДИ 0,93-1,00), гриппом – 0,97 [39]. Наконец, в двух исследованиях классифицирующая способность уровня С-РБ при верификации ВП и декомпенсации ХСН соответствовала показателю AUC=0,91 и AUC=0,92, что полностью подтверждало результаты нашего исследования [8,11].
ПКТ, в отличие от С-РБ, является более специфичным биомаркером, ассоциированным с развитием острой генерализованной бактериальной инфекции. Гиперпродукция его наблюдается уже через два часа от момента инициации процесса воспаления [42,43]. Однако сывороточные концентрации ПКТ при ВП, по данным разных авторов, находились в диапазоне от 0,2 (0,02-0,78) нг/мл до 4,8±14,54 нг/мл, но, как правило, не достигали 1 нг/мл [39,44-48]. Таким образом, средний уровень ПКТ в нашем исследовании у пациентов с ВП (2,48±6,97 нг/мл) следует рассматривать как существенно повышенный для данного заболевания. В то же время изучаемый показатель характеризовался выра женной межиндивидуальной вариабельностью. Сыво ро точные концентрации ПКТ достигали порога высокого риска системной инфекции (≥2 нг/мл) менее чем в 20% случаев. Данный факт может быть обусловлен особенностями изучаемой субпопуляции, в основном, включавшей больных с нетяжелым течением ВП (>90%).
Результаты определения уровня ПКТ при ХСН также различались в разных исследованиях. В некоторых из них у пациентов с тяжелой систолической дисфункцией левого желудочка было зафиксировано повышение этого показателя от 0,13 (0,05-0,22) до 1,3 (0,89-1,8) нг/мл, однако в большинстве исследований сывороточные концентрации биомаркера соответствовали референсному диапазону [2,24,49-51]. В нашей работе у 97% (34/35) больных с без ВП данный показатель не выходил за пределы нормальных значений, что, возможно, объясняется преобладанием в изучаемой выборке пациентов с невыраженной систолической дисфункцией левого желулдочка, а также пациентов с изолированной диастолической дисфункцией левого желудочка.
Достоверность различий сывороточных концентраций ПКТ у больных с подтвержденной ВП и инфекциями дыхательных путей в нашем исследовании не вызывает сомнений. В то же время, результаты определения биомаркера у пациентов с инфекциями дыхательных путей и недостаточностью кровообращения, представленные другими авторами, не столь однозначны. Так, в исследовании A. Maisel и соавт. уровни ПКТ составили (без указания статистической значимости) 0,18 (0,05-0,2) нг/мл у пациентов с ВП без ХСН, 0,09 (0,06-0,16) нг/мл у пациентов с ХСН без ВП и 0,14 (0,09-0,26) нг/мл у пациентов с сочетанием ВП и ХСН [2]. W. Wang и соавт. были получены несколько иные результаты: сывороточные концентрации биомаркера в аналогичных подгруппах составили (без указания статистической значимости) 0,28 (0,06-0,49) нг/мл у пациентов с бактериальной инфекцией дыхательных путей без ХСН, 0,13 (0,05-0,22) нг/мл у пациентов с изолированной ХСН и 0,45 (0,12-2,59) нг/мл у больных с бактериальной инфекцией дыхательных путей на фоне ХСН [25].
Регрессионный анализ продемонстрировал высокую эффективность содержания ПКТ для диагностики ВП у пациентов с сопутствующей ХСН и очень хорошую классифицирующую способность переменной: AUC= 0,81, 95% ДИ 0,72-0,90, р=0,042. Однако по данным других авторов, ценность ПКТ как предиктора ВП в различных субпопуляциях больных, в целом, оказалось достаточно вариабельной [2,25,38-40,52]. В частности, в одном исследовании дополнительное определение биомаркера по сравнению с клинической моделью существенно повысило ее эффективность (AUC=0,79, 95% ДИ 0,75-0,83 и AUC=0,88, 95% ДИ 0,85-0,91, p<0,001), а в другом – практически не изменило (AUC=0,70, 95% ДИ 0,65-0,75, и AUC=0,71, 95% ДИ 0,67-0,76, p>0,05) [40,52]. При дифференциальной диагностике ВП с другими респираторными заболеваниями (туберкулез легких, неконтролируемая бронхиальная астма) классифицирующая способность ПКТ характеризовалась AUC=0,88 (95% ДИ 0,79-0,95) и AUC=0,93 (95% ДИ 0,88-0,98), соответственно [38,39]. Показатели оценки данного биомаркера в качестве предиктора инфекции дыхательных путей/ВП в субпопуляции пациентов с недостаточностью кровообращения варьировались от AUC=0,72 до AUC>0,8, однако в целом были сопоставимыми с результатами нашего анализа [2,25].
ИЛ-6 считается классическим провоспалительным цитокином, сывороточные концентрации которого увеличиваются при многих инфекционных и неинфекционных заболеваниях [53]. В большинстве исследований было продемонстрировано повышение его уровня при ВП, однако полученные результаты оказались чрезвычайно вариабельными, что вероятно, связано с различиями в дизайне исследований. По данным разных авторов, среднее содержание биомаркера в сыворотке крови составляло от 48 до 3569 пг/мл, но в неоднородных субпопуляциях больных пневмонией, как правило, не превышало 300 пг/мл [24,54]. Таким образом, полученный в нашем исследовании уровень ИЛ-6 (94,23± 97,44 пг/мл) соответствовал представленному в литературе диапазону концентраций. Однако превышающее среднюю величину стандартное отклонение показателя свидетельствует о выраженной его вариабельности, что может ограничивать диагностическую ценность данного биомаркера.
Гиперпродукция цитокинов, в том числе ИЛ-6, лежит в основе одной из теорий прогрессирования недостаточности кровообращения [55]. Однако концентрации биомаркера в различных субпопуляциях больных ХСН существенно отличались: от нормальных (2,38±2,38 пг/мл) до многократно повышенных [51 (9-219) пг/мл] [56,57]. Тем не менее, в большинстве исследований данный показатель увеличивался незна чительно, достигая лишь 10-15 пг/мл при обычном референсном диапазоне 0-10 пг/мл [58-59]. Уровень ИЛ-6, полученный нами у пациентов без ВП, несколько превышал указанный интервал (19,57±14,83 пг/мл). Учитывая преобладание в изученной выборке больных с невыраженной систолической дисфункцией левого желудочка, степень которой прямо пропорциональна секреции биомаркера, представленные результаты могут быть связаны с влиянием на интерлейкиновый профиль других, не ассоциированных с пневмонией инфекций дыхательных путей [60].
В нашем исследовании уровень ИЛ-6 был достоверно выше у пациентов с ВП, что может указывать на определенные перспективы его использования в алгоритме дифференциальной диагностики. Аналогичная тенденция была выявлена в исследовании T. Mueller и соавт.: сывороточные концентрации биомаркера при ВП без ХСН составили 48 (7-245) пг/мл, при ХСН без ВП – 4,6 (2-15) пг/мл, при сочетании ВП и ХСН – 43 (10-1088) пг/мл [24]. В упомянутой выше работе W. Wang и соавт. были зарегистрированы следующие уровни ИЛ-6: 21,3±15,1 пг/мл при бактериальной инфекции дыхательных путей без ХСН, 7,3±3,5 пг/мл при изолированной ХСН и 19,4±11,9 пг/мл при бактериальной инфекции дыхательных путей на фоне ХСН (статистическая достоверность различий авторами не указана) [25].
Диагностическая эффективность ИЛ-6 в алгоритме верификации ВП у пациентов с сопутствующей ХСН определена методом анализа на основе логистической регрессии (р=0,003). При этом классифицирующая способность биомаркера, рассчитанная по площади под ROC-кривой, оценивалась как очень хорошая (AUC= 0,81, 95% ДИ 0,71-0,91). К сожалению, аналогичных по дизайну исследований, позволяющих охарактеризовать и сравнить прикладное значение ИЛ-6 для диагностики пневмонии (в том числе, дифференциальной) в какихлибо субпопуляциях больных, в доступной литературе нами не найдено.
ФНОα, как и ИЛ-6, относится к многофункциональным цитокинам с провоспалительной активностью. Уровень ФНОα может повышаться при многих патологических состояниях [61]. Анализ исследований, предполагавших определение данного биомаркера в различных группах больных ВП, продемонстрировал его выраженную вариабельность. Сывороточные концентрации ФНОα, по данным отдельных авторов, варьировались от близких к физиологическим [7,6 (5,8-14,4) пг/мл] до существенно повышенных (56,1±80,44 пг/мл) [62,63]. В нашем исследовании уровень биомаркера у пациентов с ВП и сопутствующей ХСН не достигал верхней границы референсного интервала (6 пг/мл) и составил 3,29±5,89 пг/мл, отличаясь значительной вариабельностью. Возможно, столь низкая активность секреции ФНОα обусловлена нетяжелым течением пневмонии у подавляющего большинства больных, о чем уже упоминалось ранее. Подтверждением данной гипотезы может служить положительная корреляционная зависимость между индексом интегральной шкалы тяжести состояния пациента с ВП и сывороточной концентрацией данного цитокина, полученная A.J. Puren и соавт. (r=0,626, p<0,0002) [64].
Результаты оценки ФНОα при ХСН, несмотря на известные доказательства его роли в прогрессировании кардиальной дисфункции, также оказались противоречивыми [65,66]. Так, частота выявления нормального и повышенного уровня биомаркера в представленных исследованиях оказалось сопоставимой, при этом его содержание в сыворотке крови больных с недостаточностью кровообращения, по данным отдельных авторов, составляло от 1,3±0,3 до 29,6±0,6 пг/мл [60,67]. Средняя концентрация ФНОα у пациентов с декомпенсацией ХСН без ВП в нашей работе находилась в пределах указанного интервала и составляла 1,42±1,97 пг/мл. Данный показатель соответствовал референсным значениям биомаркера и, так же как в группе сравнения, характеризовался существенной межиндивидуальной вариабельностью. Низкое содержание ФНОα может объясняться особенностями рассматриваемой выборки, включавшей пациентов с нетяжелой систолической дисфункцией левого желудочка, степень выраженности которой, по данным некоторых авторов, прямо пропорциональна изменению профиля секреции цитокина [68,69].
Содержание ФНОα в сыворотке крови больных с ВП и без нее достоверно не отличалось (р=0,122). Следует отметить, что соответствие обеих величин референсному диапазону a priori исключает возможность использования данного биомаркера в диагностике (в том числе, дифференциальной) рассматриваемых заболеваний, так как его секреция может быть сопоставимой с таковой у здоровых людей. Учитывая изложенное выше, закономерными оказались и результаты регрессионного анализа, которые также подтвердили неэффективность ФНОα в алгоритме верификации пневмонии у пациентов с ХСН (р=0,092).
МНУП – биомаркер, гиперсекреция которого в той или иной степени отмечается при развитии и прогрессировании недостаточности кровообращения. Случаи повышения его сывороточных концентраций при других заболеваниях в литературе описаны, однако, как правило, все равно ассоциированы с поражением сердца и сосудов (тромбоэмболия легочной артерии, легочная гипертония, алкогольная кардиомиопатия) [70]. Тем не менее, в различных субпопуляциях больных ВП средние уровни МНУП варьировались от 26±14,57 до 273±360 пг/мл. В то же время дизайн исследований, в которых была выявлена гиперсекреция биомаркера, не предполагал исключение из выборки пациентов с сопутствующей ХСН, чем, вероятно, и обусловлены полученные данные [24,71-73]. Сывороточная концентрация МНУП у пациентов с пневмонией в нашем исследовании соответствовала диапазону значений, представленных другими авторами, и составила 261,75±306,84 пг/мл. Данный факт следует считать вполне закономерным, учитывая основной критерий включения больных в две группы.
Содержание МНУП при недостаточности кровообращения в других исследованиях находилось в широком диапазоне: от 140,5±125,1 до 1394±934 пг/мл [50,71]. Столь значительная вариабельность связана с неоднородностью популяций пациентов, включая различия тяжести кардиальной дисфункции, доли пациентов с систолической дисфункцией левого желудочка и изолированной диастолической дисфункцией левого желудочка, степени компенсации заболевания, влиянием на секрецию биомаркера некоторых дополнительных факторов (возраст, пол, скорость клубочковой фильтрации) [58,69,70,74,75]. По данным нашего исследования, средняя концентрация МНУП у пациентов с ХСН без ВП составила 200,42±221,93 пг/мл. Относительно невысокий уровень биомаркера (как и в группе сравнения), скорее всего, был обусловлен неоднородностью выборки пациентов с разными типами кардиальной дисфункции, а также преобладанием случаев нетяжелой систолической дисфункции левого желудочка.
Отсутствие статистически значимых различий исходного содержания МНУП в сыворотке крови в обеих группах пациентов с ХСН (р=0,593) указывало на бесперспективность его дополнительного определения в алгоритме диагностики ВП у этой категории больных. Аналогичные результаты были получены и при анализе диагностической способности биомаркера на основе логистической регрессии (р=0,339). Данный факт является вполне объяснимым, так как в доступной литературе сведения о возможности прямого воздействия механизмов развития пневмонии на секрецию МНУП не представлены. С другой стороны, сопоставимые уровни биомаркера в двух группах больных ХСН могут также свидетельствовать об отсутствии существенного влияния нетяжелой ВП на степень декомпенсации недостаточности кровообращения, что является крайне важным в клиническом и прогностическом аспектах.
На заключительном этапе анализа трех биомаркеров, потенциально перспективных для дополнительного включения в алгоритм верификации ВП на фоне ХСН, диагностическая ценность двух из них (ПКТ и ИЛ-6) была расценена как недостаточная. Оба биомаркера отличались выраженной межиндивидуальной вариабельностью показателей. При повышении специфичности определения ПКТ и ИЛ-6 отмечалось значимое снижение их чувствительности, что недопустимо для данной категории больных. Подобное несоответствие не позволило подобрать приемлемые пороговые значения сывороточных концентраций данных биомаркеров.
Таким образом, наиболее эффективным предиктором ВП при сопутствующей ХСН, можно считать С-РБ, определение которого, по сравнению с другими показателями, является наиболее валидированным и доступным в рутинной клинической практике. Финальный этап исследования предполагал выбор порогового значения биомаркера, позволяющего с оптимальным соотношением чувствительности и специфичности дифференцировать пневмонию и другие инфекции дыхательных путей.
В доступной литературе представлено достаточно данных о результатах изучения С-РБ в данном аспекте. Рядом авторов для диагностики ВП были предложены различные пороговые уровни определения биомаркера в мономерных и многомерных моделях с вариабельными показателями итоговой эффективности [12,3841,52,76-78]. Минимальная концентрация С-РБ ≥20 мг/л, позволяющая с чувствительностью 73% и специфичностью 65% дифференцировать пневмонию и другие инфекции дыхательных путей, была предложена A. Holm и соавт. [76]. Несколько более высокие пороговые значения биомаркера (>30 мг/л и >33 мг/л; чувствительность метода – 83%, специфичность – 44%) при включении его в клиническую модель диагностики были получены S.F. van Vugt и соавт. и J. Almirall и соавт. [12,52]. Уровень С-РБ 40 мг/л, предложенный для верификации ВП в двух независимых проспективных исследованиях, характеризовался несопоставимыми показателями эффективности (≥40 мг/л с чувствительностью 70% и специфичностью 90% vs >40 мг/л c чувствительностью 89% и специфичностью 52%) [40,41]. Сывороточная концентрация биомаркера >48 мг/л позволяла дифференцировать пневмонию с обострением ХОБЛ и неконтролируемой бронхиальной астмой (чувствительность – 91%, специфичность – 93%) [38]. Пороговое значение 50 мг/л было наиболее распространенным, однако варьировалось по соотношению чувствительности и специфичности в разных исследованиях: 87%/65% (клиническая модель без учета результатов рентгенологической диагностики ВП), 94%/72% (модель, позволяющая снизить частоту необоснованной антибиотикотерапии при инфекциях дыхательных путей), 74%/96% (дифференциальная диагностика ВП и других инфекций дыхательных путей), 50%/89% (дифференциальная диагностика туберкулеза легких и ВП). Данными авторами были предложены также более высокие пороговые значения С-РБ (100-200 мг/л), позволяющие с различной чувствительностью и специфичностью подтвердить или исключить пневмонию [39-41,77,78].
Необходимо подчеркнуть, что, несмотря на различия в дизайне и характеристиках рассматриваемых попу ляций пациентов, многие из указанных пороговых значений С-РБ не могут считаться достаточно эффективными для верификации ВП как острого инфекционного заболевания с возможным неблагоприятным исходом. При проведении анализа диагностической ценности биомаркеров в нашем исследовании, в первую очередь, учитывалось соотношение чувствительности и специфичности, которые должны быть максимально высокими для предложенного уровня переменной-предиктора. С учетом изложенного выше, оптимальным, по нашему мнению, является пороговое значение С-РБ >28,5 мг/л, которое позволяет с чувствительностью 85,7% и специфичностью 91,4% подтвердить ВП у пациентов с сопутствующей ХСН (положительная прогностическая значимость – 90,9%, отрицательная прогностическая значимость – 86,4%). Следует, однако, отметить, что предложенный уровень биомаркера представляется относительно низким по сравнению с полученными другими авторами. Данный факт, вероятно, обусловлен исходно невысокой средней концентрацией белка у больных с пневмонией и не лимитирует его предикторные возможности.
Заключение
Исходные сывороточные концентрации С-РБ, ПКТ, ИЛ-6 у больных ВП и ХСН достоверно выше, чем у пациентов с другими инфекциями дыхательных путей, что свидетельствует об их потенциальной ценности для дифференциальной диагностики данных заболеваний. Определение ФНОα для диагностики ВП у пациентов с ХСН не имеет практического значения. Развитие ВП у пациентов с ХСН существенно не влияет на секрецию МНУП и, вероятно, на степень декомпенсации недостаточности кровообращения. По данным регрессионного анализа наиболее эффективным из изученных биомаркеров может считаться С-РБ, пороговое значение которого >28,5 мг/л позволяет подтвердить ВП у пациентов с сопутствующей ХСН с чувствительностью 85,7% и специфичностью 91,4%. Определение С-РБ может использоваться дополнительно к рутинному алгоритму с целью оптимизации дифференциальной диагностики ВП и других инфекций дыхательных путей в сочетании с ХСН, в том числе при наличии симптомов и признаков декомпенсации кровообращения.
Используемые источники
- Чучалин А.Г., Синопальников А.И., Страчунский Л.С. и др. Внеболь ничная пневмония у взрослых: практические рекомендации по диагностике, лече- нию и профилактике. Клин микробиол антимикроб химиотер 2006;8(4):54- 86.
- Maisel A, Neath SX, Landsberg J, et al. Use of procalcitonin for the diagnosis of pneumonia in patients presenting with a chief complaint of dyspnoea: results from the BACH (Biomarkers in Acute Heart Failure) trial. Eur J Heart Fail 2012; 14(3):278-86.
- Mueller C, Scholer A, Laule-Kilian K, et al. Use of B-type natriuretic peptide in evaluation and management of acute dyspnea. N Engl J Med 2004;350:647-54.
- Dickstein K, Cohen-Solal A, Filippatos G, et al. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. Eur Heart J 2008;29:2388-442.
- Kanwar M, Brar N, Khatib R, et al. Misdiagnosis of community-acquired pneu- monia and inappropriate utilization of antibiotics: side effects of the 4-h antibiot- ic administration rule. Chest 2007;131(6):1865-9.
- Basi SK, Marrie TJ, Huang JQ, et al. Patients admitted to hospital with suspect- ed pneumonia and normal chest radiography. epidemiology, microbiology and outcomes. Am J Med 2004;117(5):305-11.
- Loeb MB, Carusone SB, Marrie TJ, et al. Interobserver reliability of radiologists’ interpretations of mobile chest radiographs for nursing home-acquired pneumonia. J Am Med Dir Assoc 2006;7(7):416-9.
- Lee YJ, Lee J, Park YS, et al. Predictors of cardiogenic and non-cardiogenic causes in cases with bilateral chest infiltrates. Tuberc Respir Dis (Seoul) 2013; 74(1):15-22.
- Zalacain R, Torres A, Celis R, et al. Community-acquired pneumonia in the elderly: Spanish multicentre study. Eur Respir J 2003;21(2):294-302.
- Maruyama T, Gabazza EC, Morser J, et al. Community-acquired pneumonia and nursing home-acquired pneumonia in the very elderly patients. Respir Med 2010;104(4):584-92.
- Joffe E, Justo D, Mashav N, et al. C-reactive protein to distinguish pneumonia from acute decompensated heart failure. Clin Biochem 2009;42(16-17):1628-34.
- Almirall J, Bolíbar I, Toran P, et al. Community-acquired pneumonia Maresme Study Group. Contribution of C-reactive protein to the diagnosis and assessment of severity of community-acquired pneumonia. Chest 2004;125(4):1335-42.
- Menéndez R, Sahuquillo-Arce JM, Reyes S, et al. Cytokine activation patterns and biomarkers are influenced by microorganisms in community-acquired pneu- monia. Chest 2012;141(6):1537-45.
- Kolditz M, Halank M, Schulte-Hubbert B, et al. Adrenal function is related to prognosis in moderate community-acquired pneumonia. Eur Respir J 2010;36(3): 615-21.
- Ramírez P, Ferrer M, Marti V, et al. Inflammatory biomarkers and prediction for intensive care unit admission in severe community-acquired pneumonia. Crit Care Med 2011;39(10):2211-7.
- Christ-Crain M, Opal SM. Clinical review: The role of biomarkers in the diagno- sis and management of community-acquired pneumonia. Crit Care 2010;14:203.
- El Solh A, Pineda L, Bouquin P, et al. Determinants of short and long term func- tional recovery after hospitalization for community-acquired pneumonia in the elderly: role of inflammatory markers. BMC Geriatrics 2006;6:12.
- Beltrami M, Palazzuoli A, Ruocco G, et al. The predictive value of plasma bio- markers in discharged heart failure patients: the role of plasma BNP. Minerva Cardioangiol 2016;64(2):147-56.
- Alehagen U, Dahlstrоm U, Rehfeld JF, et al. Association of copeptin and N-ter- minal proBNP concentrations with risk of cardiovascular death in older patients with symptoms of heart failure. JAMA 2011;305(20):2088-95.
- Klip IT, Voors AA, Anker SD, et al. Prognostic value of mid-regional pro- adrenomedullin in patients with heart failure after an acute myocardial infarction. Heart 2011;97(11):892-8.
- Balling L, Gustafsson F. Copeptin in heart failure. Adv Clin Chem 2016;73:29-64.
- Xue Y, Taub P, Iqbal N, et al. Mid-region pro-adrenomedullin adds predictive value to clinical predictors and Framingham risk score for long-term mortality in stable outpatients with heart failure. Eur J Heart Fail 2013;15(12):1343-9.
- Gravning J, Askevold ET, Nymo SH, et al. Prognostic effect of high-sensitive tro- ponin T assessment in elderly patients with chronic heart failure: results from the CORONA trial. Circ Heart Fail 2014;7(1):96-103.
- Mueller T, Leitner I, Egger M, et al. Association of the biomarkers soluble ST2, galectin-3 and growth-differentiation factor-15 with heart failure and other non- cardiac diseases. Clin Chim Acta 2015;445:155-60.
- Wang W, Zhang X, Ge N, et al Procalcitonin testing for diagnosis and short-term prognosis in bacterial infection complicated by congestive heart failure: a multi- center analysis of 4,698 cases. Crit Care 2014;18(1):R4.
- Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные рекоменда- ции ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). Журнал Сердечная Недостаточность 2013;14(7):379-472.
- Dai S, Walsh P, Wielgosz A, et al. Comorbidities and mortality associated with hospitalized heart failure in Canada. Can J Cardiol 2012;28(1):74-9.
- Xiao K, Su LX, Han BC, et al. Analysis of the severity and prognosis assessment of aged patients with community-acquired pneumonia: a retrospective study. J Thorac Dis 2013;5(5):626-33.
- Ishiguro T, Takayanagi N, Yamaguchi S, et al. Etiology and factors contributing to the severity and mortality of community-acquired pneumonia. Intern Med 2013;52(3):317-24.
- Liu L. Changes in cardiovascular hospitalization and comorbidity of heart failure in the United States: findings from the National Hospital Discharge Surveys 1980- 2006. Int J Cardiol 2011;149(1):39-45.
- Вельков В.В. С-реактивный белок – структура, функция, методы определе- ния, клиническая значимость. Лаб медицина 2006;8:1-7.
- Xu Y, Lin H, Zhou Y, et al. Ceruloplasmin and the extent of heart failure in ischemic and nonischemic cardiomyopathy patients. Mediators Inflamm 2013; 2013:348145.
- De Gennaro L, Brunetti ND, Montrone D, et al. Inflammatory activation and carbohydrate antigen-125 levels in subjects with atrial fibrillation. Eur J Clin Invest 2012;42(4):371-5.
- Moon J, Kang SM, Cho IJ, et al. Clinical and echocardiographic findings of newly diagnosed acute decompensated heart failure in elderly patients. Yonsei Med J 2011;52(1):33-8.
- Brown JS. Community-acquired pneumonia. Clin Med 2012;12(6):538-43.
- Matsubara J, Sugiyama S, Nozaki T, et al. Pentraxin 3 is a new inflammatory marker correlated with left ventricular diastolic dysfunction and heart failure with normal ejection fraction. J Am Coll Cardiol 2011;57(7):861-9.
- Steurer J, Held U, Spaar A, et al. A decision aid to rule out pneumonia and reduce unnecessary prescriptions of antibiotics inprimary care patients with cough and fever. BMC Med 2011;9(56) doi: 10.1186/1741-7015-9-56.
- Bafadhel M, Clark TW, Reid C, et al. Procalcitonin and C-reactive protein in hospitalized adult patients with community-acquired pneumonia or exacerbation of asthma or COPD. Chest 2011;139(6):1410-8.
- Kang YA, Kwon SY, Yoon H, et al. Role of C-reactive protein and procalcitonin in differentiation of tuberculosis from bacterial community acquired pneumonia. Korean J Intern Med 2009;24(4):337-42.
- Müller B, Harbarth S, Stolz D, et al. Diagnostic and prognostic accuracy of clin- ical and laboratory parameters in community-acquired pneumonia. BMC Infect Dis 2007;7:10.
- Flanders SA, Stein J, Shochat G, et al. Performance of a bedside C-reactive pro- tein test in the diagnosis of community-acquired pneumonia in adults with acute cough Am J Med 2004;116(8):529-35.
- Reinhart K, Karzai W, Meisner M. Procalcitonin as a marker of the systemic inflammatory response to infection. Intensive Care Med 2000;26(9):1193-200.
- Foushee J, Hope NH, Grace EE. Applying biomarkers to clinical practice: a guide for utilizing procalcitonin assays. J Antimicrob Chemother 2012;67(11):2560-9.
- Kim JH, Seo JW, Mok JH, et al. Usefulness of plasma procalcitonin to predict severity in elderly patients with community-acquired pneumonia. Tuberc Respir Dis (Seoul) 2013;74(5):207-14.
- Krüger S, Ewig S, Papassotiriou J, et al. Inflammatory parameters predict etiolog- ic patterns but do not allow for individual prediction of etiology in patients with CAP – Results from the German competence network CAPNETZ. Respir Res 2009;10:65.
- Claessens Y, Mathevon T, Kierzek G, et al. Accuracy of C-reactive protein, pro- calcitonin, and mid-regional pro-atrial natriuretic peptide to guide site of care of community-acquired pneumonia. Intensive Care Med 2010;36(5):799-809.
- Horie M, Ugajin M, Suzuki M, et al. Diagnostic and prognostic value of procal- citonin in community-acquired pneumonia. Am J Med Sci 2012;343(1):30-5.
- Lacoma A, Bas A, Tudela P, et al. Correlation of inflammatory and cardiovascu- lar biomarkers with pneumonia severity scores. Enferm Infecc Microbiol Clin 2014;32(3):140-6.
- Kafkas N, Venetsanou K, Patsilinakos S, et al. Procalcitonin in acute myocardial infarction. Acute Card Care 2008;10(1):30-6.
- Wang Y, Zhou Y, Meng L, et al. Inflammatory mediators in Chinese patients with congestive heart failure. J Clin Pharmacol 2009;49(5):591-9.
- Niebauer J, Volk HD, Kem M, et al. Endotoxin and immune activation in chron- ic heart failure: a prospective cohort study. Lancet 1999;353(9167):1838-42.
- van Vugt SF, Broekhuizen BD, Lammens C, et al. Use of serum C reactive pro- tein and procalcitonin concentrations in addition to symptoms and signs to predict pneumonia in patients presenting to primary care with acute cough: diagnostic study. BMJ 2013;346:f2450.
- Derosa G, Maffioli P, Simental-Mendia LE, et al. Effect of curcumin on circu- lating interleukin-6 concentrations: A systematic review and meta-analysis of ran- domized controlled trials. Pharmacol Res 2016;111:394-404.
- Calbo E, Alsina M, Rodrí guez-Carballeira M, et al. The impact of time on the systemic inflammatory response in pneumococcal pneumonia. Eur Respir J 2010; 35(3):614-8.
- Blum A, Miller H. Role of cytokines in heart failure. Am Heart J 1998;135(2): 181-6.
- Kinugawa T, Kato M, Yamamoto K, et al. Proinflammatory cytokine activation is linked to apoptotic mediator, soluble Fas level in patients with chronic heart fail- ure. Int Heart J 2012;53(3):182-6.
- Stanciu AE, Vatasescu RG, Stanciu MM, et al. Cardiac resynchronization thera- py in patients with chronic heart failure is associated with anti-inflammatory and anti-remodeling effects. Clin Biochem 2013;46(3):230-4.
- Matsumoto M, Tsujino T, Lee-Kawabata M, et al. Serum interleukin-6 and C- reactive protein are markedly elevated in acute decompensated heart failure patients with left ventricular systolic dysfunction. Cytokine 2010;49(3):264-8.
- Johansson P, Lesman-Leegte I, Svensson E, et al. Depressive symptoms and inflammation in patients hospitalized for heart failure. Am Heart J 2011;161(6): 1053-9.
- Peschel T, Schönauer M, Thiele H, et al. Invasive assessment of bacterial endo- toxin and inflammatory cytokines in patients with acute heart failure. Eur J Heart Fail 2003;5(5):609-14.
- Mannel DN, Echtenacher B. TNF in the inflammatory response. Chem Immunol 2000;74:141-61.
- Köktürk N, Kanbay A, Bukan N, et al. The value of serum procalcitonin in dif- ferential diagnosis of pulmonary embolism and community-acquired pneumonia. Clin Appl Thromb Hemost 2011;17(5):519-25.
- Bacci MR, Leme RC, Zing NP, et al. IL-6 and TNF-α serum levels are associat- ed with early death in community-acquired pneumonia patients. Braz J Med Biol Res 2015;48(5):427-32.
- Puren AJ, Feldman C, Savage N, et al. Patterns of cytokine expression in com- munity-acquired pneumonia. Chest 1995;107(5):1342-9.
- von Haehling S, Schefold JC, Lainscak M, et al. Inflammatory biomarkers in heart failure revisited: much more than innocent bystanders. Heart Fail Clin 2009;5(4):549-60.
- Lecour S, James RW. When are pro-inflammatory cytokines SAFE in heart fail- ure? Eur Heart J 2011;32(6):680-5.
- Fink AM, Gonzalez RC, Lisowski T, et al. Fatigue, inflammation, and projected mortality in heart failure. J Card Fail 2012;18(9):711-6.
- Niethammer M, Sieber M, von Haehling S, et al. Inflammatory pathways in patients with heart failure and preserved ejection fraction. Int J Cardiol 2008; 129(1):111-7.
- Boffa GM, Zaninotto M, Sartor R, et al. Interleukin-6 and tumor necrosis factor- alpha as biochemical markers of heart failure: a head-to-head clinical comparison with B-type natriuretic peptide. J Cardiovasc Med (Hagerstown) 2009;10:758-64.
- Попова К.А., Авдеев С.Н. Значение натрийуретических пептидов в диагно- стике сердечной недостаточности и других заболеваний. Пульмонология 2006;4:106-11.
- Parab R, Vasudevan A, Brensilver J, et al. Utility of brain natriuritic peptide as a diagnostic tool for congestive heart failure in the elderly. Crit Pathw Cardiol 2005;4(3):140-4.
- An JD, Zhang YP, Zhou JH. Levels of serum brain natriuretic peptide in children with congestive heart failure or with severe pneumonia. Zhongguo Dang Dai Er Ke Za Zhi 2006;8(3):201-4.
- Leli C. Utility of brain natriuretic peptide as prognostic marker in community- acquired pneumonia and chronic obstructive pulmonary disease exacerbation patients presenting to the emergency department. Infez Med 2011;19(4):235-40.
- de Denus S, Lavoie J, Ducharme A, et al. Differences in biomarkers in patients with heart failure with a reduced vs a preserved left ventricular ejection fraction. Can J Cardiol 2012;28(1):62-68.
- Базаева Е.В., Мясников Р.П., Метельская В.А., Бойцов С.А. Диагности чес - кая значимость биологических маркеров при хронической сердечной недо- статочности с сохраненной фракцией выброса левого желудочка. Журнал Сердечная Недостаточность 2015;16(1):43-51.
- Holm A, Pedersen SS, Nexoe J, et al. Procalcitonin versus C-reactive protein for predicting pneumonia in adults with lower respiratory tract infection in primary care. Br J Gen Pract 2007;57(540):555-60.
- Stolz D, Christ-Crain M, Gencay MM, et al. Diagnostic value of signs, symptoms and laboratory values in lower respiratory tract infection. Swiss Med Wkly 2006;136(27-28):434-40.
- Melbye H, Straume B, Aasebо U, et al. The diagnosis of adult pneumonia in gen- eral practice. The diagnostic value of history, physical examination and some blood tests. Scand J Prim Health Care 1988;6(2):111
