Современные представления о болезни Бехчета
Болезнь Бехчета, это редкое системное заболевание, которое относят к группе системных васкулитов без преобладающего типа сосудистого поражения (с вариабельным диаметром пораженных сосудов). Критерии диагноза включают в себя афтозный стоматит или герпетиформные язвы, рецидивирующие не менее 3 раз в год, в сочетании по крайней мере с двумя симптомами: рецидивирующие язвы гениталий, поражение глаз (передний, задний увеит, клетки в стекловидном теле, васкулит сетчатки); поражение кожи (узловатая эритема, псевдофолликулит и папулопустулезные высыпания, акнеподобная сыпь у пациента в постпубертатном периоде, не получающего глюкокортикостероиды); положительный тест патергии.
Моисеев С.В.: Болезнь Бехчета (ББ) – это редкое системное заболевание неизвестной этиологии, характеризующееся развитием острых эпизодов системной воспалительной активности и протекающее с поражением различных органов и систем. В соответствии с современной классификацией, принятой на конференции в Чапел-Хилле в 2012 г., ББ относят к группе системных васкулитов без преобладающего типа сосудистого поражения (васкулит с вариабельным диаметром пораженных сосудов), поскольку при этом заболевании в патологический процесс могут вовлекаться сосуды почти любого диаметра и локализации [1,2]. Заболевание впервые было выделено в отдельную нозологическую форму турецким дерматологом Хулуси Бехчетом в 1937 г., который на основании длительного наблюдения за тремя пациентами описал классическую триаду симптомов: увеит, афтозный стоматит и язвенное поражение гениталий. Однако первое описание этого симптомокомплекса было сделано еще Гиппократом в V веке до нашей эры.
Буланов Н.М.: Патогенез ББ до настоящего времени остается не до конца изученным. Полученные в различных исследованиях данные позволяют предположить вклад в развитие заболевания комплексных нарушений врожденного (innate) и приобретенного иммунитета, возникающих у пациентов с генетической предрас по ложенностью под действием различных факторов окружающей среды. Обсуждалась триггерная роль бактериальных и вирусных инфекций, а также нарушения микробиома ротовой полости и желудочно-кишечного тракта (ЖКТ), которые могут влиять на активность регуляторных Т-лимфоцитов и способствовать пролиферации их аутореактивных клонов [3]. Высказано предположение о том, что в патогенезе ББ ключевую роль может играть аутоиммунный каскад, который поддерживают сигналы от поврежденных клеток организма хозяина [4,5]. Вследствие этого развивается гиперреактивность иммунной системы на внешние стимулы, что ведет к неконтролируемой активации приобретенного иммунитета, опосредованной нарушением функции Т-лимфоцитов и антиген-презентирующих клеток. Избыточная экспрессия провоспалительных цитокинов Th1 и Th17 поддерживает воспалительные реакции при ББ. Под действием лимфоцитов происходит активация эндотелиальных клеток и нейтрофилов, в которые, свою очередь, демонстрируют повышенную фагоцитарную активность, хемотаксис, продуцируют свободные радикалы и лизосомальные ферменты. Нельзя также исключить вклад в развитие ББ аутовоспалительных реакций, индуцированных аутоантигенами [6].
Моисеев С.В.: За последние десятилетия произошла эволюция представлений об эпидемиологии, патогенезе, клинических проявлениях и прогнозе ББ, что привело к формированию новых подходов к лечению заболевания. Представленное далее наблюдение демонстрирует характерное течение заболевания с полиорганным поражением, которое длительное время оставалось нераспознанным, что стало причиной позднего начала патогенетической терапии.
Каровайкина Е.А.: Больная Ш., 43 года, психолог. Отец – азербайджанец (в анамнезе хориоретинит, отслойка сетчатки, язвы ротовой полости), мать – удмуртка, бабушка со стороны отца (отслойка сетчатки). Пациентка с детства отмечала периодическое появление язвочек на гениталиях и в ротовой полости, проводилось местное лечение (рис. 1). С 22 лет на фоне лихорадки до 38°С появились симметричные язвы на голенях, афтозный стоматит, боли в животе, диарея. Язвы на коже и слизистых оболочках регрессировали в течение 6 месяцев. В это же время пациентка отметила внезапное сужение полей зрения. Офтальмологом диагностирована отслойка сетчатки, проведена лазерная коррекция. В последующем наблюдалась в НИИ глазных болезней им. Гельмгольца с диагнозом тапеторетинальной абиотрофии сетчатки обоих глаз, лечения не получала.
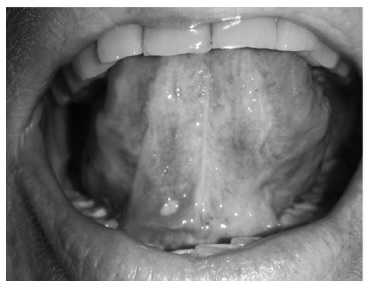
В дальнейшем 3-4 раза в год отмечала рецидивы стоматита, боли в животе, периодически диарею. Симп томатическое лечение (лоперамид, дротаверин, омепразол) без существенного эффекта. В 25 лет очередной рецидив заболевания, сопровождавшийся увеличением количества язв в ротовой полости, усилением боли в животе, нарастанием диареи. Пациентка лечилась самостоятельно, эпизод был купирован в течение 1 месяца.
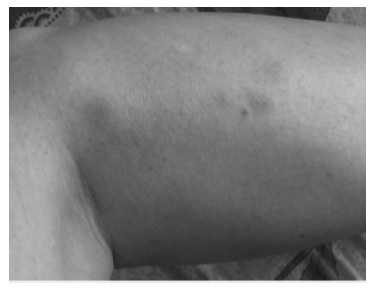
В 32 года после инсоляции появились узловатые высыпания на коже верхних и нижних конечностей (рис. 2), выраженные боли в животе и диарея. Похудела на 10 кг. При колоноскопии были исключены воспалительные заболевания кишечника. Диагноз оставался неясным. Состояние самостоятельно улучшилось в течение 2-3 месяцев.
В 34 года в связи с выраженными болями в животе пациентка была госпитализирована в хирургическое отделение ГКБ №54 г. Москва. При лапароскопии данных за наличие острой хирургической патологии не выявлено. Через 2 года развился очередной приступ выраженных болей в животе. В ЦКБ гражданской авиации при повторной диагностической лапароскопии был исключен острый аппендицит, выполнено иссечение мелких спаек. В последующем пациентку продолжали беспокоить боли в животе и диарея, рецидивирующий стоматит.
С 2015 года (41 год) пациентка стала отмечать боли в крупных суставах. Стоматит и изъязвления половых органов рецидивировали 3-4 раза в год, проводилось лечение вифероном, ацикловиром внутрь и гексидиновой мазью местно с временным эффектом. Любая травматизация приводила к появлению стоматита, язв и высыпаний на коже. С этого времени стала отмечать болезненность кожных элементов и язв слизистых оболочек, самостоятельно принимала антигистаминные препараты. При амбулаторном обследовании отмечено повышение уровня ревматоидного фактора до 512 МЕ/мл, в то время как антитела к экстрагируемому ядерному антигену, антитела к двухспиральной ДНК, антинейтрофильные цитоплазматические антитела, криоглобулины, антитела к тканевой трансглутаминазе отсутствовали. Общий анализ крови и мочи без особенностей. Иммуноэлектрофорез белков сыворотки крови и мочи не выявил моноклональной секреции. Для исключения периодической болезни проведен анализ 10 часто встречающихся мутаций гена MEFV, которые обнаружены не были. Выполнено типирование антигенов главного комплекса гистосовместимости. HLA B51 не обнаружен, выявлен антиген HLA B52.
В декабре 2017 года (43 года) после перенесенной пневмонии в S2 сегменте обоих легких впервые обнаружены единичные мягкотканные очаги, соответ ствующие внутрилегочным лимфатическим узлам, бронхиолит S2,3 сегментов правого легкого. На основании отрицательных результатов диаскинтеста, пробы Манту и посева мокроты был исключен туберкулез. При повторной компьютерной томографии органов грудной клетки в марте 2018 года изменения в легких сохранялась. Пациентка стала отмечать частые головные боли, ознобы по ночам, усилились боли в крупных суставах. Афтозный стоматит, генитальные и кожные язвы, а также диарея рецидивировали каждые 2 месяца.
В феврале 2018 г. обследована в НИИ ревматологии им. В.А. Насоновой. Тест патергии отрицательный. Однако на основании характерных клинических проявлений диагностирована болезнь Бехчета, начато лечение сульфасалазином. На этом фоне пациентка отметила заживление язв на коже и половых органах, однако стала отмечать усиление болей в животе и диареи, в связи с чем препарат был отменен. Продолжено лечение колхицином в дозе 1 мг/сут, которое привело к регрессу афтозного стоматита. В апреле 2018 года при госпитализации в клинику им. Е.М. Тареева данных за поражение центральной нервной системы и органа зрения не получено. Принимая во внимание сохраняющиеся генитальные язвы, поражение органа зрения в анамнезе, назначены азатиоприн в дозе 100 мг/сут и метилпреднизолон в дозе 12 мг/сут, продолжен прием колхицина в дозе 1,5 мг/сут.
Окончательный диагноз при выписке был сформулирован следующим образом: болезнь Бехчета (HLA B51-негативная) с поражением слизистых оболочек (рецидивирующий афтозный стоматит, язвы гениталий), глаз (хориоретинит, отслойка сетчатки с лазерной коррекцией от 1995 г.), кожи (узловатая эритема, акнеподобная сыпь), желудочно-кишечного тракта (боли в животе, диарея), суставов (артралгии).
Моисеев С.В.: Представленное наблюдение демонстрирует, как недостаточно тщательная интерпретация клинических проявлений заболевания привела к задержке установления правильного диагноза на десятилетия. Следует отметить, что в диагностике ББ до настоящего времени ключевую роль играют именно клинические проявления заболевания, а не инструментальные или лабораторные тесты. За время изучения ББ были предложены десятки вариантов критериев диагностики. В течение длительного времени использовали критерии, разработанные международной группой по изучению болезни Бехчета (ISBD). В соответствии с критериями ISBD (1990 г.) заболевание может быть классифицировано как ББ при наличии у пациента афтозного стоматита или герпетиформных язв, рецидивирующих не менее 3 раз в год, в сочетании с двумя и более симптомами:
- рецидивирующие язвы гениталий – афты или рубчики;
- поражение глаз (передний, задний увеит, клетки в стекловидном теле, васкулит сетчатки);
- поражение кожи (узловатая эритема, псевдофолликулит и папулопустулезные высыпания, акнеподобная сыпь у пациента в постпубертатном периоде, не получающего глюкокортикостероиды);
- положительный тест патергии
В 2014 г. были предложены международные критерии ББ (ICBD), в соответствии с которыми каждому клиническому проявлению присваивается определенный балл: поражение органа зрения – 2 балла, генитальные язвы – 2 балла, афтозный стоматит – 2 балла, кожные проявления – 1 балл, неврологические проявления – 1 балл, сосудистые поражения – 1 балл, положительный тест патергии – 1 балл [7]. Диагноз ББ может быть установлен при сумме баллов ≥4.
Таким образом, ББ была диагностирована у пациентки в соответствии с современными критериями, несмотря на отрицательный тест патергии и отсутствие антигена HLA-B5/51.
Буланов Н.М.: Тест патергии применяют для диагностики ББ с 1937 г. Патергию определяют как нарушение локального ответа тканей на минимальную травматизацию, что отражает избыточную активацию врожденного иммунитета. Для проведения пробы обычно используют иглу диаметром 20-26G, которой выполняют 4-6 внутрикожных уколов под углом 45° в передней области предплечья. Результат оценивают через 48 часов. Положительной пробу считают при появлении в местах уколов эритематозных папул, иногда в сочетании со стерильной пустулой, диаметром более 2 мм. Следует отметить, что чувствительность пробы снизилась за последние десятилетия. По данным одного из иранских центров она уменьшилась с 64,2% в 1970-х гг. до 35,8% в 2000-х гг., что отчасти можно объяснить совершенствованием методов асептики и антисептики, а также внедрением в практику одноразовых игл [8]. Чувстви тельность метода выше у пациентов с продолжительностью болезни менее 5 лет, носителей HLA-B51 и больных, не получавших патогенетическую терапию. Таким образом, отрицательный результат теста у нашей пациентки не противоречит диагнозу ББ, а в какой-то степени является закономерным.
Никифорова Н.В.: В пользу диагноза ББ свидетельствовало и происхождение пациентки. Хорошо известно, что распространенность заболевания зависит от географического расположения региона и этноса. Энде мичными по ББ являются регионы, расположенные по ходу “Великого шелкового пути" (30-40° северной ши ро ты) [9]. Самая высокая распространенность зарегистрирована в Турции и составляет по разным данным от 80 до 420 на 100 тыс. населения. Реже всего заболевание встречается в североевропейских странах (2 на 100 тыс.) и Северной Америке (4 на 100 тыс.) [10]. На территории нашей страны этнический состав заболевших неоднороден. По данным одноцентрового отечественного исследования среди 250 пациентов с ББ 23,2% составляли русские, 21,6% – выходцы из Дагестана, 12,8% – из Азербайджана, 14,4% – из Армении, 8,8% – из Чечни, 19,2% – из других регионов [11].
По современным представлениям вклад в развитие заболевания вносит генетическая предрасположенность. В пользу существенного влияния генетических факторов, помимо географического распространения заболевания, свидетельствуют семейные случаи, ассоциация с носительством определенных генов главного комплекса гистосовместимости и полиморфизмом генов, контролирующих иммунный ответ [10,12]. В отечественном исследовании среди 180 пациентов с ББ было выявлено 30% случаев семейной агрегации заболевания [13]. Указание на поражение кожи и слизистых оболочек, а также органа зрения у отца пациентки позволяет предполагать семейную агрегацию заболевания и в описанном случае.
ББ ассоциируется с наличием HLA-B5/51, частота которого в различных этнических группах пациентов с ББ варьируется от 40 до 80%, в российских наблюдениях – около 60% [14]. Кроме того, ББ может ассоциироваться в некоторых семьях с HLA-B52, который был выявлен у нашей пациентки [15].
Новиков П.И.: Представленное наблюдение демонстрирует характерное для ББ чередование периодов обострения (нередко разрешающегося самостоятельно) и ремиссии с постепенным накоплением необратимых изменений пораженных органов и тканей. При этом особенности клинического течения индивидуальны и могут существенно отличаться у различных пациентов (табл. 1), что отражается и на прогнозе заболевания [16].
| Клинические проявления | Частота, % |
|---|---|
| Афтозный стоматит | ~97 |
| Генитальные язвы | ~85 |
| Папулопустулезные высыпания | ~85 |
| Узловатая эритема | ~50 |
| Тест патергии | ~60 |
| Увеит | ~50 |
| Артриты | 30-50 |
| Тромбофлебит | ~25 |
| Тромбоз глубоких вен | ~5 |
| Артериальный тромбоз | ~4 |
| Поражение ЦНС | ~5 |
| Эпидидимит | ~5 |
| Поражение легких | ~5 |
| Поражение ЖКТ | 1-30 |
Поражение слизистых оболочек – это наиболее характерное клиническое проявление ББ, которое развивается у абсолютного большинства пациентов. При этом в 47-86% случаев афтозный стоматит становится первым проявлением заболевания, которое может на несколько лет опережать формирование других симптомов [17]. Язвы обычно развиваются на некератинизированных участках слизистой оболочки полости рта. Афты болезненны, имеют четкие контуры, эритематозный венчик, нередко на их дне образуется желтоватая или сероватая псевдомембрана. Афтозный стоматит может рецидивировать до 10 раз в год, при этом заживление язвенных дефектов малого размера происходит в среднем в течение 7-10 дней, крупных – до 4 недель. Поражение слизистой оболочки полости рта может приводить к появлению рубцовых изменений, дисфагии, одинофагии и одышки. К характерным особенностям поражения слизистой оболочки рта при ББ относят одновременное появление более 6 язвенных дефектов, синхронное развитие нескольких типов язв, диффузную энантему и вовлечение слизистой оболочки мягкого неба и ротоглотки [18].
Другое классическое проявление ББ – генитальные язвы, в целом сходные по внешнему виду и характеру течения с язвенным поражением слизистой оболочки полости рта. Однако они чаще приводят к формированию рубцовых изменений и в ряде случаев могут сопровождаться появлением краевого некроза. Глубокие дефекты могут осложниться образованием свищевых ходов, что чаще наблюдают у женщин. У мужчин чаще всего поражаются кожа мошонки, у женщин – большие половые губы (что наблюдалось и у нашей пациентки) [19].
Поражение кожи при ББ многообразно и может проявляться образованием папулопустулезных высыпаний, узловатой эритемы, тромбофлебита и др. При морфологическом исследовании на раннем этапе обычно выявляют картину лейкоцитокластического васкулита или нейтрофильных инфильтратов в стенке сосуда, для более старых (“зрелых") очагов характерна картина лимфоцитарного васкулита.
Папулопустулезные высыпания являются распространенным кожным проявлением ББ, частота которого выше у пациентов с положительным тестом патергии и поражением суставов. Сначала на коже формируются папулы, которые за 24-48 часов превращаются в стерильные пустулы. Последние клинически и гистологически напоминают обыкновенные угри (acne vulgaris) [20]. Отличием от последних является отсутствие комедонов, распространение высыпаний на конечности, а также неэффективность стандартной терапии, например, антибиотиками.
Узловатая эритема развивается у трети пациентов и обычно локализуется на нижних конечностях, существенно реже – в ягодичной области, на шее и лице. Высыпания сохраняются в течение 2-3 недель, при этом изъязвления кожных покровов не происходит, но могут сохраняться участки гиперпигментации. Отличием от классической узловатой эритемы является наличие картины васкулита при гистологическом исследовании [21]. Узловатую эритему необходимо дифференцировать от подкожного тромбофлебита, который сопровождается образованием эритематозных узелков, нередко располагающихся линейно и мигрирующих день ото дня, в зависимости от пораженного сегмента сосуда. Развитие подкожного тромбофлебита – важный маркер, требующий исключения поражения сосудистого русла другой локализации.
Кожные язвы различной локализации (конечности, грудь, межпальцевые промежутки, пах) относят к наиболее редким проявлениям ББ. Они развиваются у 3% пациентов, несколько чаще – в детском возрасте. Тем не менее, некоторые авторы считают их патогномоничными кожными проявлениями заболевания [22].
В спектр проявлений кожного васкулита при ББ также входит пальпируемая пурпура, инфаркты ногтевого ложа и симптомы, внешне напоминающие проявления синдрома Свита, гангренозную пиодермию и многоформную эритему [19]. В 1987 г. Schreiner и Jorizzo предложили расценивать в качестве проявлений ББ только те варианты поражения кожи, при которых удается выявить морфологическую картину нейтрофильной инфильтрации или лейкоцитокластического васкулита [23].
В соответствии с рекомендациями EULAR 2018 г. препаратами первого ряда для лечения язв ротовой полости и гениталий считают топические препараты, в первую очередь, глюкокортикостероиды [24]. Перед началом лечения язвенного поражения кожи нижних конечностей необходимо исключить тромбоз глубоких вен и хроническую ишемию вследствие артериального поражения.
При рецидивирующем течении, особенно у пациентов с узловатой эритемой и генитальными язвами, с целью профилактики назначают колхицин, эффективность которого была продемонстрирована в нескольких рандомизированных исследованиях [25,26]. Однако препарат мало эффективен в отношении папулопустулезных и акнеподобных высыпаний. В случае частых обострений заболевания, развивающихся на фоне лечения колхицином, может обсуждаться применение азатиоприна, талидомида, интерферона-α, ингибиторов фактора некроза опухоли-α (ФНО-α) или апремиласта [27–31]. Выбор препарата требует персонифицированного подхода и определяется индивидуальными особенностями пациента, соображениями безопасности и доступностью. В отдельных клинических наблюдениях продемонстрирован хороший ответ кожных проявлений ББ на антибактериальные препараты – дапсон и азитромицин [32,33].
Эффективность других классов (не ингибиторов ФНО-α) генно-инженерных биологических препаратов в отношении язвенного поражения кожи и слизистых оболочек вариабельная: ответ на лечение антагонистами интерлейкина-1 (анакинра и канакинумаб) может быть неполным, антагонисты интерлейкина-17 (секукинумаб) в целом неэффективны, а антагонисты интерлейкина-6 (тоцилизумаб) ухудшали течение заболевания в одном наблюдении [34–37].
Зыкова А.С.: Несмотря на высокую частоту поражения слизистых оболочек и кожи, прогноз заболевания определяют другие клинические проявления – вовлечение органа зрения, сердечно-сосудистой и нервной системы, ЖКТ. Поражение сетчатки или сосудистой оболочки глаза развивается у 30-70% пациентов и приводит к потере зрения в 25% случаев, несмотря на лечение глюкокортикостероидами [16]. У мужчин поражение органа зрения встречается чаще и протекает в более тяжелой форме.
Вовлечение в патологический процесс оболочек глаза обычно развивается спустя 2-3 года после появления язвенного поражения слизистых оболочек и кожи, а у 10-20% больных является первым симптомом заболевания. Для ББ характерно рецидивирующее течение двустороннего негранулематозного хронического увеита с поражением переднего и/или заднего сегмента глаза. Панувеит чаще развивается у мужчин. У трети пациентов выявляют гипопион – скопление гноя в передней камере глаза. Также при ББ могут развиваться иридоциклит, кератит, эписклерит, склерит, витрит, кровоизлияние в стекловидное тело, васкулит сосудов сетчатки, окклюзия вены сетчатки, неоваскуляризация сетчатки и неврит зрительного нерва. Все перечисленные проявления приводят к снижению остроты зрения. Кроме того, пациенты могут предъявлять жалобы на светобоязнь, слезотечение, гиперемию и боль в периорбитальной области и глазном яблоке.
Рецидивирующее течение процесса способствует развитию вторичных осложнений: задних или передних синехий, атрофии радужной оболочки, катаракты (которая может быть ассоциирована, в том числе, и с проводимым лечением), вторичной глаукомы, атрофии сетчатки и зрительного нерва, макулярной дегенерации, пролиферативной ретинопатии и других. Прогноз при поражении органа зрения зависит от частоты обострений и тяжести клинических проявлений, выраженности локального воспаления, распространенности процесса и в целом остается неблагоприятным.
У нашей пациентки длительное неконтролируемое течение ББ привело к формированию необратимых изменений органа зрения – отслойки сетчатки, которая вызвала снижение остроты и сужение полей зрения, что позволяет расценивать его как наиболее прогностически значимое проявление заболевания.
Лечение увеита должно проводиться совместно с офтальмологами. В соответствии с последними рекомендациями EULAR всем пациентам с вовлечением заднего сегмента глаза показана иммуносупрессивная терапия азатиоприном, циклоспорином А, интерфероном-α или ингибиторами ФНО-α [24]. Лечение системными глюкокортикостероидами в высокой дозе проводят в острую фазу и только в сочетании с другими иммуносупрессантами. Результаты рандомизированных контролируемых исследований подтверждают высокую эффективность азатиоприна и циклоспорина А в отношении сохранения остроты зрения и профилактики рецидивов [27,38,39]. Однако нет четких указаний о выборе следующего препарата при их неэффективности. В отдельных сериях наблюдений показана высокая эффективность ингибиторов ФНО-α (в первую очередь, инфликсимаба, а также адалимумаба) и интерферона-α [40,41].
Лечение изолированного переднего увеита может проводиться топическими глюкокортикостероидами в режиме монотерапии. Однако при тяжелом течении заболевания (гипопион) и при наличии неблагоприятных факторов риска (молодой возраст, мужской пол, ранний дебют) можно рассматривать присоединение системной иммуносупрессии.
Носова Н.Р.: Длительный анамнез абдоминалгии и диспепсических явлений позволяет обсуждать у нашей пациентки поражение ЖКТ в рамках ББ. Частота вовлечения ЖКТ при ББ варьируется от 3 до 26% в зависимости от популяции [42]. Отличительными признаками язв кишечника при ББ являются их округлая форма, а также расположение преимущественно в илеоцекальном отделе. Перфорация язвенных дефектов кишечника – это редкое, жизнеугрожающее осложнение заболевания, требующее хирургического лечения [43]. Поражение кишечника при ББ необходимо дифференцировать с болезнью Крона, язвенным колитом и глютеновой энтеропатией. В описанном нами случае поражение ЖКТ проявлялось диареей и интенсивной болью в животе, которая стала основанием для про ве дению диагностической лапароскопии. При этом язвенное поражение толстой кишки по данным колоноскопии у нашей пациентки объективно подтверждено не было. В качестве альтернативной причины абдоминального синдрома может обсуждаться поражение мезентериальных сосудов в рамках основного заболевания.
При обострении кишечного процесса показано назначение глюкокортикостероидов в сочетании с базисными препаратами – 5-аминосалициловой кислотой или азатиоприном, а при их неэффективности – ингибиторами ФНО-α и/или талидомидом [24].
Каровайкина Е.А.: Поражение легких при ББ встречается в 5% случаев. Вовлекаться в патологический процесс могут как легочные сосуды, так и паренхима легких. Клинические проявления неспецифичны и включают в себя кашель, одышку, кровохаркание. При мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки выделяют следующие изменения: аневризмы и тромбоэмболию легочной артерии, инфаркт легкого, плеврит и узелковые изменения. Степень вовлечения легочных сосудов определяет прогноз пациентов. У нашей пациентки клинические симптомы со стороны дыхательной системы отсутствовали, однако по данным МСКТ определялись мягкотканные очаги, соответствующие внутрилегочным лимфатическим узлам. Связь этих изменений с основным заболеванием вызывает определенные сомнения.
Кузнецова Е.И.: Поражение суставов, которое наблюдалось и у нашей пациентки, является достаточно частым, но не специфичным симптомом ББ. В патологический процесс вовлекаются преимущественно крупные суставы, такие как коленные, голеностопные, лучезапястные и локтевые, с развитием неэрозивного моно-, олиго- и полиартрита, чаще несимметричного. Однако возможно развитие и симметричного поражения, напоминающего ревматоидный артрит. Более того, у нашей пациентки отмечалось повышение уровня ревматоидного фактора, что создавало определенные трудности в дифференциальной диагностике. Другими симптомами вовлечения костно-мышечной системы могут быть воспалительная боль в спине и фибромиалгия, которые чаще наблюдаются у женщин [44].
Основным препаратом для купирования обострений суставного синдрома является колхицин, эффективность которого подтверждена в рандомизированных исследованиях [25,26]. При развитии моноартрита возможно интраартикулярное введение глюкокортикостероидов, однако обычно подобные эпизоды разрешаются самостоятельно в течение 2-3 недель. При рефрактерном течении суставного синдрома может обсуждаться присоединение глюкокортикостероидов в низкой дозе, азатиоприна, интерферона-α или ингибиторов ФНО-α.
Бородин О.О.: В представленном наблюдении не было получено достоверных данных в пользу поражения центральной нервной системы в рамках ББ, которое наблюдают у 5-10% пациентов. При этом чаще страдают мужчины [45]. Обычно неврологические проявления возникают через 5 лет после дебюта заболевания. Поражение центральной нервной системы (ЦНС) наблюдают чаще, чем периферической. Поражение ЦНС (“нейро-Бехчет") подразделяют на паренхиматозное (80% случаев) и непаренхиматозное, сочетание которых у одного пациента встречается достаточно редко. Существенное значение в диагностике нейроБехчета имеет магнитно-резонансная томография головного мозга, которая в ряде случаев позволяет дифференцировать ББ с другими заболеваниями ЦНС.
При паренхиматозном поражении вовлекаются ствол мозга и/или базальные ганглии, что ассоциировано с худшим прогнозом [46]. Наиболее частым симптомом поражения ЦНС является головная боль, которую отмечают 70% пациентов. В большинстве случаев паренхиматозное поражение ЦНС при ББ протекает в форме подострого менингоэнцефалита. Рецидивы развиваются в течение нескольких дней и могут длиться неделями. При вовлечении ствола мозга могут развиться парез глазодвигательных мышц, черепно-мозговых нервов, мозжечковые и пирамидные нарушения. Возможно формирование субкортикальной деменции в сочетании с атаксией, энцефалопатии, гемипареза, судорог, дисфазии, когнитивных нарушений и психоза [47]. Поражение спинного мозга может приводить к пирамидным чувствительным нарушениям, нарушению тазовых функций. В редких случаях возможно развитие острого нарушения мозгового кровообращения, эпилепсии, опухолеподобных образований, острого менингеального синдрома [48]. Также описано бессимптомное и малосимптомное течение.
Непаренхиматозное поражение включает в себя тромбоз вен головного мозга и венозных синусов, васкулит артерий головного мозга и асептический менингит и характеризуется крайне неблагоприятным прогнозом вплоть до развития комы и летального исхода.
Прогрессирующее поражение ЦНС со временем приводит к формированию глубокого неврологического дефицита, а у трети пациентов на поздних стадиях заболевания развивается деменция. Возможно формирование и других когнитивных нарушений: снижение памяти, внимания, мотивации, изменения личности. Таким образом, поражение нервной системы входит в число прогностически наиболее неблагоприятных проявлений ББ.
Паренхиматозное поражение ЦНС требует сочетанной терапии высокими дозами глюкокортикостероидов (пульс-терапия в дозе 1 г/сут до 7 дней с последующим переходом на прием 1 мг/кг/сут в пересчете на преднизолон) в комбинации с иммуносупрессивными препаратами, например, азатиоприном. Мета-анализ показал, что применение циклоспорина А повышает риск поражения центральной нервной системы (относительный риск [ОР] 12,66; 95% доверительный интервал [ДИ] 4,75-33,76), поэтому назначение препарата противопоказано пациентам с нейро-Бехчетом в анамнезе, даже при отсутствии признаков активного поражения нервной системы на момент обследования [24,49,50]. Рефрактерное и прогрессирующее течение поражения ЦНС может быть основанием для назначения ингибиторов ФНО-α, эффективность которых была доказана в ряде исследований [51,52].
Макаров Е.А.: Уникальной особенностью ББ, позволяющей выделить ее среди других системных васкулитов, является более частое поражение венозного, а не артериального русла. Заболевание ассоциировано с высоким риском тромбозов, который обусловлен, в первую очередь, высокой воспалительной активностью, приводящей к повреждению и дисфункции эндотелия, но не традиционными протромбогенными факторами или склонностью к гиперкоагуляции [53,54]. Риск тромбоэмболии обычно невысокий, однако ее развитие может быть спровоцировано внутривенным введением игл и катетеров в ходе медицинских манипуляций.
Чаще всего наблюдают тромбозы вен нижних конечностей, несколько реже – нижней и верхней полых вен, печеночных вен, мозговых синусов, полостей сердца [55]. Среди артерий наиболее часто поражаются легочные артерии, что, по всей видимости, обусловлено их анатомическим сходством с венозными сосудами (сравнительно тонкая стенка, меньшая эластичность, низкое давление). При этом вовлечение аорты и периферических артерий происходит существенно реже. Следует отметить, что в отличие от поражения вен, васкулит артерий чаще сопровождается формированием аневризм, чем тромботическими осложнениями.
Как и большинство органных поражений, вовлечение сосудистого русла при ББ чаще развивается у мужчин, а его частота по данным разных авторов составляет от 5 до 40% [56]. Более чем у 70% пациентов сосудистые проявления возникают в течение 5 лет после дебюта заболевания, однако тромбозы вен нижних конечностей и мозговых синусов могут развиться существенно раньше. Кроме того, у 20% пациентов сосудистые поражения выявляют уже в дебюте болезни, а у 10% – еще до установления диагноза и появления классических симптомов ББ (синдром Hughes-Stovin) [57].
При ББ у одного пациента нередко удается выявить несколько вариантов сосудистого поражения. В литературе описаны ассоциации между тромбозом мозговых синусов и поражением легочных артерий, тромбозом камер сердца и поражением легочных артерий, синдромом Бадда-Киари и тромбозом нижней полой вены [55]. Кроме того, тромбоз вен нижних конечностей может сочетаться с любым другим вариантом сосудистого поражения.
На долю тромбоза глубоких вен нижних конечностей приходится более 70% в структуре всех сосудистых проявлений ББ. Наиболее часто поражаются бедренные, подколенные, подкожные вены и вены голеней [58]. При тромбозе поверхностных вен при пальпации можно выявить уплотненные тяжи по ходу вен. Острый тромбоз глубоких вен, напротив, проявляется отеком, болью и хромотой. Поражение вен нижних конечностей характеризуется частыми рецидивами (до 20% за первый год наблюдения, до 40% – за два года), в связи с чем у пациентов нередко можно наблюдать признаки посттромбофлебитического синдрома и хронической венозной недостаточности – варикозные изменения вен, гиперпигментацию и уплотнение кожи, хронические боли, формирование трофических язв. Методы лучевой диагностики, в первую очередь, ультразвуковая допплерография, могут помочь дифференцировать острый процесс от хронического. Перспективным представляется применение МРТ и позитронно-эмиссионной томографии для оценки состояния сосудистой стенки [59,60].
В отличие от других заболеваний, которые могут протекать с поражением венозного русла нижних конечностей, для ББ характерно преобладание молодых мужчин среди заболевших, более высокая частота рецидивов, что ведет к неполной реканализации и активному формированию коллатералей, одновременное вовлечение как глубоких, так и поверхностных вен, а также симметричный характер поражения.
При ББ может развиться тромбоз любого отдела нижней полой вены (НПВ), однако чаще всего наблюдают вовлечение подпеченочного отдела вследствие распространения тромбоза вен нижних конечностей. Так, у пациентов с двусторонним тромбозом общей бедренной вены риск развития тромбоза подвздошной вены составляет 50%, а НПВ – 20% [58]. Пациенты могут предъявлять жалобы на боли в нижней части спины и живота, при осмотре можно выявить венозные коллатерали на передней брюшной стенке. В редких случаях развивается отек нижних конечностей и мошонки.
Поражение печеночного и надпеченочного отдела НПВ, иногда в сочетании с тромбозом печеночных вен, может приводить к развитию синдрома Бадда-Киари, который развивается у <5% пациентов с сосудистыми поражениями [61]. Поражение печени может протекать с яркой клинической картиной, представленной распространенными отеками, асцитом, признаками портальной гипертензии, печеночно-клеточной недостаточности и холестаза, при этом 10-месячная выживаемость составляет порядка 60%. У части пациентов развитие синдрома Бадда-Киари происходит бессимптомно, выживаемость при таком варианте течения существенно выше – около 90% [61].
Поражение легочных артерий наблюдают менее чем у 5% пациентов с ББ, наиболее характерным является развитие аневризм пораженных сосудов, которые могут протекать бессимптомно. В связи с этим обсуждается целесообразность выполнения визуализирующих исследований ветвей грудного отдела аорты у всех пациентов с ББ. В редких случаях наблюдают вовлечение периферических артерий и сердца (перикардит, миокардит, тромбоз полостей, поражение коронарных артерий). Кроме того, у пациентов с ББ, как и при других системных васкулитах, наблюдают ускоренное прогрессирование субклинического атеросклероза [62].
Поскольку в патогенезе венозных тромбозов при ББ ведущую роль играет воспаление сосудистой стенки, а не гиперкоагуляция, препаратами первой линии являются иммуносупрессанты – азатиоприн, циклоспорин А или циклофосфамид (чаще при тромбозах крупных вен) [24]. При этом мета-анализ показал, что применение иммуносупрессантов в сочетании с антикоагулянтами более значимо снижает риск рецидива венозных тромбозов, чем монотерапия антикоагулян тами (ОР 0,17, 95% ДИ 0,08-0,35). В то же время применение иммуносупрессантов в сочетании с антикоагулянтами не имело преимуществ перед монотерапией иммуносупрессантами (ОР 0,75, 95% ДИ 0,481,17) [24,63–65]. Однако, следует учесть, что риск развития посттромбофлебитического синдрома был выше у больных, не получавших антикоагулянты (ОР 3,8, 95% ДИ 1,04-14,1) [58]. В целом при решении вопроса о присоединении антикоагулянтов следует взвешивать риск кровотечений и предварительно исключить наличие аневризм легочных артерий, развитие которых, как уже было указано выше, ассоциировано с тромбозами глубоких вен. У пациентов с рефрактерным течением заболевания может обсуждаться присоединение ингибиторов ФНО-α или интерферона-α.
Развитие аневризм легочных артерий или периферических артерий является показанием к проведению агрессивной иммуносупрессивной терапии глюкокортикостероидами в высоких дозах (3 сеанса пульс-терапии с последующим назначением в дозе 1 мг/кг/сут в пересчета на преднизолон) и циклофосфамидом (пульстерапия ежемесячно) [66]. В качестве альтернативы при рефрактерном течении может рассматриваться инфликсимаб [67]. Развитие кровотечения или его высокий риск являются показанием к хирургическому лечению, при этом эмболизация артерий более предпочтительна, чем открытая операция. Перед выполнением оперативного вмешательства абсолютно показана инициация иммуносупрессивной терапии.
Моисеев С.В.: Накопленные к настоящему времени данные свидетельствуют о выраженной полиморфности проявлений ББ: симптомы заболевания, их выраженность и сочетания широко варьируютcя у различных пациентов в зависимости от пола и региона проживания, а ответ на лечение как традиционными базисными, так и генно-инженерными препаратам может существенно различаться. В связи с этим в рекомендациях EULAR 2018 г. термин “болезнь Бехчета" был заменен на “синдром Бехчета". В то же время имеющиеся результаты клинических исследований позволяют осуществлять персонализированный подход к ведению пациентов в зависимости от ведущих клинических проявлений, что способствует улучшению прогноза заболевания. Обследование и лечение больных требует междисциплинарного подхода с привлечением не только ревматологов, но и дерматологов, сосудистых хирургов, неврологов и специалистов других профилей.
Используемые источники
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65(1):1-11.
- Mendes D, Correia M, Barbedo M, et al. Behсet’s disease - a contemporary review. J Autoimmun 2009;32(3-4):178-88.
- Hatemi G, Seyahi E, Fresko I, et al. One year in review 2016: Behсet’s syndrome. Clin Exp Rheumatol. 34(6 Suppl 102):10-22.
- Lehner T. The role of heat shock protein, microbial and autoimmune agents in the aetiology of Behсet’s disease. Int Rev Immunol 1997;14(1):21-32.
- Matzinger P. The danger model: a renewed sense of self. Science 2002;296(5566): 301-5.
- Consolandi C, Turroni S, Emmi G, et al. Behсet’s syndrome patients exhibit spcific microbiome signature. Autoimmun Rev 2015;14(4):269-76.
- Davatchi F, Assaad-Khalil S, Calamia KT, et al. The International Criteria for Behсet’s Disease (ICBD): a collaborative study of 27 countries on the sensitivity and specificity of the new criteria. J Eur Acad Dermatology Venereol 2014; 28(3):338-47.
- Davatchi F, Chams-Davatchi C, Ghodsi Z, et al. Diagnostic value of pathergy test in Behcet’s disease according to the change of incidence over the time. Clin Rheumatol 2011;30(9):1151-5.
- Verity DH, Marr JE, Ohno S, et al. Behсet’s disease, the Silk Road and HLB51: historical and geographical perspectives. Tissue Antigens 1999;54(3):213-20. 10. Savey L, Resche-Rigon M, Wechsler B, et al. Ethnicity and association with diease manifestations and mortality in Behсet’s disease. Orphanet J Rare Dis 2014; 9(1):42.
- Lennikov A, Alekberova Z, Goloeva R, et al. Single center study on ethnic and clinical features of Behcet’s disease in Moscow, Russia. Clin Rheumatol 2015; 34(2):321-7.
- de Menthon M, Lavalley MP, Maldini C, et al. HLA-B51/B5 and the risk of Behсet’s disease: a systematic review and meta-analysis of case-control genetic association studies. Arthritis Rheum 2009;61(10):1287-96.
- Алекберова З.С. Болезнь Бехчета: этнос и семейная агрегация. Научнпрактическая ревматология 2016;54(3):244-6.
- Алекберова З.С., Измаилова Ф.И., Гусева И.А. и др. HLA-B5/51-генотип: связь с клиническими проявлениями болезни Бехчета. Научно-практичес - кая ревматология 2015;54(4):367-70.
- Arber N, Klein T, Meiner Z, et al. Close association of HLA-B51 and B52 in Israeli patients with Behсet’s syndrome. Ann Rheum Dis 1991;50(6):351-3.
- Kump LI, Moeller KL, Reed GF, et al. Behсet’s disease: comparing 3 decades of treatment response at the National Eye Institute. Can J Ophthalmol 2008;43(4): 468-72.
- Alpsoy E, Donmez L, Bacanli A, et al. Review of the chronology of clinical maifestations in 60 patients with Behсet’s disease. Dermatology 2003;207(4):354-56.
- Baс Y, Seсkin HY, Kalkan G, et al. Investigation of Behсet’s disease and recurent aphthous stomatitis frequency: the highest prevalence in Turkey. Balkan Med J 2016;33(4):390-5.
- Alpsoy E, Zouboulis CC, Ehrlich GE. Mucocutaneous lesions of Behcet’s disease. Yonsei Med J 2007;48(4):573-85.
- Ergun T, Garboz O, Dogusoy G, et al. Histopathologic features of the spontneous pustular lesions of Behсet’s syndrome. Int J Dermatol 1998;37(3):194-6.
- Kim B, LeBoit PE. Histopathologic features of erythema nodosum - like lesions in Behсet disease: a comparison with erythema nodosum focusing on the role of vaculitis. Am J Dermatopathol 2000;22(5):379-90.
- Azizlerli G, Ozarmacan G, Ovel C, et al. A new kind of skin lesion in Behсet’s disease: extragenital ulcerations. Acta Derm Venereol 1992;72(4):286.
- Schreiner DT, Jorizzo JL. Behсet’s disease and complex aphthosis. Dermatol Clin 1987;5(4):769-78.
- Hatemi G, Christensen R, Bang D, et al. 2018 update of the EULAR recommedations for the management of Behсet’s syndrome. Ann Rheum Dis April 2018: annrheumdis-2018-213225.
- Aktulga E, Altaс M, Mоftоoglu A, et al. A double blind study of colchicine in Behсet’s disease. Haematologica 1980;65(3):399-402.
- Davatchi F, Sadeghi Abdollahi B, et al. Colchicine versus placebo in Behсet’s diease: randomized, double-blind, controlled crossover trial. Mod Rheumatol 2009;19(5):542-9.
- Yazici H, Pazarli H, Barnes CG, et al. A controlled trial of azathioprine in Behсet’s syndrome. N Engl J Med 1990;322(5):281-5.
- Hamuryudan V, Mat C, Saip S, et al. Thalidomide in the treatment of the muccutaneous lesions of the Behсet syndrome. A randomized, double-blind, placebcontrolled trial. Ann Intern Med 1998;128(6):443-50.
- Alpsoy E, Durusoy C, Yilmaz E, et al. Interferon alfa-2a in the treatment of Behсet disease: a randomized placebo-controlled and double-blind study. Arch Dermatol 2002;138(4):467-71.
- Melikoglu M, Fresko I, Mat C, et al. Short-term trial of etanercept in Behсet’s disease: a double blind, placebo controlled study. J Rheumatol 2005;32(1):98-105.
- Hatemi G, Melikoglu M, Tunc R, et al. Apremilast for Behсet’s syndrome – a phase 2, placebo-controlled study. N Engl J Med 2015;372(16):1510-8.
- Sharquie KE, Najim RA, Abu-Raghif AR. Dapsone in Behсet’s disease: a doublblind, placebo-controlled, cross-over study. J Dermatol 2002;29(5):267-79.
- Mumcu G, Inanс N, Uzdemir FT, et al. Effects of azithromycin on intracellular cytokine responses and mucocutaneous manifestations in Behсet’s disease. Int J Dermatol 2013;52(12):1561-6.
- Grayson PC, Yazici Y, Merideth M, et al. Treatment of mucocutaneous manifetations in Behсet’s disease with anakinra: a pilot open-label study. Arthritis Res Ther 2017;19(1):69.
- Emmi G, Talarico R, Lopalco G, et al. Efficacy and safety profile of anti-inteleukin-1 treatment in Behсet’s disease: a multicenter retrospective study. Clin Rheumatol 2016;35(5):1281-6.
- Dick AD, Tugal-Tutkun I, Foster S, et al. Secukinumab in the treatment of noinfectious uveitis: results of three randomized, controlled clinical trials. Ophthalmology 2013;120(4):777-87.
- Cantarini L, Lopalco G, Vitale A, et al. Paradoxical mucocutaneous flare in a case of Behсet’s disease treated with tocilizumab. Clin Rheumatol 2015;34(6):1141-3.
- Ozyazgan Y, Yurdakul S, Yazici H, et al. Low dose cyclosporin A versus pulsed cyclophosphamide in Behсet’s syndrome: a single masked trial. Br J Ophthalmol 1992;76(4):241-3.
- Masuda K, Nakajima A, Urayama A, et al. Double-masked trial of cyclosporin versus colchicine and long-term open study of cyclosporin in Behсet’s disease. Lancet 1989;1(8647):1093-6.
- Vallet H, Riviere S, Sanna A, et al. Efficacy of anti-TNF alpha in severe and/or refractory Behсet’s disease: Multicenter study of 124 patients. J Autoimmun 2015;62:67-74.
- Wechsler B, Bodaghi B, Huong DL, et al. Efficacy of interferon alfa-2a in severe and refractory uveitis associated with Behсet’s disease. Ocul Immunol Inflamm 2000;8(4):293-301. h
- Hatemi I, Esatoglu SN, Hatemi G, et al. Characteristics, treatment, and lonterm outcome of gastrointestinal involvement in Behcet’s syndrome. Medicine (Baltimore) 2016;95(16):e3348.
- Lee KS, Kim SJ, Lee BC, et al. Surgical treatment of intestinal Behсet’s disease. Yonsei Med J 1997;38(6):455-60.
- Fatemi A, Shahram F, Akhlaghi M, et al. Prospective study of articular manifetations in Behсet’s disease: five-year report. Int J Rheum Dis 2017;20(1):97-102.
- Hadfield MG, Aydin F, Lippman HR, Sanders KM. Neuro-Behсet’s disease. Clin Neuropathol 16(2):55-60.
- Noel N, Bernard R, Wechsler B, et al. Long-term outcome of neuro-Behсet’s diease. Arthritis Rheumatol (Hoboken, NJ). 2014;66(5):1306-14.
- Kidd D. Neurological complications of Behсet’s syndrome. Curr Neurol Neurosci Rep 2012;12(6):675-9.
- Akman-Demir G, Serdaroglu P, Tasсi B. Clinical patterns of neurological involvement in Behсet’s disease: evaluation of 200 patients. The Neuro-Behсet Study Group. Brain 1999;122 ( Pt 11):2171-82.
- Akman-Demir G, Ayranci O, Kurtuncu M, et al. Cyclosporine for Behсet’s uveitis: is it associated with an increased risk of neurological involvement? Clin Exp Rheumatol 2008;26(4 Suppl 50):S84-90.
- Kоtter I, Gunaydin I, Batra M, et al. CNS involvement occurs more frequently in patients with Behсet’s disease under cyclosporin A (CSA) than under other meications - results of a retrospective analysis of 117 cases. Clin Rheumatol 2006;25(4):482-6.
- Zeydan B, Uygunoglu U, Saip S, et al. Infliximab is a plausible alternative for neurologic complications of Behсet disease. Neurol Neuroimmunol Neuro - inflammation 2016;3(5):e258.
- Borhani Haghighi A, Safari A, Nazarinia MA, et al. Infliximab for patients with neuro-Behcet’s disease: case series and literature review. Clin Rheumatol 2011; 30(7):1007-12.
- Leiba M, Seligsohn U, Sidi Y, et al. Thrombophilic factors are not the leading cause of thrombosis in Behсet’s disease. Ann Rheum Dis 2004;63(11):1445-9.
- Seyahi E, Yurdakul S. Behсet’s Syndrome and Thrombosis. Mediterr J Hematol Infect Dis 2011;3(1):e2011026.
- Tascilar K, Melikoglu M, Ugurlu S, et al. Vascular involvement in Behсet’s sydrome: a retrospective analysis of associations and the time course. Rheumatology (Oxford) 2014;53(11):2018-22.
- Kural-Seyahi E, Fresko I, Seyahi N, et al. The long-term mortality and morbidty of Behсet syndrome: a 2-decade outcome survey of 387 patients followed at a dedicated center. Medicine (Baltimore) 2003;82(1):60-76.
- Erkan D, Yazici Y, Sanders A, et al. Is Hughes-Stovin syndrome Behсet’s disease? Clin Exp Rheumatol 22(4 Suppl 34):S64-8.
- Seyahi E, Cakmak OS, Tutar B, et al. Clinical and ultrasonographic evaluation of lower-extremity vein thrombosis in Behcet syndrome: An observational study. Medicine (Baltimore) 2015;94(44):e1899.
- Ambrose N, Pierce IT, Gatehouse PD, et al. Magnetic resonance imaging of vein wall thickness in patients with Behсet’s syndrome. Clin Exp Rheumatol 2014;32(4 Suppl 84):S99-102.
- Trad S, Bensimhon L, El Hajjam M, et al. 18F-fluorodeoxyglucose-positron emission tomography scanning is a useful tool for therapy evaluation of arterial aneurysm in Behсet’s disease. Joint Bone Spine 2013;80(4):420-3.
- Seyahi E, Caglar E, Ugurlu S, et al. An outcome survey of 43 patients with Budd–Chiari syndrome due to Behсet’s syndrome followed up at a single, dedcated center. Semin Arthritis Rheum 2015;44(5):602-9.
- Merashli M, Ster IC, Ames PRJ. Subclinical atherosclerosis in Behcet’s disease: A systematic review and meta-analysis. Semin Arthritis Rheum 2016;45(4):502-10.
- Ahn JK, Lee YS, Jeon CH, et al. Treatment of venous thrombosis associated with Behcet’s disease: immunosuppressive therapy alone versus immunosuppressive therapy plus anticoagulation. Clin Rheumatol 2008;27(2):201-5.
- Desbois AC, Wechsler B, Resche-Rigon M, et al. Immunosuppressants reduce venous thrombosis relapse in Behсet’s disease. Arthritis Rheum 2012;64(8):27560.
- Alibaz-Oner F, Karadeniz A, Ylmaz S, et al. Behсet disease with vascular involvment: effects of different therapeutic regimens on the incidence of new relapses. Medicine (Baltimore) 2015;94(6):e494.
- Hamuryudan V, Er T, Seyahi E, et al. Pulmonary artery aneurysms in Behсet sydrome. Am J Med 2004;117(11):867-70.
- Hamuryudan V, Seyahi E, Ugurlu S, et al. Pulmonary artery involvement in Behсet’s syndrome: Effects of anti-Tnf treatment. Semin Arthritis Rheum 2015;45(3):369-73.
