Эффективность и безопасность апремиласта в лечении псориаза и псориатического артрита
Апремиласт, ингибирующий фосфодиэстеразу 4 типа и подавляющий синтез различных провоспалительных цитокинов, – это низкомолекулярный базисный противовоспалительный препарат таргетного действия, предназначенный для лечения средне-тяжелого и тяжелого бляшечного псориаза и активного псориатического артрита (ПсА). В рандомизированных, плацебо-контролируемых исследованиях 3 фазы, проводившихся в целом у нескольких тысяч больных псориазом (ESTEEM 1, 2) и ПсА (PALACE 1-3, ACTIVE), апремиласт по эффективности достоверно превосходил плацебо. Апремиласт не является белком и, соответственно, не обладает иммуногенностью. В клинических исследованиях апремиласт характеризовался благоприятным профилем безопасности, в частности не вызывал увеличения риска инфекционных осложнений.
Псориаз – это хроническое иммуновоспалительное заболевание кожи, распространенность которого в общей популяции достигает 2% [1]. В настоящее время псориаз рассматривают как системное заболевание, поражающее не только кожу, но и другие ткани, в частности суставы и ногти [2]. Псориатический артрит (ПсА) развивается примерно у каждого третьего больного псориазом и может сопровождаться воспалением энтезисов (энтезит) и сухожилий пальцев кистей и стоп (дактилит, теносиновит), тел позвонков (спондилит) и илиосакральных сочленений (сакроилиит) [3,4]. Для лечения средне-тяжелого и тяжелого бляшечного псориаза и ПсА применяют различные базисные противовоспалительные препараты (БПВП), прежде всего метотрексат, и генно-инженерные биологические препараты (ГИБП), в том числе ингибиторы фактора некроза опухоли-α (ФНО-α), интерлейкинов-12/23 (ИЛ-12/23) и ИЛ-17А, которые оказывают действие на все проявления псориатической болезни [5,6].
Апремиласт – это таблетированный представитель низкомолекулярных БПВП таргетного действия для лечения псориаза и ПсА [7]. Апремиласт оказывает селективное ингибирующее действие на фосфодиэстеразу 4 типа (ФДЭ 4), которая разрушает цикло-аденозинмонофосфат (цАМФ) [8]. Увеличение содержания цАМФ в клетках, экспрессирующих ФДЭ 4, сопровождается подавлением синтеза провоспа лительных цитокинов, в том числе ФНО-α, интерферона-g, интерлейкинов 12, 17, 22, 23, и хемокинов (CXCL9, CXCL10 и CCL4). Таким образом, апремиласт действует на начальном этапе воспалительного каскада и регулирует продукцию многочисленных компонентов воспалительного ответа [9].
В Российской Федерации апремиласт в дозе 30 мг два раза в день зарегистрирован под торговым названием ОТЕСЛА® для лечения активного ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением. Апремиласт был включен в Российские федеральные рекомендации, рекомендации EULAR (European League Against Rheumatism), GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis), NICE (National Institute for Health and Care Excellence) для лечения пациентов с активным ПсА и псориазом [10-13].
Эффективность апремиласта в лечении псориатического артрита и псориаза
Эффективность и безопасность апремиласта в лечении ПсА изучались в рандомизированных, плацебо-контролируемых клинических исследованиях 3 фазы (программа PALACE), которые проводились по сходным протоколам [14-16]. В целом в эти исследования были включены более 2000 взрослых больных активным ПсА (по крайней мере 3 опухших и болезненных сустава, длительность артрита ≥3 или ≥6 месяцев), которые получали апремиласт в дозах 20 или 30 мг два раза в день или плацебо. В исследования PALACE 1, PALACE 2 и PALACE 3 включали больных, которые ранее принимали стандартные БПВП (72-83% пациентов) или ГИБП (15-28%). Допол ни тель ным критерием включения в исследование PALACE 3 было наличие по крайней мере одной псориатической бляшки размером ≥2 см. Во время исследований допускалась сопутствующая терапия метотрексатом, сульфасалазином, лефлуномидом, глюкокортикостероидами в низких дозах и/или нестероидными противовоспалительными препаратами. Первичной конечной точкой исследований PALACE была частота ответа по критериям Амери канской коллегии ревматологов (АКР 20) через 16 недель, а основной вторичной конечной точкой – изменение индекса нетрудоспособности по вопроснику Health Assessment Questionnaire (HAQ-DI).
По частоте ответа по критерию АКР 20 апремиласт превосходил плацебо как у больных, получавших БПВП (32-41% и 18-19%, соответственно), так и пациентов, которые ранее не принимали БПВП или ГИБП (31% и 16%). К настоящему времени опубликованы результаты долгосрочной терапии апремиластом. Так, через 1 год применения препарата ответ по AКР 20 наблюдался у 61,3% пациентов, через 4 года – у 66,4% [17]. Таким образом, с течением времени отмечалось постепенное стабильное нарастание терапевтического эффекта (рис. 1).
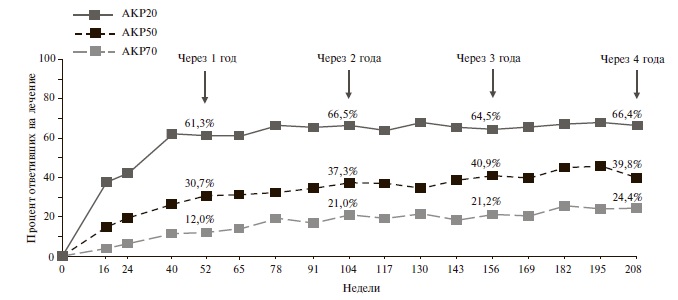
Эффективность апремиласта была подтверждена и при анализе динамики индекса HAQ-DI, который в большей степени снизился при применении исследуемого препарата. Клинически значимое снижение индекса HAQ-DI по крайней мере на 0,35 через 156 недель было достигнуто у 48% больных в исследованиях PALACE 1, 2 и 3. Стоит также отметить, что по данным мета-анализа исследований PALACE 1, 2 и 3, у больных, завершивших 52- и 104-недельную терапию апремиластом, отмечалось снижение индекса утомляемости (FACIT-F) на 4,8 и 5,6 балла, соответственно, а клинически значимое снижение этого показателя в обеих точ ках было достигнуто примерно у половины пациентов.
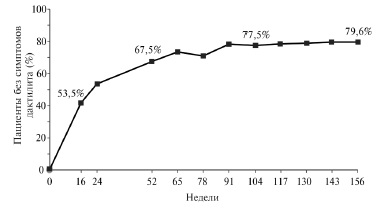
Во всех трех исследованиях лечение апремиластом привело также к достоверному уменьшению числа болезненных и припухших суставов, индекса DAS28СРБ, а также к уменьшению проявлений энтезитов и дактилитов. По данным анализа исследований PALACE 1, 2 и 3, через 3 года применения апремиласта симптомы дактилита были полностью устранены у 79,6% пациентов, симптомы энтезита – у 55,0% (рис. 2, 3).
Эффективность апремиласта была подтверждена в рандомизированном, двойном слепом, международном исследовании ACTIVE, в которое были включены 219 пациентов с активным ПсА (по крайней мере три болезненных сустава и по крайней мере три припухших сустава) длительностью ≥3 мес [18]. Больные ранее не получали ГИБП, а стандартные БПВП отменяли перед началом исследования, во время которого допускалась только сопутствующая терапия пероральными глюкокортикостероидами в стабильных низких дозах и/или НПВП. Пациентов рандомизировали на группы апремиласта в дозе 30 мг два раза в день или плацебо. Через 16 недель больных, у которых счет болезненных и при суставов не улучшался по крайней мере на 10%, переводили на апремиласт, а через 24 недели исследуемый препарат назначали всем оставшимся пациентам группы плацебо.
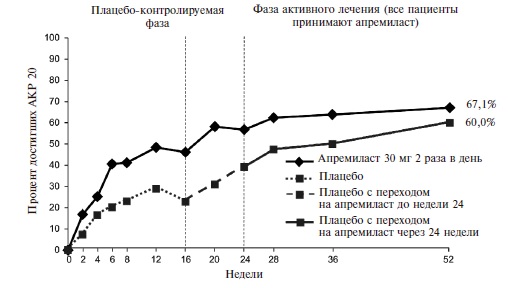
Действие монотерапии апремиластом проявлялось быстро. Уже через 2 недели частота ответа по критерию АКР 20 в основной группе достоверно превышала таковую в группе плацебо (16,4% и 6,4%, соответственно; p=0,0252) (рис. 4). При продолжении лечения частота ответа постепенно нарастала и через 16 недель (первичная конечная точка) достигла 38,2% против 20,2% в группе плацебо (p<0,01).
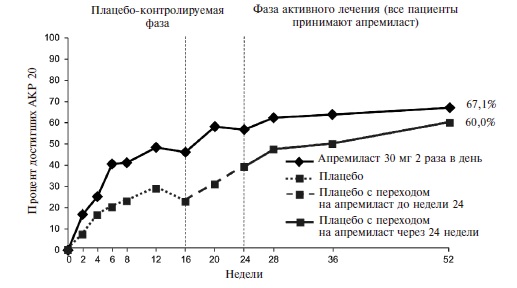
Достигнутый эффект сохранялся в отдаленном периоде. Через 52 недели частота ответа по критерию АКР 20 у больных, продолжавших прием апремиласта (n=171), составила 63,3%. Достоверное преимущество апремиласта перед плацебо было выявлено и при анализе снижения индекса HAQ-DI как через 2 недели (на 0,13 и 0,05, соответственно; p<0,05), так через 16 недель (на 0,21 и 0,06; p<0,05). Лечение апремиластом по сравнению с плацебо привело также к достоверному снижению индекса DAS28-CРБ (p<<0,05) через 2 и 16 недель (табл. 1).
| Показатели | Исходно | 2 нед | 16 нед | 52 нед |
|---|---|---|---|---|
| Частота ответа по АКР20, | - | 16,4 | 38,2 | 67,1 |
| DAS-28 (СРБ) | 4,81 | -0,59 | -1,07 | -1,71 |
| Выраженность энтезита (GEI: 0-6 | 2,30 | -1,10 | -1,50 | -1,60 |
| Функциональные нарушения (HAQ-DI: 0-3) | 1,25 | -0,13 | -0,21 | -0,40 |
Таким образом, результаты двойных слепых, контролируемых исследований 3 фазы показали, что апремиласт в дозе 30 мг два раза в день по эффективности превосходит плацебо у больных ПсА. Действие препарата проявлялось уже в первые 2 недели, а через 16 недель доля пациентов, ответивших на лечение (АКР 20), составляла 30-40% и достоверно превышала таковую в группе плацебо. Через 3-4 года ответ по критерию АКР 20 наблюдался примерно у 2/3 больных ПсА, продолжавших терапию апремиластом.
Эффективность апремиласта у пациентов со среднетяжелым и тяжелым псориазом изучалась в регистрационных, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях 3 фазы ESTEEM [19,20]. В эти исследования были включены взрослые больные средне-тяжелым или тяжелым бляшечным псориазом кожи (индекс PASI≥12), нуждавшиеся в системной терапии или фототерапии.
Первые результаты лечения отмечались уже через 2 недели применения препарата, а через 16 недель исходное значение индекса PASI уменьшилось по крайней мере на 75% (PASI 75) у трети пациентов. Через 52 недели достигнутый ответ на лечение сохранялся у пациентов, продолживших прием апремиласта.
Особый интерес представляют данные субанализа исследований, отражающие терапевтическую эффективность препарата в отношении проявлений псориаза ногтей и волосистой части головы, которые, в целом, хуже поддаются лечению [21]. В исследовании ESTEEM через 16, 32 и 52 недели индекс NAPSI, который используется для оценки тяжести поражения ногтей, уменьшился на 22,5%, 43,6% и 60,2%, соответственно, а в исследовании ESTEEM 2 – на 29,0%, 60,0% и 59,7%. При этом индекс NAPSI в те же сроки уменьшился по крайней мере в два раза у 33,3%, 45,2% и 63,0% больных, соответственно, в первом исследовании и у 44,6%, 55,4% и 68,6% пациентов во втором исследовании.
Эффективность апремиласта была показана и при анализе динамики поражения волосистой части головы. Так, через 52 недели полное или практически полное разрешение псориаза этой локализации быдо достигнуто у 73,0% пациентов в исследовании ESTEEM 1 и у 62,5% больных в исследовании ESTEEM 2.
Профиль безопасности апремиласта у больных ПсА и псориазом
Отличительной особенностью апремиласта являются хорошая переносимость и благоприятный профиль безопасности [22,23]. При длительном лечении апремиластом у больных псориазом и ПсА не было выявлено увеличения риска серьезных инфекций, сердечно-сосудистых исходов или злокачественных опухолей, частота которых оставалась очень низкой [7]. Также не было выявлено ни одного случая реактивации латентного туберкулеза.
Все ГИБП представляют собой белки, которые обладают иммуногенностью и вызывают образование антител, в том числе с нейтрализующей активностью. Появление нейтрализующих антител при введении ГИБП может нивелировать эффект лечения. По данным мета-анализа 68 исследований более чем у 14000 пациентов с различными аутоиммунными заболеваниями, получавших ингибиторы ФНО-α, частота образования антител к препаратам этой группы составила в целом 12,7%, а при применении инфликсимаба достигла 25,3% [24]. Риск формирования антительного ответа был ниже при применении ГИБП, представляющих собой человеческие антитела, таких как секукинумаб или устекинумаб. Апремиласт – это низкомолекулярный непептидный препарат, поэтому он не способен вызывать появление антител.
В клинических исследованиях основными нежелательными эффектами препарата были легкие или умеренно выраженные желудочно-кишечные нарушения, в том числе диарея, тошнота и рвота, которые возникали в течение первых 2 недель и проходили в течение 4 недель [25]. У большинства больных желудочно-кишечные расстройства не требовали прекращения приема апремиласта. Кроме того, при лечении апремиластом встречались инфекции верхних дыхательных путей и головная боль, в том числе напряжения [7]. При более длительном применении апремиласта (до 156 недель в исследованиях ESTEEM и до 208 недель в исследованиях PALACE) частота и тяжесть нежелательных явлений не нарастали, а новых значимых нежелательных реакций выявлено не было [26,27].
В клинических исследованиях у больных псориазом и ПсА частота депрессии при лечении апремиластом была несколько выше, чем при приеме плацебо. У пациентов с псориазом депрессия ни в одном случае не потребовала прекращения лечения, в то время как у больных ПсА частота отмены апремиласта из-за депрессии составила 0,2% (3 из 1945 пациентов). Псориаз сам по себе ассоциируется с депрессией. Соот ветственно, депрессивное состояние не является основанием для отказа от лечения, однако в таких случаях следует соблюдать осторожность.
У пациентов с легким или умеренным нарушением функции почек апремиласт применяют в стандартной дозе, в то время как при тяжелой почечной недостаточности (клиренс креатинина <30 мл/мин) дозу снижают до 30 мг один раз в сутки. При нарушении функции печени дозу апремиласта менять не следует.
Заключение
Апремиласт – это таблетированный препарат, который действует на более раннем этапе воспалительного каскада, чем ГИБП, в том числе ингибиторы ФНО-α, ИЛ12/23 и ИЛ-17А, и вызывает подавление продукции различных медиаторов воспаления. Апремиласт применяют в дозе 30 мг два раза в день для лечения ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением.
В рандомизированных, двойных слепых клинических исследованиях 3 фазы у больных средне-тяжелым и тяжелым бляшечным псориазом и ПсА апремиласт по эффективности достоверно превосходил плацебо, а достигнутый ответ сохранялся в отдаленном периоде. Терапия апремиластом вызывала уменьшение тяжести псориаза ногтей и волосистой части головы, который в целом хуже поддается лечению, а также улучшала качество жизни пациентов с псориазом.
У пациентов с активным ПсА апремиласт оказывал быстрое действие и уменьшал симптомы артрита, энтезита и дактилита. Судить о сравнительной эффективности апремиласта и ГИБП сложно, учитывая отсутствие прямых сравнительных исследований. Преимуществом апремиласта являются возможность приема внутрь и благоприятный профиль безопасности. Лечение этим препаратом не сопровождается повышением риска инфекционных осложнений, в том числе активации латентного туберкулеза, и образованием антител.
Используемые источники
- Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med 2009;361(12):496-509.
- Круглова Л.С., Моисеев С.В. Блокада интерлейкина-17 – новые горизонты эффективности и безопасности в лечении псориаза. Клин фармакол тер 2017;26(2):5-12.
- Коротаева Т.В. Псориатический артрит: классификация, клиническая картина, диагностика, лечение. Научно-практическая ревматология 2014;52(6): 650–9.
- Национальное руководство по ревматологии. Под ред. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010, 320 с.
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060–71.
- Keating GM. Apremilast: a review in psoriasis and psoriatic arthritis. Drugs 2017;77(4):459-72.
- Abdulrahim H, Thistleton S, Adebajo AO, et al. Apremilast: a PDE4 inhibitor for the treatment of psoriatic arthritis. Expert Opin Pharmacother 2015;16(7):1099108.
- Haber SL, Hamilton S, Bank M, et al. Apremilast: a novel drug for treatment of psoriasis and psoriatic arthritis. Ann Pharmacother 2016;50(4):282–90.
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060-71.
- Кубанов А.А. Резолюция Совета российских экспертов: “Апремиласт, ингибитор фосфодиэстеразы 4, как представитель нового класса малых молекул: место в лечении среднетяжелого, тяжелого псориаза и псориатического артрита”. Современная ревматология 2017;11(1):87-9.
- NICE Evidence-based recommendations on apremilast (Otezla) for treating active psoriatic arthritis in adults. https://www.nice.org.uk/guidance/ta433.
- Kavanaugh A, Mease PJ, Gomez-Reino JJ, et al. Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014;73(6):1020-6.
- Cutolo M, Myerson GE, Fleischmann RM, et al. A phase III, randomized, controlled trial of apremilast in patients with psoriatic arthritis: Results of the PALACE 2 trial. J Rheumatol 2016;43(9):1724-34.
- Edwards CJ, Blanco FJ, Crowley J, et al. Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with psoriatic arthritis and current skin involvement: a phase III, randomised, controlled trial (PALACE 3). Ann Rheum Dis 2016;75(6):1065-73.
- Edwards C, Blanco F, Crowley J, et al. Apremilast is associated with long-term (4-YEAR) DAS-28 (CRP) remission and improvements in skin disease: results from a phase III study in DMARD/biologic-experienced patients with active psoriatic arthritis. Ann Rheum Dis 76(Suppl 2):672.1
- Nash P, Ohson K, et al; ACTIVE investigators. Early and sustained efficacy with apremilast monotherapy in biological-naïve patients with psoriatic arthritis: a phase IIIB, randomised controlled trial (ACTIVE). Ann Rheum Dis 2018;77(5): 690-8.
- Papp K, Reich K, Leonardi CL, et al. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol 2015; 73:37-49.
- Paul C, Cather J, Gooderham M, et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in patients with moderate to severe plaque psoriasis over 52 weeks: a phase III, randomized, controlled trial (ESTEEM 2). Br J Dermatol 2015;173:1387-99.
- Nguyen CM, Leon A, Danesh M, et al. Improvement of nail and scalp psoriasis using apremilast in patients with chronic psoriasis: phase 2b and 3, 52-week randomized, placebo-controlled trial results. Drugs Dermatol 2016;15(3):272-6.
- Новиков П.И., Моисеев С.В. Безопасность генно-инженерных биологических препаратов и ингибитора фосфодиэстеразы 4 типа в лечении псориаза и псориатического артрита. Клин фармакол тер 2018;27(1):
- Dattola A, Del Duca E, Saraceno R, et al. Safety evaluation of apremilast for the treatment of psoriasis. Expert Opin Drug Saf 2017;16(3):381-5.
- Thomas SS, Borazan N, Barroso N, et al. Comparative immunogenicity of TNF inhibitors: impact on clinical efficacy and tolerability in the management of autoimmune diseases. A systematic review and meta-analysis. BioDrugs 2015; 29(4):241-58.
- Celgene Corporation. Otezla (apremilast) tablets, for oral use: US prescribing information. 2015. http://www.celgene.com/content/uploads/otezla-pi.pdf.
- Crowley J, Thaçi D, Joly P, et al. Long-term safety and tolerability of apremilast in patients with psoriasis: Pooled safety analysis for ≥156 weeks from 2 phase 3, randomized, controlled trials (ESTEEM 1 and 2). J Am Acad Dermatol 2017; 77(2):310-7.
- Crowley J, Wollenhaupt J, Reich K, et al. Long-term safety in psoriasis and psoriatic arthritis patients treated with apremilast: pooled analysis for C156 weeks in the ESTEEM and PALACE 1-3 phase 3 trials [abstract no. P2052 plus poster]. In: 25th Congress of the European Academy of Dermatology and Venereology. 2016.
