Клинические ассоциации анемии у пациентов с хронической сердечной недостаточностью
Изучить частоту, клинические ассоциации анемии и ее влияние на прогноз у пациентов с хронической сердечной недостаточностью (ХСН).
В индийском штате Керала были обследованы 170 пациентов, в том числе 137 мужчин (средний возраст 53,1±12,5 лет), с ХСН. Артериальная гипертония имелась у 56,5% больных, сахарный диабет – у 58,0%, перенесенный инфаркт миокарда с подъемом сегмента ST – у 28,0%, хроническая болезнь почек 3-5 стадии – у 13,5%, сахарный диабет 2 типа – у 58,0%. Частоту анемии определяли по критериям ВОЗ.
Анемия диагностирована у 53 (31,2%) пациентов с ХСН. По данным многофакторного регрессионного анализа, она ассоциировалась со следующими факторами: сопутствующие заболевания (хроническая болезнь почек [ХБП], сахарный диабет, артериальная гипертония), расчетная скорость клубочковой фильтрации [СКФ]≤54,8 мл/мин/1,73м 2 , сывороточный уровень креатинина ≥1,25 мг/дл, уровень мочевины ≥19,7 мг/дл и возраст ≥55,5 лет (p<0,05). У пациентов с анемией частота повторных госпитализаций по поводу сердечно-сосудистых заболеваний в течение 3 месяцев после выписки из стационара была выше, чем у больных без анемии (45% и 14%, соответственно, p=0,015).
Анемия была выявлена у трети пациентов с ХСН, ассоциировалась с более старшим возрастом, артериальной гипертонией, ХБП, сахарным диабетом 2 типа, более низкой СКФ и сопровождалась повышенным риском повторных госпитализаций по поводу сердечно-сосудистых заболеваний.
Сердечно-сосудистые заболевания, в том числе сердечная недостаточность, остаются одной из главных причин смертности во всем мире [1-4]. Анемию и хроническую болезнь почек (ХБП) считают основными факторами риска неблагоприятного исхода у больных хронической сердечной недостаточностью (ХСН). Результаты исследований свидетельствуют о том, что анемия увеличивает общую и сердечно-сосудистую смертность у больных ХСН [7-9]. Актуальность проблемы анемии при ХСН обусловлена старением населения и отсутствием алгоритмов коррекции уровня гемоглобина у таких пациентов [5]. Кроме того, ХСН все чаще встречается у пожилых пациентов, больных сахарным диабетом (СД) и ХБП, которые ассоциируется с повышением риска возникновения анемии [6]. У таких пациентов, а также больных ХСН III-IV функционального класса по NYHA ее частота может достигать 55% [9]. Данные о распространенности анемии при ХСН многочисленны, но весьма противоречивы, что объясняется применением различных критериев диагностики и неоднородностью популяций пациентов. Так, частота анемии у больных ХСН в разных исследованиях варьировалась от 4 до 61% [5-6].
Целью исследования было изучить частоту, клинические ассоциации анемии и ее влияние на прогноз у пациентов с ХСН.
Материал и методы
В исследование, которое проводилось в штате Керала (Индия) с сентября 2008 года по март 2012 года, включали пациентов с диагнозом ХСН, госпитализированных в кардиологическое отделение. Диагноз ХСН устанавливали в соответствии с национальными и международными рекомендациями [1-4]. Тяжесть ХСН оценивали в соответствии с критериями Нью-йоркской ассоциации сердца (NYHA).
Критериями исключения были острый коронарный синдром, терминальная стадия хронической почечной недостаточности, тяжелые нарушения функции печени, аутоиммунные и онкологические заболевания. Пациенты с ХСН получали терапию в соответствии с национальными рекомендациями [1].
Согласно определению ВОЗ, критерием диагностики анемии у взрослых женщин было снижение концентрации гемоглобина <12 г/дл, а у мужчин – <13 г/дл [10]. Железодефицитную анемию диагностировали при снижении содержания железа в сыворотке крови <8,95 ммоль/л у женщин и <11,64 ммоль/л у мужчин и уровня ферритина <10 мг/дл и <20 мг/дл, соответственно, B12-дефицитную анемию – при снижении уровня витамина В12 <160 пг/мл, фолиеводефицитную анемию – при снижении уровня фолатов <3 нг/мл.
Для оценки функционального состояния почек рассчитывали скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI. ХБП диагностировали согласно критериям KDIGO 2012 г. [11]. Определяли также уровни мочевины, электролитов (калий, натрий, хлор) и глюкозы крови.
Статистический анализ проводили с использованием пакета прикладных статистических программ Statistica 8.0 для Windows с применением стандартных алгоритмов вариационной статистики. Для количественных показателей рассчитывали среднее арифметическое значение и стандартное отклонение (M±SD). При сравнении средних значений использовали двусторонний t-критерий Стью дента. Качественные переменные описаны абсолютными (n) и относительными (%) значениями. Для сравнения частот признаков и качественных переменных пользовались критерием χ2. Оценку достоверности различий между группами проводили при помощи непараметрического критерия Манна-Уитни. При непараметрическом распределении данных рассчитывали коэффициент ранговой корреляции Спирмена. Различия средних величин и корреляционные связи считали достоверными при уровне значимости р<0,05.
Результаты
В исследование были включены 170 пациентов, в том числе 137 мужчин, в возрасте от 18 до 90 лет (в среднем 53,1±12,5 лет) с диагнозом ХСН (табл. 1). Более чем у 2/3 больных была диагностирована ХСН III-IV функционального класса. У большинства пациентов (86,0%) имелся синусовый ритм. Более половины пациентов страдали артериальной гипертонией или СД 2 типа, а около четверти перенесли инфаркт миокарда с подъемом сегмента ST. Снижение расчетной СКФ <60 мл/мин/1,73 м2 выявили у 99 (58,0%) обследованных пациентов.
| Показатель | Значение |
|---|---|
| Мужчины, n (%) | 137 (80,6) |
| Возраст, годы (диапазон) | 53,1±12,5 (18-90) |
| Масса тела, кг | 71,5±12,9 |
| Индекс массы тела, кг/м2 | 26,3±4,4 |
| Курение, n (%) | 67 (39,4) |
| Функциональный класс ХСН, n (%) | |
| I | 6 (3,5) |
| II | 37 (21,8) |
| III | 67 (39,4) |
| IV | 50 (29,4) |
| Артериальная гипертония, n (%) | 6 (56,5) |
| Инфаркт миокарда в анамнезе, n (%) | 48 (28,0) |
| Сахарный диабет, n (%) | 99 (58,2) |
| Инсульт в анамнезе, n (%) | 7 (4,1) |
| Хроническая болезнь почек 3-5 стадии, n (%) | 23 (13,5) |
| Дислипидемия, n (%) | 55 (32,4) |
| Синусовый ритм при поступлении, n (%) | 146 (86,0) |
| Фракция выброса ЛЖ, % (диапазон) | 36,1±12,2 (15-69) |
| Частота сердечных сокращений, в минуту | 102,0±23,6 |
| Систолическое АД, мм рт. ст. | 148,4±40,9 |
| Диастолическое АД, мм рт. ст. | 90,8±24,8 |
| Лабораторные показатели | |
| Гемоглобин, г/дл (диапазон) | 13,7±2,3 (6,8-19,5) |
| Лейкоциты, x109/л | 13,2±8,9 |
| Натрий, ммоль/л | 4,2±0,7 |
| СКФ, мл/мин/1,73 м2 | 69,6±31,3 |
| Сывороточный креатинин, мг/дл | 1,4±1,3 |
| Мочевая кислота, мг/дл | 24,1±18,4 |
Анемия наблюдалась у 53 (31,2%) из 170 пациентов с ХСН, в том числе у 44 (32%) из 137 мужчин и 9 (27%) из 33 женщин. У 46 пациентов анемия была легкой, у 7 – средне-тяжелой. У всех пациентов с анемией был выявлен дефицит железа, 4 (7,5%) – фолиевой кислоты, у 1 (1,9%) – витамина В12.
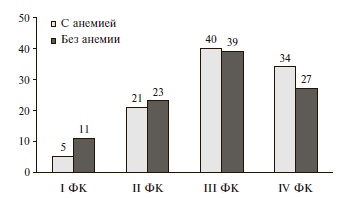
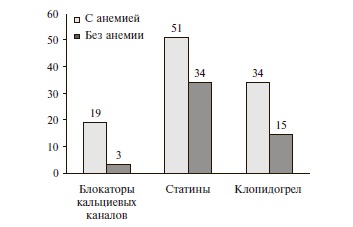
Группы пациентов с ХСН, сочетавшейся и не сочетавшейся с анемией, были сопоставимы по полу, однако первые были старше (р=0,002; табл. 2). Кроме того, у больных с анемией чаще встречались артериальная гипертония (p=0,04), СД (p=0,008) и ХБП 3-5 стадии (p=0,00002) и были выше сывороточный уровень креатинина (p=0,0003), мочевины (p=0,000001) и ниже расчетная СКФ (p=0,0003) и фракция выброса левого желудочка (p=0,04). В то же время распределение пациентов по тяжести ХСН между двумя группами существенно не отличалось (рис. 1). Больные с анемией достоверно чаще получали терапию клопидогрелем (p<0,003), блокаторами кальциевых каналов (p<0,0007) и статинами (p<0,038) (рис. 2). Частота назначения препаратов других групп, используемых для лечения ХСН, была сопоставимой у больных, страдавших и не страдавших анемией.
| Параметры | Анемия (n=53) | Без анемии (n=117) | p |
|---|---|---|---|
| Возраст, годы | 56,5±13,4 | 51,5±11,7 | 0,002 |
| Гипертония, n (%) | 36 (67,9) | 60 (51,3) | 0,04 |
| Сахарный диабет, n (%) | 40 (75,5) | 59 (50,4) | 0,008 |
| ХБП 3-5 стадии, n (%) | 16 (30,2) | 7 (6,0) | 0,00002 |
| Фракция выброса ЛЖ, % | 35,1 ±12,7 | 38,2±11,1 | 0,04 |
| Лабораторные показатели | |||
| СКФ, мл/мин/1,73 м2 | 56,8±33,9 | 75,5±28,1 | 0,0003 |
| Сыв. креатинин, мг/дл | 1,9±1,9 | 1,2±0,8 | 0,0003 |
| Мочевина, мг/дл | 34,8±24,8 | 19,2±11,7 | 0,000001 |
Для определения пограничных значений возможных предикторов анемии у больных ХСН использовали ROC-анализ. При построении ROC-моделей, отражающих взаимосвязь между значимыми параметрами и развитием анемии при ХСН, были получены кривые, которые не пересекали контрольную диагональ, обеспечивали чувствительность и специфичность >50%, площадь под кривой >0,6 (как минимум удовлетворительное качество модели) при уровне статистической значимости р<0,05 (табл. 3).
| Параметр | AUC | Пороговое значение | Чувствительность | Специфичность |
|---|---|---|---|---|
| Возраст, лет | 0,647 | ≥55,5 | 60 | 65 |
| СКФ, мл/мин/1,73 м2 | 0,676 | ≤54,8 | 62 | 78 |
| Мочевина, мг/дл | 0,736 | ≥19,7 | 68 | 70 |
| Креатинин, мг/дл | 0,672 | ≥1,25 | 60 | 80 |
С помощью многофакторного регрессионного анализа установлены факторы, ассоциировавшиеся с развитием анемии у больных ХСН, в том числе сопутствующие заболевания (ХБП, СД, артериальная гипертония), расчетная СКФ ≤54,8 мл/ мин/1,73м2, сывороточный уровень креатинина ≥1,25 мг/дл, уровень мочевины ≥19,7 мг/дл) и возраст ≥55,5 лет (табл. 4).
| Отношение шансов | 95% доверительный интервал | |
|---|---|---|
| Возраст ≥55,5 лет | 2,83 | 1,48-5,51 |
| Артериальная гипертония | 2,01 | 1,02-3,98 |
| Сахарный диабет | 3,03 | 1,47-6,23 |
| Хроническая болезнь почек | 6,80 | 2,59-17,80 |
| Клопидогрел | 3,03 | 1,41-6.51 |
| Блокаторы кальциевых каналов | 6,57 | 1,96-22,07 |
| Статины | 1,99 | 1,03-3,87 |
| СКФ ≤54,8 мл/мин/1,73 м2 | 5,54 | 2,73-11,25 |
| Креатинин ≥1,25 мг/дл | 5,91 | 2,90-12,01 |
| Мочевина ≥19,7 мг/дл | 4,77 | 2,37-9,57 |
В результате стационарного лечения доля пациентов с ХСН III и IV функционального класса значительно уменьшилась с 39,4% до 4,1% и с 29,4% до 2,9%, соответственно. Для оценки влияния анемии на исходы ХСН анализировали внутрибольничную смертность, 30дневную смертность и частоту повторных госпитализаций по поводу сердечно-сосудистых заболеваний в течение 3 и 12 месяцев. У пациентов с анемией было выявлено достоверное увеличение частоты повторных госпитализаций в течение 3 мес после выписки из стационара (45,0% против 14,0% у пациентов без анемии (p=0,015). Достоверных различий смертности через год не отмечено (1,9% и 2,6%, соответственно).
Обсуждение
В развитых странах распространенность ХСН среди взрослых составляет приблизительно 1-2%, а в возрасте старше 70 лет превышает 10% [12-15]. В возрасте 55 лет риск развития ХСН составляет 33% у мужчин и 28% у женщин [14]. Среди людей старше 65 лет с впервые выявленной одышкой при физической нагрузке каждый шестой страдает нераспознанной ХСН, в основном с сохранной фракцией выброса [16-17]. Доля последних среди больных ХСН варьируется от 22 до 73% в зависимости от критериев диагностики, возраста, пола, наличия инфаркта миокарда в анамнезе, года публикации [15-16,18-23].
В нашем исследовании частота анемии у пациентов с ХСН, обследованных в штате Керала (Индия), составила 31,2%. По данным мета-анализа 34 исследований, в целом у 153 180 пациентов с ХСН частота анемии достигла 37,2% (10-49%) [24]. Сходные данные были получены в проспективном исследовании STAMINAHFP (Study of Anemia in a Heart Failure Population), в котором распространенность анемии составила 34% [25]. Данных о распространенности анемии при ХСН в развивающихся странах, в частности в Индии, мало. В одном из самых крупных исследований, которое проводилось в Танзании, анемия была выявлена у 57% из 401 пациента с ХСН [26]. В Эфиопии были ретроспективно проанализированы медицинские документы 370 пациентов с ХСН, госпитализированных в университетскую больницу в 2010-2016 гг. Частота анемии составила в целом 41,9%, в том числе 64,6% у женщин [27].
Причиной анемии чаще всего служит дефицит железа. Например, в исследовании, проводившемся в штате Раджастхан (Индия), он был выявлен у 76% больных с анемией и ХСН и у женщин встречался чаще, чем у мужчин (91,6% и 68,6%, соответственно) [5].
Проведенные исследования позволили выделить факторы риска развития анемии у пациентов с ХСН. К ним в первую очередь следует отнести пожилой возраст. Так, по данным Т. Horwich и соавт., анемия при ХСН значительно чаще встречалась у больных старше 55 лет [28]. Сходные данные были получены и в нашем исследовании. По литературным данным у мужчин анемия при ХСН встречается, чем у женщин [29]. Однако полученные нами данные не выявили различий по полу среди исследуемой популяции пациентов.
В многочисленных крупных рандомизированных исследованиях (OPTIME, FAIR-HF и др.) было показано, что наличие анемии ассоциировано с более высоким функциональным классом по NYHA у больных с ХСН [30-32]. В настоящем исследовании анемия не оказала значимого влияния на тяжесть ХСН, что еще раз указывает на неоднородность получаемых данных в зависимости от особенностей популяций пациентов.
Неоспорима связь СД и анемии при ХСН. Доказано, что нарушенная функция почек и сопутствующий СД являются факторами, не только усугубляющими течение ХСН, но и увеличивающими вероятность развития анемии [33]. В нашем исследовании анемия у пациентов с ХСН ассоциировалась с возрастом ≥55,5 лет, ХБП, сахарным диабетом, артериальной гипертонией, а также показателями функции почек (исходная СКФ ≤54,8 мл/мин/1,73м2, сывороточный креатинин ≥1,25 мг/дл, мочевина ≥19,7 мг/дл), что не противоречит литературным данным.
Анемия при ХСН усугубляет течение заболевания и значительно ухудшает прогноз пациентов как в ближайшем, так и в отдаленном периоде [35-36], хотя неблагоприятный эффект анемии был подтвержден не во всех исследованиях. Так, в госпитале Ботсваны (Южная Африка) изучалось влияние анемии и ХБП на внутрибольничные исходы у 193 пациентов с ХСН. Анемия была выявлена в 32% случаев, почечная дисфункция – в 31%. Однако, несмотря на распространенность анемии и нарушения функции почек при ХСН, они не были независимыми предикторами внутрибольничной смертности и продолжительности госпитализации. По мнению авторов, результаты исследований, которые проводятся в развитых странах и странах с низким и средним уровнем доходов, могут отличаться [34]. В настоящем исследовании анемия ассоциировалась с более частыми повторными госпитализациями в течение 3 месяцев после выписки из стационара, однако не влияла на смертность пациентов.
Заключение
Анемия встречается у трети больных ХСН, ассоциируется со старшим возрастом, некоторыми сопутствующими заболеваниями (ХБП, сахарным диабетом и артериальной гипертонией) и лабораторными показателями функции почек (снижением СКФ и повышением сывороточных уровней креатинина и мочевины), а также увеличением риска повторных госпитализаций по поводу сердечно-сосудистых заболеваний в течение 3 месяцев после выписки из стационара.
Используемые источники
- Мареев В.Ю., Фомин И.В., Агеев Ф.Т., и др. Клинические рекомендации. Хроническая сердечная недостаточность (ХСН). Журнал Сердечная Недостаточность 2017;18(1):3-40.
- Ponikowski P, Voors AA, Anker SD, et al; Authors/Task Force Members. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37(27):2129-200.
- Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation 2017;9:23–4.
- Ларина В.Н., Чукаева И.И. Диагностика и лечение хроническои сердечнои недостаточности (по рекомендациям Европейского общества кардиологов по диагностике и лечению острои и хроническои сердечнои недостаточности 2016 г.). Лечебное дело 2016;3:37–48.
- Sharma SK, Agarwal SK, Bhargava K, et al. Prevalence and spectrum of iron deficiency in heart failure patients in south Rajasthan. Indian Heart J 2016;68:493–7.
- Abebe TB, Gebreyohannes EA, Tefera YG, Abegaz TM. Patients with HFpEF and HFrEF have different clinical characteristics but similar prognosis: a retrospective cohort study. BMC Cardiovasc Disord 2016;16(1):232.
- Yeo TJ, Yeo PS, Ching-Chiew Wong R, et al. Iron deficiency in a multiethnic Asian population with and without heart failure: prevalence, clinical correlates, functional significance and prognosis. Eur J Heart Fail 2014;16(10):1125–32.
- Enjuanes C, Klip IT, Bruguera J, et al. Iron deficiency and health-related quality of life in chronic heart failure: results from a multicenter European study. Int J Cardiol 2014;174(2):268–75.
- Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work GroupKDIGO Clinical Practice Guideline for anemia in chronic kidney disease. Kidney Int 2012;2:279-335.
- Hillman RS, Autl KA: Hematology in clinical practice. New York, Mc GrawHill, 2002.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Intern Suppl 2013;3:1–150.
- Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007;93:113746.
- Redfield MM, Jacobsen SJ, Burnett JC, et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003;289:194–202.
- Bleumink GS, Knetsch AM, Sturkenboom MCJM, et al. Quantifying the heart failure epidemic: prevalence, incidence rate, lifetime risk and prognosis of heart failure The Rotterdam Study. Eur Heart J 2004;25:1614–9.
- Ceia F, Fonseca C, Mota T, et al. Prevalence of chronic heart failure in Southwestern Europe: the EPICA study. Eur J Heart Fail 2002;4:531–9.
- van Riet EES, Hoes AW, Limburg A, et al. Prevalence of unrecognized heart failure in older persons with shortness of breath on exertion. Eur J Heart Fail 2014;16:772–7.
- Filippatos G, Parissis JT. Heart failure diagnosis and prognosis in the elderly: the proof of the pudding is in the eating. Eur J Heart Fail 2011;13:467–71.
- Boonman-de Winter LJM, Rutten FH, et al. High prevalence of previously unknown heart failure and left ventricular dysfunction in patients with type 2 diabetes. Diabetologia 2012;55:2154-62.
- van Riet EES, Hoes AW, Wagenaar KP, et al. Epidemiology of heart failure: the prevalence of heart failure and ventricular dysfunction in older adults over time. A systematic review. Eur J Heart Fail 2016;
- Фомин И.В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал 2016;(8):7–13.
- Поляков Д.С., Фомин И.В., Валикулова Ф.Ю. и др. Эпидемиологическая программа ЭПОХА–ХСН: декомпенсация хронической сердечной недостаточности в реальной клинической практике (ЭПОХА–Д–ХСН). Журнал Сердечная Недостаточность 2016;17(6):299–305.
- Von Haehling S, Gremmler U, Krumm M, et al. Prevalence and clinical impact of iron deficiency and anaemia among outpatients with chronic heart failure: the PrEP Registry. Clin Res Cardiol 2017;106(6):436-43.
- Tiller D, Russ M, Greiser KH, et al. Prevalence of symptomatic heart failure with reduced and with normal ejection fraction in an elderly general population – the CARLA study. PLoS One 2013;8:e59225.
- Groenveld HF, Januzzi JL, Damman K, et al. Anemia and mortality in heart failure patients. A systematic review and meta-analysis. J Amer Coll Cardiol 2008;52(10):818–27.
- Adams KF, Pisa IL, Ghali JK, et al. Prospective evaluation of the association between hemoglobin concentration and quality of life in patients with heart failure. Amer Heart J 2009;158(6):965–71.
- Makubi A, Hage C, Lwakatare J, et al, Prevalence and prognostic implications of anaemia and iron deficiency in Tanzanian patients with heart failure. Heart 2015;101:592–9.
- Abebe TB, Gebreyohannes EA, Bhagavathula AS, et al. Anemia in severe heart failure patients: does it predict prognosis? BMC Cardiovasc Disord 2017; 17(1):248.
- Horwich TB, Fonarow GC, Hamilton MA, et al. Anemia is associated with worse symptoms, greater impairment in functional capacity and a significant increase in mortality in patients with advanced heart failure. J Amer Coll Cardiol 2002;39(11):1780–6.
- Le Jemtel TH, Arain S. Mediators of anemia in chronic heart failure. Heart Failure Clinics 2010;6(3):289–93.
- Anker SD, Comin Colet J, Filippatos G, et al; FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009;361(25):2436-48.
- Felker GM, Benza RL, Chandler AB, et al, for the OPTIME-CHF Investigators. Heart failure etiology and response to milrinone in decompensated heart failure: results from the OPTIME-CHF study. J Am Coll Cardiol 2003;41:997–1003.
- Go A, Tabada G, Leong T, et al. Incidence and predictors of anemia complicating heart failure: The RBC HEART Study. Circulation 2017;136:A14167
- Резник Е.В., Гендлин Г.Е., Сторожаков Г.И., Волынкина В.М. Почечная гемодинамика у больных хроническои сердечнои недостаточностью. Жур нал Сердечная Недостаточность 2007;8(3):118-25.
- Mwita JC, Magafu MGMD, Omech B, et al. Anaemia, renal dysfunction and inhospital outcomes in patients with heart failure in Botswana. S Afr Med J 2017; 108(1):56-60.
- Ponikowski P, van Veldhuisen DJ, Comin-Colet J, et al; CONFIRM-HF Investigators. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J 2015;36(11):657-68.
- Moe GW, Ezekowitz JA, O’Meara E, et al. The 2014 Canadian Cardiovascular Society Heart Failure Management Guidelines Focus Update: anemia, biomarkers, and recent therapeutic trial implications. Can J Cardiol 2015;31:3-16.
