Нарушение мозгового венозного кровотока у больных с гипертонической дисциркуляторной энцефалопатией
Изучить клинико-нейровизуализационные особенности венозной дисциркуляции у больных с гипертонической дисциркуляторной энцефалопатией (ГДЭ).
Были обследованы 132 пациента с ГДЭ, которых распределили на группы в зависимости от стадии ГДЭ, а также с учетом наличия конституциональной венозной недостаточности (КВН). Всем пациентам проведено полное клинико-неврологическое исследование, МРТ головного мозга и МР-венография.
У пациентов с КВН гипоплазия поперечных и сигмовидных синусов (57,5%), расширение поверхностных вен мозга (68,5 %) и вены Галена (65,6%), хронические тромбозы венозных синусов (24,7%) визуализировались чаще, чем у больных без КВН на всех стадиях ГДЭ. Установлена взаимосвязь выявленных изменений с клиническими проявлениями церебральной венозной дисциркуляции.
Применение методов нейровизуализации в сочетании с клинико-неврологическим исследованием позволяет оптимизировать этиопатогенетическую терапию, а также программу профилактических и реабилитационных мероприятий, которые должны проводиться с учетом выраженности венозных расстройств.
Хронические цереброваскулярные заболевания представляют собой важную медико-социальную проблему [1-3]. Одной из наиболее распространенных форм хронических цереброваскулярных заболеваний является ГДЭ [3,4], развитие которой во многом зависит от нарушения венозного компонента церебральной гемодинамики, что может быть обусловлено наличием как врожденных причин в виде конституциональной венозной недостаточности (КВН), так и, в соответствии с концепцией "энцефалопатии пульсовой волны", формироваться вторично при гипертоническом поражении сосудов [5-8]. В настоящее время выделен патогенетический подтип ГДЭ, сопровождающейся КВН, описан его клинико-неврологический симптомокомплекс, с помощью ультразвуковых методов изучено состояние гемодинамики на всех структурно-функциональных уровнях сосудистой системы мозга [7,8,10]. Тем не менее, в полной мере оценить структурное состояние венозного компонента сосудистой системы мозга ультразвуковыми методами диагностики не представляется возможным [11]. Внедрение в клиническую практику магнитно-резонансной томографии (МРТ) открыло новые перспективы в изучении венозной системы головного мозга [12].
Целью исследования было изучить клинико-нейровизуализационные особенности венозной дисциркуляции у больных ГДЭ.
Материал и методы
В исследование включали пациентов с артериальной гипертонией, сопровождавшейся ГДЭ, которые были обследованы в неврологическом отделении для больных с нарушением мозгового кровообращения ГУЗ "Центральная клиническая медико-санитарная часть им. заслуженного врача России В.А. Егорова" г. Ульяновска. Клиническими критериями КВН были "венозные" жалобы, обусловленные венозной церебральной дисциркуляцией, такие как пастозность лица и век в утренние часы, симптом "тугого воротника", симптомы "песка в глазах" и "высокой подушки", семейный "венозный" анамнез, наличие типичных проявлений венозной патологии (варикозное расширение и тромбоз вен нижних конечностей, геморрой, варикоцеле, варикозное расширение вен пищевода) и неврологических симптомов, в развитии которых особую роль играет венозная дисциркуляция. Критерием исключения служили соматические заболевания, которые могут быть причиной вторичных нарушений венозного кровообращения [10].
МРТ проводили на аппарате Siemens Magnetom Symphony с силой поля 1,5 Тесла. Исследование параметров церебрального венозного оттока осуществляли с использованием времяпролетной МР-венографии (Time of flight – TOF) в двухмерном (2D) изображении.
Статистический анализ полученных результатов проводился с использованием пакета прикладных программ Statistica 8.0 и Excel. Для проверки гипотезы о различии выборок групп больных использовали U-тест Манна– Уитни, а для определения связи между количественными показателями – непараметрический корреляционный анализ Спирмена. Результаты представлены в виде медианы, 25% и 75% квартилей – Мe [25%; 75%]. Различия считали достоверными при р<0,05.
Результаты
Обследовали 132 пациентов с ГДЭ, в том числе 47 мужчин и 85 женщин в возрасте от 41 до 76 лет (в среднем 60±10,7 лет). Все пациенты страдали гипертонической болезнью в течение более 5 лет (в среднем 11,2±7,2 лет). В соответствии с классификацией Научного центра неврологии (1985 г.) у 37 (28,1%) пациентов диагностирована ГДЭ I стадии, у 51 (38,6 %) – II стадии, у 44 (33,3 %) – III стадии. Контрольную группу составили 30 человек с нормальным АД, в том числе 17 женщин и 13 мужчин в возрасте в среднем 59,4±10,3 лет.
| КВН (n=73) | КВН (n=59) | |
|---|---|---|
| Примечание: *p<0,05 | ||
| Женщины, n (%) | 48 (65,8) | 37 (62,7) |
| Средний возраст, лет | 56,4±10,2 | 60,5±11,8 |
| Стадия ГДЭ, n (%) | ||
| I | 21 (28,8) | 16 (27,1) |
| II | 29 (39,7) | 22 (37,3) |
| III | 23 (31,5) | 21 (35,6) |
| Симптомы, n (%) | ||
| Симптом "тугого воротника" | 49 (67,2)* | 24 (40,7) |
| Симптом "высокой подушки" | 50 (68,5)* | 23 (38,9) |
| Симптом "песка в глазах" | 55 (75,3)* | 22 (37,3) |
| Пастозность лица и век в утренние часы | 60 (82,2)* | 22 (37,3) |
Признаки КВН выявили у 73 (55,3%) пациентов. Группы пациентов с КВН и без КВН не отличались по возрасту, полу и стадиям ГДЭ (табл. 1). "Венозные" жалобы у больных с КВН встречались достоверно чаще, чем в группе сравнения. Снижение корнеальных рефлексов, болезненность точек выхода и гипестезия в зоне иннервации первой ветви тройничного нерва и диссоциация коленных и ахилловых рефлексов, в развитии которых играет роль венозная дисциркуляция, у пациентов с КВН определялись уже на I стадии ГДЭ и наблюдались чаще, чем у пациентов без КВН, на всех стадиях ГДЭ (р<0,05; табл. 2).
| ГДЭ I ст. | ГДЭ II ст. | ГДЭ III ст. | ||||
|---|---|---|---|---|---|---|
| КВН (n=21) | Без КВН (n=16) | КВН (n=29) | Без КВН (n=22) | КВН (n=23) | Без КВН (n=21) | |
| Примечание: *p <0,05 – статистически значимые различия между группами больных с КВН и без КВН; "статистически значимые различия между группами пациентов с ГДЭ III и I ст. | ||||||
| Снижение корнеальных рефлексов | 10 (47,6) | - | 14 (48,3)* | 4 (18,2) | 15 (65,2)*" | 4 (19,0) |
| Болезненность точек выхода и гипестезия в зоне иннервации первой ветви тройничного нерва |
8 (38,1) | - | 11 (37,9)* | 2 (9,1) | 11 (47,8)*" | 3 (14,3) |
| Диссоциация коленных и ахилловых рефлексов | 5 (23,8) | - | 7 (24,1)* | 3 (13,6) | 7 (30,4)*" | 4 (19,0 |
Результаты визуализации анатомического строения интракраниальной венозной системы по данным МРвенографии представлены в (табл. 3). Симметричное строение поперечных и сигмовидных синусов у пациентов с КВН на всех стадиях ГДЭ определялось значительно реже, чем у пациентов без КВН (р<0,05), у которых результаты МР-венографии были сопоставимыми с таковыми в контрольной группе. У подавляющего большинства больных с КВН (90,4%) были выявлены анатомические варианты поперечных и сигмовидных синусов, в том числе гипоплазия (57,5%) или асимметрия (32,9%), которые визуализировались значительно чаще, чем у больных без КВН, на всех стадиях ГДЭ (р<0,05). Гипоплазия синусов чаще определялась слева (р<0,05), что соответствует данным проведенных ранее исследований у больных дисциркуляторной энцефалопатией [13]. Частота визуализации вариантов строения поперечных и сигмовидных синусов не зависела от стадии ГДЭ, но зависела от наличия КВН. Таким образом, асимметрия и гипоплазия венозных синусов, представляющие врожденные варианты строения церебральной венозной системы, являются нейровизуализационными признаками КВН.
| ГДЭ I ст. | ГДЭ II ст. | ГДЭ III ст. | Контроль (n=30) | ||||
|---|---|---|---|---|---|---|---|
| КВН (n=21) | Без КВН (n=16) | КВН (n=29) | Без КВН (n=22) | КВН (n=23) | Без КВН (n=21) | ||
| Примечание: *p <0,05 – статистически значимые различия между группами больных с КВН и без КВН; "статистически значимые различия между группами пациентов с ГДЭ III и I ст. | |||||||
| Симметричное строение синусов | 2 (9,5)* | 7 (43,8) | 3 (10,3)* | 8 (36,4) | 2 (8,7)* | 9 (42,9) | 11 (36,7) |
| Анатомические варианты строения | 19 (90,5)* | 9 (56,2) | 26 (89,7)* | 14 (63,6) | 21 (91,3)* | 12 (57,4) | 19 (63,3) |
| Асимметрия | |||||||
| Всего | 7 (36,8)* | 6 (66,7) | 10 (38,5)* | 9 (64,3) | 7 (33,3)* | 8 (66,7) | 14 (73,7) |
| D>S | 5 (71,4)" | 4 (66,7)" | 7 (70,0) " | 5 (55,6) | 5 (71,4)" | 6 (75,0)" | 9 (64,2) |
| S>D | 2 (28,6) | 2 (33,3) | 3 (30,0) | 4 (44,4) | 2 (28,6) | 3 (25,0) | 5 (35,8) |
| Гипоплазия | |||||||
| Всего | 12 (63,2)* | 3 (33,3) | 16 (61,5)* | 5 (35,7) | 14 (66,7)* | 4 (33,3) | 5 (26,3) |
| Правые синусы | 3 (25,0) | 1 (33,3) | 5 (31,3) | 2 (40,0) | 4 (28,6) | 1 (25,0) | 2 (40,0) |
| Левые синусы | 9 (75,0)# | 2 (67,7)# | 11 (68,7)# | 3 (60,0) | 10 (71,4# | 3 (75,0)# | 3 (60,0) |
У больных с КВН диаметры поверхностных вен и вены Галена превышали таковые у пациентов без КВН и пациентов контрольной группы и нарастали по мере прогрессирования ГДЭ. У больных ГДЭ III стадии они были значительно больше, чем у пациентов с ГДЭ I стадии (p<0,05; табл. 4). Одной из причин этого может быть наличие анатомического варианта строения венозной системы головного мозга, такого как гипоплазия венозных синусов, которая приводит к затруднению венозного оттока и формированию застойных явлений, визуализирующихся уже на I стадии ГДЭ и нарастающих при прогрессировании заболевании. Кроме того, расширение вен мозга у больных ГДЭ свидетельствует о недостаточности компенсаторных возможностей коллатерального венозного оттока, а также о нарастании венозной дисциркуляции при прогрессировании артериальной микроангиопатии.
| ГДЭ I ст. | ГДЭ II ст. | ГДЭ III ст. | Контроль (n=30) | ||||
|---|---|---|---|---|---|---|---|
| КВН (n=21) | Без КВН (n=16) | КВН (n=29) | Без КВН (n=22) | КВН (n=23) | Без КВН (n=21) | ||
| Примечание: *p<0,05 статистически значимые различия с контрольной группой; "статистически значимые различия между группами пациентов с ГДЭ с КВН и без КВН; #статистически значимые различия с ГДЭ I стадии с КВН | |||||||
| Поверхностные мозговые вены | 2,8 [1,9;3,6]*" | 1,8 [1,2;2,4] | 3,8 [2,6;4,9]*" | 2,0 [1,4;2,6] | 4,6 [3,4;5,6]*"# | 2,4 [1,6;3,2] | 1,8 [1,1;2,5] |
| Вена Галена | 1,2 [0,8;1,6]*" | 0,7 [0,5;0,9] | 1,8 [1,1;2,4]*" | 0,9 [0,5;1,3] | 2,8 [1,8;3,5]*"# | 1,0 [0,8;1,2] | 0,8 [0,6;1,0] |
| Верхний сагиттальный синус | 6,1 [5,0;7,1] | 5,9 [4,8;7,0] | 6,2 [5,0;7,4] | 5,9 [4,7;7,1] | 6,3 [5,1;7,4] | 6,0 [4,8;7,2] | 5,9 [4,8;7,1] |
| Правый поперечный синус | 6,2 [3,1;9,2] | 6,1 [3,0;9,2] | 6,8 [2,9;10,5] | 6,5 [2,7;10,0] | 6,5 [3,0;10,4] | 6,3 [2,6;9,8] | 6,1 [3,0;9,2] |
| Левый поперечный синус | 5,9 [3,0;8,9] | 5,7 [3,1;8,3] | 6,1 [2,8;9,4] | 5,9 [2,9;8,9] | 6,0 [3,2;9,1] | 5,8 [2,5;8,1] | 5,8 [2,6;8,5] |
| Правый сигмовидный синус | 7,3 [3,9;10,6] | 7,1 [3,8;10,4] | 7,7 [4,0;11,4] | 7,4 [3,4;10,4] | 7,9 [3,9;12,0] | 7,6 [3,6;10,4] | 7,7 [3,9;11,2] |
| Левый сигмовидный синус | 6,9 [3,5;10,3] | 7,0 [3,0;11,0] | 7,2 [3,8;11,0] | 7,1 [3,7;10,5] | 7,0 [3,7;10,8] | 6,9 [3,7;10,5] | 6,9 [3,8;10,7] |
В соответствии с триадой R. Virchow (1856) стаз и иммобилизация крови в венозном русле играют важную роль в развитии венозного тромбоза [14]. В нашем исследовании при МР-венографии определялись тромбозы поперечных и сигмовидных синусов, сигнальная характеристика которых соответствовала диагностическим нейровизуализационным критериям тромбоза в хронической стадии [15,16]. У больных с тромбозом отсутствовали указания в анамнезе на клинические состояния, соответствующие классическому описанию церебрального венозного тромбоза, который часто развивается подостро (в 50-80% случаев в течение от нескольких дней до одного месяца) [17,18] и характеризуется полиморфизмом и неспецифичностью клинической картины [19], особенно у пациентов с КВН. На фоне уже имеющихся венозных жалоб и относительной адаптации к клиническим проявлениям КВН не всегда заметно нарастание симптомов центрального венозного тромбоза, что обусловливает позднее обращение больных за медицинской помощью. Тромбозы поперечных и сигмовидных синусов у пациентов с КВН встречались чаще (24,7%), чем у больных без КВН (8,5%, p<0,05; рис. 1). Частота тромбозов венозных синусов не зависела от стадии ГДЭ как в группе пациентов с КВН, так и без КВН (p>0,05). В контрольной группе случаев тромбоза поперечных и сигмовидных синусов не выявлено.
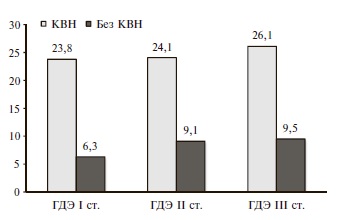
В целом при МР-венографии у 65,8% пациентов с КВН визуализировали расширение поверхностных вен головного мозга, у 57,5% – гипоплазию венозных синусов, у 64,4% – расширение вены Галена, у 24,7% – тромбозы венозных синусов (рис. 2).
| Расширение поверхностных вен | Расширение вены Галена | Гипоплазия венозных синусов | Тромбозы венозных синусов | |||||
|---|---|---|---|---|---|---|---|---|
| r | p | r | p | r | p | r | p | |
| Симптом "тугого воротника" | 0,46 | 0,03 | 0,52 | 0,02 | 0,54 | 0,02 | 0,47 | 0,03 |
| Симптом "песка в глазах" | 0,56 | 0,01 | 0,46 | 0,03 | 0,47 | 0,03 | 0,46 | 0,04 |
| Пастозность лица и век в утренние часы | -0,52 | 0,02 | -0,58 | 0,01 | -0,46 | 0,03 | -0,54 | 0,01 |
| Симптом "высокой подушки" | -0,47 | 0,02 | -0,44 | 0,04 | -0,42 | 0,04 | -0,48 | 0,03 |
| Снижение корнеальных рефлексов | 0,47 | 0,01 | 0,58 | 0,01 | 0,84 | 0,001 | 0,50 | 0,02 |
| Болезненность точек выхода и гипестезия в зоне иннервации первой ветви тройничного нерва | 0,42 | 0,04 | 0,48 | 0,02 | 0,80 | 0,01 | 0,46 | 0,04 |
| Диссоциация коленных и ахилловых рефлексов | 0,56 | 0,02 | 0,44 | 0,03 | 0,83 | 0,003 | 0,42 | 0,04 |
У больных с КВН наблюдалась корреляционная связь средней силы между расширением поверхностных вен и вены Галена, тромбозами венозных синусов и "венозными" жалобами и неврологическими симптомами церебральной венозной дисциркуляции, а также между гипоплазией венозных синусов и "венозными" жалобами (табл. 5). Обращало на себя внимание наличие высокой корреляции между гипоплазией венозных синусов и неврологическими симптомами церебральной венозной дисциркуляции.
Обсуждение
У больных ГДЭ с КВН в клинической картине заболевания существенное место занимают симптомы, свидетельствующие о венозной церебральной дисциркуляции и проявляющиеся уже на ранних стадиях ГДЭ. У пациентов без КВН нарастание клинических проявлений венозной дисциркуляции зависит от прогрессирования ГДЭ. МР-венография является важнейшим неинвазивным методом диагностики КВН у пациентов с ГДЭ. Нейровизуализационными коррелятами КВН у являются расширение поверхностных вен и вены Галена, гипоплазия и тромбозы венозных синусов в хронической стадии. При наблюдении больных ГДЭ, особенно при наличии КВН, необходим высокий уровень настороженности в отношении центрального венозного тромбоза вследствие неспецифичности, стертости и медленного нарастания симптоматики. Применение методов нейровизуализации в сочетании с клиниконеврологическим исследованием позволяет оптимизировать этиопатогенетическую терапию, а также программу профилактических и реабилитационных мероприятий, которые должны проводиться с учетом выраженности венозных расстройств у больного. Медикаментозная терапия должна быть направлена на облегчение венозного оттока из полости черепа.
Винпоцетин (Кавинтон®, "Гедеон Рихтер", Венгрия), производное алкалоида винкамина, содержащегося в растении барвинок малый, является препаратом выбора в лечении больных с церебральными венозными расстройствами, что обусловлено его воздействием на целый ряд патофизиологических процессов, вызывающих поражение эндотелия сосудов и нарушение церебральной, в том числе, венозной гемодинамики. Винпоцетин модулирует активность митохондриальной поры и предотвращает нарушение метаболизма в этих органеллах и гиперпродукцию активных форм кислорода (АФК) [20]. В эксперименте показано, что увеличение содержания АФК в сосудах приводит к стимуляции вазоконстрикции и ремоделирования с повышением системного сосудистого сопротивления, а увеличение концентрации АФК в головном мозге вызывает стимуляцию нейронов с увеличением симпатической активации и продукции провоспалительных цитокинов, воздействующих на эндотелий сосудов [21]. Кроме того, винпоцетин ингибирует фосфодиэстеразу и увеличивает уровень цГМФ в сосудистом эндотелии, что способствует вазодилатации [20], а также уменьшает выделение воспалительных цитокинов и хемокинов из эндотелиальных клеток, гладкомышечных клеток сосудов, макрофагов и микроглии путем ингибирования сигнального пути NF-κB [21]. Таким образом, препарат оказывает положительное действие на мышечную стенку и эндотелий сосудов и улучшает состояние церебральной гемодинамики в целом.
Благоприятное влияние винпоцетина на артериальные сосуды, вероятно, реализуется посредством воздействия как на мышечную стенку, так и на эндотелий. Предотвращая нарастание гипертонического или атеросклеротического ремоделирования, уменьшая периферическое сосудистое сопротивление, нормализуя пульсацию и улучшая вазоактивные свойства артерий, винпоцетин способствует улучшению и венозной гемодинамики, так как отток в венах осуществляется пассивно, в том числе за счет проталкивания крови. В венозных сосудах, с их невыраженной мышечной стенкой, вазоактивный эффект винпоцетина, вероятнее всего, преимущественно определяется воздействием на эндотелий, который, в отличие от артериального, обладает большей восприимчивостью к провоспалительным цитокинам, фактору некроза опухоли, липополисахаридам и запрограммирован на более высокий уровень адгезионного ответа [22,23]. В связи с этим противовоспалительный и антиоксидантный механизмы действия винпоцетина имеют крайне важное значение в отношении именно венозного эндотелия.
Важнейшим эффектом винпоцетина, способствующим увеличению микроциркуляции и перфузии ткани мозга, является улучшение реологических свойств крови путем снижения ее вязкости. В свою очередь, вязкость крови во многом зависит от агрегации и деформируемости эритроцитов, составляющих 99% всех ее клеток. Исследования показали, что винпоцетин, увеличивая уровень цГМФ в мембранах эритроцитов, оказывает положительное влияние на их деформируемость у больных с хроническими цереброваскулярными заболеваниями [20] и инсультом [24]. Помимо защиты нейронов в условиях ишемии и гипоксии за счет улучшения перфузии данный механизм уменьшает вероятность развития церебральных венозных тромбозов вследствие улучшения текучести крови и уменьшения выраженности застойных явлений, прежде всего, в венозных структурах мозга, что имеет важное значение для больных ГДЭ [25]. Уменьшение вероятности развития венозных тромбозов при лечении винпоцетином происходит также за счет противовоспалительного действия препарата на венозный эндотелий. Наряду с этим, винпоцетин предотвращает развитие и артериальных тромбозов путем снижения агрегации тромбоцитов, увеличения простациклин-тромбоксанового соотношения, что приводит к увеличению защитного атромбогенного потенциала сосудистой стенки, в частности, его антиагрегационного звена [26].
Таким образом, терапия винпоцетином у больных с хроническими цереброваскулярными заболевания оказывает системное действие и улучшает состояние всей сосудистой системы мозга, в том числе, ее венозного компонента. Препарат оказывает выраженное проти вовоспалительное действие на венозный эндотелий, улучшает его барьерную функцию, способствует сохранению структурной целостности венозных сосудов, улучшает их функциональное состояние. Следствием этого является улучшение реактивности вен и оттока венозной крови от мозга и, как следствие, уменьшение застойных явлений в сосудах мозга и выраженности хронической гипоксии у данной группы больных. Наряду с этим, важнейшими механизмами действия препарата при восстановлении неврологического дефицита, уже сформировавшегося в условиях хронического нарушения мозгового кровообращения, являются активация периферических бензодиазепиновых рецепторов [20] и влияние на нейропластические процессы путем стимуляции экспрессии BDNF [27].
Клиническая эффективность Кавинтона® установлена в двойных слепых, плацебо-контролируемых, рандомизированных исследованиях у больных с различными формами цереброваскулярной патологии: уменьшение частоты жалоб на головную боль, головокружение, шум в ушах, выраженности когнитивных, эмоциональных и астенических расстройств, статических нарушений, снижение риска падений, регресс речевых, двигательных, мнестических расстройств, улучшения качества жизни [24,27-33]. Кроме того, последние исследования [34] позволили выявить уникальный механизм действия винпоцетина, аналогичный феномену ишемического прекондиционирования (феномен прерывистой ишемии или метаболической адаптации) и позволяющий рассматривать препарат как средство профилактики развития церебральных катастроф у больных с хроническими нарушениями как артериальной, так и венозной гемодинамики различной степени выраженности.
Следует отметить хорошую переносимость и безопасность терапии винпоцетином у больных различных возрастных групп, а также у пациентов с сопутствующими заболеваниями. Препарат хорошо сочетается с другими лекарственными средствами, в том числе его можно комбинировать с другими венотоническими препаратами и антиоксидантами.
Появление на фармацевтическом рынке инновационной лекарственной формы винпоцетина (Кавин тон® Комфорте) в виде диспергируемых (растворимых в воде или слюне) таблеток способствовало повышению приверженности к терапии и ее эффективности у ряда пациентов. Одним из наиболее важных преимуществ данной формы является высокая биодоступность, обусловленная тем, что микросферы, на которые распадается таблетка во время растворения в полости рта, защищают находящееся в них действующее вещество при прохождении по желудочно-кишечному тракту до всасывания в тонком кишечнике. Также растворение Кавинтон® Комфорте в полости рта исключает травматизацию слизистой оболочки желудка и обеспечивает оптимальную скорость всасывания препарата.
Кавинтон® Комфорте является предпочтительной формой для больных с нарушениями глотания, возникшими в результате хронического нарушения мозгового кровообращения, а также больных с острым инсультом или инсультом в анамнезе, у которых прием обычных таблеток и желатиновых капсул сопряжен с определенными трудностями. Тошнота, когнитивные и психоэмоциональные расстройства, часто возникающие при данных состояниях, также являются причиной выбора новой формы. С учетом отсутствия у Кавинтона® Комфорте отрицательного воздействия на слизистую оболочку желудка он является препаратом выбора для больных с сопутствующими заболеваниями желудочнокишечного тракта. Кроме того, Кавинтон® Комфорте не требуется запивать водой, что делает его применение удобным и комфортным для работающих, занятых пациентов, а также для путешественников.
Немедикаментозные методы лечения больных с хроническими цереброваскулярными заболеваниями должны включать соблюдение растительной диеты, дозированную дыхательную гимнастику, отводящий массаж головы и шеи, физиотерапевтические процедуры (гальванический воротник, СМТ на шейно-воротниковую зону, теплые ножные ванны). Для пациентов с хроническими цереброваскулярными заболеваниями, обязательным компонентом которых являются венозные расстройства различной степени выраженности, необходима разработка индивидуальной программы реабилитации. В соответствии с консенсусом International Union of Phlebology, основные составляющие реабилитационной программы больных с хроническими венозными заболеваниями включают лечебную физкультуру, адаптированную физическую нагрузку, психологическую и социальную поддержку. Особое внимание уделено необходимости системного подхода к пациентам с венозными расстройствами, индивидуальной разработке алгоритма реабилитационных мероприятий для каждой группы пациентов с учетом выраженности венозной недостаточности, возраста, двигательной активности, сопутствующих заболеваний, состояния психического здоровья. Отмечена необходимость проведения рандомизированных контролированных исследований для оценки эффективности многочисленных реабилитационных протоколов.
Используемые источники
- Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Сосудистые заболевания головного мозга. М.: МЕДпресс-информ, 2015; 356. Машин В.В., Белова Л.А., Сапрыгина Л.В. и др. Факторы риска развития цереброваскулярных заболеваний по данным скрининга популяции средне- го возраста г. Ульяновска. Анналы клинической и экспериментальной нев- рологии 2014;1:4–9.
- Гнедовская Е.В., Кравченко М.А., Прокопович М.Е. и др. Распространенность факторов риска цереброваскулярных заболеваний у жителей мегаполиса в возрасте 40-59 лет (клинико-эпидемиологическое исследование). Анналы клинической и экспериментальной неврологии 2016;10(4):131-6.
- Кадыков А.С., Шахпаронова Н.В., Кадыков А.В. Гипертоническая энцефа- лопатия: узловые точки диагностики и лечения. Consilium medicum (Неврология) 2013;2:36-9.
- Henry-Feugeas MC, Koskas P. Cerebral vascular aging: extending the concept of pulse wave encephalopathy through capillaries to the cerebral veins. Chinese Med J 2012;125(7):1303-9.
- Белова Л.А., Машин В.В. Венозная дисциркуляция при хронических фор- мах цереброваскулярной патологии. Ульяновск: УлГУ; 2015: 132. Белова Л.А. Гипертоническая энцефалопатия: роль артерио-венозных взаи- моотношений в формировании ее клинико-патогенетических подтипов. Дис. ... доктора мед. наук. М; 2010: 258.
- Белова Л.А. Роль артериовенозных взаимоотношений в формировании кли- нико-патогенетических вариантов гипертонической энцефалопатии. Журнал неврологии и психиатрии им. С.С. Корсакова 2012;6:8–12.
- Куликов В.П., Дическул М.Л., Жестовская С.И. Информативность доппле- рографической оценки церебральной венозной реактивности при различ- ных патогенетических вариантах нарушения оттока крови от мозга. Клиническая физиология кровообращения 2013;3:17-21.
- Машин В.В., Кадыков А.С. Гипертоническая энцефалопатия. Клиника и патогенез. Ульяновск: УлГУ. 2002: 139.
- Никитин Ю.М. Алгоритм ультразвуковой диагностики поражений функ- ционально-морфологических уровней кровоснабжения головного мозга в неврологической практике. Журнал неврологии и психиатрии им. С.С. Корсакова. Инсульт (приложение) 2007;20:46-9.
- Singh RK, Bhoi SK, Kalita J, et al. Cerebral venous sinus thrombosis – present- ing feature of systemic lupus erythematosus. J Stroke Cerebrovasc Dis 2017; 26(3):518-22.
- Гачечиладзе Д.Г., Берулава Д.В., Антия Т.А. Особенности церебральной венозной гемодинамики при хронических нарушениях мозгового кровооб- ращения. Медицинская визуализация 2012;4:104-12.
- Virchow R. Gesammelte Abhandlungen zur Wissenshaftlichen Medicin. Fran - kfurt, 1856. Bonneville F. Imaging of cerebral venous thrombosis. Diagn Interv Imaging 2014; 95(12):1145-50.
- Carducci C, Colafati GS, Figà-Talamanca L, et al. Cerebral sinovenous thrombo- sis (CSVT) in children: what the pediatric radiologists need to know. Radiol Med 2016;121(5):329-41.
- Bouser M, Ross Russel R. Cerebral venous thrombosis. London: W.B. Saunders. 1997.
- Максимова М.Ю., Домашенко М.А., Брюхов В.В. Трудности диагностики тромбоза мозговых вен и венозных синусов. РМ. 2015;24:1476-82. Guo XB, Song LJ, Guan S. Endovascular treatment of chronic, recurrent headache secondary to chronic cerebral venous sinus thrombosis. J Stroke Cerebrovasc. Dis 2014;23(3):560-3.
- Guo XB, Song LJ, Guan S. Endovascular treatment of chronic, recurrent headache secondary to chronic cerebral venous sinus thrombosis. J Stroke Cerebrovasc Dis 2014;23(3):560-3.
- Alkuraishy HM, Al-Gareeb AI, Albuhadilly AK. Vinpocetine and pyritinol: a new model for blood rheological modulation in cerebrovascular disorders – a random- ized controlled clinical study. Biomed Res Int 2014;2014:324307.
- Lob HE, Schultz D, Marvar PJ, et al. Role of the NADPH oxidases in the sub- fornical organ in angiotensin II-induced hypertension. Hypertension 2013;61(2): 382–7.
- Kalogeris TJ, Kevil CG, Laroux F, et al. Differential monocyte adhesion and adhesion molecule expression in venous and arterial endothelial cells. Am J Physiol 1999;276:L9–19.
- Raffetto JD. Which dressings reduce inflammation and improve venous leg ulcer healing. Phlebology 2014;29(1 suppl):157–64.
- Белова Л.А., Машин В.В., Прошин А.Н. и др. Терапия препаратами кавин- тон для инфузий и кавинтон комфорте в остром и раннем восстановитель- ном периодах ишемического инсульта. Журнал неврологии и психиатрии им. С.С.Корсакова 2017;117(9):51-8
- Moiseev M, Mashin V, Belova L, et al. Clinical-imaging features of venous strokes. J Noninvasive Vasc Invest 2016;1:1-5.
- Танашян М.М., Бархатов Д.Ю., Родионова Ю.В., Коновалов Р.Н. Новые подходы к коррекции когнитивных нарушений у больных с хроническими цереброваскулярными заболеваниями. Нервные болезни 2010;2:7–12.
- Живолупов С.А., Самарцев И.Н., Яковлев Е.В. и др. Оценка эффективно- сти винпоцетина (Кавинтона Комфорте) в лечении головокружения у паци- ентов с дисциркуляторной энцефалопатией по уровню нейротрофического фактора мозга (BDNF) в плазме крови. Клин фармакол тер 2016;25(1):49- 54.
- Суслина З.А., Танашян М.М., Ионова В.Г. и др. Кавинтон в лечении боль- ных с ишемическими нарушениями мозгового кровообращения. РМЖ 2002;25:1170.
- Чуканова Е.И. Современные аспекты эпидемиологии и лечения хрониче- ской ишемии мозга на фоне артериальной гипертензии (результаты про- граммы КАЛИПСО). Неврология, нейропсихиатрия, психосоматика 2011; 3(1):38–42.
- Табеева Г.Р., Азимова Ю.Э. Мультимодальная стратегия нейропротекции при инсульте: результаты российской многоцентровой клинико-эпидемио- логической программы СОКОЛ (Сравнительная Оценка эффективности Кавинтона и Общепринятых схем Лечения пациентов, перенесших острое нарушение мозгового кровообращения). Журнал неврологии и психиатрии им. С.С. Корсакова 2012;12:20–30.
- Танашян М.В., Лагода О.В., Антонова К.В., Коновалов Р.Н. Хронические цереброваскулярные заболевания и метаболический синдром: подходы к патогенетической терапии когнитивных нарушений. Журнал неврологии и психиатрии им. С.С.Корсакова 2016;9:98–102.
- Вахнина Н.В., Милованова О.В. Неврологические расстройства у пациентов с артериальной гипертензией и их коррекция. Неврология, нейропсихиат- рия, психосоматика 2016;4:32-7.
- Zhang L, Yang L. Anti-inflammatory effects of vinpocetine in atherosclerosis and ischemic stroke: a review of the literature. Molecules 2014;20(1):335-47.
- Nivison-Smith L, Khoo P, Acosta ML, Kalloniatis M. Pre-treatment with vin- pocetine protects against retinal ischemia. Exp Eye Res 2017;154:126-38.
