Терапия липидснижающими препаратами у пациентов с семейной гиперхолестеринемией в реальной клинической практике
Оценить эффективность гиполипидемической терапии статинами у пациентов с гетерозиготной семейной гиперхолестеринемией (СГХС) в клинической практике.
Анализировали данные пациентов в возрасте старше 18 лет с гетерозиготной СГХС из Карельского регистра. СГХС диагностировали на основании критериев Dutch Lipid Clinic Network. Диагноз СГХС считали “определенным“, если общее количество баллов превышало 8, “вероятным“, если количество баллов составляло 6–8, и “возможным“, если оно составляло 3–5. Высокими дозами статинов считали 40-80 мг аторвастатина и 20-40 мг розувастатина, средними – 10-15 мг розувастатина и 20-30 мг аторвастатина, низкими – 10 мг аторвастатина, 5 мг розувастатина и 20-40 мг симвастатина.
В исследование были включены 191 пациент, в том числе 75 мужчин, в возрасте 50,0±1,1 лет с гетерозиготной СГХС. 124 (64,9%) пациента получали статины, в том числе 31 (25,0% от числа больных, принимавших эти препараты) – в высоких дозах, 25 (20,1%) – в средних и 68 (54,8%) – в низких. Даже у пациентов с СГХС, получавшихвысокие и средние дозы статинов, целевые уровни ХС ЛНП были достигнуты только в 19,4-20,0% случаев.
В обычной клинической практике терапия статинами, даже в высоких дозах, у пациентов с СГХС редко позволяет достичь целевых показателей липидного спектра крови, что обосновывает применение гипохолестеринемических препаратов с другим механизмом действия, в частности ингибиторов PСSK9.
Гиперхолестеринемия является одним из недооцененных факторов риска сердечно-сосудистых заболеваний в России, в том числе за счет моногенной семейной гиперхолестеринемии (СГХС). СГХС, характеризующаяся повышением уровня холестерина липопротеинов низкой плотности (ХС ЛНП), является самой распространенной генетической причиной раннего развития инфаркта миокарда и стенокардии [1-3]. От потенциально предотвратимых сердечных приступов ежегодно в мире погибают около 200 тыс больных с СГХС, а своевременно начатая гиполипидемическая терапия значительно продлевает жизнь таких пациентов [3-5].
Уровень ХС ЛНП в крови зависит от структуры и функции рецепторов ЛНП. ХС ЛНП удаляется из кровотока рецептор-опосредованным путем, а экспрессия новых рецепторов регулируется внутриклеточным содержанием холестерина по механизму отрицательной обратной связи. Фермент, регулирующий разрушение рецепторов – протеин конвертаза, относится к семейству сериновых протеаз и получил название пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK9). PCSK9 синтезируется в печени, секретируется в кровоток и далее образует комплекс с рецептором ЛНП на поверхности гепатоцита. После образования комплекса рецептора с ХС ЛНП и попадания его в клетку PCSK9 способствует разрушению рецептора. Синтез PCSK9 и рецепторов регулируется механизмами, которые пересекаются между собой, что может снижать эффективность статинов [6-8]. Понимание механизмов регуляции функции рецепторов ЛНП привело к созданию новых гиполипидемических препаратов, которые представляют собой моноклональные антитела, ингибирующие PCSK9. Подобные препараты снижают уровни ХС ЛНП на 50-70% независимо от наличия фоновой гиполипидемической терапии. Фармакологический контроль уровня PCSK9 "выключает" проконвертазу из процесса регуляции метаболизма ХС ЛНП и способствует дополнительному снижению уровня ХС ЛНП [9-11]. Высокая эффективность ингибиторов PCSK9, в том числе эволокумаба и алирокумаба, установлена в рандомизированных клинических исследованиях [11-15]. Эти препараты снижают уровни ХС ЛНП у всех пациентов, экспрессирующих ЛНП-рецепторы в печени, в том числе с гетерозиготной СГХС [16]. Ингибиторы PCSK9 применяют у больных, у которых терапия статинами в максимальных переносимых дозах не обеспечивает достижение целевых уровней ХС ЛНП.
Целью исследования было проанализировать эффективность гиполипидемической терапии статинами у пациентов с гетерозиготной СГХС в реальной клинической практике.
Материал и методы
Для оценки эффективности гиполипидемической терапии статинами анализировали данные пациентов в возрасте старше 18 лет с гетерозиготной СГХС из Карельского регистра. СГХС диагностировали на основании критериев Dutch Lipid Clinic Network (DLCN, Нидерланды). Диагноз СГХС считали "определенным", если общее количество баллов превышало 8, "вероятным", если количество баллов составляло 6–8, и "возможным", если оно составляло 3–5.
Высокими дозами статинов считали 40-80 мг/сут аторвастатина и 20-40 мг/сут розувастатина, средними дозами – 10-15 мг/сут розувастатина и 20-30 мг/сут аторвастатина, низкими дозами – 10 мг/сут аторвастатина, 5 мг/сут розувастатина и 20-40 мг/сут симвастатина.
Целевыми показателями липидного обмена считали уровень ХС ЛНП 1,8 ммоль/л, если пациент относился к группе очень высокого риска, и ХС ЛНП <2,6 ммоль/л, если пациент относился к группе высокого риска [16].
Для оценки приверженности пациентов к лечению использовали опросник Мориски-Грина [17]. Привер женными считали пациентов, ответивших на нижеследующие вопросы "нет" более 3 раз (набравшие более 3 баллов):- Забывали ли Вы когда-либо принимать препараты? (нет/да).
- Не относитесь ли Вы иногда невнимательно к часам приема лекарств? (нет/да).
- Не пропускаете ли Вы прием препаратов, если чувствуете себя хорошо? (нет/да).
- Если Вы чувствуете себя плохо после приема лекарств, не пропускаете ли Вы следующий прием? (нет/да).
Все пациенты подписывали информированное согласие на участие в исследовании. Исследование проводилось в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хель син ской декларации.
Статистическая обработка результатов проводилась с помощью программы Statistica 10.0.
Результаты
В исследование были включены 191 пациент, в том числе 75 мужчин, в среднем возрасте 50,0±1,1 лет с гетерозиготной СГХС. У 89 больных была диагностирована определенная СГХС, у 87 – вероятная, у 15 – возможная. У 109 пациентов был выполнен генетический анализ на базе ИЭМ г. Санкт-Петербурга (д.б.н. М.Ю. Мандельштам). Частота мутаций рецептора ЛНП у пациентов с определенной СГХС в Карелии составила 42,3%. Они характеризовались разнообразием, уникальностью и отсутствием эффекта основателя. Мутация R3500Q гена APOB не характерна для жителей Карелии, установлена низкая частота мутации FH – North Karelia (1:100). Были выявлены следующие новые мутации в рецепторе ЛНП: c.192del10/ins8 (p. (Ser65Glyfs*64), FsS44:D108X); c.195–196insT (p. (Val66Cysfs*64), FsV45: D108X); p. (Ser206Arg) (p.S185R, p.S206R); p. (Ser447Cys) (p. S426C, p.S447C); c.1686del8/ins (p. (Trp562Cysfs*5); FsW541:L547X; c.1686_1693delinsT); 2191delG (p. (Val731 Serfs*6), FsV710:V715X); c.313+2T>G; p.(Cys82Ser)(p.C82S, p.C61S); (p.(Trp620Ser), p.W620S , p.W599S).
124 (64,9%) пациента получали статины, в том числе 31 (25,0% от числа больных, принимавших эти препараты) – в высоких дозах, 25 (20,1%) – в средних дозах и 68 (54,8%) – в низких дозах. Высокие дозы статинов применяли у 20 (22,5%) из 89 больных с определенной СГХС, 10 (11,5%) из 87 пациентов с вероятной СГХС и 1 (6,7%) из 15 пациентов возможной СГХС.
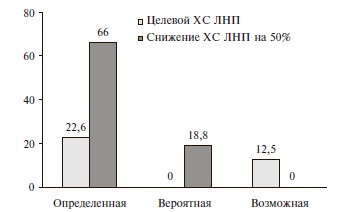
Даже у пациентов с СГХС, которым назначали высокие и средние дозы статинов, целевые уровни ХС ЛНП были достигнуты только в 19,4-20,0% случаев (табл. 1). Сопоставимость гиполипидемических эффектов высоких и средних доз статинов объяснялась тем, что у больных, которым эти препараты назначали в средних дозах, исходные уровни ХС ЛНП были ниже, а приверженность к лечению оказалась выше, чем у пациентов, принимавших высокие дозы (88% и 77%, соответственно). Ни один пациент с вероятной СГХС не достиг целевого уровня ХС ЛНП при лечении статинами, что было связано с отказом от их приема у пациентов молодого возраста и женщин с планируемой беременностью и приемом преимущественно низких доз препаратов. Уровень ХС ЛНП снизился по крайней мере на 50% у 18,8% пациентов этой группы (рис. 1). Среди пациентов с возможной СГХС целевой уровень ХС ЛНП был достигнут в 12,5% случаев, а среди пациентов с определенной СГХС – в 22,6%. У 66,0% больных с определенной СГХС удалось снизить уровень ХС ЛНП на 50%. Именно пациенты с определенной СГХС характеризовались наибольшей приверженностью к терапии и чаще получали высокие дозы статинов.
| Показатель | Всего | Не принимали статины | Принимали статины | Высокие дозы | Средние дозы | Низкие дозы |
|---|---|---|---|---|---|---|
| n (%) | 191 (100) | 67 (35,1) | 124 (64,9) | 31 (16,2) | 25 (13,1) | 68 (35,6) |
| Мужчины, n (%) | 75 (39,3) | 31 (46,3) | 44 (35,5) | 9 (29,0) | 10 (40,0) | 25 (36,8) |
| Возраст, лет | 50,0±1,1 | 41,9±1,9 | 54,8±2,0 | 54,6±2,0 | 56,7±2,6 | 54,2±1,8 |
| ОХС, ммоль/л | 9,4±0,1 | 8,9±0,2 | 9,7±0,3 | 10,2±0,3 | 9,9±0,4 | 9,4±0,2 |
| ЛНП, ммоль/л | 6,7±0,1 | 6,2±0,2 | 7,0±0,2 | 7,4±0,3 | 6,8±0,3 | 6,8±0,2 |
| Достижение целевых уровней ХС ЛНП, n (%) | 18 (9,4) | 0 (0,0) | 18 (14,5) | 6 (19,4) | 5 (20,0) | 7 (10,3) |
| Снижение исходного ХС ЛНП на 50%, n (%) | 64 (33,5) | 0 (0,0) | 64 (51,6) | 20 (64,5) | 15 (60,0) | 29 (42,6) |
У одной пациентки, не ответившей на прием статинов в высоких дозах, для лечения СГХС был использован ингибитор PCSK9 алирокумаб (Пралуэнт).
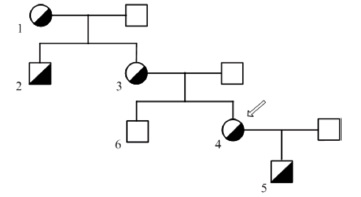
Пациентка, 36 лет, в течение 5 лет наблюдается с диагнозом: гетерозиготная СГХС, определенная форма, мутация 9-го экзона рецептора ЛНП c.1327 T>C (W443R[W422R]), описанная нами впервые ранее [18]. При первичном обращении были выявлены выраженные нарушения липидного спектра крови: общий холестерин сыворотки (ОХС) – 9,5-11 ммоль/л, ХС ЛНП – 7,0 ммоль/л, ХС липопротеинов высокой плотности (ЛВП) – 3,0 ммоль/л, триглицериды (ТГ) – 2,3 ммоль/л, липопротеин (а) – 0,08 г/л. Глюкоза – 4,1 ммоль/л, общий билирубин – 12 мкмоль/л, АЛТ – 23 МЕ/л, АСТ – 27 МЕ/л. При осмотре определялись ксантелазмы век. Липоидной дуги роговицы, ксантом сухожилий не выявлено. Индекс массы тела 27 кг/м2. Клинических проявлений ИБС нет. Данных за вторичную гиперлипидемию не выявлено. АД нормальное. Не курит.
 C (W443R [W422R]) в гене рецептора ЛНП">
C (W443R [W422R]) в гене рецептора ЛНП">
На рис. 2 представлена родословная пациентки. Отец умер от острого инфаркта миокарда в возрасте 64 лет, у матери, страдающей стенокардией II функционального класса с 52-летнего возраста, отмечается повышение уровня общего ХС до 10-12 ммоль/л. Выраженная дислипидемия выявлена также у бабушки, дяди пациентки и 4-летнего сына. У брата пациентки дислипидемии и мутации рецептора ЛНП обнаружено не было (табл. 2).
| Номер пациента | Возраст, лет | ОХС | ТГ | ЛВП | ЛНП |
|---|---|---|---|---|---|
| Примечание: номера пациентов, указанные в родословной. 4 - пробанд | |||||
| 4 | 31 | 9,5 | 2,3 | 3,0 | 7,0 |
| 1 | 81 | 12,0 | 1,3 | 1,2 | 10,0 |
| 2 | 51 | 7,4 | 1,7 | 1,3 | 4,2 |
| 3 | 53 | 12,4 | 1,3 | 1,3 | 8,4 |
| 5 | 4 | 7,7 | 5,8 | 1,1 | 2,6 |
| 6 | 27 | 4,2 | 0,7 | 1,4 | 2,4 |
Пациентке проводилась гиполипидемическая терапия розувастатином в дозе 40 мг/сут, которая привела к снижению уровней ОХС до 6,6 ммоль/л, ХС ЛНП – 4,1 ммоль/л и ТГ – 2,2 ммоль/л. Лечение розувастатином сопровождалось болями в мышцах нижних конечностей, поэтому его доза была снижена до 20 мг/сут, а к терапии добавлен эзетимиб в дозе 10 мг/сут. Тем не менее, комбинированная терапия оказалась недостаточно эффективной (табл. 3). В связи с этим был назначен алирокумаб в стартовой дозе 75 мг подкожно 1 раз в 2 недели в сочетании с розувастатином 20 мг/сут. После 3 инъекций препарата через 8 недель уровень ОХС снизился до 5,3 ммоль/л, ХС ЛНП – до 2,7 ммоль/л, ТГ – до 1,2 ммоль/л. Активность аминотрансфераз, сывороточные уровни мочевины и креатинина остаются нормальными (табл. 3).
| Показатели | Исходно | Розувастатин 40 мг | Розувастатин 20 мг | Розувастатин 20 мг + эзетимиб 10 мг | Розувастатин 20 мг + алирокумаб |
|---|---|---|---|---|---|
| ОХС, ммоль/л | 9,5 | 6,6 | 7,6 | 6,4 | 5,3 |
| ХС ЛНП, ммоль/л | 7,0 | 4,1 | 5,4 | 4,5 | 2,7 |
| ХС ЛВП, ммоль/л | 3,0 | 2,8 | 1,7 | 2,5 | 2,0 |
| ТГ, ммоль/л | 2,3 | 2,2 | 2,1 | 1,9 | 1,2 |
| АЛТ, МЕ/л | 15 | 18 | 14 | 15 | 15 |
| АСТ, МЕ/л | 18 | 19 | 16 | 17 | 16 |
| Креатинин, мкмоль/л | 72 | 98 | 92 | 96 | 84 |
| Глюкоза, ммоль/л | 5,4 | 5,9 | 5,6 | 5,3 | 5,8 |
Обсуждение
По данным нашего исследования, только у 22,6% пациентов с определенной СГХС удалось достичь целевых показателей липидного спектра крови на терапии статинами. Результаты ряда исследований также указывают на крайне неудовлетворительные результаты лечения пациентов с СГХС [19-22]. Следует отметить, что в рекомендациях Национального общества атеросклероза указаны более низкие целевые уровни ХС ЛНП для пациентов очень высокого сердечно-сосудистого риска (менее 1,5 ммоль/л). По нашим данным, такой уровень ХС ЛНП был достигнут только у 5,7% пациентов с определенной СГХС. Причинами таких результатов являются не только низкая приверженность пациентов к проводимой терапии, но и недостаточная эффективность статинов у пациентов с СГХС.
Важное значение в начале лечения пациентов с тяжелыми нарушениями липидного обмена имеет стратификация риска, в зависимости от которого определяют целевые уровни ХС ЛНП. Пациенты с СГХС относятся к категориям высокого и очень высокого сердечно-сосудистого риска при наличии сердечно-сосудистых заболеваний или стенозирующего (более 50%) атеросклероза любой локализации, а также сахарного диабета с поражением органов-мишеней, хронической болезни почек (скорость клубочковой фильтрации <30 мл/мин/1,73 м2) или 10-летнего риска смерти от сердечно-сосудистого заболевания (индекс SCORE) >10%. У пациентов очень высокого риска целевой уровень ЛНП составляет <1,5 ммоль/л, в то время как у пациентов высокого сердечно-сосудистого риска (вероятный или установленный диагноз семейной гиперхолестеринемии при отсутствии ИБС и других проявлений атеросклероза, сахарного диабета и хронической болезни почек) – <2,5 ммоль/л [23].
Одной из причин недостижения целевых показателей липидного спектра у пациентов с СГХС являются высокие уровни ОХС и ХС ЛНП, существующие с рождения. Было показано, что 27% пациентов с СГХС, принимающих максимальные дозы липидснижающих препаратов, не достигают целевого уровня ХС ЛНП [24]. Добавление эзетимиба приводит к дополнительному снижению уровня ХС ЛНП на 14-20% [25]. Однако наиболее мощной следует считать комбинацию статинов с ингибиторами PСSK9 [26]. Преодоление барьеров в лечении статинами – важный резерв в снижении остаточного риска развития сердечно-сосудистых заболеваний у пациентов с СГХС [1,9,21].
Нами на клиническом примере продемонстрирован мощный гиполипидемический эффект комбинации статина и алирокумаба, который превосходил таковой розувастатина в высокой дозе и комбинации средней дозы статина и эзетимиба. Терапия розувастатином 20 мг/сут привела к снижению уровня ХС ЛНП на 22,8% от исходного, комбинация розувастатина 20 мг/сут и эзетемиба 10 мг/сут – на 35,8%, в то время как при лечении алирокумабом в дозе 75 мг и розувастатином 20 мг/сут уровень ХС ЛНП уже через 8 недель снизился на 61,4% по сравнению с исходным. Кроме того, на фоне терапии значимо снизился уровень триглицеридов (с 2,3 до 1,2 ммоль/л). Следует отметить, что уровни ХС ЛНП оценивали в начале терапии (8-я неделя). При необходимости доза препарата может быть увеличена до 150 мг. Переносимость алирокумаба была хорошей. Побочных эффектов зарегистрировано не было.
Выраженная гиполипидемическая эффективность алирокумаба установлена в нескольких крупных рандомизированных клинических исследованиях [14,27-29]. В исследовании ODYSSEY MONO сравнивали монотерапию алирокумабом в дозе 75/150 мг каждые 2 нед или эзетимибом в дозе 10 мг/сут у пациентов с гиперлипидемией (ХС ЛНП 2,6–4,9 ммоль/л) и умеренным риском сердечно-сосудистых осложнений, не принимавших статины в течение как минимум 4 недель. К 24-й неделе лечения алирокумаб по гиполипидемической эффективности на 37% превосходил эзетимиб (p<0,0001). Хотя достоверное снижение уровня ХС ЛНП в обеих группах было достигнуто уже через 4 недели, тем не менее, снижения его концентрации по крайней мере на 50% по сравнению с исходной удалось достичь только у 3% пациентов, получавших эззетимиб, и 58% пациентов группы алирокумаба (p<0,0001) [30].
В исследованиях ODYSSEY COMBO I, ODYSSEY COMBO II, ODYSSEY OPTION I и ODYSSEY OPTION II доказана высокая гиполипидемическая эффективность алирокумаба при его добавлении к высоким и средним дозам статинов. При изучении различных схем лечения у пациентов, не достигших целевых уровней показателей липидного обмена на терапии статинами, показано преимущество добавления к лечению инъекций алирокумаба перед присоединением эзетимиба или дальнейшим повышением дозы статинов. На фоне лечения алирокумабом достоверно возрастало число пациентов, у которых достигались целевые уровни ХС ЛНП (<2,5 ммоль/л для пациентов с высоким риском и <1,8 ммоль/л для пациентов с очень высоким риском сердечно-сосудистых осложнений) [31].
Принципиально важны результаты исследования ODYSSEY LONG TERM, проходившего одновременно в 27 странах у 2341 пациента с высоким риском сердечно-сосудистых осложнений, получающих максимальные переносимые дозы статинов (± другая липидснижающая терапия) и не достигших целевого уровня ХС ЛНП (<1,8 ммоль/л). Лечение алирокумабом в дозе 150 мг 1 раз в 2 недели привело к достоверному снижению уровня ХС ЛНП на 61,0% от исходного, тогда как в группе плацебо этот показатель увеличился на 0,8% (p<0,0001) [28]. Целевой уровень ХС ЛНП <1,8 ммоль/л через 24 недели был достигнут у 79,3% пациентов группы алирокумаба и только у 8,0% больных группы плацебо (p<0,001). Гиполипидемическая эффективность алирокумаба не зависела от типа дислипидемии и была сопоставимой у больных с СГХС и другими формами дислипидемии. По данным post hoc анализа исследования ODYSSEY LONG TERM было показано, что терапия алирокумабом ассоциирована со снижением риска крупных сердечно-сосудистых событий (смерть от ИБС, фатальный и нефатальный инсульт, нефатальный инфаркт миокарда или нестабильная стенокардия, потребовавшая госпитализации) [28].
J. Robinson и соавт. изучили суммарную частоту побочных эффектов алирокумаба в 14 рандомизированных клинических исследованиях программы ODYSSEY [32]. Лечение алирокумабом не сопровождалось существенным повышением частоты нежела тельных эффектов по сравнению с контролем. Невро логические параметры, показатели высшей нервной деятельности, функции печени и почек были сопоставимы в группах сравнения. Частота нейромышечных расстройств на фоне лечения алирокумабом не увеличивалась. По данным ретроспективного анализа более чем у 3000 пациентов применение алирокумаба не сопровождалось увеличением риска развития сахарного диабета по сравнению с плацебо и эзетимибом [33].
В исследовании ODYSSEY OUTCOMES изучалось влияние терапии алирокумабом по сравнению с плацебо на частоту крупных сердечно-сосудистых событий (смерть от ИБС, нефатальный инфаркт миокарда, ишемический инсульт или нестабильная стенокардия, потребовавшая госпитализации) у 18924 пациентов с недавним (4-52 недели до рандомизации) острым коронарным синдромом. Все пациенты, включенные в исследование, получали максимальные переносимые дозы статинов, продолжительность лечения алирокумабом составила от 2 до 5 лет. Первичные результаты ODYSEEY OUTCOMES были доложены в марте 2018 г. на научной сессии Американской коллегии кардиологов, исследование достигло первичной конечной точки [34,35]. Таким образом, учитывая результаты исследования FOURIER, в котором изучался другой представитель этого класса препаратов эволокумаб, на сегодняшний день имеются убедительные доказательства влияния терапии ингибиторами PCSK9 на сердечно-сосудистые исходы [36].
Заключение
Результаты настоящего исследования свидетельствуют о том, что в обычной клинической практике частота достижения целевых показателей липидного спектра у больных СГХС на фоне применения стандартных схем гиполипидемической терапии составляет около 20%. Появление гиполипидемических препаратов с принципиально новым механизмом действия с доказанными эффективностью и безопасностью открывает новые возможности в лечении таких пациентов, относящихся к группе высокого сердечно-сосудистого риска.
Используемые источники
- Карпов Ю.А., Бойцов С.А., Кухарчук В.В. Заключение совета экспертов национального общества по изучению атеросклероза (НОА). Семейная гиперхолестеринемия в Российской Федерации: нерешенные проблемы диагностики и лечения. Атеросклероз и дислипидемии 2015; 2:5-16.
- Austin M, Zimmern R, Humphries S. Familial hypercholesterolemia and coro nary heart disease: a HuGE association review. Am J Epidemiol 2004;160:421-9.
- Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J 2013;34(45):3478-90.
- Hovingh GK, Davidson MH, Kastelein JJP. Diagnosis and treatment of familial hypercholesterolaemia. Europ Heart J 2013;34:962-71.
- Ray KK, Hovingh GK. Familial hypercholesterolaemia: a common disease. Europ Heart J 2016;37:1395-7.
- Кухарчук В.В., Бажан С.С. Протеин конвертаза субтилизин/кексин типа 9 (PCSK9) – регулятор экспрессии рецепторов липопротеинов низкой плотности. Атеросклероз и дислипидемии 2013;2:19-26
- Farnier M. PCSK9 inhibitors. Curr Opin Lipidol 2013;24(3):251-8.
- Lambert G, Sjouke B, Choque B, et al. The PCSK9 decade: thematic review series: new lipid and lipoprotein targets for the treatment of cardiometabolic diseases J Lipid Res 2012;53(12):2515-24.
- Сусеков А.В. Гиполипидемическая терапия: взгляд в прошлое и перспективы на ближайшее будущее. Кардиология 2016;6:81-6.
- Farnier M. An evaluation of alirocumab for the treatment of hypercholesterolemia. Expert Rev Cardiovasc Ther. 2015;13(12):1307-23.
- Kastelein JJ, Akdim F, Stroes ES, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with heterozygous familial hypercholesterolaemia. Eur Heart J 2015;36(43):2996-3003.
- Sullivan D, Scott R, Kim JB, et al. Effect of a monoclonal antibody to PCSK9 on low-density lipoprotein cholesterol levels in statin-intolerant patients: the GAUSS randomized trial. JAMA 2012;308(23):2497-506.
- Stroes E, Colquhoun D, et al. Anti-PCSK9 antibody effectively lowers cholesterol in patients with statin intolerance: the GAUSS-2 randomized, placebo-controlled phase 3 clinical trial of evolocumab. J Am Coll Cardiol 2014; 63(23):2541-8.
- Moriarty PM, Thompson PD, Cannon CP, et al. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: The ODYSSEY ALTERNATIVE randomized trial. J Clin Lipidol 2015;9(6):758-69.
- Bays H, Gaudet D, Weiss R, et al. Alirocumab as add-on to atorvastatin versus other lipid treatment strategies: ODYSSEY OPTIONS I randomized trial. J Clin Endocrinol Metab. 2015; 8:3140-8.
- 2016 ESC/EAS Guidelines for the management of dyslipidaemias. The Task Force for the Management of Dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Europ Heart J 2016;37(39):2999-3058.
- Morisky DE, Green LW, Levine DM. Concurrent and predictive validity of selfreported measure of medical adherence. Med Care 1986;24(1):67-73.
- Корнева В.А., Кузнецова Т.Ю., Муртазина Р.З. и др. Семейная гиперхолестеринемия, вызванная новой мутацией c.1327 T>C (p.W433R) в гене рецептора липопротеинов низкой плотности человека. Кардиология 2017;2:12-6.
- Huijgen R, Kindt I, Verhoeven SBJ, et al. Two years after molecular diagnosis of familial hypercholesterolemia: majority on cholesterol-lowering treatment but a minority reaches treatment goal. PLoS ONE 2010;5(2):e9220.
- Huijgen R, Vissers MN, et al. Familial hypercholesterolemia: current treatment and advances in management. Expert Rev Cardiovasc Ther 2008; 6:567-81.
- Pijlman AH, Huijgen R, Verhagen SN, et al. Evaluation of cholesterol lowering treatment of patients with familial hypercholesterolemia: a large cross-sectional study in the Netherlands. Atherosclerosis 2010;209:189-94.
- Galema-Boers JM, Lenzen MJ, van Domburg RT, et al. Predicting non-adherence in patients with familial hypercholesterolemia. Eur J Clin Pharmacol 2014; 70(4):391-7.
- Ежов M.B., Сергиенко И.В., Кухарчук B.B. и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации VI пересмотр. Атеросклероз и дислипидемии 2017;3:5-22.
- Law MR, Wald NJ, Rudnicka AR. Quantifying effect of statins on low density lipoprotein cholesterol, ischaemic heart disease, and stroke: systematic review and meta-analysis. BMJ 2003;326:1423.
- Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008;14:1431-43.
- Awan Z, Seidah NG, MacFadyen JC, et al. Rosuvastatin, proprotein convertase subtilisin/kexin type 9 concentrations, and LDL cholesterol response: the JUPITER trial. Clin Chem 2012;1:183-9.
- Gouni-Berthold I. The efficacy of anti-PCSK9 antibodies: Results from recent trials. Atherosclerosis Suppl 2017;30:9-18
- Robinson JG, Farnier M, Krempf M, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372:1489-99.
- Сорокин Е.В., Карпов Ю.А. Алирокумаб – представитель нового класса гиполипидемических препаратов. Атмосфера 2016;3:23-8.
- Roth EM, Taskinen MR, et al. Monotherapy with the PCSK9 inhibitor alirocumab versus ezetimibe in patients with hypercholesterolemia: results of a 24 week,double-blind, randomized Phase 3 trial. Int J Cardiol 2014; 176:55-61.
- Greig SL, Deeks ED. Alirocumab: a review in hypercholesterolaemia. Am J Cardiovasc Drugs 2016;16(2):141–52.
- Robinson J, Farnier M, Chaudhari U, et al. Adverse events in patients with LDLC <25 or 15 mg/dL on ≥2 consecutive visits in fourteen randomized trials of alirocumab. 17th Triennial Intern Symp on Atherosclerosis, 2015. Abstr. 295.
- Colhoun HM, Ginsberg HN, Robinson JG, et al. No effect of PCSK9 inhibitor alirocumab on the incidence of diabetes in a pooled analysis from 10 ODYSSEY Phase 3 studies. Eur Heart J 2016;37(39):2981-9.
- Schwartz GG, et al. Effect of alirocumab, a monoclonal antibody to PCSK9, on long-term cardiovascular outcomes following acute coronary syndromes: rationale and design of the ODYSSEY outcomes trial. Amer Heart J 2014;168:682-9.
- Steg G on behalf of ODYSSEY OUTCOMES Investigators. Oral presentation at 67th Scientific Sessions of American College of Cardiology (2018), Orlando. https://accscientificsession.acc.org/features/2018/03/video-sanofi-regeneron.
- Sabatine MS, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376(18):1713-22.
