Когнитивная дисфункция у пациентов с цереброваскулярными заболеваниями и нарушениями углеводного обмена
Оценка взаимосвязи когнитивных расстройств и нарушений углеводного обмена у пациентов с хронической цереброваскулярной патологией.
В исследование были включены 112 пациентов (средний возраст 64,0±8,3 лет) с ишемическими цереброваскулярными заболеваниями, которые были разделены на 2 группы: 48 пациентов с сахарным диабетом (СД) 2 типа и 64 пациента без СД 2 типа. Для изучения состояния высших корковых функций применяли следующие нейропсихологические тесты: Арнольда-Кольмана, две группы слов, Векслера, тест “свободных ассоциаций по заданному (семантическому) признаку”, таблицы Шульте, шкалы MMSE и МоСа, серийный счет “100-7”. Проводили также компьютерную ЭЭГ и определяли когнитивные вызванные потенциалы (ВП Р300).
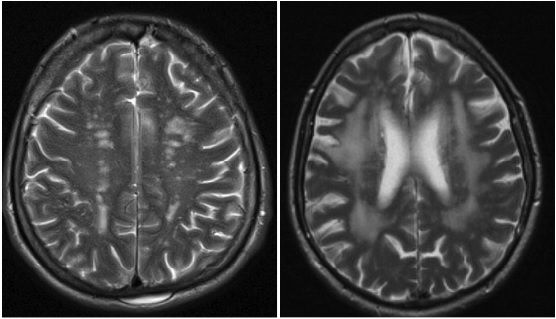
В обеих группах выявили снижение памяти и динамики психической деятельности, которые были более выраженными у пациентов с СД 2 типа. Частота снижения памяти составила 96% и 68% у больных с СД 2 типа и без СД 2 типа, соответственно. Средний балл по шкале MoCA был достоверно ниже у пациентов с СД 2 типа (p=0,04), среди которых была выше доля больных с умеренными и выраженными когнитивными нарушениями (общий балл по шкале MoCA 23-19) (p=0,02). Кроме того, у больных СД 2 типа достоверно чаще встречались диффуз- ные изменения вещества головного мозга в виде лейкоареоза и расширения ликворных пространств с признаками атрофии
СД 2 типа у больных с сосудистой патологией головного мозга ассоциируется с более выраженными когнитивными расстройствами и более частым диффузным поражением белого вещества головного мозга.
Проблема когнитивных расстройств сосудистого генеза в последнее время приобрела особую актуальность в связи со все большей “интеллектуализацией” современного общества [1]. Когнитивная дисфункция нарушает социальную адаптацию пациентов, приводя не только к ухудшению качества жизни, но и к снижению адекватного контроля за течением заболевания (как сосудистой патологии головного мозга, так и коморбидных состояний – артериальной гипертонии, атеросклероза, сахарного диабета [СД] 2 типа), что чревато развитием осложнений, приводящих к тяжелой инвалидизации и смерти.
Попытки описать нарушения когнитивных функций при СД предпринимались с 1922 г., а термин “диабетическая энцефалопатия” был предложен E. Reske-Nielsen в 1965 г. [2]. Под ним обычно понимают церебральное осложнение СД, характеризующееся прогрессирующими когнитивными расстройствами. Условно выделяют первичную диабетическую энцефалопатию, предположительно связанную с нарушением действия инсулина и гипергликемией, и вторичную энцефалопатию, возникающую в результате присоединившихся макрососудистых осложнений [3,4].
Согласно морфологическим исследованиям, в основе поражения головного мозга у больных с СД 2 типа лежат макро- и микроангиопатии с вовлечением экстракраниальных и церебральных артерий крупного и мелкого калибра и нарушением микроциркуляции. Дальнейшее прогрессирование заболевания обусловливает распространение патологического процесса на вещество мозга с развитием очагового и диффузного поражения и формированием субклинических ишемических нарушений: “немых” инфарктов мозга, подкоркового поражения белого вещества с развитием лейкоареоза, расширения желудочковой системы и субарахноидальных пространств мозга. При этом очаговые изменения вещества головного мозга чаще всего локализуются в таламусе, внутренней капсуле и варолиевом мосту [5,6].
Вышеуказанные изменения вещества мозга являются патоморфологической основой возникновения когнитивных нарушений, которые нельзя объяснить лишь пожилым возрастом и другими зависимыми от возраста процессами. Обсуждается множество гипотез влияния хронической гипергликемии на структуру и функцию головного мозга, включая сосудистые нарушения, дегенерацию нейронов, изменение глиального метаболизма, синаптической пластичности нейронов гиппокампа, нарушение обмена инсулина в мозге. Много общего найдено в механизмах формирования когнитивных расстройств в условиях нарушения углеводного обмена и в процессе естественного старения [7].
Показано, что молодые люди с нарушениями углеводного обмена хуже выполняют тесты на логическую и ассоциативную память независимо от уровня глюкозы крови в момент тестирования. У 20% пациентов с СД 2 типа отмечают снижение показателей по данным нейропсихологического тестирования по Mini Mental Scale (MMSE), а сопутствующая депрессия является серьезной и частой проблемой когнитивной дисфункции [8]. В целом отклонения от возрастной нормы обнаруживают у 20–40% пациентов с СД 2 типа, но в большинстве случаев когнитивный дефект остается легким или умеренным, хотя и способен негативно влиять на качество жизни пациентов. Кроме того, когнитивные расстройства у пожилых больных СД 2 типа ассоциировались с увеличением риска смерти на 20% в течение 2 лет [9,10].
Среди расстройств когнитивных функций у пациентов с СД 2 типа преобладают нейродинамические и регуляторные нарушения, которые выявляют с помощью тестов на внимание, скорость психомоторных реакций, речевую активность, способность к переключению. В то же время функция памяти часто остается более сохранной или страдает вторично по отношению к вниманию и регуляции психической деятельности. Тем не менее, в некоторых исследованиях отмечен дефект, выходящий за пределы нейродинамических и регуляторных когнитивных нарушений и связанный, например, с первичным расстройством памяти или зрительно-пространственных функций [11].
Уровень гликированного гемоглобина (HbA1c) коррелировал с выраженностью когнитивной дисфункции. Более того, при успешном контроле гипергликемии выраженность когнитивных нарушений может уменшится, по крайней мере, частично [12]. Таким образом, развитие когнитивной дисфункции может быть индикатором неадекватной терапии СД 2 типа и, в свою очередь, способствовать снижению приверженности к лечению. Быстрое увеличение уровня глюкозы (в том числе после приема пищи) у больных СД 2 типа сопровождалось снижением внимания и других нейродинамических функций. Острая гипогликемия может снижать регионарную перфузию мозга и нарушать осмотическое равновесие в церебральных нейронах. Нарушение перфузии глубинных отделов мозга приводит к снижению резерва ауторегуляции, т.е. к ослаблению вазодилатации в ответ на ишемию, что способствует развитию инсульта, который в 4–7 раз чаще встречается у больных СД 2 типа даже при отсутствии гемодинамически значимого стеноза экстракраниальных артерий [13].
Эффекты хронической гипергликемии на когнитивную функцию могут быть более выраженными и опосредованы образованием конечных продуктов гликирования, активацией альтернативных метаболических путей (полиолового и гексозного), активацией протеинкиназы С и воспалительных процессов в мозге (подтверждается усилением продукции провоспалительных цитокинов). В целом гипергликемия, безусловно, играет роль в развитии когнитивной дисфункции, но непосредственно с ней удается связать лишь умеренный, преимущественно нейродинамический когнитивный дефицит. По-видимому, большее значение в ухудшении когнитивной функции имеет цереброваскулярная или нейродегенеративная патология, развитие которое ускоряется под действием метаболических расстройств, характерных для СД 2 типа, а также гипогликемических эпизодов.
После установления диагноза СД 2 типа пациентам приходится значительно изменять привычный образ жизни: самостоятельно контролировать гликемию, принимать лекарственные препараты, вносить ограничения в диету, расширять физическую нагрузку, чаще посещать врача для коррекции лечения и обследования. Когнитивные нарушения могут оказать существенное влияние на адекватный контроль гликемии и в некоторых случаях снизить приверженность к лечению.
Целью работы была оценка взаимосвязи когнитивных расстройств и нарушений углеводного обмена у пациентов с хронической цереброваскулярной патологией.
Материал и методы
В одномоментное когортное исследование были включены 112 пациентов с ишемическими цереброваскулярными заболеваниями, которые были разделены на две группы: 48 пациентов с СД 2 типа и 64 пациента без СД 2 типа. Среди обследованных было 46 (41%) мужчин и 66 (59%) женщин, средний возраст пациентов составил 64,0±8,3 [58–72] лет. 72 (64%) больных страдали дисциркуляторной энцефалопатией (ДЭ), а 40 (36%) – перенесли нарушения мозгового кровообращения (НМК) по ишемическому типу (более 6 мес назад). Средняя продолжительность СД 2 типа составила 9±7 лет.
У всех пациентов определяли содержание глюкозы в крови и гликированного гемоглобина иммунотурбодиметрическим методом. Гликемию измеряли 4 раза на второй день после госпитализации – натощак, а также перед основными приемами пищи и перед сном. После оценки показателей углеводного обмена при необходимости проводилась коррекция фармакотерапии.
Для оценки состояния высших корковых функций применяли следующие нейропсихологические тесты: Арнольда-Кольмана, две группы слов, Векслера, тест “свободных ассоциаций по заданному (семантическому) признаку”, таблицы Шульте, шкалы MMSE и МоСа, серийный счет “100-7”. Нейропсихологическое обследование осуществлялось с использованием Госпитальной шкалы тревоги и депрессии (Hospital Anxiety and Depression Scale – HADS, Zigmond A.S, 1983) и Монреальской шкалы оценки когнитивных функций (Montreal cognitive assessment – MoCA, ZiadNasreddine, 1996). Из нейрофизиологических методик применяли компьютерную ЭЭГ и когнитивные вызванные потенциалы (ВП Р300).
Статистическая обработка данных проводилась с применением программ Microsoft Excel, а также пакета компьютерных прикладных программ Statistica, версия 6.0 (StatSoft, 2003). Использованы общепринятые критерии различий с определением статистической достоверности при р<0,05
Результаты
В обеих группах пациентов выявили снижение памяти и динамики психической деятельности, однако у больных с сопутствующим СД 2 типа эти изменения были более выраженными. У пациентов с СД 2 типа снижение памяти встречалось чаще (96%), чем у пациентов без СД (68%). Кроме того, у больных СД 2 типа была выше частота нарушений памяти средней и тяжелой степени (79% и 57% в двух группах, соответственно). Наиболее выраженные нарушения были отмечены в субтесте запоминания трех историй и ассоциативном запоминании. Трудности запоминания проявлялись в невозможности воспроизведения отдельно каждой группы слов после нескольких предъявлений.
У пациентов с СД 2 типа чаще встречались нарушения мыслительной деятельности: выполнение серийного счета было нарушено у 92% и 56% пациентов двух групп, соответственно, а изменение ассоциативной деятельности выявили у 17% и 10% пациентов. Нарушения в счетных операциях проявлялись в выраженном снижении темпа деятельности и большом количестве ошибок. При назывании слов на заданную букву была резко снижена продуктивность называния (7 и менее слов; норма – 11), наблюдалось большое количество инертных повторов и замедленность по типу брадифрении. Резкое снижение темпа проявилось при поиске чисел по таблицам Шульте. Среднее время поиска составило 63 с, достигая в отдельных случаях двух и более минут.
Нейропсихологическое тестирование показало, что у пациентов с цереброваскулярными заболеваниями и СД 2 типа средний балл по шкале MoCA был достоверно ниже, чем у пациентов без СД (p=0,04). При этом в группе больных СД 2 типа преобладали пациенты с умеренными и выраженными когнитивными нарушениями (общий балл по шкале MoCA 23-19) (p=0,02) (табл. 1). При детализации результатов тестирования по шкале MoCA в целом у обследованных пациентов преобладали изменения исполнительной функции (черчение ломаной линии), оптико-пространственные нарушения и ухудшение отстроченного воспроизведения слов (слухоречевая память). При этом нарушения слухоречевой памяти чаще отмечались у больных СД 2 типа.
| Без СД 2 типа (n=64) | СД 2 типа (n=48) | Примечание: *p<0,05 между группами |
|---|---|---|
| Балл по шкале MoCA, n (%) | ||
| ≥26 (норма) | 24(38) | 10(20) |
| 24-25 | 22(34) | 12(25) |
| 23-19 | 14(22) | 24(50)* |
| 18 и менее | 4(6) | 2(5) |
| Средний балл | 24,2±2,9 | 22,7±2,9* |
В группе пациентов с СД 2 типа чаще встречались психо-эмоциональные нарушения в виде дисфории, раздражительности, демонстративности поведения, снижения уровня внимания и более быстрого истощения при выполнении задачи.
Доля пациентов с клинически выраженной депрессией (балл по шкале HADS >11) среди больных СД 2 типа достоверно превышала таковую среди пациентов без СД. При этом средний балл по шкале HADS в первой группе был значительно больше, чем во второй (p<0,05) (табл. 2).
| Без СД 2 типа (n=64) | СД 2 типа (n=48) | |
|---|---|---|
| Примечание: *p<0,05 между группами | ||
| Балл по шкале ≥11, n (%) | ||
| HADS тревога | 10(16) | 9(19) |
| HADS депрессия | 2(3) | 9(19)* |
| Средний балл | ||
| HADS тревога | 6,8±3,7 | 6,8±4,0 |
| HADS депрессия | 6,4±3,6 | 7,5±3,7* |
У пациентов с СД 2 типа средний уровень HbA1c составил 7,56±2,13% (5,6–14,7%). У 7 больных этой группы в течение суток определялись значения глюкозы крови <3,9 ммоль/л. У 4 из них снижение гликемии сопровождалось слабостью и головокружением, а у 3 – было бессимптомным (у 2 из них имелись нарушения речи). Гипогликемические состояния в основном развивались у больных, получавших препараты сульфонилмочевины и инсулин, и ассоциировались с более длительным течением СД 2 типа (11,3 против 7,9 лет у пациентов без эпизодов гипогликемии; р=0,026).
При магнитно-резонансной томографии у всех обследованных пациентов обнаружены признаки сосудистого поражения головного мозга (рис. 1). У больных СД 2 типа достоверно чаще встречались более выраженные изменения в виде лейкоареоза и расширения ликворных пространств с признаками атрофии головного мозга (рис. 2).
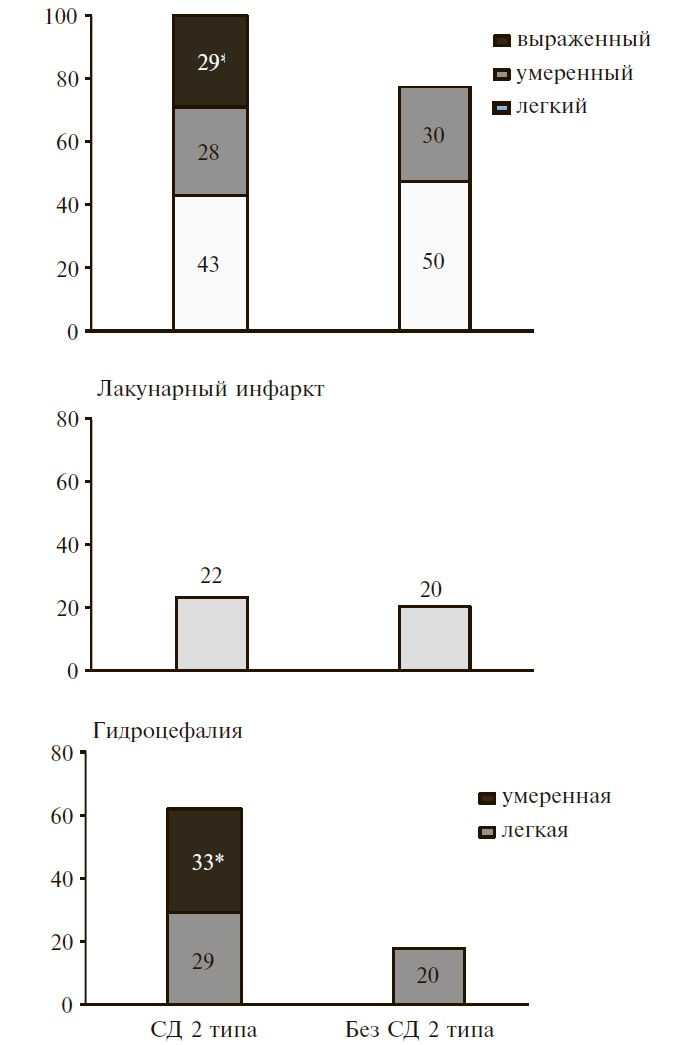
Выраженные изменения ЭЭГ в виде замедлении α-ритма с признаками энцефалопатии, наличия диффузной и/или очаговой медленной активности, высокого индекса пароксизмальной активности, эпилептиформных паттернов в исследуемых группах отмечались не часто (табл. 3). У пациентов без СД 2 типа выраженные изменения функциональной активности головного мозга были выявлены только у 5% пациентов, перенесших НМК. Напротив, выраженные изменения ЭЭГ определялись у 17% пациентов с СД 2 типа, среди которых преобладали больные с ДЭ.
| ДЭ + СД 2 типа | ДЭ без СД 2 типа | Последствия НМК + СД 2 типа | Последствия НМК без СД 2 типа | |
|---|---|---|---|---|
| Примечание: ДЭ – дисциркуляторная энцефалопатия. *p<0,05 при сравнении подгрупп пациентов с ДЭ и последствими НМК среди больных СД 2 типа; #p<0,05 при сравнении подгрупп пациентов с ДЭ и последствиями НМК среди больных без СД 2 типа | ||||
| Замедленный α-ритм (≤8 Гц) | 22 | 0 | 11 | 10 |
| Низкоамплитудный α-ритм (≤30 мкВ) | 30 | 20 | 11 | 11 |
| Межполушарная асимметрия α-ритма | 16* | 0* | 37* | 44 |
| Очаговая медленная активность | 0 | 0 | 4 | 11 |
| Локальная эпилептиформная активность | 5 | 0 | 4 | 11 |
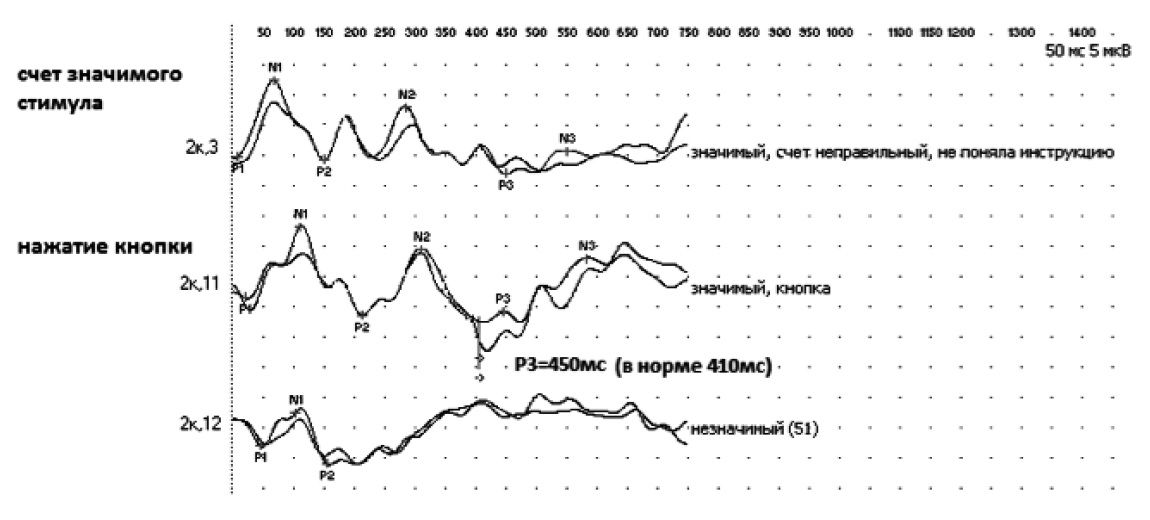
При анализе параметров когнитивных вызванных потенциалов (Р300) более выраженные изменения выявлены у больных с СД 2 типа в виде затруднений в распознавании редкого стимула, значимого удлинения времени возникновения пика Р300 и снижения его амплитуды (рис. 3). У пациентов без СД 2 типа более выраженное удлинение латентности пика Р300 отмечалось при ДЭ (p<0,05), тогда как при СД 2 типа таких различий получено не было. Не исключено, что СД 2 типа сам по себе влияет на эти показатели, что возможно обусловлено нарастанием микроангиопатии и диффузного поражения белого вещества головного мозга на фоне диабета.
Обсуждение
Снижение когнитивных функций и способности к самообслуживанию представляет опасность для больных СД 2 типа, так как не позволяет им своевременно оценить симптомы гипогликемии и самостоятельно ее купировать, а при афазии – сообщить о своих ощущениях окружающим. Большее значение в развитии когнитивных расстройств при нарушении углеводного обмена имеет поражение мелких мозговых сосудов, которое вызывает развитие диффузной патологии белого вещества больших полушарий, множественных лакунарных очагов и микроинфарктов. Нами было показано, что у больных с СД 2 типа имеются более выраженные диффузные и очаговые изменения вещества мозга по данным нейровизуализационных исследований [14,15]. При этом диффузное поражение белого вещества головного мозга, неадекватная компенсация углеводного обмена, инсулинорезистентность и гиперурикемия у пациентов с цереброваскулярными заболеваниями и СД 2 типа ассоциировались с более выраженными когнитивными нарушениями.
Расстройства памяти у пациентов с СД 2 типа были связаны преимущественно с недостаточностью самостоятельного воспроизведения при сохранной способности к запоминанию и хранению информации, что характерно для мнестических расстройств при патологии лобно-подкорковых структур. В ранее опубликованных исследованиях у пациентов с хроническими цереброваскулярными заболеваниями и СД 2 типа были выявлены достаточно выраженные эмоциональные нарушения: у большинства пациентов определялись высокий уровень личностной тревоги и легкие или умеренные депрессивные расстройства. Средний уровень депрессии по шкале Бэка соответствовал легкой депрессии (13,8±7,6), уровень личностной тревоги (в тесте Спилбергера) был высоким (48,3±7,7), а уровень реактивной (ситуативной) тревоги был умеренным (37,0±7,1) [16]. В нашем исследовании в группе пациентов с цереброваскулярными заболеваниями и СД 2 типа преобладали психоэмоциональные нарушения в виде дисфории, раздражительности, демонстративности поведения, снижения уровня внимания и более быстрого истощения при выполнении задачи, а также клинически выраженной депрессией (балл по шкале HADS>11). Средний балл по шкале HADS у пациентов с СД 2 типа был выше, чем у больных без СД 2 типа. Результаты нашего исследования соответствуют данным литературы. Так, в предыдущих исследованиях было показано, что депрессия часто встречается (14,4-32,5%) у больных СД (в два раза чаще, чем у людей, не страдающих СД). При этом депрессия ассоциируется с ухудшением течения и повышением риска развития хронических осложнений СД, снижением приверженности к лечению, а также качества жизни [16,17].
Снижение уровня глюкозы в крови также играет важную роль в развитии нарушений функции ЦНС [18]. Гипогликемия до 1,5–2,5 ммоль/л сопровождается нарушением сознания, вплоть до комы. При уровне гликемии <2 ммоль/л глюкоза в веществе мозга практически не определяется. При гипогликемическом эпизоде клетки мозга лишаются необходимых питательных веществ, что существенно повышает риск развития когнитивных нарушений: при однократном эпизоде – в 1,4 раза, а при повторных – в 2,4 раза. По-видимому, при недостаточном поступлении глюкозы головной мозг начинает использовать эндогенный гликоген [19]. Неблагоприятное действие гипогликемии на функцию головного мозга может быть связано с гибелью нейронов, особенно в нескольких наиболее уязвимых зонах, таких как гиппокамп. Повреждающее действие гипогликемии, по-видимому, более выражено у пожилых людей, которые в силу более низкого когнитивного резерва и низкой пластичности в меньшей степени способны нивелировать последствия повреждения. У молодых пациентов с СД 1 типа, несмотря на высокую частоту гипогликемических эпизодов, существенного когнитивного снижения даже при многолетнем наблюдении не отмечено.
Анализ нейровизуализационных “портретов” пациентов с различными проявлениями цереброваскулярных заболеваний на фоне метаболического синдрома показал более чем двукратное увеличение по сравнению с пациентами без метаболического синдрома доли трех основных видов субклинических поражений мозга: “немых” инфарктов мозга (очаг диаметром 3 мм и более), подкорковых поражений белого вещества с развитием лейкоареоза, расширения желудочковой системы и субарахноидальных пространств мозга. У пациентов с СД 2 типа более выражен лейкоареоз, а также чаще встречались лакунарные инфаркты. Данный факт свидетельствует о негативном влиянии хронической гипергликемии на состояние белого вещества полушарий большого мозга, что реализуется через механизмы как непосредственного повреждения вещества мозга, так и через поражение сосудов микроциркуляторного русла. Нейровизуализационная картина инфаркта головного мозга была представлена преимущественно множественными очагами, которые характеризуются сочетанием свежего или организующегося обширного либо среднего инфаркта с одним или несколькими организованными лакунарными, а также средними и малыми поверхностными инфарктами. При этом в случае множественных инфарктов чаще определяются один или несколько организованных лакунарных инфарктов, которые не сопровождались, в том числе анамнестически, развитием очаговой неврологической симптоматики. В связи с высокой частотой организованных бессимптомных малых глубинных инфарктов их можно рассматривать в качестве предикторов развития тяжелого ишемического инсульта.
Более выраженные когнитивные нарушения у пациентов с сосудистой патологией головного мозга на фоне СД 2 типа подтверждаются изменением когнитивных вызванных потенциалов (Р300): удлинением латентности и снижением амплитуды пика Р300, нарушением распознавания стимула. Эти нейрофизиологические данные ассоциируются с гипергликемией, неадекватным контролем гликемии, инсулинорезистентностью, диффузным поражением белого вещества головного мозга.
Проведенное исследование показало не только общность изменений клинических и нейрофизиологических параметров и взаимосвязь их с показателями метаболизма, но и возможность диагностики ранних, субклинических проявлений нарушения функциональной активности нервной системы у больных с сосудистой патологией на фоне нарушений углеводного обмена. Нейрофизиологические методы позволяют выявить изменения когнитивной сферы, которые не удается диагностировать при обычном обследовании. Это особенно важно на ранних стадиях заболевания для уточнения диагноза, коррекции проводимой терапии и определения прогноза заболевания.
Одним из девизов “Дня борьбы с инсультом”, проводимого ежегодно под эгидой ВОЗ, было “предотвратить инсульт и деменцию”. В связи с этим раннее выявление и лечение пациентов с повышенным риском развития когнитивных расстройств сосудистого генеза имеет важное практическое значение.
Используемые источники
- Гуторова Д.А., Васенина Е.Е., Левин О.С. Скрининг когнитивных наруше- ний у лиц пожилого и старческого возраста с помощью шкалы 3-КТ. Журнал неврологии и психиатрии им. С.С. Корсакова 2016;116(6):35-40.
- Mijnhout GS, Scheltens P, Diamant M, et al. Diabetic encephalopathy: a concept in need of a definition. Diabetologia 2006;49:1447–8.
- Чугунова Л.А., Семенова И.В., Орлов Ю.Ю., Шестакова М.В. Сахарный диабет и когнитивные нарушения. Сахарный диабет 2008;38(1):61-8.
- Reske-Nielsen E, Lundbaek K, Rafeisen Q.J. Pathological changes in the cerebral and peripheral nervous system of young long-term diabetics. Diabetic encephalopathy. Diabetologia 1965;1:233-41.
- Van Harten B, de Leeuw F, Weinstein HC, et al. Brain imaging in patients with diabetes: a systematic review. Diabetes Care 2006;29:2539–48.
- Танашян М.М., Лагода О.В., Антонова К.В. Сосудистые заболевания головного мозга и метаболический синдром. Методические рекомендации. М., 2011.
- Strachan MWJ, Reynolds RM, Frier BM. The relationship between type 2 dia- betes and dementia. Brit Med Bull 2008;88:131–46.
- Biessels GJ, van der Heide LP, Kamal A, et al. Ageing and diabetes: implications for brain function. Eur J Pharmacol 2002;41(1-2):1-14.
- Kalaria RN. Diabetes, microvascular pathology and Alzheimer disease. Nature Rev Neurol 2009;5:305–6.
- Luchsinger JA, Tang MX, Stern Y, et al. Diabetes mellitus and risk of dementia in amultiethnic cohort. Am J Epidemiol 2001;154:635–41.
- Котов С.В., Рудакова И.Г., Исакова Е.В. Энцефалопатия у больных сахар- ным диабетом II типа. Клиника и лечение. Неврологический журнал 2001;3:35.
- Yaffe K, Blackwell T. Glycosylated hemoglobin level and development of mild cognitive impairment or dementia in older women. J Nutr Health Aging 2006;10:293–5.
- Cosentino F, Battista R, Scuteri A, et a l. Impact of fasting glycemia and region- al cerebral perfusion in diabetic subjects. Stroke 2009;40:306.
- Танашян М.М., Лагода О.В., Орлов С.В. и соавт. Сосудистые заболевания головного мозга и метаболический синдром. Терапевтический архив 2013;85(10):34-42.
- Танашян М.М., Лагода О.В., Антонова К.В. Хронические цереброваскуляр- ные заболевания на фоне метаболического синдрома: новые подходы к лечению. Журнал неврологии и психиатрии им. C.C. Корсакова 2012; 112(11):21-6.
- Сосина В.Б. Когнитивные нарушения у больных сахарным диабетом: Автореф. дисс. ... канд. мед. наук. М., 2010.
- Чацкая А.В. Вегетативные и когнитивные функции при цереброваскуляр- ных заболеваниях на фоне метаболического синдрома (клинико-нейрофи- зиологическое исследование). Автореф. дисс. ... канд. мед. наук. М., 2016.
- Whitmer RA, Karter AJ, Yaffe K, et al. Hypoglycemic episodes and risk of dementia in older patients with type 2 diabetes mellitus. JAMA 2009;301: 1565–72.
- Антонова К.В., Танашян М.М., Романцова Т.И. и др. Показатели углеводного обмена и риск гипогликемии у больных сахарным диабетом 2-го типа и ишемическими цереброваскулярными заболеваниями. Медицинский совет 2017;5: 148-54.
