Распространенность и клинико-лабораторные особенности сахарного диабета 2 типа у больных шизофренией
Сравнить распространенность сахарного диабета 2 типа (СД), концентрацию инсулина, С-пептида и показатели инсулинорезистентности у больных шизофренией и психически здоровых лиц.
В исследование были включены 146 пациентов с шизофренией и 602 пациентов, не страдавших психическими заболеваниями и не получавших препараты, влияющие на углеводный обмен. У всех пациентов определяли гликемию, а при наличии нарушения гликемии натощак проводили пероральную пробу с нагрузкой глюкозой 75 г. У пациентов с СД определяли концентрации С-пептида и инсулина в плазме крови и рассчитывали индексы инсулинорезистентности HOMA-IR и CARO.
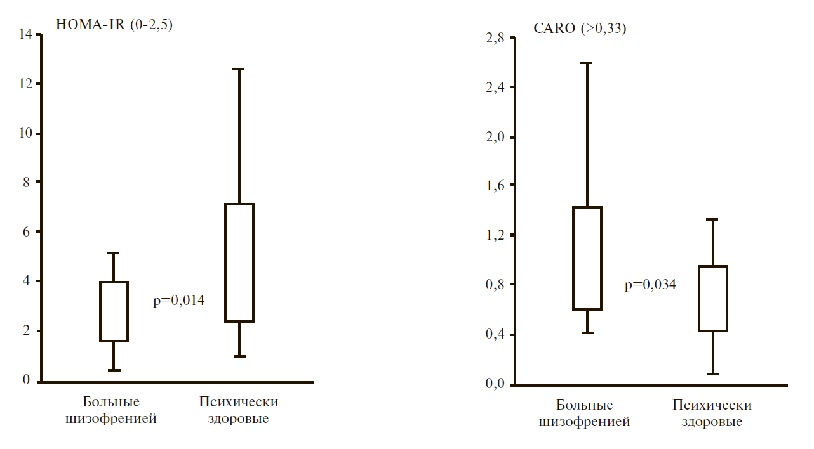
У пациентов с шизофренией и психически здоровых людей частота СД 2 типа и нарушений углеводного обмена достоверно не отличалась, в то время как у женщин с шизофренией нарушения толерантности к глюкозе и углеводного обмена встречались значительно чаще, чем у пациенток контрольной группы (р<0,001 и р=0,003, соответственно). Атипичные нейролептики получали только 6 из 20 пациентов с шизофренией и нарушением углеводного обмена. Нарушения углеводного обмена у пациентов с шизофренией по сравнению с контролем ассоциировались с более низкими концентрациями инсулина и С-пептида и менее выраженной инсулинорезистентностью.
У пациентов у шизофренией более важное значение в развитии нарушений углеводного обмена имеет гипоинсулинемия, а не инсулинорезистентность.
Обращение к теме сахарного диабета (СД) у больных шизофренией, позволяющее анализировать эндокринные расстройства с учетом состояния высших регуляторных механизмов центральной нервной системы, – не ново. Еще в 1879 г. H. Maudsley описал нарушения метаболизма глюкозы при шизофрении [1], а в 1919 г., т.е. еще задолго до появления психотропных препаратов, F. Kooy отметил более частое развитие гипергликемии у пациентов психоневрологической клиники по сравнению с таковым у психически здоровых лиц [2]. В последние годы расстройства углеводного обмена при шизофрении преимущественно связывают с инсулинорезистентностью и сопряженными с ней метаболическими эффектами, развивающимися в результате применения атипичных нейролептиков, в то время как другие аспекты этой проблемы остаются недостаточно изученными.
Целью исследования было сравнение частоты сахарного диабета 2 типа (СД), концентраций инсулина, Спептида и показателей инсулинорезистентности у больных шизофренией и психически здоровых лиц.
Материал и методы
В исследование включали пациентов с шизофренией, наблюдавшихся в психиатрической клинике и способных кооперировать с врачом. Контрольную группу составили лица, находившиеся на лечении в соматических отделениях многопрофильных клиник (исключая специализированные эндокринологические службы), и не получавшие препараты, влияющие на углеводный обмен (глюкокортикостероиды, β-адреноблокаторы, тиазиды и т. д.).
У всех пациентов определяли гликемию натощак. Нарушения углеводного обмена оценивали в соответствии с клиническими рекомендациями Российской ассоциации эндокринологов 2015 г. (“Алгоритмы специализированной помощи больным сахарным диабетом”). За нормальные значения принимали уровень глюкозы в плазме венозной крови <6,1 мммоль/л натощак и <7,8 ммоль/л через 2 ч после нагрузки глюкозой. При наличии нарушения гликемии натощак (концентрация глюкозы в плазме крови 6,17,0 ммоль/л) пациентам проводили пероральную пробу с нагрузкой глюкозой 75 г. Критерием нарушения толерантности к глюкозе служили гликемия натощак 6,1-7,0 ммоль/л и 7,8-11,1 ммоль/л через 2 ч после нагрузки глюкозой. Диагноз СД устанавливали при наличии гликемии натощак >7,0 ммоль/л или >11,1 ммоль/л после нагрузки глюкозой. У пациентов с СД определяли концентрации Спептида и инсулина в плазме крови методом иммуноэлектрохемилюминисцентного анализа (Cobas Е-411, Roche, Швейцария), гликированного гемоглобина (HbА1с, Cobas b 101, Roche, Швейцария). Рассчитывали индексы инсулинорезистентности (ИР): HOMA-IR = [ин су лин натощак (мкЕд/мл) × гликемия натощак (ммоль/л)]/ 22,5 и CARO = гликемия натощак (ммоль/л)/инсулин натощак (мкМЕ/мл).
| Больные шизофренией (n=146) | Психически здорвые(n=602) | P | |
|---|---|---|---|
| Примечание: достоверность р по критерию χ2 | |||
| Нарушения углеводного обмена | 20 (13,7%) | 46 (7,6%) | 0,054 |
| Мужчины | 4 (5,6%) | 15 (7,2%) | 0,851 |
| Женщины | 16 (21,6%) | 31 (7,8%) | 0,003 |
| СД2 | 11 (7,5%) | 38 (6,3%) | 0,753 |
| Мужчины | 4 (5,6%) | 12 (5,8%) | 0,851 |
| Женщины | 7(9.5%) | 26 (6,6% | 0,565 |
| Нарушение толерантности к глюкозе | 6 (4,1%) | 4 (0,7%) | 0,005 |
| Мужчины | 0 | 2 (1,0%) | 0,984 |
| Женщины | 6 (8,3%) | 2 (0,5%) | 0,001 |
| Нарушение гликемии натощак | 3 (2,1%) | 4 (0,7%) | 0,286 |
| Мужчины | 0 | 1 (0,5%) | 0,578 |
| Женщины | 3 (4,1%) | 3 (0,8%) | 0,089 |
Полученные результаты обрабатывали с помощью вариационно-статистических методов с использованием статистических программ STATISTICA 10.0 (StatSoft, Inc, США) и Primer of Biostatistics, 4.03. Для сравнения количественных признаков (описываемых медианой, 25% и 75% квартилем) применяли Т-критерий Манна–Уитни при парном сравнении, при сравнении качественных признаков – критерий χ2 для произвольной таблицы сопряженности (в таблице 2×2 с поправкой Йейтса). Различие показателей считали статистически значимым при р<0,05 (при 5% уровне значимости).
Результаты
Основную группу составили 146 больных шизофренией, в том числе 72 (49,3%) мужчины и 74 (50,7%) женщины, контрольную – 602 пациента, в том числе 207 (39,4%) мужчин и 395 (65,6%) женщин. По возрасту (медиана – 46 лет [36-56] в основной группе и 52 года [40-59] в контрольной группе) и индексу массы тела (27,1 кг/м2 [25,3-28,7] и 27,5 кг/м2 [24,2-31,6], соответственно) две группы достоверно не отличались.
СД 2 типа диагностировали у 11 из 146 пациентов с шизофренией (4 мужчины и 7 женщин). Кроме того, с помощью пробы с нагрузкой глюкозой еще у 6 пациентов (все женщины) выявили нарушения толерантности к глюкозе, а у 3 (все женщины) – нарушение гликемии натощак (табл. 1). У 19 пациентов с нарушением углеводного обмена имелась параноидная форма шизофрении, у 1 – резидуальный вариант психоза. Пятнадцать пациентов получали пероральные сахароснижающие препараты, 2 – инсулинотерапию.
В контрольной группе СД 2 типа выявили у 38 из 602 пациентов (12 мужчин и 26 женщин), нарушение толерантности к глюкозе – у 4 (2 мужчин и 2 женщины) и нарушение гликемии натощак – у 4 (1 мужчина и 3 женщины). Пероральные сахароснижающие препараты получал 21 пациент, инсулинотерапию – 17.
У пациентов с шизофренией и психически здоровых людей частота СД 2 типа и нарушений углеводного обмена достоверно не отличалась, в то время как у женщин с шизофренией нарушения толерантности к глюкозе и углеводного обмена встречались значительно чаще, чем у пациенток контрольной группы (р<0,001 и р=0,003, соответственно (табл. 1).
Атипичные нейролептики получали только 6 из 20 пациентов с шизофренией и нарушением углеводного обмена, причем продолжительность лечения обычно не превышала одного месяца. У остальных пациентов для коррекции психического заболевания применяли нейролептики первого поколения ± традиционные психотропные средства.
Нарушения углеводного обмена у пациентов с шизофренией по сравнению с контролем ассоциировались с более низкими концентрациями инсулина (на 40%) и С-пептида (на 10%) в плазме, уровня HbA1c (на 12%) (табл. 3), а также менее выраженной инсулинорезистентностью.
Обсуждение
В нашем исследовании частота нарушений углеводного обмена у больных шизофренией была выше, чем у психически здоровых лиц (13,7% и 7,6%, соответственно), хотя разница не достигла статистической значимости (р=0,054). В то же время у женщин с шизофренией нарушения углеводного обмена, прежде всего нарушение толерантности к глюкозе, встречались достоверно чаще, чем у пациенток контрольной группы. В других исследованиях частота СД 2 типа у пациентов с психиатрическими заболеваниями находилась в диапазоне 10-15% [3-7]. Нарушения углеводного обмена у пациентов с шизофренией ассоциировались с более низкими уровнями инсулина (р=0,004) и С-пептида (р=0,046), а также менее выраженной инсулинорезистентностью, которую оценивали с помощью индексов HOMA-IR и CARO.
| Показатели | |
|---|---|
| Примечание: в скобках указано число мужчин/женщин | |
| Продолжительность психофармакотерапии, дни | 40[30-80] |
| Атипичные нейролептики | 5 (2/3) |
| Нейролептики первого поколения + атипичные нейролептики | 1 (0/1) |
| Нейролептики первого поколения | 12 (2/10) |
| Нейролептики первого поколения + антидепрессант | 2 (0/2) |
| Больные шизофренией (n=20) | Психически здоровые (n=46) | P | |
|---|---|---|---|
| Примечание: ИМТ - индекс массы тела. Достоверность р по критерию χ2 | |||
| Возраст, лет | 54 [42-60] | 54 [43-62] | нд |
| Окружность талии, см | 107 [98-114] | 103 [95-116] | нд |
| Масса тела, кг | 82 [70-95] | 97 [80-105] | <0,05 |
| Рост, см | 163 [157-175] | 168 [161-178] | нд |
| ИМТ, кг/м2 | 31,6 [26,9-32,0] | 32,5 [30,2-37,6] | нд |
| Гликемия, ммоль/л | 6,6 [6,0-7,8] | 7,3 [6,1-9,6] | нд |
| HbAlc, %, | 6,1 [5,8-7,5] | 6,9 [6,3-9,7] | 0,007 |
| С-пептид, нг/мл | 2,79 [2,15-3,14] | 3,12 [2,74-3,87] | 0,046 |
| Инсулин, мкед/л | 7,4 [4,0-11,0] | 12,2 [9,0-17,1] | 0,004 |
Хорошо известно, что атипичные нейролептики вызывают снижение чувствительности тканей к инсулину, хотя связь между их приемом и развитием метаболических расстройств отмечена только среди больных моложе 45 лет [8]. В нашем исследовании большинство пациентов с шизофренией и нарушением углеводного обмена не получали атипичные нейролептики или принимали их короткое время, а для коррекции психических нарушение использовали нейролептики первого поколения. Последние могут выступать в роли модуляторов 5-HT1A рецепторов, блокада которых сопровождается снижением секреции инсулина [9]. Подобные эффекты были отмечены при введении высоких доз хлорпромазина (аминазина), хотя при продолжительном лечении этим препаратом гликемия оставалась стабильной [10]. Возможную роль в развитии гипоинсулинемии могут играть изменения α-адренергических рецепторнов или продукции соматостатина [11,12].
Таким образом, у пациентов с шизофренией, не получающих атипичные нейролептики, более важное значение в развитии нарушений углеводного обмена имеет гипоинсулинемия, а не инсулинорезистентность.
Используемые источники
- Maudsley H. The Pathology of Mind. London, Macmillan and Co, 1879, 113
- Kooy FH. Hyperglycemia in mental disorders. Brain 1919;42:214-89.
- De Hert M, van Winkel R, Van Eyck D, et al. Prevalence of diabetes, metabolic syndrome and metabolic abnormalities in schizophrenia over the course of the illness: a cross-sectional study. Clin Practice Epidemiol Mental Health, 2006;1:14.
- Подвигин С.Н. К вопросу о причинах метаболического синдрома у больных параноидной шизофренией. Вестник новых медицинских технологий 2010;17(2):142-3.
- Allison DB, Fontaine KR, Heo M, et al. The distribution of body mass index among individuals with and without schizophrenia. J Clin Psychiatry 1999;60:215–20.
- Bobes J, Alegr ía AA, Saiz-Gonzalez MD, et al. Change in psychiatrists’ attitudes towards the physical health care of patients with schizophrenia coinciding with the dissemination of the consensus on physical health in patients with schizophrenia. Europ Psychiatry 2011;26(5):305-12.
- Buse JB, Cavazzoni P, Hornbuckle K, et al. A retrospective cohort study of diabetes mellitus and antipsychotic treatment in the United States. J Сlin Еpidemiol 2003;56(2):164-70.
- Мартынихин И.А. Метаболический синдром и факторы риска его развития среди госпитализированных больных параноидной формой шизофрении. Социальная и клиническая психиатрия 2009;19(1):24-8.
- Beettnger TL, Mendelson SC, Dorson PG, et al. Olanzapine-induced glucose dysregulation. Pharmacother 2000;34:865-7.
- Erle G, Basso M, Federspil G, et al. Effect of chlorpromazine on blood glucose and plasma insulin in man. Eur J Clin Pharmacol 1977;11(1),15-8.
- Lin L-C, Sibille E. Reduced brain somatostatin in mood disorders: a common pathophysiological substrate and drug target? Front Pharmacol 2013;4:110.
- Pallis E, Vasilaki A, Fehlmann D, et al. Antidepressants influence somatostatin levels and receptor pharmacology in brain. Neuropsychopharmacology 2009;34: 952–63.
