Прогностические факторы неблагоприятных исходов хронического гепатита С
Изучение факторов риска, частоты и скорости развития неблагоприятных исходов хронического гепатита С (ХГС), в том числе цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК), криоглобулинемического васкулита (КГВ) и В-клеточной лимфомы.
Проведен ретроспективный анализ данных 824 больных ХГС, обследованных в клинике имени Е.М. Тареева с 2010 по 2016 гг. Возможные предикторы неблагоприятных исходов оценивали с помощью одно- и многофакторного анализа.
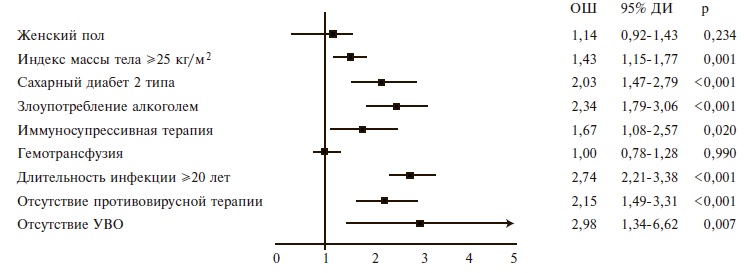
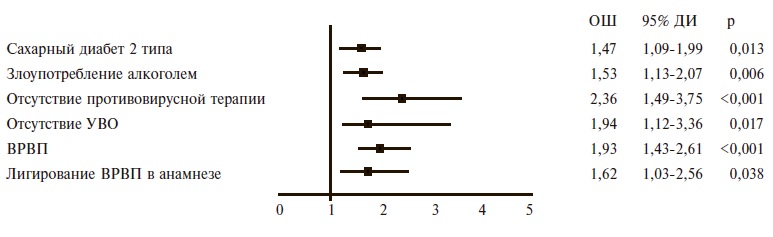
Частота ЦП, декомпенсированного ЦП, ГЦК, тяжелого КГВ и В-клеточной лимфомы составила 39,1%, 14,0%, 2,8%, 5,2% и 1,2%, соответственно, а частота развития ЦП, декомпенсированного ЦП и ГЦК, взвешенная по полу и возрасту, – 22,5%, 8,0% и 1,5%. Ежегодная частота развития ЦП у больных ХГС равнялась 1,5%, ежегодная частота развития декомпенсации и ГЦК у больных ЦП – 2,9% и 1,0%, соответственно. Независимыми факторами риска развития ЦП у больных ХГС были избыточная масса тела/ожирение (отношение шансов [ОШ] 1,43), иммуносупрессивная терапия (ОШ 1,67), сахарный диабет 2 типа (ОШ 2,03), отсутствие противовирусной терапии (ОШ 2,15), употребление алкоголя (ОШ 2,34), длительность инфекции ≥20 лет (ОШ 2,74) и отсутствие устойчивого вирусологического ответа (ОШ 2,98). Независимые факторы риска развития декомпенсации ЦП включали в себя сахарный диабет 2 типа (ОШ 1,47), употребление алкоголя (ОШ 1,53), отсутствие противовирусной терапии (ОШ 2,36) и устойчивого вирусологического ответа (ОШ 1,94). Независимым предиктором развития ГЦК при ЦП был эпизод декомпенсации (ОШ 3,99), а независимыми факторами риска КГВ тяжелого течения – генотип вируса 1b (ОШ 1,66) и отсутствие противовирусной терапии (ОШ 3,31).
Для оценки риска развития ЦП, декомпенсации ЦП и ГЦК рекомендуется использовать разработанные балльные шкалы. Фактором, более чем в 2-3 раза увеличивающим риск развития ЦП, декомпенсированного ЦП, ГЦК и КГВ тяжелого течения у больных ХГС, является отсутствие противовирусной терапии.
Одной из задач, изложенных в Глобальной стратегии ВОЗ по проблеме вирусных гепатитов (2016 г.), является сокращение смертности от гепатитов на 65% к 2030 г. [1]. Смертность больных хроническим гепатитом С (ХГС) в основном связана с формированием цирроза печени (ЦП) и его осложнений, в том числе гепатоцеллюлярной карциномы (ГЦК), поэтому предотвращение данных исходов позволит улучшить прогноз больных ХГС, а также уменьшить экономические затраты на ведение таких пациентов.
По данным ВОЗ, в 2017 г. в мире насчитывался 71 млн больных ХГС, при этом около 400 000 человек ежегодно умирают от болезней печени, связанных с HCVинфекцией, включая ЦП и ГЦК [1]. В России истинная распространенность ХГС неизвестна. Маркеры HCVинфекции определяются у 4,1% взрослого населения Российской Федерации (РФ), что составляет 4,9 млн больных [2]. По мнению отечественных экспертов расчетное число HCV-инфицированных составляет 6,9–9,7 млн человек [3]. В условиях высокой распространенности и растущей заболеваемости ХГС, низкой доступности противовирусной терапии следует ожидать роста числа далеко зашедших форм ХГС, таких как ЦП и ГЦК, а также HCV-ассоциированных заболеваний, в том числе криоглобулинемического васкулита (КГВ) и В-клеточной лимфомы. В США общее число больных HCV-индуцированной ГЦК за 10 лет увеличилось более чем в 2 раза (с 37697 в 1999 г. до 86765 в 2010 г.) и по прогнозам будет продолжать расти [4]. По оценкам исследования глобального бремени болезней смертность, связанная с гепатитом С, во всем мире составила 333 000 случаев в 1990 г., 499 000 – в 2010 г. и 704 000 – в 2013 г. [5]. Частично смертность при ХГС обусловлена развитием внепеченочных проявлений, а именно тяжелых форм КГВ, при которых смертность достигает 20-80% [6]. Социально-экономическое бремя ХГС в России чрезвычайно велико: неутешительные эпидемиологические показатели тесно связаны с экономическими потерями государства. По самым скромным подсчетам финансовые потери, связанные с неблагоприятными исходами ХГС, составили 40 млрд руб (83% всех экономических потерь от гепатита С в РФ в 2010 г.) [7]. Приведенные данные определяют актуальность изучения факторов риска неблагоприятного течения, так как их модификация теоретически позволит улучшить клинические исходы больных с ХГС.
Целью исследования было изучение прогностических факторов неблагоприятных исходов ХГС, таких как ЦП, в том числе, декомпенсированный, ГЦК, КГВ и В-клеточная лимфома.
Материал и методы
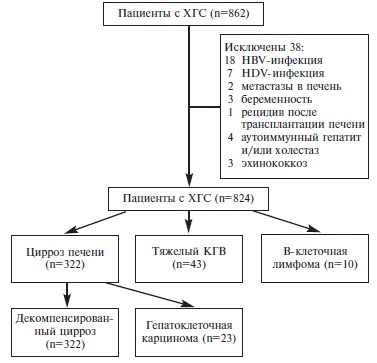
Проведен ретроспективный анализ данных 862 больных ХГС в возрасте 18 лет и старше, обследованных с 2010 г по 2016 г. в гепатологическом отделении клиники им. Е.М. Тареева. Диагноз ХГС устанавливался на основании типичных клинических признаков и наличия HCV RNA в сыворотке крови на протяжении 6 месяцев и более. Критериями исключения были наличие другой причины хронической болезни печени (холестатические заболевания, аутоиммунный гепатит, болезнь Вильсона, активная HBV-инфекция [HBsAg+], сочетанная дельта-инфекция, метастатическое поражение, эхинококкоз печени), беременность и перенесенная трансплантация печени.
У всех больных оценивали следующие возможные факторы риска (ФР): демографические показатели (возраст в момент заражения, пол, длительность инфекции), путь заражения, генотип вируса, злоупотребление алкоголем, индекс массы тела (ИМТ), сахарный диабет (СД) 2 типа, факт проведения иммуносупрессивной терапии, противовирусная терапия и наличие устойчивого вирусологического ответа (УВО). За начало инфицирования принимался эпизод гемотрансфузии, инъекционной наркомании или донорства в анамнезе; при отсутствии этих факторов учитывалось первое указание в анамнезе на инвазивную процедуру – операцию, татуировку, стоматологическое вмешательство.
Диагноз цирроза печени устанавливали на основании выявления портальной гипертензии (ПГ; расширение вен передней брюшной стенки, расширение вен портальной системы, спленомегалия, асцит, наличие варикозно-расширенных вен пищевода [ВРПВ] и желудка), синдрома печеночно-клеточной недостаточности (желтуха, снижение уровней альбумина, протромбинового индекса, холинэстеразы) и печеночной энцефалопатии (астериксис, инверсия сна, проба Рейтана, психические нарушения). В ряде случаев диагноз ЦП был подтвержден данными биопсии (16/322, 5%) и/или эластометрии печени (119/322, 37%). ЦП определяли как компенсированный при отсутствии следующих осложнений: асцит, кровотечение из ВРВП, печеночная энцефалопатия, желтуха, тяжелые инфекционные осложнения (спонтанный бактериальный перитонит, пневмония и др.), тромбоз воротной вены, гепато-ренальный синдром. При наличии одного или нескольких осложнений ЦП считали декомпенсированным независимо от того, отмечались ли эти осложнения в анамнезе или на момент обследования.
Диагноз ГЦК устанавливали в соответствии с современными рекомендациями Европейского общества по изучению печени: ГЦК диагностировали по данным биопсии печени и/или визуализирующих методов. Типичным признаком ГЦК считали накопление контрастного вещества в артериальную фазу и вымывание его в венозную фазу [8]. КГВ тяжелого течения диагностировали в случае крио васкулита с тяжелым органным поражением, включая активный криоглобулинемический гломерулонефрит (остронефритический синдром/нефротический синдром, снижение функ ции почек), тяжелое поражение кожи (язвеннонекротический ангиит), тяжелое поражение периферической нервной системы с развитием двигательных нарушений, поражение легких (легочный фиброз), требующих назначения активной иммуносупрессивной терапии. При подозрении на В-клеточную лимфому (генерализованная лимфаденопатия, спленомегалия, М-градиент, высокий уровень ревматоидного фактора) диагноз подтверждался гематологами (биопсия лимфатических узлов, трепанобиопсия).
Для расчета скорости (ежегодной частоты) развития определенного исхода (ЦП, в том числе декомпенсированного, и ГЦК) мы применили следующую формулу: скорость (% в год) = (R2-R1)/(t2-t1), где R1 – частота исхода во время первого учета (%), R2 – частота исхода во время второго учета (%), t1 – время первого учета (год), t2 – время второго учета (год). Время развития ЦП, декомпенсированного ЦП и ГЦК определяли как разницу между годом развития ЦП, первого эпизода декомпенсации или ГЦК, с одной стороны, и годом выявления ХГС или установления диагноза ЦП – с другой стороны. Чтобы объективизировать данные, мы определили медиану, 25 и 75 перцентили времени развития исходов, что позволило оценить 50% наиболее распространенных результатов, уменьшить возможное их смещение, связанное с крайними и пропущенными данными.
Для статистической обработки данных использовали программы Microsoft Office Excel 13 и IBM SPSS Statistics 21. Нормальность распределения проверяли с помощью теста Колмогорова-Смирнова. При несоответствии нормальному распределению для анализа количественных признаков определяли групповую медиану и квартили (25-75 перцентили). Качественные признаки представлены в абсолютных значениях и процентах. При сравнении групп по количественным признакам применяли методы непараметрической статистики: U-критерий Манна-Уитни (дву сторонний тест) для двух выборок и критерий Краскала-Уоллиса для трех и более выборок. Сравнение групп по качественным признакам проводили с помощью таблиц сопряженности и критерия χ2 Пирсона (двусторонний тест, точный критерий Фишера при числе наблюдений менее 5). Для определения оптимальных пограничных значений непрерывных переменных использовали анализ чувствительности и специфичности при построении ROCкривых. Для выявления взаимосвязи количественных и порядковых признаков применяли непараметрические методы корреляционного анализа Спирмена (до 0,3 – слабая, 0,3-0,7 – умеренная, 0,7-1,0 – сильная). Для номинальных признаков оценивали меру сопряженности: значимость оценивали по критерию χ2 Пирсона, силу связи – по критерию сопряженности для сравнения номинальных признаков и критерию эта-квадрат (h2) для оценки связи между количественными и номинальными признаками. Для параметров, выявленных при однофакторном анализе, проводился многофакторный анализ методом бинарной логистической регрессии. Переменные включали в регрессию при значимости р<0,05 при однофакторном анализе. Использовали метод принудительного включения с вероятностью включения 0,05 и вероятностью исключения 0,10 или более. Определяли отношение шансов (ОШ) с 95% доверительным интервалом (ДИ). Для создания балльных шкал проведен дискриминантный анализ с оценкой нормированных коэффициентов канонической дискриминантной функции прогностических факторов. Иерархия коэффициентов использовалась для их конверсии в целочисленные компоненты (баллы). Была подсчитана сумма баллов для каждого больного и выполнен анализ ROC-кривых для определения наилучших пороговых значений.
Результаты
Частота неблагоприятных исходов у больных ХГС. Были проанализированы данные 862 больных ХГС; 38 из них были исключены из анализа (рис. 1). Среди оставшихся 824 больных ЦП выявлен у 322 (39,1%), декомпенсированный ЦП – у 115 (14,0%), ГЦК – у 23 (2,8%), КГВ тяжелого течения – у 43 (5,2%) и В-клеточная лимфома – у 10 (1,2%) (табл. 1). У 19 (2,3%) больных отмечалось сочетание ЦП и КГВ, у 6 (0,7%) – ЦП и В-клеточной лимфомы, у 6 (0,7%) – КГВ и В-клеточной лимфомы.
| Параметры | Все больные (n=824) |
ХГС F0-F3 (n=502) |
Цирроз печени (n=322) |
Декомп. ЦП (n=115) |
Тяжелый КГВ (n=43) |
В-лимфома (n=10) |
ГЦК (n=23) |
|---|---|---|---|---|---|---|---|
| Примечание: ХГС (F0-F3) – хронический гепатит С (стадия фиброза F0-F3); КГВ – криоглобулинемический васкулит; ГЦК – гепатоцеллюлярная карцинома; ИМТ – индекс массы тела; СД 2 типа – сахарный диабет 2 типа; УВО – устойчивый вирусологический ответ; декомп. ЦП – декомпенсированный цирроз печени. Для количественных признаков приведены медиана, 25-й и 75-й перцентили | |||||||
| Возраст, лет | 47 (36-56) | 41 (33-51) | 53 (45-61) | 53 (46-62) | 53 (44-62) | 55 (48-61) | 54 (50-65) |
| Мужчины, n (%) | 422 (51) | 272 (54) | 150 (47) | 53 (46) | 13 (30) | 1 (10) | 14 (61) |
| ИМТ, кг/м2 | 26 (23-29) | 25 (23-28) | 28 (25-31) | 27 (25-31) | 26 (23-29) | 25 (22-32) | 29 (26-31) |
| Путь заражения | |||||||
| инвазивные процедуры | 341 (41) | 125 (39) | 216 (43) | 46 (40) | 16 (37) | 4 (40) | 9 (39) |
| наркомания | 99 (12) | 79 (16) | 20 (6) | 7 (6) | 1 (2) | 0 (0) | 0 (0) |
| гемотрансфузия | 158 (19) | 77 (15) | 81 (25) | 28 (25) | 11 (26) | 4 (40) | 3 (13) |
| Возраст заражения, лет | 25 (20-33) | 25 (19-33) | 26 (20-34) | 26 (21-34) | 27 (22-39) | 24 (22-40) | 25 (20-40) |
| Длительность HCV, лет | 18 (11-25) | 14 (10-20) | 25 (20-32) | 24 (19-31) | 20 (13-26) | 22 (12-32) | 28 (19-32) |
| Употребление алкоголя, n (%) | 146 (18) | 55 (11) | 91 (28) | 51 (44) | 4 (9) | 0 (0) | 8 (35) |
| СД 2 типа, n (%) | 103 (13) | 23 (5) | 80 (25) | 40 (35) | 4 (9) | 3 (30) | 6 (26) |
| Иммуносупрессия, n (%) | 45 (6) | 18 (4) | 27 (8) | 13 (11) | - | - | 6 (26) |
| Эластометрия, кПа | 8 (6-17) | 7 (5-8) | 21 (17-29 | 29 (24-42) | 8 (6-12) | 11 (8-29) | 40 (29-41) |
| Генотип вируса, n (%) | |||||||
| 1b | 523 (64) | 308 (62) | 215 (67) | 68 (59) | 36 (84) | 10 (100) | 18 (78) |
| 3a | 237 (29) | 152 (31) | 85 (27) | 36 (31) | 5 (12) | 0 (0) | 4 (17) |
| 2 | 54 (7) | 35 (7) | 19 (6) | 7 (6) | 2 (5) | 0 (0) | 1 (4) |
| Противовирусная терапия, n (%) | 290 (35) | 173 (34) | 17 (5) | 23 (20) | 17 (40) | 3 (30) | 3 (13) |
| УВО, n (%) | 153 (54) | 117 (67) | 3 (18) | 6 (5) | 8 (47) | 2 (67) | 0 (0) |
Пациенты с ЦП были старше больных c F0-F3 стадией фиброза печени (медиана возраста – 53 и 41 год, соответственно; р<0,001). Кроме того, среди пациентов с ЦП была выше доля женщин (53% и 46%, соответственно; р=0,038). Для устранения неравномерности количества респондентов разного пола и возраста и для повышения репрезентативности выборки произведено взвешивание наблюдений в зависимости от пола и возраста. После взвешивания корреляция ЦП с возрастом сохранилась (р<0,001 – при расчете критерия U МаннаУитни; р<0,001 – при регрессии), тогда как корреляция ЦП с женским полом оказалась незначимой (р=0,416 – при регрессии, р=0,470 – при расчете критерия Пирсона). Взвешенная по полу и возрасту частота ЦП составила 22,8%, декомпенсированного ЦП – 8,0%, ГЦК – 1,5%. Эти показатели с определенной погрешностью можно экстраполировать на российскую популяцию больных ХГС.
Ежегодная частота развития неблагоприятных исходов у больных ХГС. Ежегодная частота развития ЦП у больных ХГС (F0-F3) составила 1,5%, декомпенсации ЦП у больных ЦП – 2,9%, ГЦК у больных ЦП – 1,0% (табл. 2).
| Частота развития цирроза у больных ХГС (n=322) | Частота декомпенсации у больных ЦП (n=115) | Частота развития ГЦК у больных ЦП (n=23) | |
|---|---|---|---|
| Примечание: *25 и 75-й перцентили времени от года выявления ХГС или установления диагноза ЦП. **25 и 75-й перцентили времени от установления диагноза ЦП или первого эпизода декомпенсации или ГЦК. ***разница в частоте болезни при первом и втором учетах | |||
| t1 - время первого учета* | 18 | 1 | 1 |
| t2 - время второго учета** | 29 | 5 | 4 |
| t2-t1 (количество лет между учетами), лет | 11 | 4 | 3 |
| R1 (частота во время первого учета), % | 9,8 | 3,7 | 1,7 |
| R2 (частота во время второго учета), % | 26,7 | 15,3 | 4,7 |
| R2-R1, %*** | 16,9 | 11,6 | 3,0 |
| Ежегодная частота = (R2-R1)/(t2-t1), % | 1,5 | 2,9 | 1,0 |
Независимые факторы риска развития ЦП у больных ХГС. По данным многофакторного анализа независимыми факторами риска развития ЦП у больных ХГС (F0-F3) были избыточная масса тела/ожирение, иммуносупрессивная терапия, сахарный диабет 2 типа, отсутствие противовирусной терапии, злоупотребление алкоголем, длительность HCV-инфекции 20 лет и более и отсутствие устойчивого вирусологического ответа (рис. 2).
Независимые факторы риска развития декомпенсации у больных ЦП. Предикторами декомпенсации ЦП были сахарный диабет 2 типа, злоупотребление алкоголем, отсутствие противовирусной терапии и отсутствие устойчивого вирусологического ответа, наличие ВРПВ и их лигирование в анамнезе (рис. 3).
Независимые факторы риска развития ГЦК у больных ЦП. ГЦК была диагностирована у 23 больных (у всех – на стадии ЦП). Противовирусная терапия проводилась только трем из них, причем всем – уже на стадии ЦП. Устойчивый вирусологический ответ не был достигнут ни у одного больного. Однофакторный анализ выявил следующие предикторы ГЦК: отсутствие противовирусной терапии (ОШ 1,32, 95% ДИ 1,11-1,58, р=0,038), иммуносупрессивная терапия (ОШ 2,90, 95% ДИ 1,067,94, р=0,043), заражение вирусом во время гемотрансфузии (ОШ 0,77, 95% ДИ 0,64-0,92, р=0,046), декомпенсация ЦП (ОШ 5,15, 95% ДИ 1,86-14,27, р=0,001), интервал между первым и вторым эпизодами декомпенсации более 12 мес (ОШ 9,25, 95% ДИ 1,0184,73, р=0,032). При многофакторном анализе статистическую значимость сохранил только эпизод декомпенсации ЦП (ОШ 3,99, 95% ДИ 1,36-11,73, р=0,012).
Факторы риска развития КГВ и В-клеточной лимфомы у больных ХГС. КГВ у больных с ЦП встречался достоверно чаще, чем у пациентов без ЦП (14,6% и 9,2%, соответственно, р=0,018). Однако частота КГВ, требовавшего иммуносупрессивной терапии, не зависела от наличия ЦП (5,9% и 4,8%, соответственно, р=0,522). Независимыми факторами риска развития КГВ, требовавшего иммуносупрессивной терапии, были генотип вируса 1b (ОШ 1,66, 95% ДИ 1,09-2,53, р=0,019) и отсутствие противовирусной терапии (ОШ 3,31, 95% ДИ 1,61-6,77, р=0,001).
Среди больных с В-клеточной лимфомой доля женщин составила 90%. У всех больных выявили генотип вируса 1b. Противовирусная терапия проводилась трем больным до развития В-клеточной лимфомы, причем у двух из них был достигнут устойчивый вирусологический ответ. По данным однофакторного анализа, предикторами В-клеточной лимфомы были женский пол (р=0,01) и генотип вируса 1b (р=0,017). При многофакторном анализе установить независимые факторы риска развития В-клеточной лимфомы не удалось, что, вероятно, связано с малым количеством больных (n=10).
| Прогностический фактор | Коэффициент дискриминантной функции | Балл прогностической модели* |
|---|---|---|
| Примечание: Описание модели – лямбда Уилкса 0,576, χ2 433,5, р<0,001. *Округленное до целого число, кратное минимальному коэффициенту дискриминантной функции. ИМТ – индекс массы тела; ПВТ – противовирусная терапия; УВО – устойчивый вирусологический ответ | ||
| ИМТ ≥25 кг/м2 | 0,272 | 3 |
| Сахарный диабет 2 типа | 0,355 | 4 |
| Злоупотребление алкоголем | 0,362 | 4 |
| Иммуносупрессивная терапия | 0,147 | 2 |
| Длительность инфекции ≥20 лет | 0,754 | 8 |
| Отсутствие ПВТ | 0,359 | 4 |
| Отсутствие УВО | 0,092 | 1 |
Балльные шкалы оценки риска развития ЦП и его осложнений у больных ХГС. Первая шкала разработана на основе дискриминантного анализа данных 824 больных ХГС (табл. 3). У больных ХГС (F0-F3) при сумме баллов 10 и более риск развития ЦП увеличивается в 2,54 раза (ОШ 2,54, 95% ДИ 2,26-2,86; p<0,001, чувствительность 89,4%, специфичность 73,3%). Вторая шкала разработана аналогичным образом на основе данных 322 больных ЦП (табл. 4). При сумме баллов 4 и более риск развития декомпенсации ЦП или развития ГЦК повышен в 8 раз (ОШ 8,19, 95% ДИ 4,86-13,82, p<0,001, чувствительность 77,4%, специфичность 70,6%).
| Прогностический фактор | Коэффициент дискриминантной функции | Балл прогностической модели* |
|---|---|---|
| Примечание: Описание модели – лямбда Уилкса 0,706, χ2 102,6, р<0,001. *Округленное до целого число, кратное минимальному коэффициенту дискриминантной функции. ВРВП – варикозное расширение вен пищевода; ПВТ – противовирусная терапия; УВО – устойчивый вирусологический ответ. | ||
| Сахарный диабет 2 типа | 0,251 | 1 |
| Злоупотребление алкоголем | 0,319 | 1 |
| Отсутствие ПВТ | 0,782 | 3 |
| Отсутствие УВО | 0,329 | 1 |
| ВРВП | 0,561 | 2 |
| Лигирование ВРВП в анамнезе | 0,285 | 1 |
Обсуждение
На основании анализа течения болезни у большой группы пациентов с ХГС (n=824) рассчитана взвешенная по полу и возрасту частота ЦП (22,8%), декомпенсированного ЦП (8,0%) и ГЦК (1,5%). Эти показатели с определенной погрешностью можно экстраполировать на российскую популяцию больных ХГС. В целом ре зуль таты согласуются с данными литературы о частоте развития неблагоприятных исходов ХГС [9], хотя проводить сравнение с отечественными данными крайне затруднительно в связи с отсутствием соответствующих популяционных исследований в РФ. Тем не менее, частота ЦП у больных ХГС (22,8%) в нашем исследовании сопоставима с показателем в работе И.Е. Пиро говой (17% у 319 больных ХГС) [10].
Частота развития КГВ у больных ХГС в нашем исследовании (11,2%) согласуется с результатами немногочисленных отечественных и зарубежных исследований (5-10%) [11,12]. По нашим данным, у половины пациентов с хронической HCV-инфекцией на стадии как гепатита, так и ЦП наблюдались тяжелые формы КГВ, что, скорее всего, связано с особенностями выборки больных, наблюдающихся в клинике. В-клеточная лимфома развивается у 8-10% больных с HCV-ассоциированной криоглобулинемией [13], чему не противоречат наши данные: частота В-лимфомы среди всех больных ХГС составила 1,2% (10/824), а среди больных с КГВ – 10,7% (10/93). Тем не менее, оценить полученный результат сложно, учитывая относительную редкость данного проявления ХГС.
При рассчитанной нами ежегодной частоте развития ЦП у больных ХГС (1,5%) частота ЦП за 20 лет составит около 30%, что, в целом, согласуется с данными литературы. Так, по данным ВОЗ частота развития ЦП у больных ХГС составляет 15–30% в течение 20 лет [4]. Следует отметить, что результаты исследований крайне вариабельны: по данным разных авторов частота развития ЦП при HCV-инфекции составляет от 2–3% до 51% в течение 20-22 лет [14] [15], что, вероятнее всего, обусловлено неоднородностью групп больных. Результаты мета-анализа (n=33121) показали, что в течение 20 лет ЦП развивается у 16% больных ХГС [16].
По данным систематизированного обзора британских авторов (13 исследований, 2386 больных ЦП в исходе ХГС), ежегодная частота развития декомпенсации и ГЦК у больных ЦП составила 6,4% и 3,4%, соответственно [17]. Более низкие показатели в нашем исследовании (2,9% и 1,0%, соответственно) можно объяснить тем, что часть больных получали противовирусную терапию, тогда как W. Alazawi и соавт. изучали естественное течение ЦП. По данным других крупных исследований, ежегодная частота развития декомпен сации и ГЦК у больных с ЦП, вызванным HCV, сос тавляет 3-6% и 1-5%, соответственно [9], с чем согласуются наши результаты.
Выявленные нами независимые факторы риска развития ЦП у больных ХГС описаны в многочисленных исследованиях [15,18,19]. Следует отметить, что сахарный диабет 2 типа и злоупотребление алкоголем, которые более чем в 2 раза увеличивают риск развития ЦП при ХГС, являются модифицируемыми факторами.
Особенностью нашей работы было изучение факторов риска развития декомпенсации ЦП у большой группы больных (n=322); в отечественной литературе работ по данной теме не найдено. Закономерно, что часть факторов риска, способствующих прогрессированию заболевания, одновременно оказались независимыми предикторами декомпенсации ЦП. Наши данные согласуются с результатами зарубежных исследований [20-22]. Так, при мета-анализе 20 исследований (19942005 гг. более 15000 больных ХГС) было показано, что прием алкоголя в дозах 210-560 г в неделю значительно ухудшает исходы пациентов: ОШ развития декомпенсированного ЦП составило 3,54 [23] (по нашим данным – 1,53). Хотя гепатотоксическое влияние алкоголя очевидно, а частота его приема у больных ХГС выше, чем в популяции [24], тем не менее, роль злоупотребления алкоголем как фактора риска неблагоприятных исходов у пациентов с ЦП в исходе ХГС подтверждается не всегда. Это связано с тем, что влияние алкоголя как кофактора прогрессирования оценить сложно. В российской популяции больных ЦП доля пациентов с вирусно-алкогольным поражением печени является высокой: так, в работе А.И. Хазанова и соавт. приблизительно у трети из 209 больных вирусным ЦП прием алкоголя (≥50 г/сут) был дополнительным фактором поражения печени, а также фактором риска летального исхода [25].
Среди компонентов метаболического синдрома значимым фактором риска развития ЦП у больных ХГС (F0-F3) были избыточная масса тела/ожирение (>25 кг/м2), а фактором риска декомпенсации ЦП – сахарный диабет 2 типа. Взаимосвязь между компонентами метаболического синдрома и прогрессированием ХГС является чрезвычайно сложной и многогранной. Вопервых, наличие хронического заболевания печени само по себе независимо от этиологии влияет на метаболизм глюкозы, а сахарный диабет 2 типа развивается у 30-60% пациентов с ЦП [26]. Во-вторых, описана триггерная роль HCV-инфекции в развитии диабета [27]. В-третьих, уже имеющийся диабет у больных ХГС вне зависимости от времени его возникновения способствует развитию ЦП, его декомпенсации [20], а также увеличению частоты ГЦК [28]. В нашем исследовании СД 2 типа имелся у 5% больных ХГС (F0-F3), у 25% больных ЦП и у 35% пациентов с декомпенсированным ЦП. В популяционном тайваньском исследовании (424 больных ХГС и сахарным диабетом 2 типа и 1708 пациентов без сахарного диабета, 11 лет наблюдения) показано, что сахарный диабет 2 типа является фактором риска развития не только ЦП, но и его декомпенсации: у больных с диабетом декомпенсация ЦП отмечалась в 2 раза чаще [29]. В нашем исследовании были получены сходные результаты (ОШ 1,47).
Одними из самых “сильных” факторов, влияющих на исход ХГС, в том числе на стадии ЦП, являются противовирусная терапия и достижение устойчивого вирусологического ответа, что согласуется с данными многочисленных исследований [30,31]. При проведении противовирусной терапии риск развития ЦП снижался более чем в 2 раза (ОШ 2,15), а при эффективном лечении – почти в 3 раза (ОШ 2,98). У больных ЦП противовирусная терапия также приводит к улучшению исходов, в частности риск декомпенсации ЦП снижался приблизительно в 2 раза при проведении противовирусной терапии (ОШ 2,36) и достижении устойчивого вирусологического ответа (ОШ 1,94). Современные режимы противовирусной терапии препа ратами с прямым противовирусным действием обеспечивают очень высокую частоту устойчивого вирусологического ответа. Достижение устойчивого вирусологического ответа целесообразно не только с клинической, но и с экономической точки зрения. Фармакоэкономический анализ (2002-2013 гг.) показал, что через 5 лет после достижения устойчивого вирусологического ответа у больных ХГС стоимость медицинской помощи уменьшается в 13 раз за счет снижения частоты ГЦК и смертности по сравнению с пациентами, не ответившими на противовирусную терапию и не получавшими лечение [32].
ВРВП, отражающее длительность и тяжесть портальной гипертензии, было независимым предиктором декомпенсации ЦП (ОШ 1,93). В проспективном 14-летнем исследовании наличие ВРВП у 352 больных ЦП также примерно в 2 раза повышало риск декомпенсации ЦП [33].
Более высокая частота КГВ у больных с ЦП свидетельствует о том, что стадия поражения печени и/или длительность инфекции играют важную роль в его развитии. У больных ХГС, не получавших противовирусную терапию, риск развития КГВ, требовавшего иммуносупрессивной терапии, увеличивался более чем в 3 раза. Связь КГВ с такими факторами риска, как женский пол и генотип вируса 1b, также описана в литературе [13]. В то же время другие исходы, в том числе ЦП и ГЦК, не были связаны с определенным генотипом вируса. Вопрос о возможном влиянии генотипа HCV на течение ХГС остается спорным. В американских исследованиях показана роль генотипа 3 в развитии ЦП и ГЦК [34], тогда как итальянские авторы отмечают роль генотипа 1b [35]. Нам не удалось выявить независимые факторы риска развития В-клеточной лимфомы, что, вероятно, связано с малым количеством больных (n=10).
Разработанные нами балльные шкалы являются простыми для использования в обычной клинической практике и не требуют определения дорогостоящих параметров. Шкалы разработаны на основании обследования большого числа пациентов (824 больных с хронической HCV-инфекцией и 322 больных с ЦП), однако требуют валидизации.
Мы не обнаружили связи определенных исходов ХГС с длительностью HCV-инфекции. Вероятно, это объясняется ретроспективным дизайном исследования, а также наличием других факторов, способствовавших прогрессированию болезни печени, например, злоупотребления алкоголем.
Ограничения работы
Ограничениями являются ретроспективный дизайн, а также типичная для одноцентрового исследования возможность системной ошибки. Также недостатком работы было малое число больных с ГЦК и В-клеточной лимфомой, не позволившее в полной мере оценить факторы риска их развития. При расчете ежегодной частоты развития исходов мы анализировали ретроспективные данные, поэтому рассчитанные значения являются лишь оценочными, а для получения более точных цифр необходимо проспективное исследование. Кроме того, наше исследование проводилось методом поперечного среза. Результаты таких исследований следует интерпретировать на момент их проведения, а их перенос на другие периоды времени нежелателен.
Заключение
Для оценки риска развития ЦП, декомпенсации ЦП и ГЦК рекомендуется использовать разработанные балльные шкалы. Универсальным фактором, более чем в 2-3 раза увеличивающим риск развития ЦП, декомпенсированного ЦП, ГЦК и тяжелого КГВ у больных ХГС, является отсутствие противовирусной терапии.
Используемые источники
- ВОЗ Гепатит С Информационный бюллетень. [Электронный ресурс]. http://www.who.int/mediacentre/factsheets/fs164/ru/
- Gower E, Estes C, Blach S, et al. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol 2014;61(1):S45–S57.
- Якушечкина Н.А. Определение бремени гепатита C в Российской Федерации и фармакоэкономическая оценка новых методов противовирусной терапии. Автореферат дис. ... канд. мед. наук. Москва, 2016; 24 с.
- Davis GL, Alter MJ, El-Serag H, et al. Aging of hepatitis C virus (HCV)-infected persons in the United States: a multiple cohort model of HCV prevalence and disease progression. Gastroenterology 2010;138(2):513–26.
- GBD 2013 Mortality and Causes of Death Collaborators Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2015;385(9963):117–71.
- Ramos-Casals M, Robles A, Brito-Zer ón P, et al. Life-threatening cryoglobulinemia: clinical and immunological characterization of 29 cases. Semin Arthritis Rheum 2006;36(3):189–96.
- Ющук Н.Д., Знойко O.O., Дудина К.Р. и др. Проблема вирусного гепатита С в Российской Федерации. Терапевтический архив 2014;86(10):77–81.
- EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012;56(4):908–43.
- Westbrook RH, Dusheiko G. Natural history of hepatitis C. J Hepatol 2014;61(1): 58–68.
- Пирогова И.Ю. Диагностика фиброза печени у больных хроническими гепатитами В и С и ее клиническое значение. Автореф. дис. ... доктора мед. наук. Москва, 2011; 48с.
- Игнатова Т.М., Чернова О.А., Бурневич Э.З. и др. Успешное лечение HCVкриоглобулинемического васкулита тяжелого течения с помощью CD-20 моноклональных антител и противовирусных препаратов. Клиническая медицина 2014;92(8):62–4.
- Cacoub P, Comarmond C. New insights into HCV-related rheumatologic disorders: A review. J Adv Res 2017;8(2):89–97.
- Ferri C, Sebastiani M, Giuggioli D, et al. Mixed cryoglobulinemia: demographic, clinical, and serologic features and survival in 231 patients. Semin Arthritis Rheum 2004;33(6):355–74.
- Tong MJ, el-Farra NS, Reikes AR, et al. Clinical outcomes after transfusion-associated hepatitis C. N Engl J Med 1995;332(22):1463–6.
- Wiese M, Berr F, Lafrenz M, et al. Low frequency of cirrhosis in a hepatitis C (genotype 1b) single-source outbreak in germany: A 20-year multicenter study. Hepatology 2000;32(1):91–6.
- Thein HH, Yi Q, Dore GJ, et al. Estimation of stage-specific fibrosis progression rates in chronic hepatitis C virus infection: a meta-analysis and meta-regression. Hepatology 2008;48(2):418–31.
- Alazawi W, Cunningham M, Dearden J, et al. Systematic review: Outcome of compensated cirrhosis due to chronic hepatitis C infection. Aliment Pharmacol Ther 2010;32(3):344–55.
- Игнатова Т.М. Естественное течение хронической HCV-инфекции. Рос журн гастроэнтерологии, гепатологии и колопроктологии 2002;12(2):20–30.
- Шифф Ю.Р., Соррел М.Ф., Мэддрей У.С. Вирусные гепатиты и холестатические заболевания. Москва, ГЭОТАР-Медиа, 2010; 408c.
- Calzadilla-Bertot L, Vilar-Gomez E, Torres-Gonzalez A, et al. Impaired glucose metabolism increases risk of hepatic decompensation and death in patients with compensated hepatitis C virus-related cirrhosis. Dig Liver Dis 2016;48(3):283–90.
- Meer AJ van der, Feld JJ, Hofer H, et al. Risk of cirrhosis-related complications in patients with advanced fibrosis following hepatitis C virus eradication. J Hepatol 2017;66(3):485-93.
- Trinchet JC, Bourcier V, Chaffaut C, et al. Complications and competing risks of death in compensated viral cirrhosis (ANRS CO12 CirVir prospective cohort). Hepatology 2015;62(3):737–50.
- Hutchinson SJ, Bird SM, Goldberg DJ, et al. Influence of alcohol on the progression of hepatitis C virus infection: a meta-analysis. Clin Gastroenterol Hepatol 2005;3(11):1150–9.
- Маев И.В. Абдурахманов Д.Т., Андреев Д.Н. и др. Алкогольная болезнь печени: современное состояние проблемы. Терапевтический архив 2014; 86(4):108–16.
- Хазанов А.И., Плюснин С.В., Васильев А.П. и др. Алкогольные и вирусные циррозы печени у стационарных больных (1996–2005 гг.): распространенность и исходы. Росс журн гастроэнтерологии, гепатологии, колопроктологии 2007;17(2):19-28.
- Garc ía-Compean D, Jaquez-Quintana JO, Maldonado-Garza H, et al. Hepato -genous diabetes. Current views of an ancient problem. Ann Hepatol 2009;8(1): 13–20.
- Ruhl CE, Menke A, Cowie CC, et al. Relationship of hepatitis C virus infection with diabetes in the U.S. population. Hepatology 2014;60(4):1139–49.
- Arase Y, Kobayashi M, Suzuki F, et al. Effect of type 2 diabetes on risk for malignancies includes hepatocellular carcinoma in chronic hepatitis C. Hepatology 2013;57(3):964–73.
- Huang YW, Yang SS, Fu SC, et al. Increased risk of cirrhosis and its decompensation in chronic hepatitis C patients with new-onset diabetes: a nationwide cohort study. Hepatology 2014;60(3):807–14.
- Aleman S, Rahbin N, Weiland O, et al. A risk for hepatocellular carcinoma persists long-term after sustained virologic response in patients with hepatitis C-associated liver cirrhosis. Clin Infect Dis 2013;57(2):230–6.
- Bruno S, Stroffolini T, Colombo M, et al. Sustained virological response to interferon-alpha is associated with improved outcome in HCV-related cirrhosis: a retrospective study. Italian Association of the Study of the Liver Disease (AISF). Hepatology 2007;45(3):579–87.
- Smith-Palmer J, Cerri K, Valentine W. Achieving sustained virologic response in hepatitis C: a systematic review of the clinical, economic and quality of life benefits. BMC Infect Dis 2015;15(1):19.
- Bruno S, Zuin M, Crosignani A, et al. Predicting mortality risk in patients with compensated HCV-induced cirrhosis: A long-term prospective study. Am J Gastroenterol. 2009;104(5):1147–57.
- Kanwal F, Kramer JR, Ilyas J, et al. HCV genotype 3 is associated with an increased risk of cirrhosis and hepatocellular cancer in a national sample of U.S. Veterans with HCV. Hepatology 2014;60(1):98–105.
- Raimondi S, Bruno S, Mondelli MU, et al. Hepatitis C virus genotype 1b as a risk factor for hepatocellular carcinoma development: a meta-analysis. J Hepatol 2009;50(6):1142–54.
