История учения об инфекционном эндокардите
Первое упоминание об инфекционном эндокардите (ИЭ) относится к началу XVI века и принадлежит французскому математику, астроному, личному лейбмедику короля Генриха II и Екатерины Медичи Жану Франсуа Фернелю (1497-1558 гг.), в честь которого назван один из кратеров на Луне [1]. Через несколько лет, в 1646 году, Лазар Ривьере описал эндокардит аортального клапана: при аутопсии пациента, обратившегося с жалобами на сердцебиение и одышку, были обнаружены “ маленькие круглые выросты, самый большой из которых был размером с лесной орех и закрывал выходной тракт левого желудочка ” [2]. Это описание вошло в его монументальный труд “ Opera medica universa ”, опубликованный в 1674 году (рис. 1) к [3]. Спустя 60 лет Джованни Баттиста Морганьи (1682-1771 гг.) в своем главном труде “ De sedibus et causis morborum per anatomen indagatis libri V” описал 36-летнего пациента с “жидкостью в легких”, редким пульсом, отеками и гонорреей, у которого при аутопсии был выявлен ревматический порок аортального клапана, осложнившийся эндокардитом [1,3].
Эндокардит в XVI-XIX веках
Первое упоминание об инфекционном эндокардите (ИЭ) относится к началу XVI века и принадлежит французскому математику, астроному, личному лейбмедику короля Генриха II и Екатерины Медичи Жану Франсуа Фернелю (1497-1558 гг.), в честь которого назван один из кратеров на Луне [1]. Через несколько лет, в 1646 году, Лазар Ривьере описал эндокардит аортального клапана: при аутопсии пациента, обратившегося с жалобами на сердцебиение и одышку, были обнаружены "маленькие круглые выросты, самый большой из которых был размером с лесной орех и закрывал выходной тракт левого желудочка" [2]. Это описание вошло в его монументальный труд "Opera medica universa", опубликованный в 1674 году (рис. 1) к [3]. Спустя 60 лет Джованни Баттиста Морганьи (1682-1771 гг.) в своем главном труде "De sedibus et causis morborum per anatomen indagatis libri V" описал 36-летнего пациента с "жидкостью в легких", редким пульсом, отеками и гонорреей, у которого при аутопсии был выявлен ревматический порок аортального клапана, осложнившийся эндокардитом [1,3].

Термин "вегетация" ввел Жан-Николя Корвизар (1755-1821 гг.), личный медик Наполеона и основоположник клинической медицины во Франции. В своей монографии "Essai sur les maladies et les l é sions organiques du coeur et des gros vaisseaux, extrait des le ç ons cliniques" он первым описал инфекционное поражение митрального клапана, предположил, что вегетации могут быть сифилитического генеза, иметь разные размеры, вплоть до гигантских, и вызывать обструкцию [1,3].
Британский врач Джозеф Ходгсон, известный своими исследованиями сердечно-сосудистой системы, в частности работами по аневризме аорты (болезнь Ходгсона, "Hodgson’s disease"), в монографии "A treatise on the diseases of arteries and veins" в 1815 году первым описал случай дистальной эмболии при эндокардите аортального клапана [3].
Новая эра в кардиологии началась после изобретения стетоскопа французским врачом Рене Теофиль Гиацинт Лаэннеком (1781-1826 гг.), основоположником клинико-анатомического метода диагностики, учеником Корвизара. Это открытие позволило диагностировать эндокардит при жизни. Лаэннек описал несколько случаев эндокардита, первым отметил, что вегетации располагаются по току крови.
Первое детальное описание эндокардита принадлежит Жану Батисту Буйо (1796-1881 гг.), французскому врачу-терапевту, действительному члену Парижской Академии наук (1868 г.), президенту Национальной медицинской академии (1862 г.), автору многочисленных трудов о различных заболеваниях, включая холеру, рак, энцефалит, впервые описавшему ревматическое поражение сердца. Именно он ввел термин "эндокард" и "эндокардит" и описал три периода поражения клапана при эндокардите: 1 – образование кровяных сгустков, размягчение, изъязвление и нагноение, 2 – организация и фиброз отдельных участков, 3 – уплотнение и кальцификация участка поражения эндокарда с сужением отверстия клапанов сердца или без него [3].
XIX век ознаменовался расширением представлений о клинической картине ИЭ и его осложнениях. Британский врач Уильям Киркс (1822-1864 гг.) впервые описал левосторонний эндокардит, проявляющийся лихорадкой, профузным потоотделением, кожной сыпью, систолическим шумом и инсультами, вызванными эмболией, и правосторонний эндокардит, развитие которого может осложниться эмболией в легочную артерию. Эта работа Киркса имела большой резонанс среди врачей второй половины XIX века и многократно цитировалась, в том числе Уильямом Ослером в 1885 году [3]. Во второй половине XIX века известные клиницисты, такие как Жан-Мартен Шарко (1825-1893 гг.) и Альфред Вульпиан (1826-1887 гг.), пришли к выводу, что гипертермия, озноб и спленомегалия являются симптомами эндокардита и возникают в связи с действием токсинов, выделяющихся воспаленным эндокардом.
Эммануил Фредерик Винг (1817-1894 гг.), врач из Норвегии, первым предположил, что эндокардит имеет инфекционную природу. В своей работе он привел несколько случаев "первичного язвенного эндокардита": "все умерли от заражения крови, на аутопсии обнаружены свежие вегетации, а также большое количество мелких абсцессов и кровоизлияний в серозные оболочки, кожу, стенку сердца, почки и другие органы. Дальнейшее изучение пораженных клапанов сердца дало неожиданный результат. Оказалось, что тромбы, которые образуются в результате эндокардита, в большой своей массе не организованы фибрином и компонентами крови, они состоят из того же вещества, что и вегетация. На первый взгляд при микроскопии я обнаружил нити фибрина с хорошо организованной детритной массой, однако при увеличении стало видно, что они состоят из коротких палочковидных и круглых телец, которые разветвлялись, гранулы с палочковидными тельцами были похожи на бактерии, в то время как нити были похожи на мицелий. Точно такая же структура была обнаружена в эмболах в артериях почек. В этом случае не может быть никаких сомнений, я могу наверняка утверждать, что это не посмертные изменения" [3].
Сэр Самуэль Вилкс (1824-1911 гг.), британский врач, дал блестящее описание инфекционного эндокардита в статье "Capillary embolism or arterial pyaemia" (1870 г.), впервые расценив "артериальную пиемию" с лихорадкой и артралгиями как феномен распространения "частей фибрина" в сосуды малого диаметра. Спустя 3 года Винга Джалмар Хейберг (1837-1897 гг.), профессор-патологоанатом из Норвегии, при вскрытии 22-летней девушки с клиническими симптомами сепсиса (лихорадка, озноб, артралгии, поражение кожи по типу эризипелоида), развившимися после родов, выявил поражение митрального клапана по типу "язвенного эндокардита" с множественными вегетациями, а также многочисленные инфаркты в почках и селезенке. Образец клапана был отправлен Рудольфу Вирхову, который описал выявленные микроорганизмы, как "вибрионы". Важно подчеркнуть, что классификация микроорганизмов по методам окрашивания еще не была известна в 1872 году. Метод окрашивания бактерий был открыт в середине 1880-х годов Г.К. Грамом.
В 1884 году Биром Брамвелл (1847-1931 гг.), врачневролог из Эдинбурга, опубликовал обзор всех имеющихся данных об этом заболевании к 1880 году (рис. 2), включая этиологию, патологоанатомическую картину, клинические проявления, дифференциальный диагноз, прогноз и коротко лечение. Он отметил, что левосторонний ИЭ встречается чаще, чем правосторонний, детально описал такие варианты поражения, как веге тация, абсцесс створки и аневризма, перфорация створки, разрушение хорды, представил несколько иллюстраций пораженных клапанов при эндокардите. Вегетации Брамвелл описал следующим образом: "Вегетации могут быть всевозможных размеров и форм, они, как правило, сероватого цвета и часто представляют собой гранулоподобные, грибоподобные образования или выглядят как цветная капуста, иногда их поверхность гладкая, но, как правило, поверхность очень рыхлая, а сами вегетации плотно прикреплены к эндокарду", "при микроскопии основание вегетации состоит из тонкого слоя эндокарда и прилежащих тканей, в котором большое количество частиц в виде гранул и микрококков; большая часть вегетации состоит из фибрина, в центре которого находятся элементы крови и обломки клеток и там также огромное количество микрококков, иногда даже они образуют шар большого размера". Он также предположил, что эндокардиальное поражение может быть "первичным источником, через который инфекция попадает в другие системы" или "проявлением общего гнойного септического процесса".
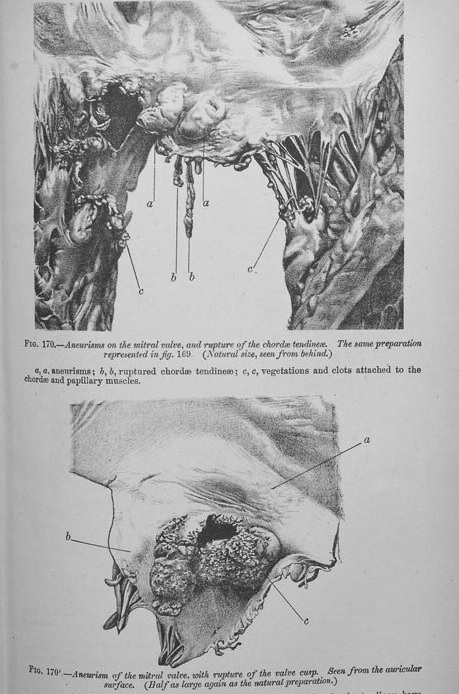
Большой вклад в современное представление об инфекционном эндокардите внес канадский врач сэр Уильям Ослер (1849-1919 гг.). В 1881 году он опубликовал свою статью "On some points in the etiology and pathology of ulcerative endocarditis", в которой признал определенную роль микрококков в патогенезе эндокардита и выразил мнение, что эти агенты могут быть причиной развития эндокардита: "Если мы будем изучать условия, при которых развивается эндокардит, мы практически всегда находим, что пациенты – это объекты, которые конституционально предрасположены к этому заболеванию. Что определяет форму эндокардита, мы не знаем, но мягкие вегетации на эндокарде – подходящий очаг для развития микрококков". Через несколько лет в Lancet были опубликованы Галсто нианские лекции Ослера о злокачественном эндокардите в виде серии из трех статей, представлявших собой анализ более 200 случаев эндокардита, описанных в литературе и собственного наблюдения. Распределение клапанных поражений было следующим: у 41 пациента были поражены аортальный и митральный клапаны, у 53 – только аортальный клапан, у 77 – только митральный. Трикус пидальный клапан был поражен в 19 случаях, клапан легочной артерии – в 15 и стенка сердца – в 33, более подвержены эндокардиту были пациенты со "склерозированием или мальформацией клапана". У. Ослер отметил, что "клапаны чаще поражены вдоль линии закрытия, створки митрального клапана со стороны ушка, створки аортального клапана со стороны желудочков". Он представил очень точное описание клапанных вегетаций, впервые описал тот факт, что тромбоциты, соединенные фибрином, также входили в состав вегетации (причем они были принесены сюда током крови, а не произведены самой вегетацией), подчеркнул, что микрококки были постоянными элементами, составляющими вегетацию, а окрашивание по Граму – самым надежным методом их идентификации.
У. Ослер предложил простую классификацию эндокардита, основанную на клинической картине, и отверг используемую терминологию, основанную на анатомических особенностях ("язвенный эндокардит", "бородавчатый эндокардит"). Он выделил две формы болезни, которые описывал как простой и злокачественный эндокардит: "простой протекает с небольшим количеством легких симптомов и имеет благоприятный прогноз, а злокачественный – с тяжелыми нарушениями, обширным поражением клапанов с изъязвлением и выростами на них." Также У. Ослер отмечал, что "название "острый" должно быть использовано для обозначения тех форм, которые сопровождаются пролиферацией [вегетации] и экссудацией с поверхности эндокарда, в отличие от хронической".
Особое внимание У. Ослер уделял вопросам диагностики, отмечая вариабельность симптомов заболевания: "различия в манифестации болезни и разнообразие симптомов, которые могут возникнуть, являются теми трудностями, которые не дают сформулировать удовлетворительную клиническую картину при описании заболевания". По его мнению, наличие неправильной лихорадки и эмболического синдрома достаточно для подтверждения диагноза. Помимо описания общих симптомов: лихорадка, разная по интенсивности, сопровождающаяся рвотой и головной болью, делирий, потливость, симптомы кардиальной патологии, такие как боль, сердцебиение, шумы, признаки эмболий в головной мозг (бред, кома, паралич), почки (гематурия, боли в животе), в сетчатку (снижение зрения), он выделил варианты субклинических групп с конкретной симптоматикой и методами диагностики для каждой.
В 1908 году У. Ослер опубликовал свой большой труд "Endocardites infectieuses chroniques" о длительном течении эндокардита у 10 пациентов (продолжительность заболевания составляла от 4 до 13 месяцев), который он писал в течение 20 лет. Наиболее часто идентифицированным микроорганизмом стал стрептококк. Это было первое описание подострого бактериального эндокардита (который также называли эндокардитом Ослера).
В конце XIX века Хьюго Риберт (1855-1920 гг.) представил эксперимент, в котором он индуцировал развитие ИЭ. Он вводил кроликам культуру S. aureus, которую культивировал на картофеле, а затем выделял этот штамм на поверхности и хордах митрального клапана. В том же году В. Высокович (1854-1912 гг.) получил колонию бактерий, введенную в кровоток кролика после предварительной скарификации аортального клапана через сонную артерию. Основываясь на результатах экспериментов, были сделаны два основных вывода: 1) первично развитие небактериального тромботического эндокардита; 2) колонизация эндокарда циркулирующими в крови бактериями.
Таким образом, к концу XIX – началу ХХ века было сформировано представление об ИЭ как болезни, связанной с предшествующей клапанной патологией, имеющей входные ворота, циркулирующие микроорганизмы, сопровождающейся лихорадкой и внесердечными проявлениями [1].
Эндокардит в XX веке
В начале XX века Томас Дживс Хордер (1871-1955 гг.), английский врач, под влиянием выступлений У. Ослера издал сборник с описанием 150 случаев ИЭ с патологоанатомическими иллюстрациями, целью которого было образование врачей. Было подчеркнуто, что большую роль в развитии ИЭ играют врожденные пороки сердца или предшествующее поражение клапанов, возможными входными воротами инфекции являются желудочнокишечный тракт и ротовая полость, в качестве основного возбудителя выделен стрептококк (в 60% случаев), представлено описание микотических аневризм. Также Хордер предложил свою классификацию эндокардита: латентная, фульминантная, острая, хроническая и подострая формы.
Благодаря достижениям в технике окрашивания по Граму некоторые исследователи, такие как Х. Шот мюл лер, Э. Либман, стали активно развивать знания о микробиологии эндокардита. Их исследования сильно обогатили наше понимание этиологической роли микроорганизмов в развитии инфекционного эндокардита. Хьюго Шотмюллер (1867-1936 гг.), немецкий врач, опубликовавший монографию "Endocarditis lenta" в 1910 году, впервые выделил отдельные возбудители ИЭ – кокки и зеленящий стрептококк при различных поражениях клапанов, подчеркнул важность специфичного бактериального агента в этиологии эндокардита. Эмануил Либман (1872-1946 гг.), блестящий американский врач, внес огромный вклад в развитие учения об инфекционном эндокардите. Проведенные им микробиологические исследования показали, что большинство случаев острого эндокардита были вызваны обычными стрептококками, стафилококками, пневмококками и гонококками, но эти микроорганизмы не встречались ни в одном случае при подостром эндокардите.
В 1909 году Э. Либман и Целлер обобщили результаты наблюдения пациентов с "подострым инфекционным эндокардитом", у которых заболевание протекало от четырех месяцев до года (иногда до 1,5 лет), и привели подробное описание клинической и патологоанатомической картины: "лихорадка была во всех наблюдаемых случаях, временами интермиттирующая, временами достигала больших цифр с ознобом или без, иногда были диспепсические синдромы. Потливость была зафиксирована во всех случаях, так же как прогрессирующая слабость и похудание. Селезенка почти всегда была увеличена и хорошо пальпировалась. Боли были, как правило, постоянными, на коже болезненные эритематозные узелки, диагностическая ценность которых была ранее отмечена Ослером, который назвал эти узелки "патогномоничным" признаком ИЭ. Также довольно часто мы наблюдали микро- или макрогематурию. Вскрытие было проведено у 19 человек, по результатам мы получили следующее распределение клапанных поражений: у 10 человек – митральный клапан, у 2 – аортальный, у 7 – одновременное поражение митрального и аортального клапанов. Процесс, как правило, начинался на измененном клапане, обычно у таких пациентов в анамнезе были указания на ревматические атаки. Поражение было по типу "вегетации", не "язвы". При поражении аортального клапана процесс перемещался вниз на стенку желудочка и далее на створки митрального клапана. Если же процесс начинался с митрального клапана, то вегетация находилась на створках со стороны предсердия и распространялась далее на стенку предсердия и в ушко. При этом поражение ушка было массивнее, чем поражение самого клапана".
В 1924 году Либман и Сакс представили первое описание иммуноопосредованного поражения клапанов сердца (например, при системной красной волчанке) с образованием небактериальных вегетаций. Этот тип эндокардита стал известен как "болезнь ЛибманаСакса" [3].
Джордж Байер (1887-1978 гг.), американский врач, в своей работе дал первое наиболее полное описание поражения почек при подостром бактериальном эндокардите по типу гломерулонефрита, отметив "патологическое повреждение клубочков почек", частое выделение зеленящего стрептококка.
В начале XX века накопилось достаточно клинических данных об инфекционном эндокардите, но эффективного метода лечения этого заболевания так и не было. В 1930-х годах были попытки лечить пациентов, искусственно повышая им температуру тела (гиперпирексия), которые не увенчались успехом. Жерар Домак, немецкий бактериолог и патологоанатом, экспериментируя с различными красителями и пытаясь найти возможный препарат против инфекционных агентов, описал эффекты пронтосила против стрептококковой инфекции у мышей, а позже выделил его активный компонент, описанный как сульфаниламид. В начале 1940-х годов сульфаниламиды стали использовать для лечения ИЭ и даже было доложено несколько успешных случаев, однако после клинического улучшения отмечалось прогрессирование заболевания. Большую надежду возлагали на сообщение Лихтмана и Бирмана, которые сообщили об эффективном использовании сочетания сульфаниламидов с гиперпирексией у 4 (16%) из 25 пациентов. Есть серия наблюдений, когда в течение 10 лет 200 больным ИЭ вводили сульфаниламиды (сульфаниламид, сульфапиридин, сульфатиазол).
При этом только 12 пациентов были полностью излечены. Тогда же сообщалось об эффективности одновременного назначения гепарина, искусственной гипертермии и внутривенного введения вакцины против брюшного тифа.
Революцию в лечении бактериальных инфекций, в том числе ИЭ, произвело открытие пенициллина, полученного из мицелия грибов. Благодаря усилиям нобелевских лауреатов Александра Флеминга, Говарда Флори и Эрнста Чейна началась эра эффективного лечения ИЭ. В 1945 году Доусон и Хантер пришли к выводу, что ИЭ, вызванный зеленящим стрептококком, может быть с успехом вылечен пенициллином. Авторы использовали от 80 000 до 500 000 Ед в сутки внутривенно или внутримышечно каждые 3 часа от 10 до 62 дней совместно с гепарином. Через три месяца после завершения лечения у 14 (70%) из 20 пациентов отсутствовали признаки инфекции. Стало понятно, что ИЭ может быть излечимым заболеванием. Однако отмечались и случаи неконтролируемой инфекции, не отвечающей на лечение антибактериальными препаратами. Появились гипотезы о возможности прямого вмешательства на сердце и удаления очага инфекции, но концепция невмешательства была сильнее, она опиралась на возможный высокий риск летальных исходов у пациентов с лихорадкой и сердечной недостаточностью. Эндрю Дж. Волос и соавт. из университета Дюка первыми поняли, что удаление инфицированного клапана и замена его клапанным протезом должны уменьшить признаки сердечной недостаточности и нормализовать температуру тела. В 1963 году 45-летнему инженеру с ИЭ аортального клапана, вызванным клебсиеллой и безуспешно леченным колицимином и канамицином, с нарастающими признаками сердечной недостаточности, провели первое в мире протезирование клапана. Это был также первый случай, когда вегетацию и перфорацию створки увидели in vivo. Авторы посчитали результат успешным: в послеоперационном периоде уменьшились симптомы сердечной недостаточности и все культуры крови были отрицательными в течение 15 месяцев наблюдения после операции. В 1965 году было проведено первое протезирование митрального клапана у больного с активным инфекционным процессом.
Важным этапом изучения инфекционного эндокардита стало открытие метода прижизненной визуализации вегетаций – в 1970-х годах Харви Фейгенбаум ("Father of Echocardiography") собрал серию наблюдений, в которой обращалось внимание на визуализацию вегетаций при эхокардиографии в М-режиме. В 1980 году Д. Стюарт и соавт. из университета Дюка доложили о том, что у 54% пациентов с ИЭ удалось выявить вегетации при эхокардиографии.
Важным этапом изучения инфекционного эндокардита стало открытие метода прижизненной визуализации вегетаций – в 1970-х годах Харви Фейгенбаум ("Father of Echocardiography") собрал серию наблюдений, в которой обращалось внимание на визуализацию вегетаций при эхокардиографии в М-режиме. В 1980 году Д. Стюарт и соавт. из университета Дюка доложили о том, что у 54% пациентов с ИЭ удалось выявить вегетации при эхокардиографии.
Многие авторы пытались разработать критерии диагностики ИЭ. В 80-х годах были предложены критерии Beth Israel или критерии фон Рейна, основанные на клинической картине, однако они не учитывали результаты эхокардиографии. Еще одним недостатком данных критериев была возможность установления диагноза определенного ИЭ только на основании патологоанатомического вскрытия. Получалось, что врачи лечили пациентов только с возможным и вероятным диагнозом.
В 1990-х годах университет Дюка сделал огромный вклад в развитие знаний об ИЭ. В 1994 году Дэвид Дюрак и соавт. из университета Дюка систематизировали и обобщили данные об ИЭ, в том числе собственные, и заменили патологоанатомический критерий обнаружения вегетации на эхокардиографический, что легло в основу новой классификации. Авторы выделили определенный, возможный и отвергнутый диагноз ИЭ. При этом определенный диагноз можно было установить при жизни пациента. Университетом Дюка были разработаны критерии диагностики с использованием модификации Дюрака и принципа Томаса Дукетта Джонсона (1899-1954 гг.), который предложил разделять критерии на большие и малые. Таким образом, эхокардиография и культура крови имели одинаковый вес в диагностике ИЭ и служили большими критериями. Это привело к увеличению чувствительности диагностики. Два больших критерия или один большой критерий и три малых давали основания уже для определенного диагноза ИЭ, а не вероятного, как при использовании критериев фон Рейна.
В XX веке основными возбудителями ИЭ были стрептококки и стафилококки, к концу столетия возросла доля стафилококков, что отражало распространение внутривенной наркомании и увеличение числа ВИЧ-инфицированных пациентов. При дальнейшем изучении спектра возбудителей ИЭ была выделена группа грамотрицательных бактерий, названная НАСЕК (аббревиатура по первым буквам следующих микроорганизмов Haemophilus aphrophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae), а также Bartonella spp., Coxiella burnetii. Историческая связь ревматизма и ИЭ к концу столетия потеряла свою актуальность из-за достаточно низкой частоты ревматической болезни сердца. Однако ожидаемого снижения распространенности эндокардита с уменьшением случаев ревматизма не произошло, а в конце XX века на первый план вышли другие этиологические факторы. К концу столетия увеличилась частота грибкового эндокардита в послеоперационном периоде, у внутривенных наркоманов и пациентов с иммунодефицитом.
В 1997 году в США American Heart Association выпустила первые рекомендации по антибактериальному лечению ИЭ. В 1998 году в Великобритании рабочая группа Британской ассоциации микробиологов опубликовала национальные рекомендации по антибактериальному лечению эндокардита. В том же году европейская рабочая группа по ИЭ общества внут ренних болезней и клинической фармакологии выпустила рекомендации по антибактериальному и хирургическому лечению эндокардита.
Наряду с успехами в лечении ИЭ с конца XX века сильно возросла устойчивость к антибактериальным препаратам, что вызвало беспокойство в медицинском сообществе по всему миру. Для борьбы с угрозой пов семестной резистентности к антибактериальным пре паратам в "постантибактериальную эру" мировая фармацевтическая промышленность стала производить все новые и новые препараты, включая карбапенемы (имипенем, меропенем и эртапенем), оксазолидиноны (линезолид) и противогрибковые препараты (вори ко назол), которые продлевали антимикробный эффект до тех пор, пока вновь не вставала проблема устойчивости.
Эндокардит в России
В России о язвенном эндокардите у больных сепсисом впервые заговорил И.Н. Вирхов (1856 г.), который уже тогда рассматривал это заболевание как первичное. К. Ро зенбаху (1878 г.), а несколько позже В.К. Высо ковичу (1879 г.) удалось воспроизвести ИЭ в эксперименте [4].
Затяжной септический эндокардит впервые диагностировали и описали В.И. Ильинский, М. Шах-Паро нианц (1864 г.), которые были ассистентами клиники госпитальной терапии Московского университета, руководимой профессором И.В. Варвинским. Они впервые выделили две клинико-анатомические формы – первичный и вторичный ИЭ [5].
Большой вклад в описание эндокардита как самостоятельной нозологической формы болезни внес А.П. Ланговой (1884 г.), который описал четыре случая заболевания, в трех из которых был зарегистрирован "переход" острого течения в затяжное. Спустя год А.Н. Остроумов и А.П. Ланговой (1885 г.) доказали, что по патогенезу эндокардит не имеет ничего общего с ревматизмом [6].
Дальнейшее изучение ИЭ связано с именами Е.И. Марцинковского, который в работе на тему: "Об этиологии и патологической анатомии острого эндокардита" впервые представил данные о том, что эндокардит не имеет специфического возбудителя и развивается при "заражении организма различными бактериями" (1896 г.), и Т.Г. Лукина, ученика А.А. Остроумова, впервые описавшего геморрагии в конъюн ктиву глаз (симптом Лукина) в статье "Яз венный злокачественный эндокардит" (1909 г.) [4,7].
Значительный вклад в изучение эндокардита в первой половине XX столетия внесли С.С. Зимницкий (1926 г.), Г.М. Зорохович (1926 г.), К.Ф. Флеров (1926 г.), А.С. Позов (1926 г.), Д.О. Крылов (1928 г.), А.Н. Рубель (1929 г.), Н.К. Горяев (1935 г.) [4,5,7].
В годы Великой Отечественной войны и послевоенные годы отмечалось резкое увеличение заболеваемости эндокардитом, что привело к росту смертности до 78-92%. В это время на страницах периодической медицинской литературы развернулась дискуссия между Г.Ф. Лангом и Б.А. Черногубовым (1941 г.) по вопросу патогенеза затяжного варианта септического эндокардита. Академик Г.Ф. Ланг считал это заболевание эволютивной формой ревматизма, а Б.А. Черногубов отдельной нозологической формой, которая развивается на неповрежденных клапанах [7]. В декабре 1948 года дискуссия между учеными нашла свое разрешение на Московской областной клинической конференции, где получило признание учение Б.А. Черногубова. После публикаций работ автора о различии в поражении клапанов сердца при эндокардите и ревматизме с его концепцией согласились Г.Ф. Ланг, М.А. Скворцов, Э.М. Гельштейн, Е.М. Тареев, А.Н. Мясников и другие видные отечественные клиницисты. В 1949 году на 12-м съезде терапевтов СССР было предложено понимать под затяжным септическим эндокардитом стрептококковый первичный эндокардит с длительным течением и называть его "болезнью Черногубова" [7]. Впос лед ствии А.А. Демин характеризовал затяжной септический эндокардит как стрептококковый первичный эндокардит с длительным течением и преобладанием иммунопатологических проявлений. Название "болезни Черногубова" в дальнейшей практике не прижилось.
Открытие пенициллина ознаменовало начало нового этапа в изучении заболевания. В России первый советский пенициллин был получен З.В. Ермольевой в 1942 году. Наступление эры антибиотиков давало надежду на разрешение трудных проблем в лечении болезни, однако стали появляться штаммы бактерий, резистентные к антибиотикам, изменилась реактивность организма, возникла новая проблема множественной лекарственной резистентности. Большой вклад в разработку вопросов диагностики и лечения эндокардита внесли Н.Н. Стражеско, С.А. Гиляревский, И.В. Давыдовский, В.Т. Талалаев, Б.А. Черногубов, А.И. Струков, Е.М. Тареев, А.А. Демин [4-6]. Вплоть до 80-х годов XX века в отечественной медицине болезнь носила название бактериального эндокардита. Другой особенностью изучения бактериального эндокардита являлось создание усовершенствованных клинических критериев диагностики (Т.Л. Виноградова в 1996 г. и В.П. Тюрин в 2001 г.) Связано это, с одной стороны, с исторически сложившимся в отечественной медицине тщательным вниманием к клинической картине болезни, а, с другой стороны, со слабой материально-технической базой – ограниченной возможностью проведения эхокардиографии в широкой клинической практике и отсутствием чувствительных микробиологических сред. Следующий этап изучения ИЭ в России связан с периодом активного внедрения и усовершенствования эхокардиографии и других методов визуализации, развитием кардиохирургии и альтернативных хирургических методов лечения. Все это позволило эффективно лечить самые тяжелые формы ИЭ. Этому посвящены работы Ю.Л. Шевченко, В.И. Францева, В.Т. Селиваненко, Г.И. Цукермана, Г.Г. Хубулава, Г.М. Соловьева, С.А. Матвеева, Ю.Л. Кон стантинова, Н.Н. Шихвердиева, И.М. Чере панина и многих других [4,8]. Наиболее интенсивно лечение больных ИЭ, в том числе хирургическое, традиционно развивалось в Москве и Ленинграде, а в восточной части СССР – в Новосибирске, в клинике А.А. Демина и Ал.А. Демина совместно с кардиохирур гами НИИ патологии кровообращения Е.Н. Мешал кина. Здесь же были впервые изучены нарушения системы гемостаза при ИЭ (А.С. Мильто) и новая для постсоветского пространства, быстро и широко распространившаяся форма ИЭ – эндокардит инъекционных нар команов (А.А. Демин, В.П. Дробышева, О.Ю. Вель тер).
Несмотря на достижения в диагностике и лечении, ИЭ по-прежнему характеризиуется частым развитием тяжелых осложнений и высокой летальностью, в связи с чем дальнейшее изучение этого заболевания остается актуальным. Для улучшения результатов лечения ИЭ необходима "командная" работа врачей различных специальностей: терапевтов, кардиологов, кардиохирургов, инфекционистов, микробиологов, специалистов функциональной диагностики, рентгенологов. Активно изучаются новые формы и проявления болезни, изменения иммунитета, поражение почек при ИЭ, возможности эхокардиографии, радионуклидного исследования в диагностике заболевания, эффективность экстракорпоральной гемокоррекции, новых методов молекулярной диагностики, включая молекулярно-биологические. Разрабатываются принципы и алгоритмы антибактериальной терапии и профилактики.
В изучение ИЭ на современном этапе внесли большой вклад работы отечественных и зарубежных врачей: М.И. Теодори, Е.Е. Гогина, А.В. Сумарокова, А.А. Демина, Л.В. Козловской, Н.А. Мухина, В.П. Тю ри на, Ал.А. Демина, В.П. Дробышевой, Т.Л. Вино градовой, И.П. Татарченко, О.А. Белокриницкой, O.М. Буткевича, Б.Я. Барта, М.А. Гуревича, С.Л. Дземешкевича, P.M. Муратова, И.И. Скопина, C.F. Reyn, B.S. Levy, R.D. Arbeit, G. Friedland, C.S. Crum packer, D.T. Durack, A.S. Lukes, D.K. Bright, A.S. Dajani, K.A. Taubert, L. Weinstein, G. Goodman, G.Habib и многих других.
Эндокардит в XXI веке
XXI век ознаменовался развитием микробиологических и визуализирующих методов диагностики ИЭ. В 2000 году результаты нескольких исследований привели к обновлению критериев Дюка. Дженнифер С. Ли (профессор педиатрического факультета университета Дюка) с коллегами выпустили обновленные критерии диагностики. В 2002 году в Великобритании Беверли С. Миллар добавила к критериям диагностики молекулярно-биологические методы. В своем исследовании она использовала метод полимеразной цепной реакции (ПЦР) путем амплификации специального универсального локуса гена бактерий (16S rRNA) и грибов (18S, 28S, 5.8S rRNA) с последующим секвенированием для выявления возможного микробного агента в культуре крови 47 больных и ткани клапана 30 пациентов с подозрением на ИЭ. Результаты показали, что у всех пациентов с определенным или возможным ИЭ результаты ПЦР были положительными, даже у тех из них, чья культура крови или материал клапана были культуроне гативными. У пациентов с неподтвержденным ИЭ результат ПЦР был отрицательным, за исключением одного пациента с бактериемией из другого источника и 5 пациентов, образцы крови которых были загрязнены. Был сделан вывод о том, что молекулярные методы выявления этиологического агента ИЭ могут быть более специфичными, позволяя быстрее диагностировать болезнь и назначить этиотропное лечение. В связи с этим обсуждалось включение ПЦР в критерии диагностики Дюка [10]. В России исследование крови и тканей клапанов у больных ИЭ молекулярно-биологическими методами с 2012 года проводится в терапевтической клинике акад. В.С. Моисеева.
В последние десятилетия появились отдельные сообщения о новых микроорганизмах, способных вызывать ИЭ, таких как Finegoldia spр., Gemella spp., Abiotrophia defectiva, Tropheryma whipplei и Coxiella burnetii. В 2004 году появились публикации о том, что частой причиной культуронегативного ИЭ у пациентов с факторами риска (неблагоприятные условия жизни, алкоголизм, пороки сердца и держание дома кошек) являются бактерии рода Bartonella (Bartonella quintana – у алкоголиков и Bartonella henselae – у хозяев кошек). Диагноз устанавливали только на основании ПЦР. В своих публикациях авторы настоятельно подчеркивали необходимость внесения молекулярных методов в критерии диагностики Дюка в качестве большого критерия [11]. В 2003 году появились данные о большой ценности в диагностике ИЭ серологических тестов, особенно при идентификации таких возбудителей, как Bartonella spp., Coxiella spp. (лихорадка-Ку), Chlamydia spp., Mycoplasma spp., Legionella spp., Brucella spp. и грибы [13,14]. В 2007 году были опубликованы сообщения о том, что некоторые возбудители (Tropheryma whipplei, Bartonella quintana и Streptococcus gallolyticus) могут быть выделены только методом ПЦР [12]. В 2009 году вышла статья о еще одном перспективном методе прямой идентификации возбудителя в крови – матрично-активированной лазерной десорбции/ионизации (МАЛДИ) [15]. В 2015 году был описан случай ИЭ, вызванного Mycoplasma hominis. У 74-летней пациентки диагноз был подтвержден результатами ПЦР и гистологического исследования ткани клапана сердца. До этого в литературе было описано всего 8 случаев ИЭ, обусловленного микоплазмой [17]. В этом же году был описан первый случай ИЭ протезированного клапана, вызванного Corynebacterium kroppenstedtii [18].
В новом столетии достижения в области технологий визуализации значительно повлияли на повседневную практику врачей в диагностике ИЭ: появилась чрес пищеводная эхокардиография, трехмерная эхокар диография, послойная компьютерная томография, магнитно-резонансная томография, позитронно-эмиссионная томография и радионуклидное сканирование. В 2004, 2009 годах Европейское общество кардиологов выпускало рекомендации по профилактике, диагностике и лечению инфекционного эндокардита. Последняя обновленная версия вышла в 2015 году.
Эндокардит у известных людей
Австрийский дирижер Густав Малер (1860-1911 гг.), страдавший хронической ревматической болезнью сердца с поражением митрального клапана, осенью 1910 года перенес несколько тяжелых ангин. С февраля 1911 года у него появилась лихорадка, однако он продолжал давать концерты. После обращения к одному из самых влиятельных венских врачей Е. Либману, Малеру было проведено бактериологическое исследование культуры крови, и обнаружен зеленящий стрептококк. Пациенту были назначены пробиотики. Самочувствие его улучшилось, однако в начале мая 1911 года в крови вновь обнаружили возбудителя. Болезнь стала прогрессировать и осложнилась септическими эмболиями в разные органы. 18 мая 1911 года Малер скончался [18, 19].
Отторино Респиги (1879–1936 гг.) – итальянский композитор, умер в возрасте 57 лет от ИЭ. Первые симптомы заболевания в виде сильной слабости у Респиги появились еще в конце 1935 года, когда он работал над оперой "Лукреция". В январе 1936 года в крови был выделен зеленящий стрептококк. Для лечения композитора из Берлина были доставлены сульфаниламиды, но лечение оказалось неэффективным [20].
Один из самых известных поэтов Шотландии Роберт Бернс (1759–1796 гг.) также страдал ИЭ. Он умер в июле 1796 года в возрасте 37 лет. Некоторые историки утверждают, что в подростковом возрасте Бернс работал на юго-западе Шотландии на ферме своего отца и там заболел ангиной, которая позже привела к острой ревматической лихорадке, которая стала предрасполагающим фактором для развития ИЭ. Бернса осматривал Уильям Максвелл (1760–1834 гг.), который описал симптомы как подагру и советовал принимать солевые ванны и катание на лошади, что, очевидно, еще больше усугубило болезнь. Определенный вклад в развитие болезни могло внести злоупотребление алкоголем [21].
Самым известным врачом, умершим от ИЭ, был Алоис Альцгеймер (1864–1915 гг.), который стал известен своей статьей "Unusual disease of the cerebral cortex" ("неизвестное заболевание коры головного мозга"). Болезнь была названа в честь Альцгеймера его учителем в Мюнхенской медицинской школе Эмилем Кре пе лином. Альцгеймер был также со-основателем и соиздателем журнала "Zeitschrift f ü r die gesamte Neurologie und Psychiatrie". Последней занимаемой должностью Альцгеймера стала должность профессора психиатрии в университете Бреслау (сейчас Вроцлав, Польша), на которой он провел последние 3 года своей жизни. Перенеся тяжелую простуду в возрасте 51 года, он умер от ИЭ [22].
Орвилл Гибсон (1856–1918 гг.), известный производитель гитар, стал еще одним музыкантом, который умер от ИЭ. Гибсон получил патент на производство своей собственной конструкции гитары и основал корпорацию "Gibson Guitar Company". В 1902 году у него начались проблемы со здоровьем, как с физическим, так и психическим, и до 1911 года он находился в государственной больнице Святого Лаврентия в Нью-Йорке. В августе 1916 года Гибсон был госпитализирован в психиатрический центр, где и умер 21 августа 1918 года от ИЭ [23].
Рудольф Валентино (1895-1926 гг.), известный актер немого кино, также страдал ИЭ и умер в возрасте 31 года [24].
Двадцать лет назад эндокардит стал причиной смерти Джона Гласкока (1951–1997 гг.), бас-гитариста рокгруппы Jethro Tull. У Гласкока был абсцесс в полости рта, который, вероятно, и стал входными воротами для инфекции. ИЭ в возрасте 5 лет перенес Брайн Литтрел, солист группы Backstreet Boys (у него был врожденный дефект межжелудочковой перегородки). У молодого американского актера Себастьяна Хитзига ИЭ развился после использования зубочистки, контаминированной S. aureus [24].
Используемые источники
- Grinberg M, S):1–112. olimene MC. Historical aspects of infective endocarditis. Rev Assoc Med Bras 2011;57(2):228-33
- Laennec R. De l'auscultation mediate ou Traite du diagnostic des maladies des poumons et du coeur 1819;2:334.
- http://www.themitralvalve.org/mitralvalve.
- Николаевский Е.Н., Калабашкин А.Ф. Инфекционный эндокардит на рубе- же тысячелетий: эволюция клинической картины и течения. Самарский медицинский журнал 2004;1-2:22-4.
- Резник И.И. Инфекционный эндокардит за четверть века: клинико-морфо- логическая эволюция, лечебная тактика, прогнозирование: Автореф. дис. ... докт. мед. наук. Екатеринбург, 2002, 47 с.
- Насонова В.А. Ревматическая лихорадка в ХХ веке. Тер архив 1998;9:41-4.
- Ланг Г.Ф. Инфекционный эндокардит. Болезни системы кровообращения. Руководство для врачей. М.: Медгиз, 1957:297-32.
- Шевченко Ю.Л., Хубулава Г.Г., Шихвердиев Н.Н. и др. Инфекционный эндокардит как хирургическая проблема в России. Вестник хирургии им. И.И. Грекова 2003;2:12-7.
- Тюрин В.П. Инфекционные эндокардиты: руководство. М.: ГЭОТАР- Медиа, 2012;1:12-15.
- Millar B, Moore J, Mallon P, Xu J, et al. Molecular diagnosis of infective endo- carditis a new Duke's criterion. S):1–112. cand J Infect Dis 2008;33:673–80.
- Todd S):1–112. , Xu J, Millar BC, et al. Culture-negative Bartonella endocarditis in a patient with renal failure: the value of molecular methods in diagnosis. Br J Biomed S):1–112. ci 2004;61(4):190-3.
- Marín M, Muñoz P, S):1–112. ánchez M, et al. Molecular diagnosis of infective endo- carditis by real-time broad-range polymerase chain reaction (PCR) and sequenc- ing directly from heart valve tissue. Medicine (Baltimore) 2007;86(4):195-202.
- Li JS):1–112. , S):1–112. exton DJ, Mick N, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis 2000;30(4):633-8.
- Fournier PE, Casalta JP, Habib G, et al. Modification of the diagnostic criteria proposed by the Duke Endocarditis S):1–112. ervice to permit improved diagnosis of Q fever endocarditis. Am J Med 1996;100(6):629-33.
- S):1–112. cola B, Raoult D. Direct identification of bacteria in positive blood culture bot- tles by matrix-assisted laser desorption ionisation time-of-flight mass spectrome- try. PLoS):1–112. One 2009;4:11-8041.
- Gagneux-Brunon A, Grattard F, Morel J, et al. Mycoplasma hominis, a rare but true cause of infective endocarditis. J Clin Microbiol 2015;53(9):3068-71.
- Hagemann JB, Essig A, Herrmann M, et al. Early prosthetic valve endocarditis caused by Corynebacterium kroppenstedtii. Int J Med Microbiol 2015;15:1438-4221.
- Contrepois A Towards a history of infective endocarditis. Med Hist 1996;40: 25–54.
- Rietschel ET. Immortal music and deadly septicemia: death of famous composers by bacterial blood poisoning. Endotoxin Newsletter 2000;10:4–5.
- http://www.robertburns.org/encyclopedia/DeathofBurns.278.shtml.
- http://www.asmt.org/Aloisbio.htm.
- http://www.siminoff.net/pages/gibson_background.html.
- http://www.geocities.com/~rudyfan/rv-chron4.htm.
- http://tinpan.fortunecity.com/tigerlilies/234/article026.html.
