Оценка краткосрочной эффективности и безопасности биоаналога ритуксимаба при АНЦА-ассоциированных васкулитах
Изучение эффективности и безопасности биоаналога ритуксимаба (Ацеллбия®, ЗАО "БИОКАД", Россия) в лечении АНЦА-ассоциированных васкулитов.
В исследование включали пациентов с АНЦА-ассоциированным васкулитом, диагноз которого был установлен в соответствии с критериями, принятыми на конференции в Чапел-Хилл (2012 г.), и критериями Американской коллегии ревматологов. Все пациенты получали терапию ритуксимабом. Активность васкулита оценивали с помощью индекса BVAS v.3. У всех пациентов измеряли число CD19+-лимфоцитов в крови.
В исследование были включены 42 пациента с АНЦА-ассоциированными васкулитами, в том числе 29 – с гранулематозом с полиангиитом, 12 – с микроскопическим полиангиитом и 1 – с эозинофильным гранулематозом с полиангиитом. У 10 пациентов ритуксимаб применяли для индукционной терапии, в том числе у 2 – в качестве препарата первой линии. Тридцать два пациента получали поддерживающую терапию ритуксимабом. Медиана длительности наблюдения составила 12 мес (6;26). Через 1 и 3 месяца после начала терапии у всех пациентов наблюдалась деплеция В-лимфоцитов. Через 6 мес репопуляция В-лимфоцитов выявлена у 9 (20%) пациентов. Индукционная терапия ритуксимабом привела к снижению медианы индекса BVAS с 16 (10;24) до 1 (0;4) через 3 мес и до 0 (0;2) через 6 мес. При поддерживающей терапии ритуксимабом признаки активности васкулита отсутствовали как через 3, так и 6 мес. Нежелательные явления включали в себя инфузионные реакции умеренной степени тяжести (у 2), мочевую (у 3) и бронхолегочную инфекции (у 5),гипогаммаглобулинемию (у 2), сохранявшуюся в течение 12 месяцев, и остроченную нейтропению (у 1).
Биоаналог ритуксимаба был эффективным и относительно безопасным препаратом в терапии АНЦА-ассоциированных васкулитов.
Генно-инженерные биологические препараты (ГИБП), согласно определению Европейского агентства по лекарствам (EMA), – это лекарственные средства, активной субстанцией которых является биологическое вещество, полученное или выделенное из биологического источника при помощи биотехнологических методов (технология рекомбинантной ДНК, методы гибридом и моноклональных антител и т.д.). В ревматологии ГИБП обычно применяют в случае резистентности заболевания к терапии стандартными иммуносупрессивными средствами.
Системные васкулиты, ассоциированные с антителами к цитоплазме нейтрофилов (АНЦА), включают в себя гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА). Выделяют две фазы лечения АНЦА-ассоциированного васкулита – индукцию ремиссии (обычно в течение 3-6 месяцев) и поддерживающую терапию, которую продолжают в течение по крайней мере 2 лет. Стандартная схема индукционной терапии предполагает применение циклофосфа мида внутрь или внутривенно в сочетании с глюкокортикостероидами. После достижения ремиссии дозу кортикостероидов постепенно снижают (в идеале до 7,5 мг или полной отмены), циклофосфамид отменяют и назначают поддерживающую терапию (чаще всего применяют азатиоприн, реже – метотрексат, а при их непереносимости – лефлуномид или мико фе нолат мофетил) [1-3]. В последние годы как для индукционной, так и поддерживающей терапии АНЦАассоциированных васкулитов используют ритуксимаб, вызывающий деплецию CD20+-лимфоцитов. В рекомендациях Европейской антиревматической лиги (EULAR) по лечению АНЦА-ассоциированных васкулитов, опубликованных в 2016 г., указано, что ритуксимаб может быть использован не только при наличии резистентности к циклофосфамиду, но и как препарат первой линии [4].
Сложная методика производства ГИБП определяет их высокую стоимость, а также невозможность получения точной копии оригинального препарата, в связи с чем воспроизведенные препараты называют не “дженериками”, а “биоаналогами” [5]. Завершение патентов на некоторые биологические препараты привело к увеличению количества биоаналогов на отечественном и зарубежном рынке (около 20 новых препаратов за последние годы) [6]. Преимуществом биоаналогов перед оригинальными ГИБП является более низкая стоимость, однако важное значение имеет подтверждение их сопоставимой эффективности и безопасности. Перед регистрацией биоаналогов проводится многоступенчатый анализ свойств воспроизведенного и оригинального биологического препаратов. В его основе лежат сравнительные исследования in vitro, направленные на оценку структурных и функциональных различий между биоаналогом и оригинальным препаратом. Доклинические исследования in vivo должны проводиться на чувствительном к действию препарата виде животного. Цель клинических исследований – доказать эквивалентность показателей фармакокинетики, фармакодинамики (при наличии соответствующих маркеров), безопасности, эффективности и иммуногенности биоаналога и оригинального биологического препаратов в целевой популяции пациентов. Для оценки эффективности и безопасности биоаналогов могут быть использованы также результаты неконтролируемых исследований, которые проводятся в обычной клинической практике.
Материал и методы
В исследование включали пациентов с ГПА, МПА и ЭГПА, диагноз которых соответствовал определениям Амери канской коллегии ревматологов (ACR) и современной классификации, принятой на конференции в Чапел-Хилл (США) в 2012 г. [7,8]. Все пациенты подписали информированное согласие на введение биоаналогичного препарата.
В исследование включали пациентов с ГПА, МПА и ЭГПА, диагноз которых соответствовал определениям Амери канской коллегии ревматологов (ACR) и современной классификации, принятой на конференции в Чапел-Хилл (США) в 2012 г. [7,8]. Все пациенты подписали информированное согласие на введение биоаналогичного препарата.
Для оценки активности определяли Бирмингемский индекс активности (BVAS):1–112. v.3). У всех пациентов измеряли количество CD19+-лимфоцитов.
Был проведен описательный статистический анализ с помощью программы IBM S):1–112. PS):1–112. S):1–112. S):1–112. tatistics 19. Для качественных переменных приведены число и процент, для количественных – медианы и межквартильный размах.
Результаты
Характеристика пациентов. В исследование были включены 42 пациента с различными АНЦА-ассоциированными васкулитами, в том числе 29 – с ГПА, 12 с МПА и 1 – с ЭГПА (табл. 1). Среди пациентов преобладали женщины. Средний возраст составил 54,2±6,5 лет. У 25 (59,5%) больных были выявлены АНЦА к протеиназе-3, у 13 (30,9%) – АНЦА к миелопероксидазе. У 30 больных диагноз был подтвержден при гистологическом исследовании биоптатов слизистой оболочки верхних дыхательных путей или орбиты.
| Показатели | Значение |
|---|---|
| Средний возраст, годы | 54,2±6,5 |
| Женщины, n | 27 |
| Диагноз, n | |
| ГПА | 29 |
| МПА | 12 |
| ЭГПА | 1 |
| Висцеральные проявления, n | |
| Поражение легких/геморрагический альвеолит | 32/12 |
| Поражение почек/БПГН | 30/10 |
| Поражение верхних дыхательных путей | 34 |
| Подскладочный стеноз гортани | 6 |
| Поражение органа зрения | 16 |
| Гранулема орбиты | 4 |
| Поражения органа слуха | 12 |
| Поражение периферической нервной системы | 8 |
| Рецидив заболевания, n | 40 |
| АНЦА, n | 38 |
| Антитела к миелопероксидазе | 13 |
| Антитела к протеиназе-3 | 25 |
У большинства больных наблюдалось поражение легких и почек, в том числе с развитием геморрагического альвеолита у 12 (28,5%) и быстропрогрессирующего гломерулонефрита (БПГН) у 10 (23,8%). Поражение верхних дыхательных путей выявлено у 34 (80,9%) пациентов, органа зрения – у 16 (38,1%), подскладочный стеноз гортани – у 5 (11,9%).
Характеристика терапии. У 10 больных ритуксимаб применяли для индукции ремиссии, в том числе у 2 – в качестве препарата первой линии. Восемь пациентов получали индукционную терапию ритуксимабом при развитии обострения васкулита (ранее для индукционной терапии использовали циклофосфамид или метотрексат). У 32 больных проводили поддерживающую терапию ритуксимабом. Биоаналог ритуксимаба использовали в качестве поддерживающего препарата после индукционной терапии ритуксимабом (у 28 пациентов), циклофосфамидом (у 3) или метотрексатом (у 1). Медиана стартовой дозы преднизолона составила 50 мг (40;80) в группе пациентов, получавших индукционную терапию, и 5 мг (0;7,5) в группе пациентов, получающих поддерживающую терапию (рис. 1).
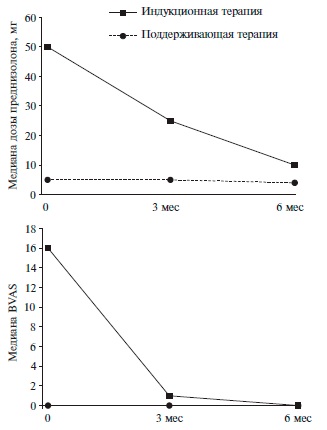
Оценка эффективности терапии. Медиана наблюдения составила 12 месяцев (6;26). У всех 10 пациентов индукционная терапия ритуксимабом позволила достичь ремиссии АНЦА-ассоциированного васкулита. Медиана BVAS):1–112. снизилась с 16 (10;24) до 1 (0;4) через 3 мес и до 0 (0;2) через 6 мес (рис. 2), а медиана дозы преднизолона – до 25 мг (15;40) и 10 мг (5;20), соответственно (рис. 1).
У пациентов, получавших поддерживающую терапию ритуксимабом, медиана значений BVAS):1–112. указывала на отсутствие активности (0;1) как через 3, так и 6 мес. У 8 пациентов были полностью отменены глюкокортикостероиды.
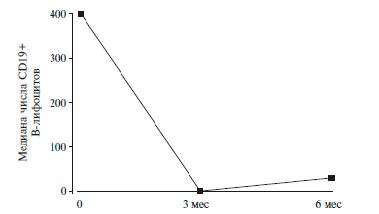
Через 1 и 3 мес у всех пациентов наблюдалась деплеция В-лимфоцитов (рис. 2). Через 6 мес репопуляция В-лимфоцитов выявлена у 9 (20%) пациентов.
Оценка безопасности терапии. Профиль безопасности биоаналогичного препарата ритуксимаба был удовлетворительным. Инфузионные реакции умеренной степени тяжести, которые не потребовали отмены препарата, зарегистрировали у 2 (4,8%) пациентов. Ин фек ционные осложнения отмечались у 8 (19,0%) пациентов и включали в себя инфекции мочевыводящих путей у 3 и инфекции дыхательных путей у 5. Во всех случаях антибактериальные препараты применяли внутрь с положительным эффектом. У 2 (4,8%) пациентов отмечена гипогаммаглобулинемия (снижение концентрации IgG до 3 и 4 г/л), сохраняющаяся в течение 12 мес, но не осложнившаяся тяжелыми инфекциями. У 1 (2,4%) пациента наблюдалась отсроченная лейко- и нейтропения со снижением количества лейкоцитов до 2,2×109/л и нейтрофилов до 0,5×109/л на 8-й месяц. Применение гранулоцитно-макрофагального колониестимулирующего фактора в течение 3 дней привело к нормализации количества лейкоцитов и нейтрофилов.
Обсуждение
Результаты нашего исследования продемонстрировали высокую эффективность и приемлемую безопасность индукционной и поддерживающей терапии биоаналогом ритуксимаба у больных различными АНЦА-ассоциированными васкулитами, прежде всего ГПА и МПА. Ремиссия системного васкулита при лечении ритуксимабом была достигнута у всех 10 пациентов в течение 3-6 мес после начала терапии. Поддерживающая терапия у 32 пациентов также была эффективной и позволяла удержать ремиссию, достигнутую ранее при лечении ритуксимабом или другими иммуносупрессивными препаратами. Нежелательные эффекты биоаналога ритуксимаба были типичными для этого препарата (инфекционные осложнения, инфузионные реакции и др.), однако они встречались относительно нечасто, были легкими или умеренно выраженными и не потребовали отмены препарата.
Эффективность индукционной терапии ритуксимабом у больных АНЦА-ассоциированными васкулитами (ГПА и МПА) была установлена в двух регистра ционных исследованиях RITUXVAS):1–112. и RAVE [9,10]. В рандомизированное контролируемое исследование RITUXVAS):1–112. были включены 44 больных АНЦА-ассоциированными васкулитами, которым с целью индукции ремиссии вводили ритуксимаб или циклофосфамид внутривенно в сочетании с глюкокортикостероидами [9]. После индукции ремиссии пациентов контрольной группы через 3-6 месяцев переводили на поддерживающую терапию азатиоприном, в то время как пациенты группы ритуксимаба продолжали только прием кортикостероидов. Ритуксимаб по эффективности и безопасности не уступал стандартной терапии. Частота стойкой ремиссии через 12 мес в основной и контрольной группах составила 76% и 82%, соответственно.
В рандомизированное двойное слепое исследование RAVE-ITN были включены 197 пациентов тяжелым АНЦА-ассоциированным васкулитом, которым проводили терапию кортикостероидами в комбинации с ритуксимабом (4 инфузии по 375 мг/м 2 в неделю) или циклофосфамидом внутрь (2 мг/кг) [10]. В случае достижения ремиссии пациенты группы ритуксимаба получали плацебо, а пациенты группы циклофосфамида – азатиоприн 2 мг/кг. Частота ремиссии в сочетании с отменой кортикостероидов (первичная конечная точка) через 6 месяцев в двух группах была сходной и составила 64% в группе ритуксимаба и 53% в группе циклофос фамида. Однако у пациентов с рецидивом васкулита индукционная терапия ритуксимабом по эффективности достоверно превосходила стандартную терапию (67% и 42%, соответственно; р=0,01). Частота нежелательных явлений была сходной в двух группах. Таким образом, ритуксимаб по эффективности не уступал циклофосфамиду во всей выборке и превосходил его у пациентов с рецидивом АНЦА-ассоциированного васкулита. В отличие от циклофосфамида, ритуксимаб не ухудшает репродуктивную функцию, поэтому в первую очередь его целесообразно применять у пациентов более молодого возраста.
Эффективность и безопасность поддерживающей терапии ритуксимабом изучались в рандомизированном контролируемом исследовании MAINRITS):1–112. AN у 115 пациентов с ГПА, МПА или АНЦА-ассоциированным гломерулонефритом, у которых была достигнута полная ремиссия васкулита при применении циклофосфамида и глюкокортикостероидов [11]. Больные основной группы получали ритуксимаб в дозе 500 мг исходно и через 12 недель, а затем через 5, 12 и 18 мес, в то время как у пациентов группы сравнения проводили терапию азатиоприном в течение 22 мес. Через 28 мес частота рецидивов в группе ритуксимаба была достоверно ниже, чем в группе азатиоприна (5% и 29%, соответственно, отношение рисков 6,61, р=0,002), в то время как частота тяжелых нежелательных явлений, прежде всего инфекционных осложнений, достоверно не отличалась между двумя группами. Таким образом, в этом исследовании поддерживающая терапия ритуксимабом по эффективности превосходила длительное лечение азатиоприном при сопоставимой безопасности двух препаратов. Следует отметить, что схема терапии азатиоприном предполагала снижение его дозы с 2 до 1,5 мг/кг через 12 мес, а затем до 1,0 мг/кг, что могло отразиться на эффективности препарата.
Недавно были опубликованы результаты рандомизированного исследования MAINRITS):1–112. AN2, в котором у 162 больных ГПА или МПА сравнивали эффективность двух схем поддерживающей терапии ритуксимабом [12]. Пациентам основной группы проводили инфузию ритуксимаба в дозе 500 мг после рандомизации, а повторно препарат вводили только в случае увеличения количества CD19+B-лимфоцитов или титра АНЦА, которые контролировали каждые 3 мес в течение 1,5 лет. В группе сравнения ритуксимаб вводили в дозе 500 мг исходно и через 14 дней, а затем каждые 6 мес в течение 1,5 лет. В течение 28 мес частота рецидивов была выше в основной группе, однако разница не достигла статистической значимости (17,3% и 9,9%, соответственно; р=0,22). При этом общее количество инфузий ритуксимаба в основной группе снизилось примерно в 1,5 раза (248 и 381, соответственно). Пере носимость двух схем поддерживающей терапии была сходной. Низкая частота рецидивов в исследовании MAINRITS):1–112. AN2 подтверждает эффективность поддерживающей терапии ритуксимабом у больных ГПА и МПА. Более того, полученные данные показали, что введение ритуксимаба под контролем количества CD19+ B-лимфоцитов или титра АНЦА не сопровождается ухудшением эффективности лечения, но позволяет значительно сократить число инфузий препарата.
Вопрос об эффективности использования ритуксимаба при ЭГПА до сих пор остается спорным в связи с отсутствием рандомизированных клинических исследований. По данным ретроспективного анализа опыта применения препарата в различных центрах у 41 пациента с ЭГПА, частота полной ремиссии через 6 месяцев составила 35%, а через 12 месяцев – 49% [13]. Мы применяли биоаналог ритуксимаба только у 1 пациента с ЭГПА, у которого поддерживающая терапия препаратом была эффективной и безопасной. Мы также использовали оригинальный ритуксимаб для индукционной терапии у 6 больных рецидивирующим ЭГПА [14]. Все они быстро ответили на лечение ГИБП (исчезновение инфильтратов в легких, уменьшение астматических симптомов, по крайней мере частичное восстановление двигательной или сенсорной функции). В течение 3-6 мес полная (4/6) или частичная (2/6) ремиссия была достигнута у всех пациентов. Четыре больных продолжили поддерживающую терапию ритуксимабом. Следует отметить, что частота нежелательных явлений в этой небольшой серии была достаточно высокой. У одного пациента развился тяжелый бронхоспазм во время инфузии препарата, а у двух пациентов мы наблюдали средне-тяжелый бронхит, потребовавший внутривенного введения антибиотиков. В целом эффективность и безопасность ритуксимаба у больных ЭГПА нуждаются в дополнительном изучении, поэтому в настоящее время этот препарат целесообразно использовать только при рецидивирующем течении заболевании, которое не удается контролировать стандартными иммуносупрессивными препаратами, а также при наличии противопоказаний к назначению последних. С целью подтверждения эффективности и безопасности терапии ритукси мабом у больных ЭГПА проводятся многоцентровые рандомизированных ис сле дования REOVAS):1–112. и MAINRITS):1–112. EG.
Для практикующего врача определенное значение имеет проблема замены референтного ГИБП биоаналогом. В рекомендациях ВОЗ уточняется, что решение по замене может приниматься только по согласованию с лечащим врачом, а не фармацевтом/провизором или организатором здравоохранения [15]. Согласно рекомендациям EULAR 2017 года, замена оригинального препарата биоаналогом допустима, однако должна производиться под контролем лечащего врача и с ведома пациента [16]. Данное положение содержится также в рекомендациях Ассоциация ревматологов России [17].
Мы не изучали экономические аспекты применения биоаналога ритуксимаба вместо оригинального препарата. При их сопоставимой эффективности и безопасности можно ожидать значительного сокращения затрат, учитывая более низкую стоимость биоаналогичного препарата. М.О. Лабеко и соавт. провели клиникоэкономическую оценку использования пре паратов Мабтера® и Ацеллбия ® для монотерапии пациен тов с CD-положительными B-клеточными неходжкинскими лимфомами в условиях российской системы здравоохранения методом анализа миними зации затрат [18]. Экономия при замещении ориги нального препарата препаратом Ацеллбия® при монотерапии одного пациента достигала 34 913–46 824 руб. для однократного применения и 139 654–187 294 руб. на курс лечения.
Очевидными ограничениями нашего исследования были небольшое число включенных пациентов, отсутствие контрольной группы и непродолжительный срок наблюдения. Для подтверждения взаимозаменяемости оригинального ритуксимаба и биоаналога в лечении АНЦА-ассоциированных васкулитов необходимы крупные рандомизированные сравнительные клинические исследования. Целью нашего исследовании было обобщить опыт применения биоаналога ритуксимаба у достаточно большой (с учетом относительной редкости системных васкулитов) группы пациентов с различными АНЦА-ассоциированными васкулитами. Получен ные данные свидетельствуют о том, что биоаналог ритуксимаба (Ацеллбия®) может быть использован для индукции и подержания ремиссии ГПА и МПА.
Заключение
Использование биоаналогов ГИБП в ревматологии позволяет обеспечить современными лекарственными средствами большее число пациентов с различными ревматическими заболеваниями, в том числе АНЦАассоциированными васкулитами. Тем не менее,эффективность и безопасность биоаналогов должны быть подтверждены результатами тщательно спланированных доклинических и клинических исследований. Для биоаналога ритуксимаба производства ЗАО “БИОКАД” доказана терапевтическая эквивалентность референтному препарату у онкогематологических больных и пациентов с ревматоидным артритом [19,20]. Результаты нашего неконтролируемого клинического исследования продемонстрировали высокую эффективность и приемлемую безопасность индукционной и поддерживающей терапии биоаналогом ритуксимаба (Ацеллбия) у больных АНЦА-ассоциированными васкулитами.
Используемые источники
- Новиков П.И., Моисеев С.В., Кузнецова Е.И. и др. Изменение клинического течения и прогноза гранулематоза с полиангиитом (Вегенера): результаты 40-летнего наблюдения. Клин фармакол тер 2014;23(1):32-7.
- S):1–112. anders J, S):1–112. lot M, S):1–112. tegeman C. Maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies. N Engl J Med 2003;349: 2072-3.
- Holle J, Gross W, Latza U et al. Improved outcome in 445 patients with Wegener's granulomatosis in a German vasculitis center over four decades. Arthritis Rheum 2011;63(1):257-66.
- Yates M, Watts R, Bajema I et al. EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann Rheum Dis 2016;75(9):1583-94.
- Новиков П.И, Моисеев С.В. Биоаналогичные лекарственные препараты – перспективы использования в ревматологии. Клин фармакол тер 2015; 24(1):13-17.
- Dörner T, Kay J. Biosimilars in rheumatology: current perspectives and lessons learnt. Nat Rev Rheumatol 2015;11(12):713-24.
- Masi A, Hunder G, Lie J et al. The American College of Rheumatology 1990 criteria for the classification of Churg-S):1–112. trauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990;33(8):1094-100.
- Jennette J, Falk R, Bacon P, et al. 2012 revised International Chapel Hill Con sensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013;65: 1-11.
- Jones R, Cohen Tervaert J, Hauser T et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med 2010;363(3):211-20.
- S):1–112. tone J, Merkel P, S):1–112. piera R et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med 2010;363(3):221-32.
- Guillevin L, Pagnoux C, Karras A et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med 2014;371(19):1771-80.
- Charles P, Terrier B, Perrodeau E, et al. Comparison of individually tailored versus fixed schedule rituximab regimen to maintain ANCA-associated vasculitis remission: results of a multicentre, randomised controlled, phase III trial (MAINRITS):1–112. AN2). Ann Rheum Dis 2018. doi:10.1136/annrheumdis-2017-212878.
- Mohammad A, Hot A, Arndt F, et al. Rituximab for the treatment of eosinophilic granulomatosis with polyangiitis. Ann Rheum Dis 2016;75:396-401.
- Novikov P, Moiseev S):1–112. , S):1–112. mitienko I, Zagvozdkina E. Rituximab as induction therapy in relapsing eosinophilic granulomatosis with polyangiitis: A report of 6 cases. Joint Bone S):1–112. pine 2016;83(1):81-4.
- World Health Organization Expert Committee on Biological S):1–112. tandardization. Guidelines on evaluation of similar biotherapeutic products (S):1–112. BPs). World Health Organization [online], http://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS):1–112. _FOR_WEB_22APRIL2010.pdf (2009).
- Kay J, S):1–112. choels M, Dorner T et al., Consensus-based recommendations for the use of biosimilars to treat rheumatological diseases. Ann Rheum Diseases 2017;77(2):165-174.
- Насонов Е.Л. Биоаналоги в ревматологии. Научно-практическая ревматология 2017;54(6):628-640.
- Лабеко М.О., Белькова Ю.А., Козлов С.Н. Перспективы использования пре парата Ацеллбия® для импортозамещения препарата Мабтера® в рамках монотерапии CD-положительных В-клеточных неходжкинских лимфом. Клин фармакол тер 2017;26(5):88-91.
- Капланов К.Д., Зарицкий А.Ю., Алексеев С.М. и др. Начало эры применения биоаналогов моноклональных антител в онкологии: современные международные рекомендации и результаты исследования первого российского биоаналога ритуксимаба у больных В-клеточной неходжкинской лимфомой. Современная онкология 2014;16(2):38-44.
- Насонов Е.Л., Зонова Е.В., Иванова О.Н. и др. Результаты сравнительного клинического исследования III фазы препаратов ритуксимаба (Ацеллбия® и Мабтера®) при ревматоидном артрите (исследование BIORA). Научнопрактическая ревматология 2016;54(5):510-9.
