Практические аспекты использования биомаркеров в диагностике нозокомиальной пневмонии: анализ литературы и собственные исследования
Нозокомиальная пневмония (НП) – одно из самых серьезных заболеваний, связанных с оказанием медицинской помощи. Своевременное выявление НП и НП, ассоциированной с искусственной вентиляцией легких (НП ИВЛ), представляет сложную клиническую задачу ввиду недостаточно высокой чувствительности и/или специфичности существующих методов диагностики. В статье представлен обзор клинических исследований биомаркеров воспаления у пациентов с НП и НП ИВЛ, анализируются перспективы их применения в качестве предикторов риска ее возникновения, оценки клинических исходов и прогнозирования ответа на антибактериальную терапию (АБТ). Приведены результаты пилотного проспективного исследования чувствительности различных биомаркеров сыворотки крови в диагностике нетяжелой НП у взрослых в многопрофильном стационаре.
Проблема поиска и внедрения в клиническую практику простых и объективных лабораторных биомаркеров является одной из актуальных для современной медицины [1]. Их востребованность определяется недостаточной специфичностью большинства клинических симптомов в ранней диагностике конкретных заболеваний, а также известными ограничениями инструментальных исследований. Роль биомаркеров не ограничивается более точной диагностикой заболеваний. Потенциальными “точками приложения” могут быть определение тяжести состояния пациента, краткосрочного и долгосрочного прогноза, объективная оценка ответа на проводимую терапию, а в случае инфекций – вероятности инфицирования определенными группами патогенов (например, вирусами или бактериальными возбудителями) [1,2]. Основными требованиями, предъявляемыми к биомаркерам, являются: 1) простота выполнения; 2) вы сокая специфичность и чувствитель ность; 3) бы стро та получения результата; 4) невысокая стоимость иссле дования.
К числу непростых для врача диагностических и терапевтических проблем относится нозокомиальная пневмония (НП). Нозокомиальной (госпитальной, внутрибольничной) считают пневмонию, которая развивается у пациента через 48 ч и более после госпитализации при отсутствии симптомов и признаков легочной инфекции на момент поступления в стационар [3,4]. НП, развивающуюся через >48 ч от момента интубации и начала проведения ИВЛ, выделяют в отдельную группу (НПИВЛ) [3]. НПИВЛ отличается высокой атрибутивной летальностью и значительными затратами на лечение [5,6].
Заболеваемость НП |ИВЛ широко варьируется и, по разным данным, составляет от 2 до 16 случаев на 1000 дней вентиляции [7]. Возможная причина столь большого разброса лежит в отсутствии единых критериев постановки диагноза, что приводит как к гипо-, так и гипердиагностике [8,9]. Спектр заболеваний и состояний, с которыми необходимо проводить дифференциальную диагностику при подозрении на НП, включает распространенные повреждения паренхимы легких – острый респираторный дистресс-синдром, тромбоэмболию легочной артерии, послеоперационные ателектазы, нозокомиальный трахеобронхит и др. [3]. Необходимо отметить, что традиционно применяющаяся рентгенография органов грудной клетки характеризуется умеренной чувствительностью и специфичностью в диагностике НПИВЛ, а широкое использование компьютерной томографии высокого разрешения (КТВР) ограничено высокой стоимостью и невозможностью выполнения исследования у постели больного [3].
Наиболее изученными лабораторными биомарке рами при НП помимо количества лейкоцитов периферической крови являются С-реактивный белок, прокальцитонин и растворимая форма триггерного рецептора, экспрессированного на миелоидных клетках I типа [10,11].
С-реактивный белок
С-реактивный белок (СРБ) – это один из самых известных биомаркеров воспаления и тканевого повреждения [12]. Его роль изучалось при различных инфекциях, таких как пневмония, абсцесс легкого, эндокардит, остеомиелит, острая ревматическая лихорадка, сепсис. Внедрение в практику высокочувствительных методов идентификации СРБ существенно расширило диагностические возможности его использования при заболеваниях неинфекционной природы [13]. Перспективы применения СРБ при НП и НПИВЛ оценивались многими исследователями с точки зрения возможности повышения точности диагностики заболевания, оценки исхода, определения эффективности антибактериальной терапии (АБТ).
Q. Lin и соавт. изучали диагностическую ценность концентрации СРБ в сыворотке крови у пациентов, находящихся на ИВЛ >48 ч, в рамках проспективного когортного исследования [14]. Медиана уровня СРБ в группе пациентов с НПИВЛ оказалась достоверно выше, чем у пациентов без НП: 125,8 (85,31-234,8) мг/л и 81,92 (62,94-112,5) мг/л, соответственно (p<0,001). При пороговом значении СРБ >112,7 мг/л специфичность и чувствительность диагностики НП ИВЛ составили 76,0% и 61,6%, соответственно, площадь под ROC-кривой – 0,715±0,044. В другом исследовании у пациентов с НПИВЛ уровень СРБ при пороговом значении ≥196,9 мг/л характеризовался менее высокой чувствительностью (56%), но более высокой специфичностью (91%) [15].
В 2016 году Р. Póvoa и соавт. провели многоцентровое проспективное наблюдательное исследование BioVAP (Biomarkers in the diagnosis and management of ventilator-associated pneumonia) у 138 пациентов отделений реанимации и интенсивной терапии (ОРИТ), которым проводилась ИВЛ >72 ч. У 35 (25,4%) пациентов развилась НПИВЛ, у 33 (23,9%) – другая нозокомиальная инфекция. Оставшиеся 70 (50,7%) пациентов без признаков инфекции и АБТ составили контрольную группу [16]. Концентрация СРБ в сыворотке у пациентов с НПИВЛ была существенно выше контрольной – скорректированное отношение шансов (ОШ) составило 1,202 (95% доверительный интервал [ДИ] 1,061, 1,363, p=0,004). Достоверные отличия выявлены при оценке скорости прироста и степени повышения уровня СРБ по сравнению с исходным значением с первого по шестой день ИВЛ [16]. Чем быстрее увеличивалась концентрация СРБ, тем выше была вероятность развития НПИВЛ. Так, риск развития НПИВЛ при увеличении концентрации СРБ на 1 мг/дл в день был на 62% выше, чем при отсутствии такого подъема. При ежедневном повышении уровня СРБ на каждые 10% по сравнению с исходным риск развития НП ИВЛ возрастал на 20%. Максимальная разница между наибольшим и наименьшим показателем с первого по шестой день также была достоверно ассоциирована с развитием НПИВЛ (ОШ 1,139, 95% ДИ 1,039, 1,248, p=0,006). Увеличение максимальной разницы концентрации СРБ на 1 мг/дл сопровождалось повышением риска развития НП ИВЛ на 14%. Авторы исследования пришли к выводу, что ежедневный мониторинг СРБ позволяет надежно прогнозировать риск развития НП ИВЛ, а его использование в дополнение к клиническим данным и шкале оценки инфекции легких (CPIS):1–112. ) может повысить точность диагностики заболевания.
Этой же группой исследователей было показано, что мониторинг уровня СРБ является хорошим предиктором адекватности ответа на АБТ, а также риска летального исхода у пациентов в ОРИТ c микробиологически подтвержденной НП ИВЛ [17]. Кинетика содержания СРБ достоверно отличалась между выжившими и умершими. На 4-й день лечения концентрация СРБ у выживших составила 47% от исходной против 96% среди умерших, при этом адекватная АБТ ассоциировалась с меньшим риском смерти и более быстрым снижением уровня СРБ.
В более раннем пилотном исследовании Р. P óvoa и соавт. у 47 пациентов с НП ИВЛ были получены сходные результаты. На 4-e сутки АБТ уровень СРБ у выживших и умерших пациентов составил 62% и 98%, соответственно, по сравнению с исходным значением [18]. По характеру изменений концентрации СРБ на фоне лечения пациенты были разделены на 4 группы: быстрый ответ, медленный ответ, отсутствие ответа и двухфазный ответ (снижение и последующее повышение концентрации СРБ выше исходной). Все пациенты первых двух групп выжили, в то время как в третьей и четвертой группе летальность составила 78% и 75%, соответственно. Адекватность стартовой АБТ оказывала значимое влияние на скорость снижения уровня СРБ сыворотки и летальность.
Возможность использования мониторинга сывороточного СРБ для оценки эффективности АБТ пациентов с НП ИВЛ подтверждена также в исследовании В. Kiaei и соавт. [19]. В данной работе уровень СРБ измеряли исходно и каждые 48 ч до окончания АБТ. С 4-го дня лечения отмечено снижение концентрации СРБ, достигшее достоверной разницы к окончанию терапии по сравнению с исходным значением.
Прокальцитонин
Прокальцитонин (ПКТ) – растворимый белок, состоящий из 116 аминокислот и являющийся предшественником кальцитонина. Он обычно поступает в системный кровоток при развитии тяжелого системного воспаления (особенно в случае инфицирования бактериальными возбудителями) [20]. В клинической практике уровень прокальцитонина широко используют для диагностики сепсиса и септического шока [20,21]. Воз мож ность применения ПКТ также активно изучалась у больных НП. В проведенных исследованиях оценивали перспективы его использования для определения вероятности развития НПИВЛ, оценки эффективности АБТ и риска смерти.
Так, в проспективном исследовании M. Abu Elyazed и соавт. было показано, что уровень ПКТ, наряду с СРБ, является точным прогностическим биомаркером развития НП после абдоминального хирургического вмешательства [22]. Причем на второй день после операции уровень ПКТ характеризовался более высокими чувствительностью и специфичностью по сравнению с СРБ (84% и 72% против 70% и 60%, соответственно).
L. S):1–112. u и соавт. показали высокую эффективность ком бинации ПКТ и шкалы CPIS):1–112. в оценке 28-дневной летальности у критически больных пациентов с сепсисом и присоединившейся НПИВЛ [23].
В цитировавшемся ранее исследовании B. Kiaei и соавт. ПКТ, наряду с СРБ, оказался эффективным маркер ответа на АБТ у пациентов с НПИВЛ, причем снижение его уровня отмечалось уже через 48 ч после начала лечения [19]. Однако стоит отметить, что даже на 10-й день лечения уровень ПКТ оставался повышенным, а при сравнении его динамики у умерших и выживших пациентов достоверных различий не выявлено.
В другом проспективном наблюдательном исследовании у пациентов в возрасте ≥65 лет, находившихся в ОИТ в связи с тяжелой НП, уровень ПКТ сыворотки измеряли при включении, на 3, 7-й день и на момент окончания терапии [24]. Динамика уровня ПКТ на 3-и сутки была лучшим предиктором эффективности лечения – при его снижении на 26,2% специфичность и чувствительность составили 72,0% и 75,7%, соответственно, площадь под ROC-кривой – 0,79 (p<0,001). Комбинация изменения уровня ПКТ (>26,2%) с модифицированной шкалой CPIS):1–112. (сумма баллов <6) характеризовалась еще более высокой надежностью в качестве раннего маркера эффективности АБТ [24].
В то же время кинетика уровня ПКТ с первого по шестой день лечения, изучавшаяся в рамках исследо вания BioVAP у 37 пациентов с микробиологически верифицированной НПИВЛ, обладала низкой информативностью в оценке вероятности неблагоприятного прогноза и ответа на АБТ [17]. Авторы отметили, что быстрое снижение уровня ПКТ у пациентов было связано с более низким риском летального исхода по сравнению с таковым при медленном снижении/отсутствии изменений, но достоверных различий между группами выявлено не было.
Среди возможных объяснений “неудачи” ПКТ авторы данной и ряда других работ упоминают его низкий исходный уровень в момент постановки диагноза у значительной части пациентов, особенно с благоприятным прогнозом [17,25-27]. Еще одной причиной противоречивых результатов исследований может быть разная доля пациентов с почечной недостаточностью, в том числе получавших заместительную почечную терапию. Y. Nakamura и соавт. в ретроспективном наблюдательном исследовании показали, что точность ПКТ в диагностике сепсиса может быть ниже у пациентов с острым почечным повреждением (ОПП), так как почки являются основным органом его элиминации [28].
G. Takahashi и соавт. в более позднем исследовании не обнаружили подобных различий, однако также пришли к выводу о том, что уровень ПКТ может отличаться у пациентов с сепсисом и ОПП, что, вероятнее всего, является результатом более сложных взаимодействий кинетики биомаркера у пациентов с сепсисом и ОПП [29]. В частности, более высокий уровень ПКТ может быть следствием не только нарушенного клиренса, но и исходно более тяжелой инфекции при сепсисе с ОПП. Таким образом, в данных подгруппах для диагностики, видимо, стоит рассматривать разные пороговые уровни или точки отсечения ПКТ.
Опубликованный в 2016 г. мета-анализ клинических исследований показал, что уровень ПКТ является хорошим предиктором летального исхода как при внебольничной пневмонии (ВП), так и НПИВЛ [30]. К ограничениям данной работы необходимо отнести превалирование исследований, проводившихся у пациентов с ВП, и в целом небольшое количество больных НП.
Триггерный рецептор I типа, экспрессируемый на миелоидных клетках (TREM-I)
Триггерный рецептор I типа, экспрессируемый на миелоидных клетках (TREM-I), относится к активирующим рецепторам из суперсемейства иммуноглобулинов и присутствует на мембранах нейтрофилов, макрофагов и моноцитов [31]. TREM-1 опосредует активацию данных клеток, наблюдающуюся при воспалительном ответе на бактерии, грибы и некоторые неинфекционные триггеры [32]. Присутствие рецептора в крови в растворимой форме (soluble TREM-1 – sTREM-1) позволяет использовать его как биомаркер. Проведенные исследования показали, что при определенных условиях sTREM-1 может быть предиктором бактериальной инфекции легких у пациентов ОИТ, а в комбинации с другими биомаркерами и/или шкалами может использоваться для диагностики НПИВЛ.
S):1–112. . Palazzo и соавт. в наблюдательном проспективном исследовании оценивали уровень sTREM-1 в бронхоальвеолярной лаважной жидкости (БАЛЖ) и выдыхаемом воздухе у пациентов ОИТ, которым в связи с подозрением на развитие НПИВЛ выполняли бронхоскопию [33]. Уровень sTREM-1 в БАЛЖ у пациентов с подтвержденной НПИВЛ был выше, а концентрация sTREM-1 в выдыхаемом воздухе была ниже у пациентов, получавших АБТ. Однако эти различия оказались статистически недостоверными, а диагностическая ценность определения sTREM-1 в БАЛЖ и выдыхаемом воздухе была недостаточной для выявления пациентов с НПИВЛ.
Ранее приводившееся исследование L.-Х. S):1–112. u и соавт. у тяжелых больных сепсисом подтвердило возможность использования сывороточной концентрации sTREM-1 в комбинации со шкалой CPIS):1–112. для улучшения диагностики НПивл [23].
V. Grover и соавт. изучали перспективы применения 11 маркеров для диагностики НПИВЛ: 6 клеточных (по 3 для моноцитов и нейтрофилов, соответственно: TREM1, CD11b и CD62L) и 5 растворимых (интерлейкин [ИЛ]-1β, ИЛ-6, ИЛ-8, sTREM-1, ПКТ) [34]. В исследование был включен 91 пациент, в том числе 37 – с подтвержденной НПИВЛ, 33 – на ИВЛ без признаков НП, 31 – без инфекции и не на ИВЛ (контрольная группа). Наряду с исследуемыми биомаркерами у пациентов измеряли сывороточную концентрацию СРБ и число лейкоцитов периферической крови. Концентрацию маркеров определяли в крови и БАЛЖ, затем подсчитывали отношение БАЛЖ/кровь. По отдельности маркеры не представляли диагностической ценности вне зависимости от способа подсчета, однако комбинация из 7 биомаркеров (отношение моноцитарных TREM-1 и CD11b в БАЛЖ/крови; уровни sTREM-1, ИЛ-8 и ИЛ-1β в БАЛЖ; уровни СРБ и ИЛ-6 в крови) позволяла достоверно выявлять пациентов с НП [34]. Однако авторы отметили, что для получения более достоверных результатов нужно провести более крупное многоцентровое исследование.
В мета-анализ J. S):1–112. hi и соавт. были включены 9 исследований (суммарно 510 пациентов), в которых изу ча лась возможность использования уровня sTREM-1 в БАЛЖ у пациентов ОИТ для диагностики бактериальной легочной инфекции [35]. Анализ показал возможность применения данного маркера с хорошей диагностической точностью – чувствительность составила 87% (95% ДИ 0,72-0,95), а специфичность – 79% (95% ДИ 0,56-0,92). Однако использование различных уровней sTREM-1 для диагностики бактериальной легочной инфекции не позволило вывести оптимальное пороговое значение показателя. Кроме того, отдельные исследования отличались широкой вариабельностью популяции пациентов и критериев клинической и лабораторной оценки.
В более поздний мета-анализ W. Ye и соавт., выполненный в 2014 г., были включены 13 исследований и суммарно 1138 пациентов c инфекциями нижних дыхательных путей (ИНДП) [36]. Пациенты были разделены на 4 группы: (1) внебольничные ИНДП; (2) нозокомиальные (внутрибольничные) ИНДП; (3) ИНДП с положительным результатом культурального исследования; (4) ИНДП с отрицательным результатом культурального исследования. Мета-анализ показал, что уровень sTREM-1 (1) одинаково эффективен в диагностике как внутри-, так и внебольничных ИНДП и (2) позволяет дифференцировать культуронегативные и культуропозитивные ИНДП, однако последний вывод должен рассматриваться с некоторыми оговорками ввиду меньшего размера выборки пациентов с доступными результатами культурального исследования. Среди наиболее значимых ограничений мета-анализа необходимо отметить неоднородность популяции больных с ИНДП, использование различных методов определения sTREM-1 и различных источников sTREM-1 [36]. При изучении потенциальных перспектив использования sTREM-1 у пациентов с НП следует учитывать, что он может повышаться при многих других неинфекционных заболеваниях/состояниях [37-38].
Другие биомаркеры
К другим биомаркерам, которые могут представлять определенный интерес при НП, относятся пресепсин, проадреномедуллин, растворимый рецептор урокиназного активатора плазминогена (S):1–112. uPAR) [39]. Иссле до вание T. Hellyer и соавт. показало, что низкие уровни ИЛ-1β в сочетании с ИЛ-8 позволяют надежно исключить НПивл [40].
Наибольшее внимание с точки зрения диагностики и оценки прогноза при серьезных инфекциях в последние годы уделяется пресепсину. Пресепсин – это растворимый N-концевой фрагмент рецептора макрофагов CD14, который в норме присутствует в сыворотке крови в следовых количествах [41,42]. Его концентрация значимо возрастает при тяжелых бактериальных инфекциях, прежде всего сепсисе, и может использоваться для его ранней диагностики и, соответственно, оценки показаний к АБТ, а также прогноза. Однако место пресепсина в диагностике НП остается неопределенным.
Несмотря на значительное число исследований биомаркеров у пациентов с НП следует отметить, что их использование в рутинной практике по-прежнему является предметом обсуждения. Так, в опубликованных в 2016 г. российских клинических рекомендациях подчеркивается, что роль биомаркеров, таких как ПКТ и СРБ, в диагностике НП представляется ограниченной, прежде всего, в силу наличия основного заболевания, которое может приводить к повышению их уровня в крови (травма, включая операционную, инсульт, рак легкого, инфекции другой локализации) [3]. Воз мож ности применения уровня пресепсина для диагностики НП не определены. Эксперты Американского торакального общества и Американского общества по инфекционным болезням также не рекомендуют использовать ПКТ, СРБ и sTREM-1 в рутинной клинической практике для принятии решения о начале АБТ [4]. Другие возможности применения биомаркеров при НП (диагностика, прогноз, оценка эффективности терапии) в клинических рекомендациях не упоминаются.
Данное обстоятельство, вероятно, является подтверждением ограниченной доказательной базы, обусловленной в первую очередь недостатком сравнительных многоцентровых рандомизированных клинических исследований. Следует также отметить, что имеющаяся доказательная база в основном касается пациентов с НПИВЛ, исследования же у пациентов с НП, не связанной с ИВЛ, остаются единичными.
Собственные наблюдения
В пилотное исследование, выполнявшееся на базе Го род ской клинической больницы им. В.В. Вино гра дова в 2016-2017 гг., проспективно включали пациентов с клиническим диагнозом нетяжелой НП, не требовавших перевода в ОРИТ и ИВЛ. Диагностика осуществлялась в соответствии с российскими клиническими рекомендациями [3]. С целью верификации пневмонической инфильтрации всем пациентам проводили компьютерную томографию высокого разрешения. Помимо рутинных лабораторных исследований у пациентов в течение 24 ч определяли сывороточные уровни СРБ, ПКТ, пресепсина. Обработка и статистический анализ данных выполнялись с использованием стандартных процедур и методов. Количественные показатели представлены с учетом характера распределения первичных данных: при параметрическом – в виде среднего арифметического значения ± стандартного отклонения, непараметрическом – в виде медианы и интерквартильного размаха (первым и третьим квартилями), качественные – абсолютными и относительными частотами. Стати стические исследования проводились для двусторонней# гипотезы на уровне значимости 0,05 (различия считали достоверными при р<0,05).
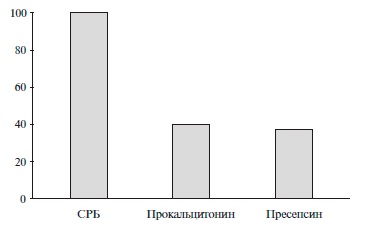
В исследование были включены 30 больных НП, в том числе 16 (54%) мужчин. Средний возраст пациентов составил 67,4±15,0 лет. В выборке преобладали пациенты с поздней НП; у большинства из них имелись хронические сопутствующие заболевания, преимущественно сердечно-сосудистой системы (табл. 1). У всех 30 пациентов на момент включения в исследование выявлено значимое повышение уровня СРБ. Повы ше ние уровня пресепсина и ПКТ регистрировалось достоверно реже (рис. 1). Медианы содержания СРБ, ПКТ и пресепсина составили 129,5 (61;174) мг/л (норма – 0-5 мг/л), 0,28 (0,08;2,67) нг/мл (норма 0-0,5 нг/мл) и 265 (150;372) пг/мл (норма 0-337 пг/мл), соответственно .
| Параметр | Значение |
|---|---|
| Количество пациентов, n | 30 |
| Мужчины, n (%) | 16 (53) |
| Возраст, годы | 67,4±15,0 |
| Поздняя НП, n (%) | 27 (90) |
| Сопутствующие заболевания/синдромы, n | |
| Артериальная гипертония | 20 |
| ИБС | 9 |
| Хроническая сердечная недостаточность | 8 |
| Сахарный диабет | 8 |
| Фибрилляция предсердий | 7 |
| Госпитальная летальность, n (%) | 4 (17) |
Результаты исследования демонстрируют низкую чувствительность ПКТ и пресепсина в ранней диагностике НП по сравнению с СРБ, что, видимо, объяс няется особенностями больных, включенных в исследование, – преимущественно терапевтические пациенты, развитие пневмонии у которых не требовало перевода в ОИТ. Следует отметить, что медиана концентрации СРБ была >100 мг/л, аналогичные показатели ПКТ и пресепсина оказались ниже пороговых значений данных биомаркеров, рекомендуемых производителями диагностических тестов.
Используемые источники
- Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001;69(3):8995.
- Unnewehr M, Kolditz M, Windisch W, et al. Biomarkers in diagnosis, treatmentand prognosis of infectious lung diseases. Pneumologie 2017 Oct 18. doi: 10.1055/s-0043-118676. [Epub ahead of print].
- Нозокомиальная пневмония у взрослых: России ̆#ские национальные рекомендации. Под ред. Б.Р. Гельфанда ̆#. 2-е изд. М., ООО “Издательство “МИА”, 2016, 176 с.
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospitalacquired and ventilator-associated pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases S):1–112. ociety of America and the American Thoracic S):1–112. ociety. Clin Infect Dis 2016;63(5):e61-111.
- Kollef MH, Hamilton CW, Ernst FR. Economic impact of ventilator-associated pneumonia in a large matched cohort. Infect Control Hosp Epidemiol 2012;33: 250–6.
- Melsen WG, Rovers MM, Groenwold RH, et al. Attributable mortality of ventilator-associated pneumonia: a meta-analysis of individual patient data from randomised prevention studies. Lancet Infect Dis 2013;13:665–71.
- Barbier F, Andremont A, Wolff M, et al. Hospital-acquired pneumonia and ventilator-associated pneumonia. Curr Opin Pulm Med 2013;19:216–28.
- Lisboa T, Rello J. Diagnosis of ventilator-associated pneumonia: is there a gold standard and a simple approach? Curr Opin Infect Dis 2008;21:174–8.
- Kollef MH. Ventilator-associated pneumonia. Chest 2015;147:1448–50.
- Fagon J. Biological markers and diagnosis of ventilator-associated pneumonia. Crit Care 2011;15(2):130.
- S):1–112. alluh JIF, S):1–112. ouza-Dantas VC, Póvoa P. The current status of biomarkers for the diagnosis of nosocomial pneumonias. Curr Opin Crit Care 2017;23:391–7.
- Вельков В.В. С-реактивный белок – структура, функция, методы определения, клиническая значимость. Лабораторная медицина 2006;8:1-7.
- Cushman M, Arnold AM, Psaty BM, et al. C-reactive protein and the 10-year incidence of coronary heart disease in older men and women: the cardiovascular health study. Circulation 2005;112(1):25-31.
- Lin Q, Fu F, S):1–112. hen L, et al. Pentraxin 3 in the assessment of ventilator-associated pneumonia: an early marker of severity. Heart Lung 2013;42:139-45.
- Ramirez P, Garcia MA, Ferrer M, et al. S):1–112. equential measurements of procalcitonin levels in diagnosing ventilator-associated pneumonia. Eur Respir J 2008;31:356–62.
- Póvoa P, Martin-Loeches I, Ramirez P, et al. Biomarker kinetics in the prediction of VAP diagnosis: results from the BioVAP study. Ann Intensive Care 2016;6:32.
- Póvoa P, Martin-Loeches I, Ramirez P, et al. Biomarkers kinetics in the assessment of ventilator-associated pneumonia response to antibiotics results from the BioVAP study. J Crit Care 2017;41:91–7.
- Póvoa P, Coelho L, Almeida E, et al. C-reactive protein as a marker of ventilatorassociated pneumonia resolution: a pilot study. Eur Respir J 2005;25(5):804-12.
- Kiaei BA, Ghiasi F, Moradi D. Precalcitonin and C-reactive protein as markers in response to antibiotic treatment in ventilator-associated pneumonia in intensive care unit-hospitalized patients. Adv Biomed Res 2015;4:240.
- Meisner M. Update on procalcitonin measurements. Ann Lab Med 2014;34: 263–73.
- Riedel S):1–112. , Melendez JH, An AT, et al. Procalcitonin as a marker for the detection of bacteremia and sepsis in the emergency department. Am J Clin Pathol 2011; 135:182–9.
- Abu Elyazed MM, El S):1–112. ayed Zaki M. Value of procalcitonin as a biomarker for postoperative hospital-acquired pneumonia after abdominal surgery. Korean J Anesthesiol 2017;70:177–83.
- S):1–112. u LХ, Meng K, Zhang X, et al. Diagnosing ventilator-associated pneumonia in critically ill patients with sepsis. Am J Crit Care 2012;21(6):e110-9.
- S):1–112. hi Y, Xu YC, Rui X, et al. Procalcitonin kinetics and nosocomial pneumonia in older patients. Respir Care 2014;59:1258–66.
- S):1–112. eligman R, Meisner M, Lisboa TC, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia. Crit Care 2006;10:R125.
- Jung B, Embriaco N, Roux F, et al. Microbiogical data, but not procalcitonin improve the accuracy of the clinical pulmonary infection score. Intensive Care Med 2010;36:790–8.
- Luyt C-E, Guérin V, Combes A, et al. Procalcitonin kinetics as a prognostic marker of ventilator-associated pneumonia. Am J Respir Crit Care Med 2005; 171:48–53.
- Nakamura Y, Murai A, Mizunuma M, et al. Potential use of procalcitonin as biomarker for bacterial sepsis in patients with or without acute kidney injury. J Infect Chemother 2015;21:257–63.
- Takahashi G, S):1–112. hibata S):1–112. , Fukui Y, et al. Diagnostic accuracy of procalcitonin and presepsin for infectious disease in patients with acute kidney injury. Diagn Microbiol Infect Dis 2016;86:205–10.
- Liu D, S):1–112. u L, Guan W, et al. Prognostic value of procalcitonin in pneumonia: A systematic review and meta-analysis. Respirology 2016;21:280–8.
- Bouchon A, Dietrich J, Colonna M. Cutting edge: inflammatory responses can be triggered by TREM-1, a novel receptor expressed on neutrophils and monocytes. J Immunol 2000;164:4991–5.
- Bouchon A, Facchetti F, Weigand MA, et al. TREM-1 amplifies inflammation and is a crucial mediator of septic shock. Nature 2001;410:1103–7.
- Palazzo S):1–112. J, S):1–112. impson TA, S):1–112. immons JM, et al. S):1–112. oluble triggering receptor expressed on myeloid cells-1 (sTREM-1) as a diagnostic marker of ventilatorassociated pneumonia. Respir Care 2012;57:2052–8.
- Grover V, Pantelidis P, S):1–112. oni N, et al. A biomarker panel (Bioscore) incorporating monocytic surface and soluble TREM-1 has high discriminative value for ventilator-associated pneumonia: a prospective observational study. PLoS):1–112. One 2014; 9:e109686.
- S):1–112. hi JX, Li JS):1–112. , Hu R, et al. Diagnostic value of sTREM-1 in bronchoalveolar lavage fluid in ICU patients with bacterial lung infections: A bivariate meta-analysis. PLoS):1–112. One 2013;8(5):e65436.
- Ye W, Hu Y, Zhang R, et al. Diagnostic value of the soluble triggering receptor expressed on myeloid cells-1 in lower respiratory tract infections: A meta-analysis. Respirology 2014;19:501–7.
- Ferat-Osorio E, Esquivel-Callejas N, Wong-Baeza I, et al. The increased expression of TREM-1 on monocytes Is associated with infectious and noninfectious inflammatory processes. J S):1–112. urg Res 2008;50:110–7.
- Bassyouni IH, Fawzi S):1–112. , Gheita TA, et al. Clinical association of a soluble triggering receptor expressed on myeloid cells-1 (sTREM-1) in patients with systemic lupus erythematosus. Immunol Invest 2017;46:38–47.
- Dupuy AM, Philippart F, Péan Y, et al. Role of biomarkers in the management of antibiotic therapy: an expert panel review: I currently available biomarkers for clinical use in acute infections. Ann Intensive Care 2013;3(1):22.
- Hellyer TP, Morris AC, McAuley DF, et al. Diagnostic accuracy of pulmonary host inflammatory mediators in the exclusion of ventilator-acquired pneumonia. Thorax 2015;70:41–7.
- Endo S):1–112. , S):1–112. uzuki Y, Takahashi G, et al. Usefulness of presepsin in the diagnosis of sepsis in a multicenter prospective study. J Infect Chemother 2012;18(6):891-7.
- Henriquez-Camacho C, Losa J. Biomarkers for sepsis. Biomed Res Int 2014; Article ID 547818.
