Сравнительная оценка влияния инфликсимаба и ритуксимаба на доклинические структурно- функциональные изменения сердечно-сосудистой системы при ревматоидном артрите
Сравнить влияние терапии инфликсимабом и ритуксимабом на сердечно-сосудистый риск у больных ревматоидным артритом.
В исследование были включены 95 пациентов (средний возраст 42,74±7,23) с достоверным диагнозом РА развернутая стадия (6,1±2,9 лет) активного течения (DAS28 6,09±1,14) без сопутствующих заболеваний. Всем пациентам проводилась терапия инфликсимабом (n=32) или ритуксимабом (n=63). Исходно и через 1 год после начала лечения определяли структурно-функциональные параметры общих сонных артерий и сердца с помощью ультразвукового метода. Через 5 лет у 39 пациентов, продолжавших лечение генно-инженерных биологическими препаратами (ГИБП), оценивали частоту сердечно-сосудистых событий.
Исходно диастолическую дисфункцию левого желудочка 1 типа (замедленную релаксацию) наблюдали у 75 (78,9%) пациентов. В течение 1 года улучшение по крайней мере одного признака диастолической дисфункции наблюдалось у 10 (31,2%) пациентов группы инфликсимаба и 19 (30,2%) больных группы ритуксимаба. Исходно толщина комплекса интима-медиа (КИМ) общей сонной артерии была увеличена у 75 (78,9%) пациентов, а индекс жесткости – у 17 (17,9%). Терапия инфликсимабом в течение года не привела к статистически значимым изменениям этих показателей, в то время как при лечении ритуксимабом толщина КИМ правой общей сонной артерии снизилась на 8,9% (p<0,01), левой – на 16,7% (p<0,01), индекс жесткости общей сонной артерии – на 6,4% (p<0,05). Через 5 лет частота сердечно-сосудистых событий в группе ритуксимаба была недостоверно ниже, чем в группе инфликсимаба (13% и 25%, соответственно).
Терапия инфликсимабом и в большей степени ритуксимабом оказывает положительное влияние на сердечно-сосудистый риск.
Ревматоидный артрит (РА) является самым рас пространенным аутоиммунным заболеванием человека, характеризуется непрерывным прогрессированием, сопровождается существенным экономическим ущербом и социальными последствиями, а также высокой преждевременной смертностью [1-4]. По данным популяционных исследований, частота развития сердечно-сосудистых осложнений у больных РА в 2-4 раза выше, чем в общей популяции, что нельзя объяснить наличием только традиционных факторов риска сердечно-сосудистых заболеваний [5-8]. Наличие и длительность системного воспаления при РА сказываются на состоянии сердечно-сосудистой системы в целом и на ее отдельных структурно-функциональных показателях [9]. Исследования в этом направлении интересны и с позиции возможной обратимости начальных признаков сосудистого ремоделирования и изменений внутрисердечной гемодинамики под действием патогенетической терапии РА, в том числе генно-инженерными биологическими препаратами (ГИБП). Управление риском сердечно-сосудистых событий может способствовать снижению сердечнососудистой заболеваемости и смертности.
Целью исследования было сравнение влияния терапии инфликсимабом или ритуксимабом на сердечнососудистый риск у больных РА.
Материал и методы
В рандомизированное открытое исследование в параллельных группах включали пациентов с достоверным диагнозом активного РА, установленным в соответствии с критериями ACR, 1987 г. и ACR/EULAR, 2010 г., у которых была неэффективной терапия базисными противовоспалительными препаратами, включая метотрексат, в адекватных дозах в течение более 3 мес [10,11]. Критериями исключения были сердечно-сосудистые заболевания, в том числе артериальная гипертония, ишемическая болезнь сердца, сердечная недостаточность, нарушения мозгового кровообращения и др., а также сахарный диабет, заболевания почек (уровень креатинина в крови выше 110 мкмоль/л) и печени (уровни АСТ, АЛТ, билирубина, в 3 и более раза превышающие нормальные значения), ожирение (индекс массы тела более 30 кг/м2), инфекции, беременность, злокачественные новообразования, применение глюкокортикоидов в дозах более 7,5 мг/сут в пересчете на преднизолон. Всем пациентам проводили терапию оригинальными ГИБП, в том числе ингибитором фактора некроза опухоли-α (ФНОα) инфликсимабом или моноклональными антителами к В-лимфоцитам ритуксимабом в стандартных дозах. Рандо мизация проводилась стратификационным методом с учетом данных ультразвуковой допплерографии общих сонных артерий и эхокардиографии, включая отклонения толщины комплекса интима-медиа (КИМ) и индекса жесткости общей сонной артерии, показателей диастолической функции левого желудочка и морфологических параметров сердца от референсных значений.
Исходно и через 1 год проводили ультразвуковую допплерографию общих сонных артерий и эхокардиографию. Через 5 лет у пациентов, оставшихся под наблюдением, оценивали частоту сердечно-сосудистых событий.
Ультразвуковую допплерографию сонных артерий проводили с помощью аппарата Acuson Х/10, оснащенного линейным датчиком 7,5 МГц, в М- и В-режимах. В М-режиме измеряли диаметр просвета общей сонной артерии в систолу и диастолу, а в В-режиме – толщину КИМ общей сонной артерии в соответствии со стандартным протоколом, предложенным экспертами ВНОК для оценки субклинического атеросклероза сонных артерий. Крите рием утолщения КИМ считали значения более 0,9 и менее 1,3 мм. Локальное утолщение КИМ до 1,3 мм и более расценивали как атеросклеротическую бляшку. Для оценки локальной ригидности сосудистой стенки рассчитывали индекс жесткости общей сонной артерии по формуле: индекс жесткости (ИЖ) = log(САД/ДАД)/(ΔД/Д) (усл. ед.), где Д – диаметр общей сонной артерии в диастолу; ΔД – разница диаметров общей сонной артерии в систолу и диастолу; САД – систолическое АД; ДАД – диастолическое АД. В качестве референсных значений были взяты верхние допустимые значения по рекомендациям программы Ангио Скан-01.
Эхокардиографию проводили по стандартной методике на приборе GE Logic 400 (США) в М- и В- режимах. Диастолическое наполнение левого желудочка изучали с помощью допплерэхографии в импульсном режиме из верхушечной четырехкамерной позиции. Массу миокарда левого желудочка определяли по формуле R. Devereux.
Статистическая обработка данных проводилась с использованием статистического пакета программы “STATISTIСA” (версия 6.0). Различия между всеми исследуемыми показателями и переменными считали статистически значимы при р<0,05. Значимость различий непрерывных величин устанавливали при помощи непарного двухвыборочного t-критерия Стьюдента при нормальном распределении переменных. Для оценки динамических изменений внутри групп для количественных признаков применяли непараметрический критерий Вилкоксона для парных величин, для качественных бинарных признаков – критерий МакНемара χ2.
Результаты
В рандомизированное открытое исследование в параллельных группах были включены 95 пациентов в возрасте от 21 до 50 лет (42,74±7,23, медиана 44,50) с достоверным диагнозом РА активного течения (среднее значение DAS28 6,09±1,14). Среди обследованных преобладали женщины – 77,9% (74/95). Длительность РА составила 6,1±2,9 лет. Степень активности по DAS28 была высокой у 79 (83,2%) пациентов и умеренной у 16 (16,8%). Ревматоидный фактор выявили у 74 (77,9%) больных, антитела к цитруллинированному пептиду – у 72 (75,8%). Лечение инфликсимабом проводили у 32 больных, ритуксимабом – у 63.
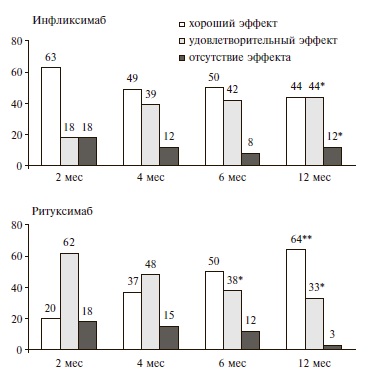
Через 1 год инфликсимаб и ритуксимаб по эффективности достоверно не отличались (р>0,05). Через 1 год хороший и удовлетворительный ответ на лечение инфликсимабом был достигнут у 28 (88%) пациентов, ремиссия РА (DAS28<2,6) – у 5 (15%) (рис. 1). Доля пациентов с хорошим эффектом статистически значимо (р<0,05) уменьшилась через 1 год на 19%, однако доля пациентов с удовлетворительным эффектом достоверно увеличилась (р<0,05) до 44% (14/32). В группе ритуксимаба хороший и удовлетворительный ответ через 1 год были отмечен у 61 (97%) пациентов, ремиссия (DAS28<2,6) – у 17 (27%). Доля пациентов, достигших хорошего ответа, в течение года продолжала увеличиваться (р<0,001).
Увеличение толщины межжелудочковой перегородки и/или задней стенки левого желудочка (>0,9 см для женщин и >1,0 см для мужчин) при эхокардиографии исходно выявили у 36 (37,8%) из 95 пациентов, а повышение индекса массы миокарда левого желудочка (>95 г/см2 для женщин и >115 г/см2 для мужчин) – у 28 (29,4%). Через 1 год после начала терапии инфликсимабом или ритуксимабом эти показатели, как и фракция выброса левого желудочка, достоверно не изменились.
Исходно диастолическую дисфункцию левого желудочка 1 типа (замедленную релаксацию), характеризовавшуюся уменьшением максимальной скорости кровотока раннего диастолического наполнения левого желудочка (Vmax Peak E ЛЖ) менее 0,53 м/с, увеличением максимальной скорости кровотока во время систолы левого предсердия (Vmax Peak A ЛЖ) более 0,70 м/с, уменьшением отношения Е/А<1 у лиц моложе 60 лет, увеличением времени замедления кровотока раннего диастолического наполнения (DT) более 220 мс, удлинением времени изоволюметрического расслабления левого желудочка (IVRT) более 100 мс, наблюдали у 75 (78,9%) пациентов. В течение 1 года улучшение по крайней мере одного признака диастолической дисфункции наблюдалось (p<0,05) у 10 (31,2%) пациентов группы инфликсимаба и 19 (30,2%) больных группы ритуксимаба (табл. 1).
| Показатель | Инфликсимаб | Ритуксимаб | ||
|---|---|---|---|---|
| Исходно | 1 год | Исходно | 1 год | |
| Примечание: Vmax Peak E - максимальная скорость кровотока раннего диастолического наполнения левого желудочка, Vmax Peak А - максимальная скорость кровотока во время систолы левого предсердия, Е/А - отношение скорости кровотока раннего диастолического наполнения левого желудочка к скорости кровотока во время систолы левого предсердия, IVRT - время изоволюметрического расслабления левого желудочка, DT - время замедления кровотока раннего диастолического наполнения левого желудочка. Фракцию выброса ЛЖ рассчитывали по Simpson. *p<0,05; **p<0,01 по сравнению с исходными данными | ||||
| Фракция выброса ЛЖ, % | 66,6±4,69 | 64,95±3,84 | 66,44±4,52 | 65,98±6,8 |
| Vmax Peak E ЛЖ, м/с | 0,62±0,11 | 0,69±0,13* | 0,65±0,10 | 0,77±0,10* |
| Vmax Peak А ЛЖ, м/с | 0,61±0,11 | 0,59±0,07 | 0,62±0,09 | 0,54±0,09 |
| Е/А | 1,05±0,32 | 1,23±0,27* | 1,08±0,29 | 1,42±0,29** |
| IVRT, мс | 100,72±7,85 | 97,42±6,75 | 100,95±7,78 | 92,95±7,78* |
| DT, мс | 218,72±9,93 | 205,87±9,63** | 221,05±11,17 | 204,14±9,35** |
Исходно толщина КИМ общей сонной артерии была увеличена у 75 (78,9%) пациентов, а индекс жесткости (референсные значения в возрасте 21-40 лет – 7,92 у.е., в возрасте 41-54 лет – 9,67 у.е.) – у 17 (17,9%). Терапия инфликсимабом в течение года не привела к статистически значимым изменениям этих показателей, в то время как при лечении ритуксимабом толщина КИМ правой общей сонной артерии снизилась на 8,9% (p<0,01), левой – на 16,7% (p<0,01), индекс жесткости общей сонной артерии – на 6,4% (p<0,05) (табл. 2).
| Показатель | Инфликсимаб | Ритуксимаб | ||
|---|---|---|---|---|
| Исходно | 1 год | Исходно | 1 год | |
| Примечание: *p<0,05; **p<0,01 по сравнению с исходными данными | ||||
| КИМ справа, мм | 0,88±0,22 | 0,83±0,26 | 0,92±0,27 | 0,80±0,31** |
| КИМ слева, мм | 0,94±0,22 | 0,80±0,20 | 0,96±0,37 | 0,80±0,31** |
| Индекс жесткости, усл. ед | 7,72±2,12 | 7,98±3,12 | 7,69±2,14 | 7,20±0,84* |
На разных сроках наблюдения 56 (58%) из 95 пациентов прекратили терапию ГИБП. Причинами отмены инфликсимаба и ритуксимаба были вторичная неэффективность у 18 и 3 пациентов, соответственно, нежелательные явления у 6 и 2. Двадцать семь пациентов из группы ритуксимаба были исключены из исследования по причине значимого нарушения схемы лечения по немедицинским или не установленным причинам. Через 5 лет лечение инфликсимабом продолжали 8 пациентов, ритуксимабом – 31. Сердечнососудистые события (ишемическая болезнь сердца, артериальная гипертония, хроническая сердечная недостаточность) в двух группах были зарегистрированы у 2 (25%) и 4 (13%) пациентов, соответственно (отношение шансов 2,25). Разница оказалась недостоверной из-за недостаточной выборки.
Обсуждение
Сравнительный анализ результатов терапии через 1 и 5 лет показал наличие определенных различий между инфликсимабом и ритуксимабом в скорости наступления и стойкости противовоспалительного эффекта, а также влиянии на отдельные параметры сердечно-сосудистой системы. Точные механизмы действия ингибиторов ФНО-α и моноклональных антител к В-лимфоцитам на структурно-функциональные параметры артерий и сердца в настоящее время не установлены. Известные аспекты фармакокинетики и фармакодинамики данных препаратов не дают основания говорить о прямом воздействии инфликсимаба и ритуксимаба на сердечно-сосудистую систему. В качестве теоретического обоснования кардиопротективного эффекта ГИБП может быть воспалительная модель атерогенеза, которая поддерживается большинством исследователей. Оба препарата снижают степень активности воспалительной реакции при РА. При этом инфликсимаб оказывает селективное действие только на один цитокин – ФНО-α. Хотя препарат быстро связывается с ФНО-α, образует с ним устойчивое соединение, подавляет функциональную активность и предотвращает дальнейшие иммунологические реакции, потенцируемые ФНО-α, основные продуценты данного цитокина – моноциты и макрофаги остаются активными, что приводит к дальнейшему росту продукции различных молекул воспалительной реакции, в первую очередь ФНО-α, при снижении концентрации инфликсимаба в крови.
В то же время, ритуксимаб, специфически связываясь с CD20, оказывает прямое угнетающее действие на пул зрелых В-лимфоцитарных клеток и в конечном итоге блокирует В-лимфоцитарный синтез всех провоспалительных цитокинов. В нашем исследовании оба препарата вызывали улучшение диастолической функции левого желудочка у больных РА, однако ритуксимаб по сравнению с инфликсимабом оказывал более выраженное действие на состояние сосудов, в частности в большей степени снижал толщину КИМ и индекс жесткости общей сонной артерии. Через 5 лет была также выявлена тенденция к снижению частоты неблагоприятных сердечно-сосудистых исходов в группе ритуксимаба по сравнению с инфликсимабом. Полу ченные данные обосновывают продолжение исследований с целью изучения механизмов влияния раз личных ГИБП на сосудистую стенку и риск сердечно-сосудистых исходов [12,13].
Заключение
Терапия инфликсимабом и ритуксимабом, оказывая положительное влияние на воспалительный процесс у больных РА с доклиническими структурно-функциональными изменениями сердечно-сосудистой системы, дает опосредованный кардиопротективный эффект в виде снижения признаков диастолической дисфункции левого желудочка и улучшения состояния сосудистой стенки. Более выраженным действием на сердечнососудистую систему обладает ритуксимаб.
Используемые источники
- Балабанова Р.М., Эрдес Ш.Ф. Распространенность ревматических заболева- ний в России в 2013-2014 гг. Научно-практическая ревматология 2014; 2:120-4.
- Насонов Е.Л. Ревматоидный артрит: проблемы и значение персонифициро- ванной медицины. Терапевтический архив 2012;5:5-9.
- Никитина Н.М., Ребров А.П., Нам И.Ф., Афанасьев И.А. Особенности лече ния больных ревматоидным артритом на современном этапе. Дневник Казанской медицинской школы 2013;1:27-32.
- Никитина Н.М. и др. Особенности коморбидности у больных ревматоид- ным артритом в разные годы наблюдения. Современная ревматология 2015;1:39-43.
- Мясоедова Е.Е. Роль традиционных факторов риска, хронического ауто- иммунного воспаления и фармакотерапии в развитии кардиоваскулярных нарушений при ревматоидном артрите. Вестник Ивановской медицинской академии 2013;18(1):57-64.
- Avina-Zubieta JA, Thomas J, Sadatsafavi M, et al. Risk of incident cardiovascu- lar events in patients with rheumatoid arthritis: a meta-analysis of observational studies. Ann Rheum Dis 2012;71(9):1524-9.
- Nurmohamed MT, Heslinga M, Kitas GD. Cardiovascular comorbidity in rheumatic diseases. Nat Rev Rheumatol 2015;11(12):693–704.
- Young A, Kodun G, Batley M, et al. Mortality in rheumatoid arthritis. Increased in the early course of disease, in ischemic heart disease and pulmonary fibrosis. Rheumatology (Oxford) 2007;46(2):350-7.
- Евенко А.Ю., Фролова О.И., Курмангулов А.А., Медведева И.В. Структурно-функциональное состояние общих сонных артерий при ревматоид- ном артрите без кардиоваскулярной патологии. Современные проблемы науки и образования 2017;6:61.
- Каратеев Д.Е., Олюнин Ю.А., Лучихина Е.Л. Новые классификационные критерии ревматоидного артрита ACR/EULAR 2010 – шаг вперед к ранней диагностики. Научно-практическая ревматология 2011;1:10–5.
- Федеральные клинические рекомендации по диагностике и лечению ревма- тоидного артрита. Москва, 2013 г. [Электронный ресурс] http://rheuma- tolog.ru/sites/default/files/Pdf/clinrec/revmatoidnyy_artrit.pdf.
- Bili A, Tang X, Pranesh S, et al. Tumor necrosis factor alfa inhibitor use and decreased risk for incident coronary events in rheumatoid arthritis. Arthritis Care Res (Hoboken) 2014;66(3):355-63.
- Novikova DS, Popkova TV, Lukina GV, et al. The effects of rituximab on lipids, arterial stiffness, and carotid intima-media thickness in rheumatoid arthritis. J Korean Med Sci 2016;31:202-7
