Эндоскопическая картина верхних отделов желудочно-кишечного тракта на фоне приема различных нестероидных противовоспалительных препаратов
Нестероидные противовоспалительные препараты (НПВП) – один из главных инструментов лечения скелетно-мышечной боли. Однако НПВП могут вызывать различные нежелательные явления, наиболее известным из которых является НПВП-гастропатия. Основной метод диагностики этой патологии – эндоскопическое исследование.
Оценить влияние различных НПВП на слизистую оболочку верхних отделов желудочно-кишечного тракта.
Проведен ретроспективный анализ данных эндоскопического исследования у 6341 пациента с ревматическими заболеваниями (82,9% женщин, возраст 50,8±15,7 лет), наблюдавшихся с 2007 по 2016 гг. Все больные не менее 2-х недель принимали различные НПВП, в том числе нимесулид – 2315 (35,9%), диклофенак – 1543 (24,0%), мелоксикам – 1177 (18,3%), кетопрофен – 257 (4,0%), индометацин – 141 (2,2%), ацеклофенак – 215 (3,4%), ибупрофен – 118 (1,8%), эторикоксиб – 408 (6,3%), целекоксиб – 193 (3,0%), другие НПВП – 64 (1,0%). Оценивали наличие эрозий (поверхностных дефектов слизистой оболочки), множественных эрозий (≥10) и язв (дефект стенки ≥5 мм, имеющий видимую глубину). Дополнительно проведено сравнение частоты множественных эрозий и язв у больных, получавших эторикоксиб и диклофенак, в зависимости от наличия основных факторов риска НПВП-гастропатии: язвенного анамнеза, возраста ≥65 лет, сопутствующего приема низких доз аспирина.
Частота множественных эрозий и язв при использовании коксибов – эторикоксиба и целекоксиба составила 5,4% и 5,7% и была достоверно ниже (p<0,05), чем при лечении диклофенаком (12,0%), кетопрофеном (12,7%), индометацином (13,2%) и ибупрофеном (18,8%). У больных с язвенным анамнезом, пациентов в возрасте ≥65 лет и больных, принимавших низкие дозы аспирина, частота множественных эрозий и язв на фоне использования эторикоксиба и диклофенака составила, соответственно, 9,7% и 24,4% (p<0,001), 8,9% и 16,0% (p<0,05), 11,3% и 30,1% (p<0,001).
Коксибы, в частности, эторикоксиб, вызывают развитие НПВП-гастропатии существенно реже, чем “традиционные” НПВП. Даже у больных с высоким риском НПВП-гастропатии, язвы и множественные эрозии на фоне приема эторикоксиба возникают с гораздо меньшей частотой, чем на фоне приема диклофенака.
Облегчение страданий больного – принципиально важная задача медицинской помощи. Цен траль ное место имеет быстрое и максимально полное купирование боли – самого мучительного симптома заболеваний человека. Особое значение анальгетическая терапия имеет при ревматических заболеваниях (РЗ), так как боль – это кардинальное проявление поражения суставов и позвоночника, определяющее снижение качества жизни, потерю трудоспособности и способствующее прогрессированию коморбидных заболеваний.
Незаменимым инструментом контроля боли при РЗ были и остаются нестероидные противовоспалительные препараты (НПВП). Широкий спектр фармакологических эффектов этих лекарств – блокада циклооксигеназы (ЦОГ) 2 и снижение синтеза важнейшего медиатора воспаления простагландина Е2, опосредованное снижение экспрессии провоспалительных цитокинов и нейромедиаторов, подавление активации металлопротеиназ, NO-синтетазы, дифференциации и активации остеокластов и др., позволяют рассматривать НПВП как универсальное патогенетическое обезболивающее и противовоспалительное средство [1].
Однако НПВП могут вызывать различные нежелательные явления (НЯ) [1,2]. Наиболее известным из них является НПВП-гастропатия – повреждение слизистой оболочки желудка и луковицы двенадцатиперстной кишки, возникающее на фоне приема НПВП и проявляющееся развитием эрозий и язв. Патогенез НПВП-гастропатии связан с блокадой ЦОГ-1 (структурного аналога ЦОГ-2) в слизистой оболочке желудочно-кишечного тракта, что приводит к снижению синтеза цитопротективных простагландинов и повышению риска пептического изъязвления под действием соляной кислоты, содержащейся в желудочном соке. НПВП-гастропатия представляет реальную опасность, поскольку может осложниться угрожающими жизни состояниями, такими как кровотечение или перфорация [3-5]. Важно отметить, что частота развития осложнений со стороны желудочно-кишечного тракта не зависит от способа введения НПВП (парентеральный, пероральный), поскольку действие лекарственного препарата в организме носит системный характер.
Основным методом диагностики НПВП-гастропатии является эндоскопическое исследование – эзофагогастродуоденоскопия (ЭГДС). Ее проведение показано всем больным, принимающим НПВП, если у них появляются какие-либо признаки поражения желудочно-кишечного тракта, или имеются факторы риска НПВП-гастропатии [1,2].
Выявление эрозий и язв слизистой оболочки желудка и/или двенадцатиперстной кишки, в том числе бессимптомных, имеет важное клиническое значение. Ведь источником большей части опасных желудочно-кишечных кровотечений становятся именно язвы или множественные эрозии. Кроме того, механизмы развития НПВП-индуцированных эрозий и язв и желудочнокишечного кровотечения, по сути, едины. Это позволяет рассматривать эндоскопические изменения желудочно-кишечного тракта как "суррогатный маркер" более опасной патологии [6,7]. Поэтому развитие изменений слизистой оболочки, выявляемых при эндоскопическом исследовании, относится к основным методам оценки негативного влияния НПВП на желудочно-кишечный тракт. Хорошо известно, что более безопасные для желудочно-кишечного тракта НПВП, которые относятся к селективным ЦОГ-2 ингибиторам (коксибы), существенно реже вызывают эндоскопические изменения, чем неселективные НПВП (н-НПВП) [1,8]. Следует отметить, что в нашей стране было проведено относительно немного крупных исследований, в которых сравнивалось влияние различных НПВП на верхние отделы желудочно-кишечного тракта, хотя эта тема представляет несомненный интерес для практикующих врачей и организаторов медицины.
Целью исследования было сравнение частоты эрозий и язв желудка и/или двенадцатиперстной кишки, вы яв ленных при ЭГДС на фоне приема различных НПВП.
Материал и методы
Мы провели ретроспективный анализ данных эндоскопического исследования пациентов с различными РЗ, регулярно (на протяжении не менее 2-х недель) принимавших НПВП. Пациенты были обследованы в клинике ФГБНУ НИИР им. В.А. Насоновой за период с 2007 по 2016 г. Во всех случаях ЭГДС проводили по направлению лечащего врача при наличии общих показаний для эндоскопического исследования верхних отделов желудочно-кишечного тракта. В анализ не включали пациентов с заболеваниями, при которых поражение желудочно-кишечного тракта является одним из характерных висцеральных проявлений (прогрессирующий системный склероз, болезнь Шегрена, болезнь Бехчета, системные васкулиты). В исследование не включали также больных, принимавших низкие дозы аспирина (≤500 мг/сут) в качестве антиагреганта, но не получавших другие НПВП.
Оценивали наличие эрозий (поверхностных дефектов слизистой оболочки), множественных эрозий (≥10) и язв (дефект стенки желудочно-кишечного тракта ≥5 мм, имеющий видимую глубину).
Средние значения количественных значений представлены в виде M±σ. Достоверность различий количественных параметров оценивали с помощью Т-теста Стьюдента, распределения ранговых переменных – с помощью критерия χ2, показателя отношения шансов (ОШ) и точного теста Фишера. Значение ОШ приведено с соответствующим 95% доверительным интервалом (ДИ).
Результаты
Результаты ЭГДС оценивали у 6431 больного, среди которых преобладали женщины среднего возраста с ревматоидным артритом, спондилоартритами, остеоартритом, подагрическим артритом и системной красной волчанкой (СКВ) (табл. 1). У многих пациентов имелись факторы риска НПВП-гастропатии, в том числе возраст ≥65 лет (19,5%), язвенный анамнез (10,1%), сопутствующий прием низких доз аспирина или других антитромботических средств (варфарин, клопидогрел, низкомолекулярный гепарин, дабигатран или ривароксабан) (12,8%).
| Показатели | Значения |
|---|---|
| Примечание: *Неспецифическая боль в спине, пирофосфатная артропатия, реактивный артрит, ревматическая патология околосуставных мягких тканей, ревматическая полимиалгия, рецидивирующий полихондрит, дермато/полимиозит. **Азатиоприн, циклофосфамид, микофенолата мофетил, циклоспорин, хлорамбуцил | |
| Женщины/мужчины, % | 82,9/17,1 |
| Возраст, годы | 50,8±15,7 |
| Диагноз, % | |
| Ревматоидный артрит | 57,6 |
| Спондилоартрит | 17,4 |
| Остеоартрит | 15,1 |
| Подагра | 3,7 |
| СКВ | 2,5 |
| Другие* | 3,7 |
| Факторы риска НПВП-гастропатии, % | |
| Возраст ≥65 лет | 19,5 |
| Язвенный анамнез | 10,1 |
| Низкие дозы аспирина | 8,4 |
| Другие антитромботические средства | 4,4 |
| Глюкокортикостероиды | 25,0 |
| Базисные противовоспалительные препараты, % | |
| Метотрексат | 29,1 |
| Лефлуномид | 7,2 |
| Сульфасалазин | 6,2 |
| Аминохинолиновые | 2,5 |
| Другие** | 1,2 |
| Генно-инженерные биологические препараты, % | 5,5 |
| Ингибиторы протонной помпы, % | 21,7 |
Больные на момент проведения ЭГДС принимали следующие НПВП: нимесулид – 2315 (35,9%), диклофенак – 1543 (24,0%), мелоксикам – 1177 (18,3%), кетопрофен – 257 (4,0%), индометацин – 141 (2,2%), ацеклофенак – 215 (3,4%), ибупрофен – 118 (1,8%), другие н-НПВП – 64 (1,0%). Коксибы получали менее 10% пациентов, в том числе эторикоксиб (Аркоксиа®, MSD) – 408 (6,3%) и целекоксиб – 193 (3,0%).
Язвы желудка и/или двенадцатиперстной кишки были выявлены у 383 (5,9%) из 6431 обследованного пациента, в том числе язвы желудка – у 262 (4,0%), язвы двенадцатиперстной кишки – у 84 (1,3%), сочетание язв желудка и двенадцатиперстной кишки – у 34 (0,5%), язвы гастроэнтероанастомоза – у 3 (0,04%). Множественные эрозии определялись у 266 (4,1%) пациентов, а единичные эрозии – у 1042 (16,2%).
На рис. 1 приведена частота язв и множественных эрозий, а также единичных эрозий слизистой оболочки желудочно-кишечного тракта, выявленных у пациентов, принимавших различные НПВП. При лечении коксибами язвы и множественные эрозии наблюдались значительно реже, чем при применении н-НПВП. Различие в частоте язв и множественных эрозий у больных, получавших эторикоксиб и целекоксиб, и пациентов, принимавших диклофенак, кетопрофен, индометацин и ибупрофен, было статистически достоверным (p<0,05), в то время как у больных, получавших нимесулид и мелоксикам, частота язв и множественных эрозий была недостоверно выше, чем при лечении коксибами.
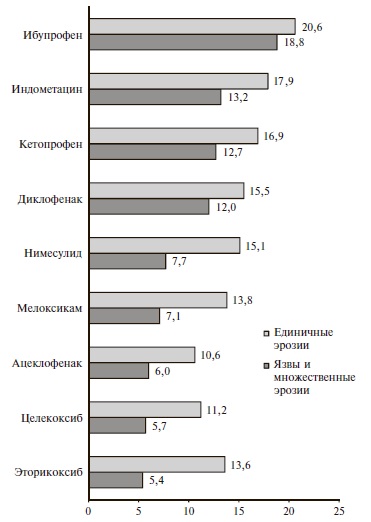
Частота единичных эрозий была ниже у пациентов, получавших эторикоксиб (Аркоксиа®) и целекоксиб, однако различие было достоверным только по сравнению с кетопрофеном, индометацином и ибупрофеном (p<0,05).
Важным аспектом оценки негативного влияния НПВП на желудочно-кишечный тракт является определение частоты НЯ у пациентов, имеющих факторы риска НПВП-гастропатии, у которых выше всего вероятность развития серьезных осложнений. В целом по группе наличие язвенного анамнеза повышало вероятность развития язв и множественных эрозий более чем в 3 раза (ОШ 3,77; 95% ДИ 2,84-5,11, р<0,0001), прием низких доз аспирина – также более чем в 3 раза (ОШ 3,17; 95% ДИ 2,07-4,85, р<0,0001), возраст ≥65 лет – почти в 2 раза (ОШ 1,98; 95% ДИ 1,40-2,81, р<0,0001). При этом прием глюкокортикостероидов ассоциировался с недостоверным снижением частоты осложнений, связанных с приемом НПВП (ОШ 0,79; 95% ДИ 0,55-1,17, р=0,102).
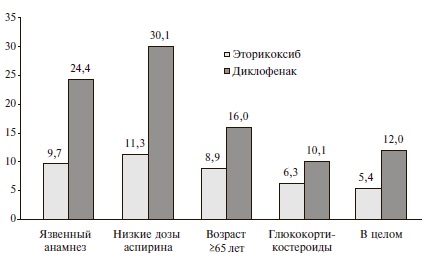
Мы сравнили частоту язв и множественных эрозий слизистой оболочки желудочно-кишечного тракта у больных, получавших эторикоксиб (Аркоксиа®) и диклофенак, в зависимости от наличия таких факторов риска, как язвенный анамнез, прием низких доз аспирина, возраст ≥65 лет и прием глюкокортикостероидов (рис. 2). Выбор этих двух НПВП определялся тем, что первый чаще всего использовался среди коксибов, а второй – среди н-НПВП. Частота желудочно-кишечных осложнений у больных с язвенным анамнезом, пациентов, принимавших низкие дозы аспирина, и у пожилых людей была существенно выше, чем в общей группе. Прием глюкокортикостероидов не оказывал значимого влияния на развитие язв и множественных эрозий. При этом во всех случаях частота этих изменений у пациентов, принимавших эторикоксиб, была достоверно ниже, чем у больных, получавших диклофенак (p<0,05).
Обсуждение
Полученные нами данные подтверждают известный факт: "ульцерогенный" потенциал разных НПВП значительно отличается, а у коксибов он существенно меньше, чем у н-НПВП. При использовании селективных ЦОГ-2 ингибиторов (в частности, эторикоксиба), частота серьезных изменений слизистой оболочки желудочно-кишечного тракта – язв и множественных эрозий оказалась в 2-3 раза ниже, чем при лечении диклофенаком, кетопрофеном, индометацином и ибупрофеном.
Наличие основных факторов риска НПВП-гастропатии, в том числе язвенного анамнеза, пожилого возраста и сопутствующего приема низких доз аспирина, существенно повышало вероятность развития эндоскопических изменений желудочно-кишечного тракта при применении как н-НПВП, так и коксибов. Тем не менее, частота язв и множественных эрозий у больных с этими факторами риска при применении эторикоксиба была достоверно ниже, чем при лечении диклофенаком.
В целом полученные нами данные полностью соответствуют результатам серии международных рандомизированных контролируемых исследований, в которых проводилось сравнение коксибов и н-НПВП. Так, опубликованы результаты крупных 12-недельных рандомизированных контролируемых исследований, в которых изучали динамику эндоскопической картины на фоне приема эторикоксиба в максимальной суточной дозе 120 мг и "традиционных" НПВП [9,10].
В первом исследовании приняли участие 742 больных (средний возраст 54 года) ревматоидным артритом и остеоартритом. У 9% из них имелся язвенный анамнез, более 35% пациентов принимали глюкокортикостероиды, около 5% – низкие дозы аспирина. Пациенты первой группы получали эторикоксиб (Аркоксиа®) 120 мг/сут, второй – напроксен 1000 мг/сут, третьей – плацебо. ЭГДС проводили до начала лечения, через 6 и 12 недель. Важно отметить, что большинство больных до начала исследования уже принимали НПВП, поэтому у 14%, 13% и 17% пациентов трех групп, соответственно, при первой ЭГДС были выявлены единичные или множественные эрозии (их наличие, в отличие от язв желудочно-кишечного тракта, не было критерием исключения из исследования). Через 12 недель язвы размером ≥3 мм определялись у 7,4%, 25,3% и 1,4% пациентов, принимавших эторикоксиб, напроксен и плацебо, соответственно. Разница между группами эторикоксиба и напроксена была высоко достоверной (p<0,001). Аналогичные данные были получены при анализе частоты язв размером ≥5 мм, которые выявили у 6,6%, 18,9% и 0,9% больных, соответственно. Среднее число эрозий слизистой оболочки желудка/двенадцатиперстной кишки при приеме эторикоксиба и плацебо практически не изменилось (оно увеличилось на 0,2 и 0,2, соответственно), в то время как в группе напроксена среднее число эрозий возросло на 3,8 (p<0,001) [9].
Во второе рандомизированное контролируемое исследовании, проводившееся по сходному протоколу были включены 680 больных остеоартритом (средний возраст 62 года). Примерно у 9% из них имелся язвенный анамнез. В отличие от первого исследования, пациенты не получали глюкокортикостероиды. Они были распределены на три группы и принимали эторикоксиб (Аркоксиа®) 120 мг/сут, ибупрофен 2400 мг/сут или плацебо. Перед началом терапии эрозии слизистой оболочки желудка/двенадциперстной кишки были выявлены у 16%, 15% и 20% больных в трех группах, соответственно. Как и в первом исследовании, язвы желудка/двенадцатиперстной кишки в группе эторикоксиба развивались существенно реже, чем в группе ибупрофена. Язвы размером ≥3 мм были выявлены у 8,2%, 17,0% и 1,9% больных трех групп, соответственно, а размером ≥5 мм – у 6,2%, 12,3% и 0,5%. Среднее число эрозий не изменилось в группах эторикоксиба и плацебо и возросло на 1,63 в группе ибупрофена (p<0,05) [10].
Следует отметить, что для эторикоксиба (Аркоксиа®) была доказана и более низкая частота опасных желудочно-кишечных осложнений, в том числе кровотечений и перфорации язв. По данным мета-анализа результатов рандомизированных клинических исследований, завершенных к 2003 г. (n=5441), у больных, принимавших эторикоксиб в дозе 60-120 мг/сут, суммарная частота желудочно-кишечных кровотечений, перфораций и клинически выраженных язв составила 1,24% и была в 2 раза ниже, чем у пациентов, получавших различные н-НПВП – 2,48% (p<0,001) [11].
Недавно были опубликованы результаты мета-анализа 9 рандомизированных контролируемых исследований, в которых сравнивали безопасность эторикоксиба и н-НПВП. Риск желудочно-кишечных осложнений при применении этого препарата был существенно ниже, чем при приеме напроксена и ибупрофена: ОШ 0,67 (95% ДИ 0,59–0,76; p<0,00001) и 0,59 (95% ДИ 0,48–0,72; р≪0,00001), соответственно [12].
Серьезной проверкой безопасности эторикоксиба (Аркоксиа®), как в отношении желудочно-кишечного тракта, так и сердечно-сосудистой системы, стала программа MEDAL (Multinational Etoricoxib and Diclofenac Arthritis Long-term) – наиболее масштабное исследование НПВП в мировой практике. В это рандомизированное контролируемое исследование был включен 34701 больной остеоартритом и ревматоидным артритом, которые в течение 1,5 лет непрерывно принимали эторикоксиб 60 или 90 мг/сут или диклофенак 150 мг/сут. При этом в ходе программы MEDAL предлагалось моделировать реальную клиническую практику – у больных с факторами риска НПВП-гастропатии допус калось применение ингибиторов протонной помпы, а при наличии сердечно-сосудистых факторов риска – низких доз аспирина [13,14]. Суммарная частота осложнений со стороны желудочно-кишечного тракта на фоне лечения эторикоксибом оказалась существенно ниже по сравнению с таковой в группе диклофенака – 1,0% и 1,4%, соответственно (р<0,001). Кроме того, прием эторикоксиб приходилось прерывать из-за желудочно-кишечных осложнений значительно реже, чем прием диклофенака – 8,6% и 11,2% (р<0,001). Необхо димо отметить, что число сердечно-сосудистых катастроф, в том числе инфаркта миокарда, ишемического инсульта и смерти от сердечно-сосудистых причин, достоверно не отличалось при использовании эторикоксиба и диклофенака. Это подтверждало тот факт, что селективность в отношении ЦОГ-2 не является основным фактором риска развития сердечно-сосудистых осложнений при приеме НПВП, а коксибы не отличаются от других НПВП по этому показателю.
Результаты исследования MEDAL позволили также оценить роль факторов риска развития серьезных желудочно-кишечных осложнений. В группах эторикоксиба и диклофенака значения ОШ при наличии факторов риска были следующими: возраст ≥65 лет – 2,25 (95% ДИ 1,84-2,76) и 4,09 (95% ДИ 2,82-5,92), соответственно, язвенный анамнез – 2,57 (95% ДИ 1,94-3,39) и 3,23 (95% ДИ 2,09-5,00), прием низких доз аспирина – 2,34 (95% ДИ 1,87-2,92) и 3,41 (95% ДИ 2,33-5,00), прием глюкокортикостероидов – 1,85 (95% ДИ 1,41-2,43) и 2,09 (95% ДИ 1,29-3,38). Таким образом, при наличии факторов риска вероятность желудочно-кишечных осложнений в большей степени увеличивалась у пациентов, принимавших диклофенак [15]. В целом наши данные соответствуют результатам этого анализа, за исключением оценки роли глюкокортикостероидов как фактора риска НПВП-гастропатии. В нашем исследовании они не оказывали негативного влияния на риск развития язв и множественных эрозий. Однако этот факт может объясняться различием выборок исследований.
Наше исследование проводилось в реальной клинической практике и предполагало анализ результатов ЭГДС у больных, у которые имелись симптомы, указывающие на поражение желудочно-кишечного тракта, или факторы риска НПВП-гастропатии. Тем более удивительно, что частота язв в нашей работе оказалась существенно ниже, чем в исследовании R. Hunt и соавт. [9]. Так, мы наблюдали язвы желудка и двенадцатиперстной кишки у 5,9% обследованных пациентов, большинство из которых получали н-НПВП. В исследованиях наших зарубежных коллег частота язв размером >5 мм составила 19% при использовании ибупрофена и 17% – напроксена. Это различие может иметь следующее объяснение. Данные R. Hunt и соавт. представляют собой результаты клинического исследования, в котором выбор НПВП проводился по "искусственному" принципу, связанному с необходимостью в рандомизации. Поэтому больные, имевшие факторы риска, такие как язвенный анамнез, пожилой возраст и прием низких доз аспирина, получали н-НПВП в высоких дозах без какой-либо профилактики. В реальной клинической практике такая ситуация невозможна: врач, планируя использовать НПВП, оценивает возможный риск, и если он достаточно высок, рекомендует более безопасные препараты и назначает гастропротективные средства. Так, каждый пятый па ци ент, прошедший ЭГДС в нашей клинике, получал ингибиторы протонной помпы. Вероятно, проведение эффективной профилактики и выбор НПВП с учетом риска осложнений определили меньшую частоту язв у обследованных нами больных по сравнению с таковой в клинических исследованиях.
Тем не менее, полученные нами данные еще раз подчеркивают значимость проблемы НПВП-гастропатии. Серьезные эндоскопические изменения (язвы и множественные эрозии слизистой оболочки желудочнокишечного тракта) встречались достаточно часто: более чем у 10% пациентов, принимавших н-НПВП, и 5% больных, получавших коксибы. В большинстве случаев НПВП-гастропатия не сопровождалась выраженными субъективными симптомами, что затрудняло ее своевременную диагностику. Очевидно, что у таких пациентов имеется риск развития угрожающих жизни осложений, таких как желудочно-кишечное кровотечение, при продолжении приема НПВП без дополнительных методов профилактики.
В связи с этим необходимо обучение врачей методам оценки риска и контроля желудочно-кишечных осложнений, связанных с приемом НПВП. Применение более безопасных НПВП, каких как эторикоксиб (Аркоксиа®), у пациентов с факторами риска НПВПгастропатии может рассматриваться как важнейшая мера по снижению частоты опасных желудочно-кишечных осложнений.
Используемые источники
- Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использо- вание нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология 2018;56:1-29.
- Harirforoosh S, Asghar W, Jamali F. Adverse effects of nonsteroidal antiinflam- matory drugs: an update of gastrointestinal, cardiovascular and renal complica- tions. J Pharm Pharm Sci 2013;16(5):821-47
- Melcarne L, García-Iglesias P, Calvet X. Management of NSAID-associated pep- tic ulcer disease. Expert Rev Gastroenterol Hepatol 2016;10(6):723-33.
- Goldstein JL, Cryer B. Gastrointestinal injury associated with NSAID use: a case study and review of risk factors and preventative strategies. Drug Healthc Patient Saf 2015;7:31-41.
- Biecker E. Diagnosis and therapy of non-variceal upper gastrointestinal bleeding. World J Gastrointest Pharmacol Ther 2015;6(4):172-82.
- Lanas A, Chan FKL. Peptic ulcer disease. Lancet 2017;390:613-24.
- Andrew Moore R. Endoscopic ulcers as a surrogate marker of NSAID-induced mucosal damage. Arthritis Res Ther 2013;15 Suppl 3:S4.
- Yang M, Wang HT, Zhao M, et al. Network meta-analysis comparing relatively selective COX-2 inhibitors versus coxibs for the prevention of NSAID-induced gastrointestinal injury. Medicine (Baltimore) 2015;94(40):e1592.
- Hunt RH, Harper S, Callegari P, et al. Complementary studies of the gastroin- testinal safety of the cyclo-oxygenase-2-selective inhibitor etoricoxib. Aliment Pharmacol Ther 2003;17(2):201-10.
- Hunt RH, Harper H, Watson DJ, et al. The gastrointestinal safety of the COX-2 selective inhibitor etoricoxib assessed by both endoscopy and analysis of upper gastrointestinal events. Am J Gastroenterol 2003;98(8):1725-33.
- Ramey D, Watson D, Yu C, et al. The incidence of upper gastrointestinal adverse events in clinical trials of etoricoxib vs. non-selective NSAIDs: an updated com- bined analysis. Curr Med Res Opin 2005;21(5):715-22.
- Feng X, Tian M, Zhang W, Mei H. Gastrointestinal safety of etoricoxib in osteoarthritis and rheumatoid arthritis: A meta-analysis. PLoS One 2018;13(1): e0190798.
- Laine L, Curtis SP, Cryer B, et al. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) pro- gramme: a randomised comparison. Lancet 2007;369:465-73.
- Cannon C, Curtis S, Fitzgerald G, et al. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) pro- gramme: a randomised comparison. Lancet 2006;368(9549):1771-81.
- Laine L, Curtis SP, Cryer B, et al. Risk factors for NSAID-associated upper GI clinical events in a long-term prospective study of 34701 arthritis patients. Aliment Pharmacol Ther 2010;32(10):1240-8.
