Канакинумаб в лечении периодической болезни и других аутовоспалительных заболеваний – исследование CLUSTER
Аутовоспалительные заболевания включают в себя различные наследственные болезни, в том числе семейную средиземноморскую лихорадку (FMF), известную в РФ как периодическая болезнь (ПБ), криопирин-ассоциированный периодический синдром (CAPS), синдром дефицита мевалонаткиназы/гипер-IgD-синдром (MKD/HIDS), периодический синдром, ассоциированный с рецепторами к фактору некроза опухоли-α (TRAPS), и др. В основе патогенеза аутовоспалительных заболеваний ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а не изменения гуморального или клеточного иммунитета. Общим медиатором при аутовоспалительных состояниях является интерлейкин (ИЛ)-1b, эффекты которого могут быть блокированы с помощью генно-инженерных биологических препаратов, в том числе канакинумаба, эффективность и безопасность которого установлены у больных CAPS, системным юношеским идиопатическим артритом и болезнью Стилла взрослых. В статье обсуждаются результаты двойного слепого, рандомизированного, плацебо-контролируемого исследования CLUSTER, в котором была подтверждена эффективность канакинумаба у пациентов с колхицинрезистентной ПБ, MKD/HIDS и TRAPS.
Термин "аутовоспалительные заболевания" был предложен M. McDermott и D. Kastner в конце XX века для описания семейных периодических лихорадок – группы наследственных моногенных заболеваний, характеризующихся повторяющимися спонтанными приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [1]. Неконтролируемое воспаление может осложниться развитием АА амилоидоза, который клинически характеризуется преимущественным поражением почек. Основное проявление амилоидоза почек – протеинурия, обычно не сопровождающаяся изменениями мочевого осадка и артериальной гипертонией. Если подавить воспаление не удается, то протеинурия постепенно нарастает, формируется нефротический синдром и начинает ухудшаться функция почек, что в конечном итоге приводит к развитию терминальной хронической почечной недостаточности [2].
В основе патогенеза аутовоспалительных заболеваний ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а не изменения гуморального или клеточного иммунитета, поэтому при обследовании у пациентов выявляют высокие лабораторные показатели активности воспаления при отсутствии аутоантител или признаков активации иммунных клеток. Для подтверждения диагноза необ хо димо молекулярно-генетическое исследование, позволяющее выявить специфические мутации определенных генов. Аутовоспалительные заболевания включают в себя различные наследственные болезни, в том числе семейную средиземноморскую лихорадку (FMF), известную в РФ как периодическая болезнь (ПБ), криопирин-ассоциированный периодический синдром (CAPS), синдром дефицита мевалонаткиназы/гиперIgD-синдром (MKD/HIDS), периодический синдром, ассоциированный с рецепторами к фактору некроза опухоли-α (TRAPS), и др.
Для оценки риска наличия семейных периодических лихорадок предложен специальный индекс [3], который можно рассчитать на сайте Eurofever Project (https://www.printo.it/eurofever/index.asp). Пациентам с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Среди земноморья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты необходимо думать о MKD/HIDS, приступы длительностью более недели являются основанием для исключения TRAPS.
Основой патогенеза многих аутовоспалительных заболеваний (т.н. инфламмасопатий), в том числе ПБ, CAPS и MKD/HIDS, считают активацию инфламмасомы в клетках фагоцитарной системы – нейтрофилах, макрофагах и дендритных клетках [4]. В состав инфламмасомы входят специфические белки, такие как криопирин (NLRP3), а также вспомогательный белок ASC и прокаспаза-1, превращающаяся в активную каспазу-1. Последняя вызывает активацию и секрецию интерлейкинов (ИЛ)-1b и 18, которые являются мощными провоспалительными цитокинами и, в свою очередь, индуцируют выделение других цитокинов, в том числе ИЛ-6, ИЛ-8 и фактора некроза опухоли-α. Образование инфламмасомы – это нормальная реакция, обеспечивающая защиту от чужеродных микроорганизмов, прежде всего, бактерий. Однако мутации генов, кодирующих криопирин или регуляторные белки (пирин, PSTPIP1 и мевалонаткиназа), приводят к неконтролируемой активации инфламмасомы, повышению экспрессии ИЛ-1b и развитию клинической картины аутовоспалительного заболевания [5].
Альтернативным механизмом аутовоспаления явля ются конформационные изменения белков рецепторов цитокинов, которые создают условия для их гиперстимуляции и развития избыточных эффектов цитокинов. Примером таких аутовоспалительных заболеваний является TRAPS [6].
ПБ – это одно из самых часто встречающихся нас лед ственных аутовоспалительных заболеваний, которое широко распространено у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков [7]. Наследуется по аутосомнорецессивному пути. Причиной развития ПБ являются мутации гена MEFV, кодирующего белок пирин, или маренострин [8]. Мутации этого гена могут сопровождаться утратой ингибирующего эффекта пирина на ASC и, как следствие, активацией каспазы-1 или формированием пирином собственной инфламмасомы [9,10].
Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется приступообразным течением. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно проходят. Продолжительность межприступного периода составляет от нескольких дней до нескольких месяцев. У большинства больных наблюдаются приступы болей в животе, сопровождающихся высокой лихорадкой и лейкоцитозом периферической крови и обусловленных рецидивирующим асептическим воспалением серозной оболочки брюшной полости [11]. У половины больных развивается торакальный вариант ПБ, в основе которого лежит асептический плеврит. Несколько реже встречаются артрит и артралгии, а также рожеподобная эритема. Самое тяжелое осложнение ПБ, как и других аутовоспалительных заболеваний, – АА-амилоидоз, формирующийся из циркулирующего белка-предшественника SAA. Для лечения ПБ применяют колхицин, который обеспечивает надежную профилактику приступов ПБ и амилоидоза. Механизм противовоспалительного действия колхицина связывают с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Приблизительно у 15-20% больных колхицин оказывается неэффективным.
Хотя молекулярные механизмы развития моногенных аутовоспалительных заболеваний отличаются, тем не менее, общим медиатором при аутовоспалительных состояниях является ИЛ-1b, эффекты которого могут быть блокированы с помощью генно-инженерных биологических препаратов, таких как анакинра, рилонацепт и канакинумаб. Последний представляет собой первый одобренный в РФ препарат для лечения 4 периодических лихорадок (колхицинрезистентной ПБ, CAPS, MKD/HIDS, TRAPS). Канакинумаб – это человеческие моноклональные IgG1 антитела к ИЛ-1b, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Средний конечный период полувыведения препарата составляет 26 дней, что позволяет вводить его подкожно каждые 4 недели (каждые 8 недель при CAPS).
Эффективность и безопасность канакинумаба у больных CAPS были установлены в двойном слепом, плацебо-контролируемом, рандомизированном исследовании [12]. CAPS – это одна нозологическая форма, проявляющаяся разными фенотипами, в том числе семейной холодовой крапивницей, синдромом МаклаУэллса и младенческим мультисистемным воспалительным заболеванием (Neonatal Onset Multisystemic Inflam matory Disease – NOMID), или хроническим младенческим неврологическим кожно-артикулярным синдромом (Chronic Infantile Neurological Cutaneous and Articular syndrome – CINCA) [13]. Семейная холодовая крапивница характеризуется развитием приступов лихорадки, крапивницы, конъюнктивита и артралгий после охлаждения. Приступы продолжаются не более 24 ч. При синдроме Макла-Уэллса отмечаются сходные приступы, однако специфические триггеры отсутствуют. Кроме того, у пациентов развивается нейросенсорная тугоухость и нередко – АА-амилоидоз с преимущественным поражением почек. Наиболее тяжелым течением отличается синдром NOMID/CINCA. Поми мо сыпи, лихорадки, артралгий и потери слуха при этом синдроме наблюдаются поражение центральной нервной системы, прогрессирующее снижение зрения, деформация костей и суставов, задержка роста, укорочение ног и рук, дисморфизм лица.
В клиническом исследовании полный ответ на одну инъекцию канакинумаба был достигнут у 34 (97%) из 35 пациентов с CAPS. Во время двойной слепой части ответ на лечение сохранялся у всех 15 больных, получавших канакинумаб, в то время как у 13 (81%) из 16 пациентов группы плацебо развивались обострения заболевания (p<0,001). Переход с плацебо на канакинумаб во время третьей части исследования привел к быстрому уменьшению симптомов и снижению концентрации острофазовых белков. К концу 48-недельного исследования ремиссия наблюдалась у 28 (90%) из 31 больного. Эффективность канакинумаба была подтверждена в 2-летнем открытом, многоцентровом исследовании у 166 детей и взрослых со всеми тремя фенотипами CAPS [14].
Еще одним зарегистрированным показанием к назначению канакинумаба является лечение системного юношеского идиопатического артрита и болезни Стилла взрослых, которые характеризуются не только сходными клиническими проявлениями, но и общими механизмами развития, в частности, важное значение в патогенезе придают аутовоспалению. Соответственно, их часто рассматривают как два варианта одного заболевания (болезнь Стилла) [15]. Эффективность канакинумаба в лечении системного юношеского идиопатического артрита установлена в двух рандомизированных клинических исследованиях [16]. В первом из них сравнивали рез ультаты однократного подкожного введения канакинумаба (4 мг/кг) или плацебо у 84 детей. По эффективности, которую оценивали на основании нормализации температуры тела и улучшения на 30% и более по крайней мере 3 из 6 основных проявлений заболевания, антагонист ИЛ-1b достоверно превосходил плацебо. Через 15 дней частота ответа на лечение, сохранявшегося через 29 дней, в двух группах составила 84% и 10%, соответственно (p<0,001).
Во втором исследовании 177 детей с системным юношеским идиопатическим артритом получали канакинумаб открытым методом в течение от 14 до 32 недель (медиана – 4 инъекции). Во время открытой фазы 73% больных ответили на лечение, а у 31% – была достигнута ремиссия заболевания. После завершения открытой фазы 100 пациентов, ответивших на лечение и снизивших дозу глюкокортикостероидов, были рандомизированы на две группы и продолжили лечение канакинумабом или плацебо. К концу наблюдения ремиссия заболевания была отмечена у 62% больных группы канакинумаба и 34% пациентов группы плацебо.
Результаты нескольких небольших исследований показали, что канакинумаб может быть эффективным в лечении колхицинрезистентной ПБ, MKD/HIDS и TRAPS [17-21]. Целью исследования CLUSTER (Cana kinumab Pivotal Umbrella Study in Three Hereditary Periodic Fevers) было подтвердить эффективность и безопасность канакинумаба при этих трех наследственных заболеваниях [22].
Дизайн исследования CLUSTER
Исследование проводилось по одинаковому протоколу в трех когортах пациентов. В него включали детей и взрослых с обострением аутовоспалительного заболевания, критериями которого были повышение уровня С-реактивного белка более 10 мг/л и общая оценка активности болезни врачом (индекс ≥2 по 5-балльной шкале). Диагноз ПБ устанавливали на основании диагностических критериев Tel-Hashomer (табл. 1) при наличии по крайней мере одной мутации гена MEFV и по крайней мере одного приступа лихорадки в месяц несмотря на лечение колхицином в стандартной дозе (1,0-3,0 мг/сут). Во время исследования терапию колхицином продолжали в стабильной дозе, не сопровождавшейся непереносимыми побочными эффектами. Критериями диагноза MKD/HIDS были наличие соответствующей мутации или снижение активности мевалонаткиназы в сочетании по крайней мере с тремя эпизодами лихорадки за предыдущие 6 мес. Диагноз TRAPS устанавливали на основании результатов генетического исследования и наличия постоянной или рецидивирующей лихорадки (более 6 эпизодов за год).
| Большие критерии | Малые критерии |
|---|---|
| Примечание: диагноз ПБ может быть установлена при наличии по крайней мере двух больших критериев или одного большого и двух малых критериев | |
|
|
|
Во время первой 16-недельной части исследования пациентов рандомизировали на две группы и назначали канакинумаб в дозе 150 мг подкожно или плацебо каждые 4 недели. При отсутствии ответа доза препарата могла быть увеличена слепым методом до 300 мг каждые 4 недели. Через 16 недель пациентов, ответивших на лечение, повторно рандомизировали и продолжали лечение канакинумабом в дозе 150 мг каждые 8 недель или плацебо. Во время второй 24-недельной части исследования допускалось увеличение кратности инъекций до одной каждые 4 недели, а также дозы препарата до 300 мг в случае развития обострения. В последующем пациенты получали канакинумаб открытым методом в течение еще 72 недель.
Первичной конечной точкой служила доля пациентов, у которых был достигнут полный ответ через 15 дней (индекс активности <2 и уровень СРБ ≤10 мг/л) и отсутствовали новые обострения в течение 16 недель.
Результаты исследования CLUSTER
Эффективность канакинумаба. В международное многоцентровое исследование были включены 63 больных колхицинрезистентной ПБ, 72 пациента с MKD/HIDS и 46 больных TRAPS. У всех пациентов диагноз был подтвержден при молекулярно-генетическом исследовании, а течение заболевание было тяжелым. Боль шинство больных ПБ получали лечение колхицином.
Через 15 дней во всех трех когортах частота купирования обострения аутовоспалительного заболевания в группах канакинумаба превышала таковую в группах плацебо (рис. 1). Еще более выраженное преимущество канакинумаба перед плацебо было выявлено при анализе первичной конечной точки, которая предполагала оценку частоты полного ответа через 16 недель: 61% и 6%, соответственно, в когорте пациентов с ПБ (р<0,001), 35% и 6% в когорте больных с MKD/HIDS (р=0,003) и 45% и 8% в когорте больных TRAPS (р=0,006) (рис. 1). При включении в анализ пациентов, у которых дозах канакинумаба была увеличена до 300 мг каждые 4 недели в связи с недостаточностью эффективностью лечения, частота полного ответа увеличилась до 71% у больных ПБ, 57% у пациентов с недостаточностью MKD/HIDS и 73% у больных TRAPS (p<0,001 по сравнению с плацебо во всех трех случаях). Канакинумаб по эффективности превосходил плацебо во всех возрастных группах пациентов (от 2 до <12 лет, от 12 до <18 лет, 18 лет и старше).
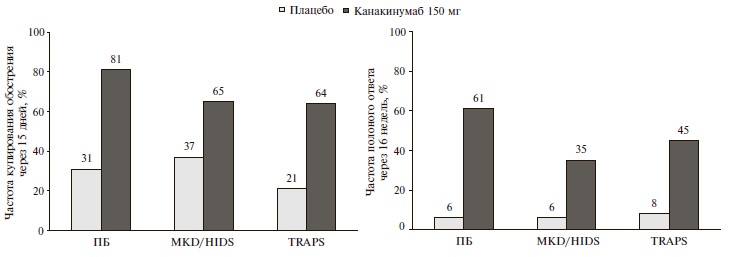
По частоте клинического ответа на лечение (индекс активности по оценке врачей <2) через 16 недель канакинумаб также достоверно превосходил плацебо у больных ПБ (65% и 9%, соответственно; р<0,001), MKD/ HIDS (46% и 6%; р=0,001) и TRAPS (45% и 4%; р=0,006). Эффективность канакинумаба была подтверждена при анализе частоты лабораторного ответа (снижение уровня СРБ ≤10 мг/л), которая при лечении ингибитором ИЛ-1b была достоверно выше, чем при введении плацебо, во всех когортах больных, в том числе ПБ (68% и 6%, соответственно; р<0,001), MKD/ HIDS (41% и 6%; р=0,002) и TRAPS (36% и 8%; р=0,03). Частота снижения уровня SAA ≤10 мг/л в группах канакинумаба также была выше, чем в группах плацебо, хотя разница достигла статистической значимости только в когорте больных TRAPS (27% и 0%, р=0,047).
У больных, прекративших лечение канакинумабом и переведенных на инъекции плацебо во время второй части исследования, частота рецидивов была достоверно выше, чем у пациентов, продолжавших терапию исследуемым препаратом (73% и 32%, соответственно). Продолжение лечения канакинумабом у больных, достигших полного ответа, позволяло сохранить достигнутый эффект в течение 24 недель у всех больных ПБ, 82% пациентов с MKD/HIDS и 83% больных TRAPS. Введение канакинумаба каждые 8 недель обеспечивало контроль над активностью болезни у 46% пациентов с колхицинрезистентной ПБ, 23% больных с MKD/ HIDS и 53% пациентов с TRAPS. Дозу препарата пришлось увеличить до 300 мг каждые 4 недели у 10%, 29% и 8% пациентов, соответственно.
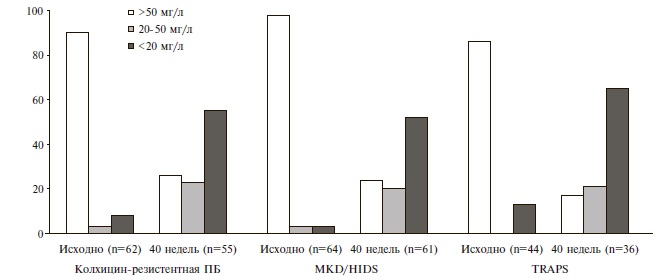
Через 40 недель уровень SAA снизился во всех когортах больных. К этому сроку медиана его концентрации составляла 20,0, 14,5 и 10,5 мг/л у больных ПБ, MKD/ HIDS и TRAPS, соответственно. Примерно у 25% пациентов содержание SAA превышало 50 мг/л, однако более чем у половины больных оно составляло менее 20 мг/л (рис. 2). Последний уровень ассоциируется с подавлением прогрессирования AA-амилоидоза [23].
Безопасность. Во время исследования оппортунистические инфекции, случаи туберкулеза или смерти зарегистрированы не были. Частота нежелательных явлений и серьезных нежелательных явлений при лечении канакинумабом была выше, чем при применении плацебо. Самыми распространенными нежелательными явлениями были инфекции (прежде всего дыхательных путей), боль в животе, головная боль и реакции в месте инъекции (табл. 2). Тем не менее, частота прекращения лечения из-за нежелательных явлений была низкой. Так, препарат был отменен только у 2 пациентов с MKD/HIDS и 2 больных TRAPS.
| Плацебо | ПБ | MKD/HIDS | TRAPS | |
|---|---|---|---|---|
| Экспозиция, пациенто-лет | 8,0 | 45,5 | 51,0 | 39,2 |
| Инфекции | 236,5 | 173,3 | 313,5 | 148,0 |
| Боль в животе | 112,0 | 26,3 | 29,4 | 25,5 |
| Головная боль | 87,1 | 28,4 | 49,0 | 28,1 |
| Диарея | 49,8 | 19,7 | 39,2 | 20,4 |
| Артралгии | 24,9 | 15,4 | 39,2 | 23,0 |
| Реакции в месте инъекции | 12,4 | 43,9 | 33,3 | 28,1 |
Заключение
ИЛ-1b – это основной провоспалительный цитокин, играющий ключевую роль в патогенезе аутовоспалительных заболеваний, что обосновывает применение ингибиторов ИЛ-1b для их лечения. Эффективность и безопасность канакикумаба ранее были установлены в двойных слепых, рандомизированных, плацебо-контролируемых исследованиях у пациентов с системным юношеским идиопатическим артритом (болезнью Стилла) и CAPS.
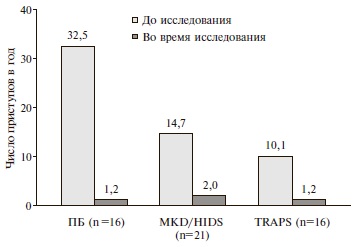
Исследование CLUSTER подтвердило эффективность препарата у больных колхицин резистентной ПБ и другими более редкими аутовоспалительными заболеваниями – MKD/HIDS и TRAPS. У пациентов, получавших плацебо, полный ответ на лечение отмечался редко – в 6-8% случаев, в то время как применение канакинумаба, дозу которого при необходимости увеличивали вдвое (со 150 до 300 мг каждые 4 недели), полного ответа удалось достичь примерно у 70% пациентов с колхицинрезистентной ПБ и TRAPS и более чем у половины больных с MKD/HIDS. Продолжение терапии канакинумабом в течение последующих 24 недель обеспечивало контроль над активностью болезни у большинства обследованных пациентов, ответивших на лечение, что указывало на устойчивость достигнутого эффекта. При отсутствии полного ответа терапия канакинумабом ассоциировалась со значительным сокращением числа и длительности эпизодов лихорадки в год (рис. 3). При поддерживающей терапии примерно у половины больных ПБ и TRAPS для профилактики приступов было достаточно введения препарата каждые 8 недель, в то время как в трети случаев кратность введения была увеличена до исходной (каждые 4 недели). У пациентов с MKD/HIDS для профилактики приступов требовались более высокие дозы канакинумаба.
Одним из основных осложнений аутовоспалительных заболеваний является АА-амилоидоз, поражающий в основном почки и приводящий к развитию терминальной хронической почечной недостаточности. АА-амилоид формируется из циркулирующего белкапредшественника SAA, близкого СРБ. В исследовании CLUSTER лечение канакинумабом у большинства пациентов привело к снижению содержания SAA в сыворотке менее 20 мг/л. Такой уровень SAA позволяет избежать развития или прогрессирования АА-амилоидоза.
Переносимость канакинумаба у детей и взрослых с аутовоспалительными заболеваниями была в целом хорошей. Лечение было прекращено из-за нежелательных явлений только у 4 пациентов.
Используемые источники
- McDermott MF, Aksentijevich I, Galon J, et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell 1999;97(1):133-44.
- Кочубей Л.Н., Виноградова О.М., Серов В.В., Васильева Н.А. Прогноз и выживаемость больных вторичным амилоидозом (анализ 146 случаев). Тер архив 1993;6:48.
- Gattorno M, Sormani M, D’Osualdo A, et al. A diagnostic score for molecular analysis of hereditary autoinflammatory syndromes with periodic fever in children. Arhtr Rheum 2008;58(6):1823.
- de Jesus AA, Canna SW, Liu Y, Goldbach-Mansky R. Molecular mechanisms in genetically defined autoinflammatory diseases: disorders of amplified danger signaling. Annu Rev Immunol 2015;33:823-74.
- Masters SL, Simon A, Aksentijevich I, Kastner DL. Horror autoinflammaticus: the molecular pathophysiology of autoinflammatory disease. Annu Rev Immunol 2009;27:621-68.
- Stojanov S, McDermott MF. The tumour necrosis factor receptor-associated periodic syndrome: current concepts. Expert Rev Mol Med 2005;7(22):1-18.
- Рамеев В.В., Козловская Л.В., Богданова М.В., Моисеев С.В. Современные представления о периодической болезни и клинические рекомендации по диагностике и лечению. Клин фармакол тер 2018;27(2):18-26.
- Pras E, Aksentijevich I, Gruberg L, et al. Mapping of a gene causing familial Mediterranean fever maps to the short arm of chromosome 16. N Engl J Med 1992;326:1509.
- Chae JJ, Wood G, Richard K, et al. The familial Mediterranean fever protein, pyrin, is cleaved by caspase-1 and activates NF-kappaB through its N-terminal fragment. Blood 2008;112(5):1794-803.
- Yu J-W, Wu J, Zhang Z, et al. Cryopyrin and pyrin activate caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death Differ 2006;13(2):236-49.
- Виноградова О.М. Периодическая болезнь, М., Медицина, 1973. Lachmann HJ, Kone-Paut I, Kuemmerle-Deschner JB, et al. Use of canakinumab in the cryopyrin-associated periodic syndrome. N Eng J Med 2009;360(23): 2416-25.
- Козловская Л.В., Рамеев В.В., Новиков П.И. и др. Криопирин-ассоциированный периодический синдром. Клин фармакол тер 2018;25(2):82-9.
- Kuemmerle-Deschner JB, Hachulla E, et al. Two-year results from an open-label, multicentre, phase III study evaluating the safety and efficacy of canakinumab in patients with cryopyrin-associated periodic syndrome across different severity phenotypes. Ann Rheum Dis 2011;70(12):2095-102.
- Моисеев С.В., Новиков П.И., Рамеев В.В. Болезнь Стилла у детей и взрослых: новые представления о патогенезе и современные методы лечения. Клин фармакол тер 2017;26(4):15-20.
- Ruperto N, Brunner HI, Quartier P, et al. Two randomized trials of canakinumab in systemic juvenile idiopathic arthritis. N Engl J Med 2012;367:2396-406. Gü l A, Ozdogan H, Erer B, et al. Efficacy and safety of canakinumab in adolescents and adults with colchicine-resistant familial Mediterranean fever. Arthritis Res Ther 2015;17:243.
- Brik R, Butbul-Aviel Y, Lubin S, et al. Canakinumab for the treatment of children with colchicine-resistant familial Mediterranean fever: a 6-month open-label, single-arm pilot study. Arthritis Rheumatol 2014;66:3241-3.
- Arostegui JI, Anton J, Calvo I, et al. Open-label, phase II study to assess the efficacy and safety of canakinumab treatment in active hyperimmunoglobulinemia D with periodic fever syndrome. Arthritis Rheumatol 2017;69:1679-88.
- Gattorno M, Pelagatti MA, Meini A, et al. Persistent efficacy of anakinra in patients with tumor necrosis factor receptor-associated periodic syndrome. Arthritis Rheum 2008;58:1516-20.
- Obici L, Meini A, Cattalini M, et al. Favourable and sustained response to anakinra in tumour necrosis factor receptorassociated periodic syndrome (TRAPS) with or without AA amyloidosis. Ann Rheum Dis 2011;70:1511-2.
- De Benedetti F, Gattorno M, Anton J, et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. N Engl J Med 2018;378(20): 1908-19.
- Lachmann HJ, Goodman HJB, Gilbertson JA, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med 2007;356:2361-71.
