Клинико-экономическая оценка подходов к лечению болезней, связанных с дефицитом лизосомной кислой липазы
Клинико-экономическая оценка применения себелипазы альфа для лечения заболеваний, связанных с дефицитом лизосомной кислой липазы (ЛКЛ) в России.
Проводили анализ стоимости болезни для пациентов с болезнью накопления эфиров холестерина (БНЭХ) и анализ “затраты-эффективность” для пациентов с болезнью Вольмана (БВ). Оценивали два терапевтических подхода: применение себелипазы альфа и стандартная симптоматическая терапия (ССТ). В анализ включали прямые и непрямые затраты.
Без патогенетической терапии затраты на лечение одного пациента с БНЭХ в год достигают 5 239 277 руб., а общие затраты на лечение всех зарегистрированных в России пациентов с дефицитом ЛКЛ (n=38) – 199 092 526 руб. в год. При горизонте моделирования 1 год для наиболее тяжелой формы дефицита ЛКЛ – БВ суммарные затраты при лечении себелипазой альфа (9 040 879 руб.) значительно превышали таковые при ССТ (4 625 810 руб.). В группе себелипазы альфа непрямые затраты и затраты в терминальной стадии заболевания были ниже таковых в группе ССТ. Стратегия применения себелипазы альфа обладала большей эффективностью по сравнению со стратегией ССТ, являясь при этом и более затратной альтернативой. Коэффициент эффективности затрат был ниже для стратегии себелипазы альфа.
На ведение больных с дефицитом ЛКЛ при использовании ССТ из бюджета здравоохранения может быть затрачено до 199 млн рублей в год. Приме нение себелипазы альфа для рассмотренных возрастных категорий пациентов с дефицитом ЛКЛ отличается большей эффективностью затрат по сравнению со ССТ.
Дефицит лизосомной кислой липазы (ЛКЛ) – это наследственное, аутосомно-рецессивное, прогрессирующее заболевание, характеризующееся внутрилизосомным накоплением липидов (триглицеридов и эфиров холестерина) в жизненно важных органах, в частности в печени, селезенке, кишечнике, надпочечниках, кровеносных сосудах [1], и обусловленное дефектом гена LIPA, который встречается у людей любого возраста и приводит к заметному снижению или потере активности ЛКЛ [2-4]. Выделяют два клинических фенотипа заболевания [5]: болезнь Вольмана (БВ) – быстро прогрессирующая форма дефицита ЛКЛ, начинающаяся в младенческом возрасте, и болезнь накопления эфиров холестерина (БНЭХ), которая характеризуется более медленным прогрессированием и проявляется в старшем возрасте. Распростра нен ность дефицита ЛКЛ у детей и взрослых в мире составляет 3,36 на 1 млн населения [6-8], а в России предполагаемая распространенность дефицита фермента – 1 на 100000 [8].
БВ – это редкий фульминантный подтип заболевания, при котором активность ЛКЛ не определяется или составляет менее 1%, что приводит к массивному накоплению эфиров холестерина и триглицеридов преимущественно в печени, селезенке, надпочечниках, костном мозге, лимфатических узлах и макрофагах по всему организму, особенно в ворсинках кишечника. Возраст, в котором проявляется БНЭХ, отличается и зависит от остаточной активности ЛКЛ [4,9-11]. Про грес сирующее накопление эфиров холестерина и триглицеридов в лизосомах вызывает поражение пе че ни, повышение сывороточной активности аминотрансфераз и уровней холестерина липопротеинов низкой плотности и триглицеридов при нормальном или низком уровне холестерина липопротеинов высокой плотности (гиперлипопротеинемия IIb типа). Прежде временная смерть наступает вследствие печеночной недостаточности или ускоренного развития атеросклероза, связанного с гиперлипидемией [12,13].
Клинические проявления дефицита ЛКЛ включают мальабсорбцию, замедленный рост и развитие ребенка, быстрое прогрессирование фиброза печени, нарушение функции селезенки, кишечника, надпочечников, ускоренное развитие атеросклероза и повышение риска сердечно-сосудистых заболеваний как у детей, так и у взрослых [2–4,13-16]. У детей раннего возраста с дефицитом ЛКЛ смертность в течение 12 мес составляет 100% (медиана выживаемости – 3,7 мес) [2–4,9,17,18].
У большинства пациентов с дефицитом ЛКЛ наблюдают поражение более одной системы органов, в частности раннее и быстрое развитие атеросклероза, который может осложниться инсультом или инфарктом миокарда [19]. У 99% больных отмечают поражение печени, включая жировую дистрофию, прогрессирующий фиброз и цирроз. Спленомегалия и гиперспленизм сопровождаются тромбоцитопенией и анемией, требующих терапевтической коррекции (22%). Симптомы поражения желудочно-кишечного тракта включают боли в животе, мальабсорбцию, желудочно-кишечные кровотечения, нарушения функции желчного пузыря, тошноту, рвоту и диарею [6,7,21-29]. Фиброз и/или цирроз печени развиваются у 64,5% детей и взрослых с дефицитом ЛКЛ [30]. Для сравнения, только у 20% пациентов с хроническим вирусным гепатитом С в течение 20 лет наблюдается прогрессирование болезни печени до стадии цирроза [31]. Печеночная недостаточность приводит к смерти пациентов в раннем возрасте: 50% случаев смерти отмечают в возрасте до 21 года [2].
Пациенты с дефицитом ЛКЛ нуждаются в пожизненной ферментозаместительной терапии рекомбинантным ферментом – себелипазой альфа [5], которая приводит к снижению содержания жира в ткани печени и нормализации сывороточной активности аминотрансфераз, восстановлению метаболизма эфиров холестерина и триглицеридов в лизосомах, улучшению роста и развития ребенка в результате улучшения всасывания питательных веществ в кишечнике [32]. Себелипаза альфа одобрена для применения в 38 странах мира [33], включая Российскую Федерацию (РФ) с конца 2017 г. [34]. Себелипазе альфа был присвоен статус орфанного препарата в США в 2010 г. и в Европейском Союзе в 2015 г. [33,35]. В РФ дефицит ЛКЛ не входит в перечень 24 орфанных заболеваний [36]. Кроме того, себелипаза альфа не входит в список ЖВНЛП и не применяется в рамках Программы госгарантий оказания бесплатной медицинской помощи гражданам [37]. Для большинства пациентов основным подходом к лечению остается стандартная симптоматическая терапия, которая направлена в первую очередь на профилактику цирроза печени. Для коррекции липидного профиля и снижения риска развития сердечно-сосудистых заболеваний возможно применение диеты и статинов. При нарушении всасывания и задержке развития необходима консультация диетолога с подбором парентерального питания [5]. Пациенты с БВ нуждаются в круглосуточном наблюдении в специализированных многопрофильных центрах и в симптоматической терапии, включающей специальную диету, парентеральное питание, антибиотики, глюкокортикостероиды [5]. При ухудшении состояния и развитии терминального состояния их переводят в реанимационное отделение. Следует отметить, что у 66% пациентов любого возраста с дефицитом ЛКЛ имеется высокий риск развития терминального поражения печени, требующего трансплантации органа [38]. По данным литературы, до 29% детей нуждаются в трансплантации костного мозга. Однако трансплантация характеризуется ограниченной эффективностью в связи с системной природой заболевания, высоким риском осложнений и проблемой приживления трансплантата. Наряду с клинико-эпидемиологическими данными о заболевании крайне важны анализ социально-экономического бремени рассматриваемой нозологии и клинико-экономическая оценка подходов к ее лечению.
Целью исследования была клинико-экономическая оценка применения себелипазы альфа для лечения заболеваний, связанных с дефицитом ЛКЛ в РФ.
Материал и методы
Анализ стоимости болезни и анализ "затраты-эффективность" проводили с позиции общества при использовании отраслевых стандартов "Клинико-экономические исследования" [39] и рекомендаций ведущих экспертов в данной области [40-43].
Для пациентов с БНЭХ проводили анализ стоимости болезни, так как экономические последствия рассматриваемых нозологий представляют собой издержки общества, государства и отдельных их субъектов [44-46]. Это определяет необходимость оценки суммарного ущерба с целью определения наиболее проблемных областей, вложения в которые приведут к наибольшему сокращению бремени болезни и дадут максимальный экономический эффект. Кроме того, отсутствие прямых сравнительных клинических исследований себелипазы альфа препятствует применению других видов клинико-экономического анализа. Для пациентов с БВ проводили анализ эффективности затрат (cost-effectiveness analysis – CEA) с расчетом соответствующего коэффициента (cost-effectiveness ratio – CER).
При определении бремени болезни использовали эпидемиологический подход, основанный на заболеваемости (incidence-based), когда рассматриваются последствия, связанные с новыми случаями заболеваний, и измеряются издержки всех зарегистрированных в рассматриваемом году случаев от момента возникновения до завершения. Оценивали прямые затраты на одного пациента с БНЭХ в возрасте от 2 лет, получающего стандартную симптоматическую терапию, с последующей экстраполяцией данных на всю популяцию. Сегментация популяции выполнена в соответствии с данными литературы [21]. В качестве косвенных (непрямых) затрат в исследование была включена стоимость жизни ребенка – моральный ущерб родителей.
Перечень прямых затрат (ПЗ): стоимость диагностических лабораторных и инструментальных методов исследования; стоимость симптоматической и поддерживающей терапии; стоимость лечения неотложных состояний и осложнений; стоимость оказания медицинской помощи в терминальном состоянии; стоимость терапии себелипазой альфа, включая сопроводительную терапию и нежелательные явления (НЯ). Затраты на лечение оценивали на основании данных "ФАРМ-ИНДЕКС – Российский Фар ма цевтический Портал" [47], Государственного реестра предельных отпускных цен [34], Постановления Прави тельства РФ от 08.12.2017 N 1492 "О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 год и на плановый период 2019 и 2020 годов" [37], Генерального тарифного соглашения на 2018 г. (ГТС) [48] и других источников [49].
Эффективность лечения для проведения СЕА. Показателем эффективности была принята медиана общей выживаемости. При этом было сделано допущение: для стратегии себелипазы альфа пациенты, продолжавшие получать лекарственный препарат, оставались живыми, однако для расчета CER смерть 50% пациентов считалась медианой выживаемости.
На первом этапе анализа были построены модели оказания помощи пациентам с дефицитом ЛКЛ.
Модель пациента №1 – пациенты в возрасте старше 2 лет с БНЭХ (стоимость болезни). Модель пациента сформирована на основе эпидемиологических данных. Стоимость ведения пациентов в течение 12 мес включала в себя следующие категории затрат: собственно ведение пациента (для всех больных); лечение основного заболевания возможными терапевтическими подходами с учетом вероятности их применения; затраты на лечение осложнений и неотложных состояний с учетом их вероятности.
| Виды медицинской помощи | Вероятность, % | Моделируемая стоимость, ру | Средневзвешенная стоимость, руб. |
|---|---|---|---|
| Примечание: БНЭХ – болезнь накопления эфиров холестерина; КСГ – клинико-статистическая группа | |||
| Комплексное обследование в условиях стационара 4 раза в год, КСГ "Другие болезни печени | 100,0 | 204 899,20 | 204 899,20 |
| Поддерживающая терапия в условиях стационара (компенсирующее лечение, подбор медикаментозной терапии), КСГ "Хронический гепатит. Цирроз печени", 4 раза в год | 100,0 | 378 071,20 | 378 071,20 |
| Ведение пациентов с циррозом печени, включая методы применения альбуминового диализа, не менее 4 раз в год по тарифу "Поликомпонентное лечение болезни Крона, неспецифического язвенного колита, гликогеновой болезни, фармакорезистентных хронических вирусных гепатитов, аутоиммунного гепатита, цирроза печени с применением химиотерапевтических, генно-инженерных биологических лекарственных препаратов и методов экстракорпоральной детоксикации" | 100,0 | 609 800,00 | 609 800,00 |
Стоимость стандартной симптоматической терапии была смоделирована на основании рекомендаций (табл. 1-3) [5]. Предпо лагалось, что пациенту требовалось обследование в стационаре 4 раза в год (КСГ "Другие болезни печени"; стоимость 51 224,80 руб.). Подбор поддерживающего паллиативного лечения осуществлялся в условиях стационара (КСГ "Хронический гепатит. Цирроз печени", 4 раза в год, стоимость 94 517,80 руб.). Кроме того, учитывая наличие у больных печеночной недостаточности и необходимость в использовании экстракорпоральных методов детоксикации, предполагалось получение высокотехнологичной медицинской помощи в рамках тарифа "Поликомпонентное лечение болезни Крона, неспецифического язвенного колита, гликогеновой болезни, фармакорезистентных хронических вирусных гепатитов, аутоиммунного гепатита, цирроза печени с применением химиотерапевтических, генноинженерных биологических лекарственных препаратов и методов экстракорпоральной детоксикации" (стоимость 152 450,00 руб.). Принимая во внимание необходимую частоту проведения детоксикации (1 раз в три дня) и применение других способов поддерживающей терапии, предполагалось использование тарифа с частотой 24 раза в год.
| Виды медицинской помощи | Вероятность, % | Моделируемая стоимость, руб. | Средневзвешенная стоимость, руб. |
|---|---|---|---|
| Трансплантация печени с наблюдением в посттрансплантационном периоде | 66,0 | 1 729 278,71 | 1 1141 323,95 |
| Аллогенная трансплантация костного мозга с наблюдением в пострансплантационном периоде | 29,9 | 6 413 848,00 | 1 917 740,55 |
| Сочетание трансплантации печени и трансплантации костного мозга | 2,9 | 8 143 126,71 | 236 150,67 |
Затраты на лечение основного заболевания включали в себя затраты на трансплантацию печени и аллогенных стволовых клеток, вероятность применения которых определяли на основании исследований с учетом возможности проведения обоих видов трансплантации [20,38].
Осложнения со стороны сердечно-сосудистой системы развиваются у 87% детей с БНЭХ [50] и включают в себя инфаркт миокарда, ишемический инсульт и аневризму аорты. Вероятность развития каждого из трех осложнений считали равной 29%. Допускалось, что половина пациентов получают консервативную медицинскую помощь, а половина – оперативную, т.е. вероятность применения каждого из этих подходов составила 14,5%.
| Виды медицинской помощи | Вероятность, % | Моделируемая стоимость, ру | Средневзвешенная стоимость, руб. |
|---|---|---|---|
| Примечание: ОНМК – острое нарушение мозгового кровообращения; КСГ – клинико-статистическая группа; ЦНС – центральная нервная система; ОИМ – острый инфаркт миокарда | |||
| ОНМК, консервативное ведение, КСГ "Закупорка и стеноз прецеребральных артерий. Инфаркт мозга" | 14,5 | 70 148,40 | 10 171,52 |
| ОНМК, комплексное ведение, тариф "Окклюзии, стенозы, эмболии и тромбозы интракраниальных отделов церебральных артерий. Ишемия головного мозга как последствие цереброваскулярных болезней" | 14,5 | 1 014 270,00 | 147 069,15 |
| Реабилитация последствия ОНМК, КСГ "РЕАБ Состояние и последствия травм и заболеваний ЦНС с применением роботизированной механотерапии" | 29,0 | 151 485,30 | 43 930,74 |
| ОИМ, консервативное ведение | 14,5 | 35 761,60 | 5 185,43 |
| ОИМ, комплексное ведение | 14,5 | 229 920,00 | 33 338,40 |
| Реабилитация после перенесенного ОИМ | 29,0 | 74 043,90 | 21 472,73 |
| Аневризма аорты, хирургическое ведение | 29,0 | 294 930,00 | 85 529,70 |
| РЕАБ Состояние после оперативного вмешательства на сердце, сосудах и клапанном аппарате с сопутствующей полиморбидной патологией | 29,0 | 294 930,00 | 85 529,70 |
| Портальная гипертензия | 43,5 | 113 177,50 | 49 232,21 |
| Желудочно-кишечные кровотечения | 43,5 | 48 674,40 | 21 173,36 |
| Септическое осложнение, КСГ "Сепсис тяжелый (SOFA≥4) для реанимации" | 25,0 | 994 635,00 | 248 658,75 |
К осложнениям со стороны желудочно-кишечного тракта, развивающимся у 87% детей с БНЭХ [50], относятся портальная гипертензия и желудочно-кишечные кровотечения. Соответственно, вероятность развития каждого из них считали равной 43,5%. Стоимость лечения больных определения на основании соответствующих КСГ на 2018 г. [48].
У 25% детей предполагалось развитие септических осложнений с оказанием медицинской помощи по тарифу КСГ "Сепсис тяжелый (SOFA≥4) для реанимации".
Модель пациента №2 – пациенты с БВ (анализ эффективности затрат). Модель начинали с выбора терапевтического подхода: себелипаза альфа в дозе 1 мг/кг/нед в возрасте до 6 месяцев и 1 мг/кг один раз в 2 недели в возрасте старше 6 месяцев или стандартная симптоматическая терапия, которая предполагала паллиативную терапию для пациентов с печеночной недостаточностью, круглосуточное наблюдение и пребывание в медицинском учреждении [5]. Конечным состоянием цикла Маркова считали смерть пациента. Длительность цикла – 1 мес, максимальный горизонт моделирования – 12 мес.
Критерием эффективности считали общую выживаемость, медиана которой в клиническом исследовании при применении себелипазы альфа составила 14,8 мес, а при стандартной симптоматической терапии – 3,4 мес [51]. При моделирования смертности пациентов были построены таблицы состояния модели в цикле Маркова в зависимости от времени.
Стоимость лечения себелипазой альфа основного заболевания включала в себя затраты на терапию лекарственным препаратом (из расчета 1 флакон на одно введение), стоимость пребывания в дневном стационаре в дни его введения, средние затраты на консультативную медицинскую помощь. В клиническом исследовании большинство пациентов были в возрасте старше 6 мес, а лечение начинали в разном возрасте, поэтому был выбран усредненный режим дозирования для всех пациентов – 1 мг/кг каждые 2 недели. Планируемая стоимость флакона себелипазы альфа при включении в список ЖВНЛП равна 430 000 руб. Таким образом, стоимость терапии в месяц составит 860 000,00 руб., в год – 10 320 000,00 руб. На каждое введение предполагалось пребывание в дневном стационаре в течение одних суток (2153,10 руб.; досуточный тариф по КСН "Синдром нарушения всасывания у детей до трех лет") [48]. Вероятность развития НЯ и стоимость оказания медицинской помощи представлены в табл. 4. В клиническом исследовании НЯ были в основном нетяжелыми (менее 3 степени), что позволило допустить оказание медицинской помощи в амбулаторных условиях, однако для серьезных НЯ предусматривалось стационарное лечение [52].
| НЯ | Вероятность развития, % | Стоимость, руб. |
|---|---|---|
| Все НЯ | 86 | - |
| Головная боль | 28 | 3 833,30 |
| Лихорадка | 19 | 2 028,30 |
| Диарея | 17 | 3 003,60 |
| Орофарингеальные боли | 17 | 2 100,60 |
| Инфекции верхних дыхательных путей | 17 | 1 356,30 |
| Носовое кровотечение | 11 | 704,10 |
| Назофарингит | 11 | 1 894,60 |
| Абдоминальные боли | 8 | 2 162,40 |
| Астения | 8 | 3 833,30 |
| Запоры | 8 | 3 003,60 |
| Кашель | 8 | 1 864,90 |
| Тошнота | 8 | 3 003,60 |
| Рвота | 8 | 3 003,60 |
| Серьезные НЯ | 8 | 29 910,70 |
Стоимость оказания медицинской помощи больным с БВ при стандартной симптоматической терапии включала в себя затраты на терапию в условиях стационара с круглосуточным наблюдением (13 158,70 руб. в сутки) [48]. Стои мость ведения пациента в течение 12 месяцев составляет 4 802 925,50 руб.
Затраты в терминальной стадии заболевания. Одна из основных причин смерти пациентов с БВ – перитонит с развитием тяжелого септического состояния [2,51]. Такие пациенты должны находиться в отделении интенсивной терапии [5]. Затраты на медицинскую помощь оценены в соответствии с тарифом на законченный случай лечения детей в стационаре "Сепсис тяжелый (SOFA≥4) для реанимации" (994 635,00 руб.).
Непрямые затраты. Без патогенетической терапии БВ неминуемо приводит к гибели ребенка. Один из родителей не работает вследствие пребывания с больным ребенком, поэтому можно было бы оценить непрямые затраты, связанные с нетрудоспособностью родителя. Однако возраст детей (до 1 года) относится к периоду декретного возраста и отпуска по уходу за ребенком, поэтому данный способ оценки непрямых затрат был отвергнут. Уровень страданий и значимость потери ребенка для семьи оценивали на основании судебной практики, посвященной рассмотрению дел о компенсации морального вреда родственникам умерших больных (непрямые неосязаемые затраты). Использовали среднее значение денежной компенсации по трем гражданско-правовым делам [52]: в декабре 2014 г. компенсация за смерть двухлетней девочки, которая скончалась в больнице Сургута по вине педиатра, составила 3 млн руб.; в ноябре 2014 г. Камчатский краевой суд обязал выплатить городскую больницу № 2, в которой не была вовремя выявлена патологию у роженицы, – 2,1 млн руб.; в мае 2012 г. Саратовский областной суд взыскал 1 млн руб. с клинической больницы № 8 в пользу мужчины, чья жена погибла при родах. Суд также присудил матери погибшей 800 тыс. руб. Расчетная средняя стоимость компенсаций при потере ребенка вследствие болезни составила 2 033 333,33 руб.
Результаты
Модель пациента №1 – пациенты в возрасте старше 2 лет с БНЭХ. При горизонте моделирования 1 год затраты при применении стандартной симптоматической терапии составили 5 239 277 руб. (рис. 1). В их структуре преобладали (63%) затраты на лечение основного заболевания, включая стоимость трансплантация печени и аллогенной трансплантации костного мозга. Доли затрат на ведение пациента и лечение осложнений и неотложных состояний равнялись 23% и 14% от общих затрат, соответственно. Результаты оценки суммарного экономического бремени БНЭХ с определенной сегментацией популяции свидетельствуют о значимом уровне затрат на одного пациента в год в случае отсутствия патогенетической терапии. Таким образом, необходимо оценить экономическую целесообразность патогенетической терапии себелипазой альфа у пациентов с дефицитом ЛКЛ, учитывая тот факт, что ведение таких больных при использовании стандартной симптоматической терапии также сопровождается значительными затратами бюджета здравоохранения. При этом заболевание продолжает прогрессировать и приводит развитию осложнений и смерти.

Модель пациента №2 – пациенты с БВ. При горизонте моделирования 1 год суммарные затраты при применении себелипазы альфа составили 9 040 879 руб. и на 95% превышали таковые при стандартной симптоматической терапии – 4 625 810 руб. (рис. 2). В наибольшей степени между двумя стратегиями отличались стоимость лечения основного заболевания, затраты в случае наступления терминальной стадии заболевания, а также непрямые затраты. Следует отметить, что при лечении себелипазой альфа непрямые затраты в расчете на одного пациента (677 777 руб.) были в 3 раза ниже таковых при стандартной симптоматической терапии (2 033 333 руб.). Также в группе себелипазы альфа были ниже затраты в терминальной стадии заболевания (331 545 и 994 635 руб. на одного пациента, соответственно). При применении себелипазы альфа доля затрат на лекарственный препарат достигла 88% в структуре общих затрат, в то время как доля непрямых затрат при использовании двух стратегий составляла 7% и 44%, соответственно (табл. 5).
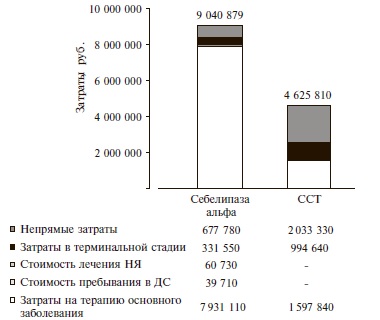
| Затраты | Себелипаза альфа | ССТ |
|---|---|---|
| Примечание: ССТ - стандартная симптоматическая терапия | ||
| Лечение основного заболевания | 88 | 35 |
| Пребывания в дневном стационаре | 0 | 0 |
| Лечение НЯ | 1 | 0 |
| Затраты в терминальной стадии | 4 | 21 |
| Непрямые затраты | 7 | 44 |
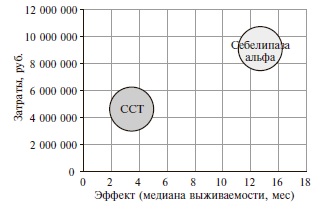
Применение себелипазы альфа сопровождалось увеличением медианы общей выживаемости с 3,4 до 14,8 мес. С точки зрения соотношения затрат и эффективности стратегия применения себелипазы альфа обладала большей эффективностью по сравнению со стратегией стандартной симптоматической терапии и одновременно была более затратной альтернативой (рис. 3). Значения CER, характеризующего эффективность суммарных общих затрат на терапию одного пациента, для стратегий себелипазы альфа и стандартной симптоматической терапии составили 612 525,66 руб. и 1 360 532,49 руб. соответственно. Таким образом, использование себелипазы альфа характеризовалось большей эффективностью затрат по сравнению со стандартной симптоматической терапией.
С целью проверки результатов анализа в условиях изменения входных параметров был выполнен анализ чувствительности, который подтвердил устойчивость полученных результатов.
Обсуждение
По данным оценки суммарного экономического бремени, без патогенетической терапии затраты на ведение пациента с БНЭХ превышают 5 млн руб. В настоящее время в РФ выявлено 38 пациентов с дефицитом ЛКЛ (по данным регистра проф. Т.В. Стро ковой; клиника ФГБУН "ФИЦ питания и биотехнологии", Москва). Таким образом, на ведение данных больных при использовании стандартной симптоматической терапии, которая не замедляет прогрессирование заболевания и не предотвращает развитие осложнений, в том числе неотложных и смертельных, из бюджета здравоохранения может уходить более 199 млн руб. в год.
Себелипазу альфа применяют для лечения дефицита ЛКЛ у пациентов любого возраста. Эффективность и благоприятный профиль безопасности себелипазы альфа продемонстрированы в клинических исследованиях [51,52], а ее применение является единственным методом патогенетической терапии дефицита ЛКЛ, улучшающим прогноз и позволяющим пациентам функционировать на уровне здоровых сверстников.
При горизонте моделирования 1 год суммарные затраты при лечении себелипазой альфа у пациентов с БВ, которая представляет собой самую тяжелую форму дефицита ЛКЛ, на 95% превышали таковые при применении стандартной симптоматической терапии, что не позволяет говорить о сравнимом уровне затрат. Однако, необходимо отметить, что лечение себелипазой альфа по сравнению с симптоматической терапией ассоциировалось со значительным снижением непрямых затрат и затрат в терминальной стадии.
Стратегия применения себелипазы альфа обладала большей эффективностью по сравнению со стратегией стандартной симптоматической терапии и одновременно была более затратной альтернативой. Значение CER, характеризующего эффективность суммарных затрат на терапию одного пациента, было ниже для стратегии себелипазы альфа, что говорит о большей эффективности затрат при использовании этого препарата. Расчет инкрементального показателя ICER (incremental costeffectiveness ratio), который позволяет оценить дополнительные затраты, необходимые для достижения дополнительного эффекта, выполнен не был, так как у данного метода есть целый ряд ограничений. Наиболее значимым является тот факт, что при расчете этого показателя принимаются во внимание только один из критериев эффективности и стоимость его достижения, что оставляет за рамками метода такие аспекты применения медицинской технологии, как полезность, финансирование, необходимое для внедрения данной технологии, а также этические и социальные аспекты. Последние, по мнению экспертов в фармакоэкономике, приобретают первостепенное значение при принятии решений об обеспечении помощью пациентов с редкими заболеваниями [54]. К тому же, принято оценивать ICER относительно "порога готовности общества платить" (порог фармакоэкономической целесообразности, cost-effectiveness threshold). Данный показатель в РФ не принят на официальном уровне и остается сугубо экспертным. В связи с этим и ICER является неинформативным и трудно интерпретируемым.
В отношении объема средств, необходимых для внедрения изученной технологии, необходимо отметить, что при использовании стандартной симптоматической терапии из бюджета здравоохранения выделяется более 199 млн руб. в год, что может обеспечить патогенетической терапией до 19 пациентов с БВ в течение 12 месяцев. По данным Федеральной службы государственной статистики, в 2017 году число новорожденных в РФ составило 1 690 307. Учитывая показатели заболеваемости БВ (1 на 130 000 [5]), можно предположить, что в прошлом году появилось до 13 пациентов с данной патологией, которые могли бы быть обеспечены патогенетической терапией.
Таким образом, применение себелипазы альфа у па циентов различного возраста с дефицитом ЛКЛ является ресурсоемким для бюджета здравоохранения, но характеризуется большей эффективностью затрат по сравнению со стандартной симптоматической терапией. Применение себелипазы альфа является жизненнонеобходимым и представляет собой единственную терапевтическую опцию для таких больных. Проведение только паллиативной терапии при наличии патогенетического лечения, заведомо понимая последствия для пациентов, в особенности раннего детского возраста, является проблемой морально-этического уровня, требующей отдельного обсуждения. БВ и БНЭХ не вклю чены в Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности [36], хотя по своим характеристикам они соответствуют рассматриваемой категории нозологий.
Среди лекарственных средств, применяемых при редких болезнях накопления, в перечень ЖВНЛП включены такие препараты, как ларонидаза, идурсульфаза, агалсидаза альфа, агалсидаза бета, имиглюцераза, элиглустат, велаглюцераза альфа. Стоимость терапии в год варьируется от 5,9 до 29 млн рублей, в зависимости от возраста и массы тела пациентов [34]. Стоимость терапии лекарственным препаратом, не включенным в указанный перечень, – галсульфазой, применяемой для лечения мукополисахаридоза VI типа, составляет 33 383 000,00 руб. Выпол ненный клинико-экономический анализ демонстрирует сопоставимую стоимость использования себелипазы альфа, что позволяет отнести применение рассматриваемого лекарственного средства при болезнях, связанных с дефицитом ЛКЛ, к экономически допустимым терапевтическим опциям.
Выводы
1. Без патогенетической терапии затраты на ведение пациента с БНЭХ превышают 5 млн рублей в год, а общие затраты бюджета здравоохранения на ведение всех таких больных при применении стандартной симптоматической терапии достигают 199 млн рублей в год.
2. Применение себелипазы альфа у различных возрастных категорий пациентов с дефицитом ЛКЛ характеризуется большей эффективностью затрат по сравнению со стандартной симптоматической терапией.
3. Клинико-экономический анализ показал сопоставимую стоимость использования себелипазы альфа и других препаратов, предназначенных для лечения редких заболеваний, что позволяет отнести применение рассматриваемого лекарственного средства при болезнях, связанных с дефицитом ЛКЛ, к экономически допустимым терапевтическим опциям.
Используемые источники
- Лаврова А.Е., Коновалова Е.Ю., Давыдова Д.А. и др. Дефицит лизосомной кислой липазы у ребенка 5 лет. Педиатрия. 2017;96(6):183–6.
- Bernstein DL, H lkova H, Bialer MG, et al. Cholesteryl ester storage disease: Review of the findings in 135 reported patients with an underdiagnosed disease. J Hepatol 2013;58(6):1230–43.
- Reiner Н, Guardamagna O, Nair D, et al. Lysosomal acid lipase deficiency An underrecognized cause of dyslipidaemia and liver dysfunction. Atherosclerosis 2014;235(1):21–30.
- Grabowski G, Charnas L, Du H. Lysosomal acid lipase deficiencies: the Wolman disease/cholesteryl ester storage disease spectrum. Scriver’s Online Metabolic & Molecular Basis of Inherited Disease, 2012
- Баранов А.А., Намазова-Баранова Л.С., Гундобина О.С. и др. Дефицит лизосомной кислой липазы: клинические рекомендации по оказания медицинской помощи детям. Педиатрическая фармакология 2016;13(3):1-5.
- Stitziel NO, Fouchier SW, Sjouke B, et al. Exome sequencing and directed clinical phenotyping diagnose cholesterol ester storage disease presenting as autosomal recessive hypercholesterolemia. Arterioscler Thromb Vasc Biol 2013;33: 2909–14.
- Scott S, Liu B, Nazarenko I, et al. Frequency of the cholesteryl ester storage disease common LIPA E8SJM mutation (c.894G>A) in various racial and ethnic groups. Hepatology 2013;58(3):958–65.
- Muntoni S, Wiebusch H, Jansen-Rust M, et al. Prevalence of cholesteryl ester storage disease. Arterioscler Thromb Vasc Biol 2007;27(8):1866–8.
- Assmann G, Seedorf U. In: Scriver CR et al. The metabolic and molecular bases of inherited disease. New York: McGraw Hill Inc.; 2001, 3551–72.
- Seedorf U, Wiebusch H, Muntoni S, et al. A novel variant of lysosomal acid lipase (Leu336–>Pro) associated with acid lipase deficiency and cholesterol ester storage disease. Arterioscler Thromb Vasc Biol 1995;15:773–8.
- Pisciotta L, Fresa R, Bellocchio A, et al. Cholesteryl ester storage disease (CESD) due to novel mutations in the LIPA gene. Mol Genet Metab 2009;97:143–8.
- Longhi R, Vergani C, Valsasina R, et al. Cholesteryl ester storage disease: risk factors for atherosclerosis in a 15-year-old boy. J Inherit Metab Dis 1988;11:143–5.
- Elleder M, Chlumska A, Hyanek J, et al. Subclinical course of cholesteryl ester storage disease in an adult with hypercholesterolemia, accelerated atherosclerosis, and liver cancer. J Hepatol 2000;32:528–34.
- Ambler GK, Hoare M, Brais R, et al. Orthotopic liver transplantation in an adult with cholesterol ester storage disease. JIMD 2013;8:41–6.
- Beaudet AL, Ferry GD, Nichols BL, et al. Cholesterol ester storage disease: clinical, biochemical, and pathological studies. J Pediatrics 1977;90(6):910–4.
- Anderson R a, Bryson GM, Parks JS. Lysosomal acid lipase mutations that determine phenotype in Wolman and cholesterol ester storage disease. Mol Genet Metab 1999;68(3):333–45.
- Wolman M, Sterk VV, Gatt S, Frenkel M. Primary familial xanthomatosis with involvement and calcification of the adrenals. Report of two more cases in siblings of a previously described infant. Pediatrics 1961;28:742–57.
- Marshall WC, Ockenden BG, Fosbrooke AS, Cumings JN. Wolman’s disease. A rare lipidosis with adrenal calcification. Arch Dis Child 1969;44:331–41.
- Wilson PW, D’Agostino RB, Levy D, et al. Prediction of coronary heart disease using risk factor categories. Circulation 1998;97(18):1837–47.
- Jones S, Valayannopoulos V, et al. Rapid progression and mortality of lysosomal acid lipase deficiency presenting in infants. Genet Med 2016;18: 452–8.
- Mayatepek E, Seedorf U, Wiebusch H, et al. Fatal genetic defect causing Wolman disease. J Inher Metab Dis 1999;22(1):93–4.
- Burton BK, Deegan PB, Enns GM, et al. Clinical features of lysosomal acid lipase deficiency. J Pediatr Gastroenterol Nutr 2015;61:619–25.
- Hoffman E, Barr M, Giovanni M, et al. Lysosomal acid lipase deficiency. In: Pagon R, Adam M, Ardinger H (eds). GeneReviews [Internet]. Seattle, WA; 2015. Available from: http://www.ncbi.nlm.nih.gov/books/NBK305870/.
- Lohse P, Lohse P, Chahrokh-Zadeh S, et al. Human lysosomal acid lipase/cholesteryl ester hydrolase and human gastric lipase: site-directed mutagenesis of Cys227 and Cys236 results in substrate-dependent reduction of enzymatic activity. J Lipid Res 1997;38(9):1896–905.
- Ferry GD, Whisennand HH, Finegold MJ, et al. Liver transplantation for cholesteryl ester storage disease. J Pediatr Gastroenterol Nutr 1991;12(3):376–8.
- Edelstein R, Filling-Katz M, Pentchev P, et al. Cholesteryl ester storage disease: A patient with massive splenomegaly and splenic abscess. Amer J Gastroenterol 1988;83(6):687–92.
- Jones SA, Brassier A, Hughes J, et al. Effect of sebelipase alfa on survival and liver function in infants with rapidly progressive lysosomal acid lipase deficiency: 2-year follow-up data. Mol Genet Metab 2016;117(2):S63.
- Balwani M, Quinn AG, Burton B. Phase 3 randomized controlled trial assessing efficacy and safety of sebelipase alfa in children/adults with lysosomal acid lipase deficiency. Hepatology 2014;60:1 Suppl.
- Jones S, Rojas-Caro S, Quinn A, et al. Sebelipase alfa (Kanuma) for lysosomal acid lipase deficiency. Medical Letter 2016;58(1504):e126–7.
- Burton B. Results of a global phase 3, randomized, double-blind, placebo-controlled trial evaluating the efficacy and safety of sebelipase alfa as an enzyme replacement therapy in children and adults with lysosomal acid lipase deficiency. Mol Genet Metab 2015;114(2):S27.
- Collier JD, Woodall T, Wight DGD, et al. Predictors of progressive hepatic fibrosis stage on sabsequent liver biopsy in chronic hepatitis C virus infection. J Viral Hepatitis 2005;12:74-80.
- Инструкция по применению лекарственного препарата для медицинского применения Канума ® .
- European Medicines Agency, Committee for Orphan Medicinal Products. Public summary of opinion on orphan designation: Sebelipase Alpha 2015.
- http://grls.rosminzdrav.ru.
- Food and Drug Administration. Orphan drug designations and approvals: Sebelipase Alpha. 2010.
- Постановление Правительства РФ от 26.04.2012 г. No 403 “О порядке ведения Федерального регистра лиц, страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности, и его регионального сегмента”.
- Постановление Правительства РФ от 08.12.2017 N 1492 "О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 год и на плановый период 2019 и 2020 годов"
- Burton BK, Silliman N, Marulkar S, et al. Progression of liver disease in children and adults with lysosomal acid lipase deficiency. Curr Med Res Opin 2017;33(7): 1211-4.
- Об утверждении отраслевого стандарта “Клинико-экономические исследования. Общие положения”. Приказ No163 Минздрава РФ от 27.05.2011.
- Авксентьева М.А., Герасимов Б.В., Сура М.В. Клинико-экономический анализ (оценка, выбор медицинских технологий и управления качеством медицинской помощи. М.: Ньюдиамед, 2004, 404 с.
- Белоусов Ю.Б. Планирование и проведение клинических исследований 104 лекарственных средств. М.: Общ. клинических исследователей, 2000, 579 с.
- Основные понятия в оценке медицинских технологий. Под. ред. Колбина А.С., Зырянова С.К., Белоусова Д.Ю. М.: Издательство ОКИ, 2013, 42 с.
- Walley T, Haycox A, Boland A. Pharmacoeconomics. Elsevier Health Sciences, 2004, 216 с.
- Омельяновский В.В., Авксентьева М.В., Деркач Е.В., Свешникова Н.Д. Методические проблемы анализа стоимости болезни. Медицинские технологии. Оценка и выбор 2011;1:42-50.
- Шаповалова М.А., Бондарев В.А., Корецкая Л.Р. Клинико-экономический анализ “стоимость болезни”. Международный журнал прикладных и фундаментальных исследований 2012;7:143-44.
- Akobundu E, Ju J, Blatt L, Mullins CD. Cost-of-Illness studies: a review of current methods. Pharmacoeconomics 2006;24(9):869-90.
- Фармацевтический портал “ФармИндекс”: https://www.pharmindex.ru/.
- Территориальный фонд ОМС Санкт-Петербурга, http://www.spboms.ru/.
- Официальный сайт Единой информационной системы в сфере закупок, http://zakupki.gov.ru/epz/main/public/home.html.
- Строкова Т.В. Нарушение липидного обмена у детей с заболеваниями печени. XXIII конгресс детских гастроэнтерологов России и стран СНГ “Актуальные вопросы абдоминальной патологии у детей”. Эффективная фармакотерапия 2016;16:22-6.
- Jones SA. Survival in infants treated with sebelipase фlfa for lysosomal acid lipase deficiency: an open-label, multicenter, dose-escalation study. Orphan J Rare Dis 2017;12:25.
- Burton BK, et al. A phase 3 trial of sebelipase alfa in lisosomal acid lipase deficiency. N Engl J Med 2015;373:1010-20.
- Плавинский С.Л. Годы качественной жизни – универсальная "валюта""ОТЗ: подходы к оценке и проблемы применения. По материалам IV Всероссийской конференция “Актуальные вопросы доклинических и клинических исследований лекарственных средств и клинических испытаний медицинских изделий”, Санкт-Петербург, 2-3 июня 2016 г.
- Ягудина Р.И., Серпик В.Г., Сороковиков И.В. Методологические основы анализа “затраты-эффективность”. Фармакоэкономика: теория и практика 2014;2(1):23-7.
- Scott S, Liu B, Nazarenko I, et al. Frequency of the cholesteryl ester storage disease common LIPA E8SJM mutation in various racial and ethnic groups. Hepatology (Baltimore) 2013;58(3):958–65.
