Безопасность и приверженность длительной терапии нуклеозидными и нуклеотидными аналогами у больных хроническим гепатитом В
Изучение безопасности и приверженности длительной терапии нуклеозид(т)ными аналогами хронического гепатита В (ХГВ)
В исследование включены 101 больной ХГВ, которые получали лечение тенофовиром, энтекавиром или телбивудином в течение не менее трех лет. Оценивали динамику сывороточного уровня креатинина и расчетной скорости клубочковой фильтрации (СКФ), активности креатинфосфокиназы (КФК), другие нежелательные явления, а также приверженность к терапии.
При лечении тенофовиром в течение 5 лет отмечено увеличение креатинина сыворотки в среднем на 14 мкмоль/л (на 12,2%) и снижение СКФ в среднем на 12,3 мл/мин (на 13,5%). При лечении телбивудином в течение 8 лет СКФ увеличилась в среднем на 6,2 мл/мин (на 5,9%), а при лечении энтекавиром в течение 8 лет она практически не изменилась. У 5 (21,7%) пациентов, принимавших телбивудин, наблюдалось выраженное повышение активности КФК с клиническими признаками миопатии, у 3 из них терапия была прекращена. При лечении энтекавиром и тенофовиром клинически значимых изменений КФК и развития миопатии не отмечено. Частота “сохранения на терапии” при лечении телбивудином была ниже (48% к 8 году лечения), чем при применении тенофовира (72% к 5 году лечения) и энтекавира (89% к 8 году лечения). Хорошая приверженность к лечению при приеме энтекавира (91%) и тенофовира (92%) отмечалась чаще, чем при приеме телбивудина (70%)
Энтекавир и тенофовир – наиболее безопасные препараты при длитель- ном лечении ХГВ и характеризуется высоким уровнем “сохранения на терапии” и приверженности. При длительном лечении тенофовиром необходим контроль функции почек.
Вмире около 260 млн человек страдают хроническим гепатитом В (ХГВ) [1]. В России заболеваемость ХГВ достигает 12,6 на 100 тыс населения, а число больных составляет от 3 до 5 млн [2]. В настоящее время для лечения ХГВ применяют пегилированный интерферон-α или аналоги нуклеозидов и нуклеотидов (АН), главным образом, энтекавир, тенофовир дизопроксил фумарат, тенофовир алафенамид и реже телбивудин [3-5]. В последние годы чаще применяют АН, которые подавляют репликацию вируса, что, как правило, сопровождается нормализацией активности печеночных ферментов и улучшением гистологической картины печени (в том числе, регрессом фиброза) [5]. Лечение ХГВ предполагает длительный прием АН (не менее 3–5 лет), а в некоторых случаях, в частности, при циррозе печени, может потребоваться и пожизненное лечение, что определяет актуаль ность оценки безопасности и приверженности к терапии [6-8]. Низкая приверженность снижает эффективность лечения, увеличивает риск осложнений, а также способствует селекции резистентных штаммов вируса [9-13].
Целью исследования было изучение безопасности и приверженности длительной терапии АН.
Материалы и методы
Для оценки безопасности терапии, наряду с опросом и осмотром, каждые 6 мес оценивали активность аминотрансфераз, креатинфосфокиназы (КФК) и сывороточный уровень креатинина. Для оценки почечной безопасности определяли скорость клубочковой фильтрации (СКФ) по формуле Cockcroft-Gault (в мл/мин).
На основании анкетирования и подсчета количества таблеток проводились оценка нежелательных явлений, приверженности пациентов к лечению и "сохранение на терапии". Анкетирование осуществлялось каждые 3-6 месяцев при встрече с пациентом или во время телефонного звонка. Приверженность к лечению оценивали на основании количества пропусков приемов препарата за один месяц (0-1 – хорошая; 2-3 – удовлетворительная; более 3 – плохая). "Сохранение на терапии" определяли как % от числа пациентов, продолжавших лечение исходно назначенным препаратом.
Статистический анализ был выполнен с использованием программы MedCalc (версия 11.2, 2011 MedCalcSoftwareb vba, Ostend, Belgium). Для определения различий количественных показателей между группами использовали ранговые тесты Манна-Уитни, Крускала-Уоллиса или критерий Джонкхиера-Терпстры. Оценка приверженности к лечению проводилась по результатам U-теста Манна-Уитни при сравнении медианы наблюдений количества принятых таблеток в группе каждого препарата за 3 месяца. Оценка мощности производилась методом Монте-Карло. Средние значения креатинина сыворотки и СКФ представлены как медиана и интерквартильный диапазон (IQR).
Результаты
За период с 2008 по 2017 г. 101 больной ХГВ получал противовирусную терапию АН в течение не менее трех лет (максимально в течение 9 лет). У 12 пациентов было отмечено развитие резистентности к препарату, а один АН был заменен на другой, поэтому число наблюдений составило 113. В 65 случаях пациенты принимали энтекавир в дозе 0,5 мг/сут, в 25 – тенофовир дизопроксил фумарат в дозе 300 мг/сут и в 23 – телбивудин в дозе 600 мг/сут. Исходная характеристика пациентов приведена в (табл. 1).
| Показатели | Тенофовир (n=25) | Энтекавир (n=65) | Телбивудин (n=23) | Всего (n=113) |
|---|---|---|---|---|
| Возраст, годы | 43±13 | 44±14 | 35±12 | 42±14 |
| Мужчины, n (%) | 21 (84) | 45 (69) | 4 (17) | 85 (75) |
| Масса тела, кг | 75±13 | 76±15 | 77±13 | 76±14 |
| Цирроз, n (%) | 5 (20%) | 5 (8%) | 0 | 10 (9%) |
| АСТ, МЕ/мл | 75±53 | 93±75 | 79±34 | 86±64 |
| АЛТ, МЕ/мл | 121±83 | 100±69 | 110±52 | 108±70 |
| Длит. лечения, мес | 43±10 | 68±28 | 64±31 | 61±30 |
Почечная безопасность. Сывороточ ный уровень креатинина при лечении энтекавиром, телбивудином и тенофовиром оставался в пределах референсных значений на протяжении всего периода лечения. При лечении тенофовиром он увеличился в среднем на 14,0 мкмоль/л (7,0;27,0) за 5 лет (p=0,0034), или на 12,2% (8,0;27,5) от исходного (рис. 1).
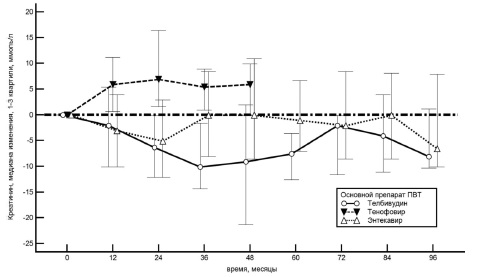
Увеличение сывороточного уровня креатинина на 10% и более от исходного наблюдалось у 17 (68%) пациентов, от 5 до 10% – у 6 (24%). При лечении энтекавиром сывороточный уровень креа тинина снизился в среднем на 6,6 мкмоль/л (-10,1;7,9) к 8-му году лечения, или на 7,5% (–11,5;8,2) от исходного. Увеличение уровня креатинина на 10% и более от исходного отмечено у 11 (17%) пациентов, от 5 до 10% – у 10 (15%). При лечении телбивудином сывороточный уровень креатинина снизился на 8,1 мкмоль/л (-10,4;1,4) к 8-му году лечения, или на 9,8% (-11,6;1,5). Увеличение сывороточного уровня креатинина сыворотки от 5 до 10% от исходного наблюдалось у 3 (13%) пациентов. Случаев более значительного повышения сывороточного уровня креатинина не было.
| Степень повышения КФК | n=23 |
|---|---|
| 1 (до 3 норм) | 6(26,1) |
| 2 (от 4 до 7 норм) | 3 (13,0) |
| 3 (от 8 до 10 норм | 2 (8,7) |
| 4 (более 10 норм) | 1 (4,4) |
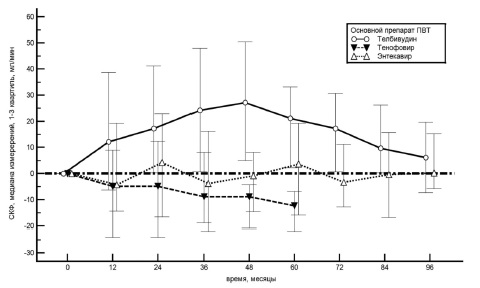
При лечении тенофовиром СКФ в среднем снизилась на 12,3 мл/мин (–21,8;–6,8) к 5-му году (p=0,008), или на 13,5% (–24,0;–7,5) (рис. 2). У 4 (16%) пациентов наблюдалось снижение СКФ на 15% и более от исходной. При лечении телбивудином СКФ в среднем увеличилась на 6,2 мл/мин (-7,3;19,7) к 8-му году (p=0,023), или на 5,9% от исходной. При лечении энтекавиром СКФ практически не изменилась (+0,2 мл/мин; –5,8;+15,2) к 8-му году, что составило +0,21% (–6,1;16,0).
Другие нежелательные явления. Большинство нежелательных явлений в ходе терапии АН были легкими или умеренно выраженными и транзиторными (табл. 3). Наиболее частые нежелательные явления, которые, вероятно, были связаны с АН, включали повышение активности АЛТ и/или АСТ (19,8%), головную боль (9,8%), тошноту (20,7%) и астенический синдром (13,8%). Повышение активности АЛТ и/или АСТ за весь период наблюдения отмечено в 20 (19,8%) случаях в среднем через 13±5 мес терапии. При этом, у 8 пациентов повышение активности АЛТ и/или АСТ было преходящим, у 12 пациентов было обусловлено разви тием резистентности к препарату и рецидивом гепатита В (2 пациента исходно получали энтекавир и 10 – телбивудин). Во всех случаях развития резистентности и вирусологического прорыва терапия была изменена (10 пациентов начали прием тенофовира и 2 – прием энтекавира).
| Нежелательные явления | Тенофовир (n=25) | Энтекавир (n=65 | Телбивудин (n=23) | Всего (n=113) |
|---|---|---|---|---|
| Миалгия | 5 (21,7) | 0 | 0 | 5(4,9) |
| Новообразования | 1 (4,3) | 1 (1,5) | 0 | 2 (1,9) |
| Дискомфорт и боль в правом подреберье | 2 (8,7) | 2 (3,0) | 1 (4,0) | 5 (4,9) |
| Тошнота | 6 (23,0) | 12 (18,4) | 3 (12,0) | 21 (20,7) |
| Головная боль | 12 (52,1) | 5 (7,6) | 3 (12,0) | 20 (19,8) |
| Повышение АЛТ и/или АСТ | 12 (52,1) | 6 (9,2) | 2 (8,0) | 20 (19,8) |
| Желудочно-кишечные нарушения | 1 (4,3) | 1 (1,5) | 1 (4,0) | 3 (2,9) |
| Астенический синдром | 5 (21,7) | 5 (7,7) | 4 (16,0) | 14 (13,8) |
| Смерть | 1 (4,3) | 1 (1,5) | 0 | 2 (1,9) |
Два (1,9%) пациента умерли. Один случай смерти не был связан с гепатитом В и лечением, у второго пациента без цирроза печени, достигшего авиремии, причиной смерти было гепатоцеллюлярная карцинома.
"Сохранение на терапии". Всего за период наблюдения (в среднем 61±30 мес) лечение исходно назначенным препаратом по различным причинам было прекращено в 25 (22,1%) случаях. "Сохранение на терапии" снижалось по мере увеличения длительности лечения и составило 100%, 99%, 99%, 90% и 82% через 12, 24, 36, 48 и 60 мес, соответственно (рис. 3).
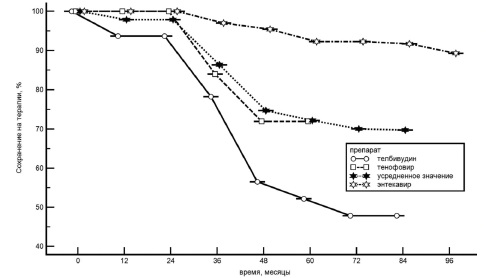
Лечение телбивудином прекратили 12 (52,1%) из 23 пациентов. К 8-му году лечения частота "сохранения на терапии" составила 47,9%. Причинами прекращения лечения были неэффективность (вирусологический прорыв) в 8 случаях, неэффективность лечения и развитие миопатии одновременно в 2, развитие миопатии в 1, немедицинские показания в 1. Лечение энтекавиром прекратили 7 (10,7%) пациентов, а частота "сохранения на терапии" в течение 8 лет составила 89,3%. Два пациента прекратили лечение вследствие его неэффективности (вирусологический прорыв), трое – по причине, не связанной с препаратом или заболеванием, и двое – умерли. Лечение тенофовиром прекратили 6 (24,0%) пациентов (во всех случаях по причине, не связанной с препаратом или заболеванием), а частота "сохранения на терапии" в течение 5 лет составила 76,0%. При этом, в первые 3 года все пациенты продолжали лечение энтекавиром и тенофовиром. Всего 10 пациентов самостоятельно (не по медицинским показаниям) прекратили лечение АН, 1 (4,3%) из них получал телбивудин, 3 (4,6%) – энтекавир и 6 (24%) – тенофовир. Причинами прекращения лечения оказались отсутствие возможности покупать препарат (n=7) и планирование беременности (n=3).
Приверженность к терапии. При лечении энтекавиром хорошая приверженность к терапии (>97%) отмечена у 59 (91%) пациентов, удовлетворительная (90-97%) – у 2 (3%) и плохая (<90%) – у 4 (6%) пациентов, при лечении тенофовиром – у 23 (92%), 1 (4%) и 1 (4%) пациентов, соответственно, при лечении телбивудином – у 16 (70%), 1 (4%) и 6 (26%) пациентов.
Обсуждение
Лечение АН, как правило, безопасно и хорошо переносится. В редких случаях, особенно у больных с декомпенсированным поражением печени, возможно развитие тяжелой миопатии, невропатии, почечной недостаточности и лактат-ацидоза вследствие повреждения митохондриальной ДНК [14]. В нашем исследовании ни у одного пациента не отмечено развитие этого тяжелого и часто фатального осложнения. Среди других нежелательных явлений АН описаны поражение почек, мышц и костной ткани.
Известно, что у больных ХГВ, особенно на стадии цирроза печени, чаще, чем в популяции, встречается нарушение функции почек. В одном исследовании СКФ у 20% больных ХГВ до начала терапии составляла 60-89 мл/мин/1,73 м2 [15]. В связи с этим, вопросы почечной безопасности при лечении АН приобретают особую актуальность. При лечении тенофовиром встречается поражение почек (включая синдром Фанкони) и костей (остеопения и остеопороз) вследствие тубулопатии [16,17]. В одной из работ показано, что терапия тенофовиром в течение 2 лет сопровождается уменьшением СКФ в среднем на 4,8 мл/мин, при этом у 18% пациентов отмечено снижение СКФ на 25% и более, а у 1,2% – ниже 50 мл/мин [18]. В исследовании Wu и соавт. СКФ при лечении тенофовиром в течение 3 лет снизилась в среднем на 6,5 мл/мин [22]. Мы также отметили снижение СКФ (в среднем на 12,3 мл/мин) и повышение уровня креатинина сыворотки (в среднем на 14 мкмоль/л) при лечении тенофовиром в течение 5 лет. У 16% пациентов наблюдалось снижение СКФ на 15% и более и лишь у 1 (4%) – на 25% от исходного. Ни у одного пациента не отмечено снижения СКФ менее 50 мл/мин. В связи с небольшим количеством пациентов (n=25) мы не выявили статистически достоверных факторов риска снижения СКФ при лечении тенофовиром. В литературе факторами риска повреждения почек при лечении тенофовиром считают наличие сахарного диабета, низкую концентрация витамина D в крови и исходное заболевание почек. Поэтому в настоящее время у пациентов с исходными признаками или факторами риска повреждения почек рекомендуется применять энтекавир или новую форму тенофовира (тенофовир алафенамид) [19]. Мы не обнаружили статистически достоверного изменения уровня креатинина сыворотки (–6,6 мкмоль/л) и СКФ (+0,2 мл/мин) при лечении энтекавиром в течение 8 лет. В исследовании Wu и соавт. также не отмечено клинически значимого изменения СКФ (в среднем +2,0 мл/мин/1,73м2) при лечении энтекавиром в течение 3 лет [22].
В нашем исследовании при лечении телбивудином (в среднем в течение 5 лет) наблюдалось снижение сывороточного уровня креатинина (в среднем на 8,1 мкмоль/л) и увеличение СКФ (в среднем на 6,2 мл/мин). Другие авторы также отмечают улучшение показателей азотовыделительной функции почек при лечении телбивудином, механизм которого остается неясным [20]. В частности в исследовании GLOBE показано, что СКФ увеличилась в среднем на 8,5% от исходной при лечении телбивудином в течение 2 лет. Более значительное повышение СКФ отмечено у пациентов с исходными факторами риска почечного повреждения: исходная СКФ в пределах 60-89 мл/мин/1,73 м2 (на 17,2%), возраст старше 50 лет (на 11,4%), компенсированный (на 7,2%) и декомпенсированный цирроз печени (на 2,0%) [21]. Могут ли эти данные рассматриваться как основание для применения телбивудина у больных с исходным нарушением функции почек или факторами риска ее развития остается неясным, особенно с учетом более высокой частоты развития резистентности при длительном приеме телбивудина по сравнению с энтекавиром и тенофовиром.
В нашем исследовании у 52% пациентов, получавших телбивудин, наблюдалось повышение активности КФК в среднем через 19±3 мес от начала лечения. У 5 (21,7%) пациентов отмечены признаки миопатии (боли и слабость в мышцах), а у 3 из них – прогрессирование поражения мышц. В работе Zou и соавт. незначительное повышение активности КФК (<3 норм) отмечено у 63% пациентов, получавших телбивудин [23]. По данным обзора Cochrane 2007 г., миалгия при терапии телбивудином развивается в 12-14% случаев, бессимптомное повышение активности КФК – в 9%, а миопатия – в 0,5% [24]. В ретроспективном исследовании Avila и соавт. поражение мышц (миалгия/миопатия/ миозит) в течение 208 недель лечения телбивудином наблюдалось в 4,1% случаев [25]. В исследовании GLOBE у 12,9% пациентов выявили повышение уровня КФК более чем в 7 раз, как правило, транзиторное, у 2 пациентов отмечена миопатия, которая проходила после прекращения терапии [26]. В другой работе повышение активности КФК наблюдалась в 10,1% случаях, а миалгия – в 6,1% [27]. В исследованиях, проводившихся в клинической практике, при лечении телбивудином отмечена более высокая частота повышения активности КФК и миопатии. В частности, в работе Ma и соавт. повышение активности КФК наблюдали у 42% пациентов в течение 3 лет, у половины из них имелись симптомы поражения мышц [28].
Удобный режим дозирования (1 таблетка в сутки), высокая безопасность и хорошая переносимость, как правило, обусловливают высокую приверженность к лечению АН при ХГВ. В нашей работе 87% пациентов пропускали прием не более одной таблетки в месяц, особенно при приеме тенофовира (92%) и энтекавира (91%) и реже при лечении телбивудином (70%). Мы не смогли выявить причины более низкой приверженности к лечению телбивудином. Хотя необходимо отметить, что средний возраст пациентов, получавших телбивудин, был достоверно ниже (35±12 лет) такового больных, принимавших тенофовир (43±13 лет) и энтекавир (44±14 лет). В ряде работ показано, что приверженность к терапии в среднем ниже у больных молодого возраста [32,39]. В связи с этим лицам молодого возраста необходимо чаще и более детально объяснять необходимость регулярного приема препарата, рекомендовать использование технических устройств для напоминания о времени приема препарата. В целом ряде работ показано, что низкая приверженность к лечению ассоциируется с более высоким риском развития резистентности к лечению [29,30]. В нашей работе среди пациентов с плохой приверженностью к лечению телбивудином чаще наблюдалось развитие резистентности к лечению и рецидива гепатита по сравнению с пациентами с хорошей приверженностью (66% и 35%, соответственно, p<0.05). Показано также, что приверженность к лечению, как правило, снижается при увеличении длительности терапии [36,37]. Среди других факторов, ассоциирующихся с приверженностью к терапии, выделяют уровень материального благо получия и образования пациента, количество других принимаемых лекарственных средств, степень взаимодействия врача и пациента [32,35,38,39]. В исследовании Peng и соавт. приверженность пациентов к терапии телбивудином и энтекавиром оказалась одинаковой (99% и 98%, соответственно), однако авторы оценивали ее через 12 мес от начала терапии [33].
Частота "сохранения на терапии" в нашей работе была ниже при лечении телбивудином (48%) и тенофовиром (76%) и выше – энтекавиром (89%). Если при лечении телбивудином основной причиной досрочного прекращения лечения было развитие резистентности к препарату или миопатии, то при лечении тенофовиром – отсутствие материальных возможностей продолжать покупать препарат. Более высокая частота "сохранения
на терапии" при лечении энтекавиром была обусловлен как высокой эффективностью и безопасностью по сраврению с таковыми телбивудина, так и тем, что подавляющее большинство пациентов получали терапию бесплатно в рамках федеральных и региональных программ (в отличие от тенофовира, который большинство пациентов приобретали самостоятельно). Аналогичные результаты были получены Chien и соавт., в работе которых терапия телбивудином была прекращена у 39% пациентов против 9% пациентов, принимавших энтекавир [34]. В исследовании Xu и соавт. также показана высокая частота прекращения лечения (в 48,7% случаев) вследствие высокой стоимости препаратов [35]. Таким образом, можно предполагать, что повышение доступности лечения и применение более эффективных и безопасных препаратов будет сопровождаться увеличением показателя "сохранения на терапии" при длительном лечении АН у больных ХГВ.
Заключение
Длительная терапия энтекавиром и тенофовиром безопасна и характеризуется высокой частотой "сохранения на терапии" и хорошей приверженностью к лечению. При длительной терапии тенофовиром необходим мониторинг функции почек. Лечение телбивудином ассоциируется с высокой частотой преждевременного прекращения терапии вследствие развития резистентности к препарату и поражения мышц. Плохая приверженность к лечению телбивудином наблюдалась у лиц молодого возраста и сопровождалась более высоким риском неэффективности терапии.
Используемые источники
- Schweitzer A, Horn J, Mikolajczyk RT, et al. Estimations of worldwide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013. Lancet 2015;386:1546-55.
- Ивашкин В.Т., Ющук Н.Д., Маевская М.В. и др. Диагностика и лечение гепатита В у взрослых: консенсус экспертов. Инфекционные болезни: Новости. Мнения. Обучение 2013;4(5):75-102 [Ivashkin VT, Yushchuk ND, Mayevskaya MV. Hepatitis B: diagnosis and treatment in adults. Expert consen- sus. Infektsionnye bolezni: Novosti. Mneniya. Obuchenie 2013;4(5):75-102. (In Russ.)].
- Terrault NA, Lok ASF, McMahon BJ: et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology 2018; 67(4):1560-99.
- European Association For The Study Of The Liver. EASL clinical practice guide- lines: Management of chronic hepatitis B virus infection. J Hepatol 2012;57(1): 167-85.
- Ивашкин В.Т., Ющук Н.Д., Маевская М.В. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации и Российского общества по изучению печени по диагностике и лечению взрослых больных гепатитом В. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2014;24(3):58-88 [Ivashkin VT, Yushchuk ND, Mayevskaya MV, et al. Clinical guidelines of the Russian gastroenterological association and the Russian society on studying of liver diseases on diagnostics and treatment of adult patients with hepatitis B. Rossiiskii zhurnal gastroenterologii, gepatologii, kolo- proktologii 2014;24(3):58-88 (In Russ.)].
- Ogawa E, Furusyo N, Nguyen MH. Tenofovir alafenamide in the treatment of chronic hepatitis B: design, development, and place in therapy. Drug Des Devel Ther 2017;11:3197-204.
- Zheng J, Deng M, Qiu X, et al. Rhabdomyolysis, lactic acidosis, and multiple organ failure during telbivudine treatment for hepatitis B: a case report and review of the literature. J Med Case Rep 2017;11(1):331.
- Sobhonslidsuk A, Numthavaj P, Wanichanuwat J, et al. Reversal of proximal renal tubular dysfunction after nucleotide analogue withdrawal in chronic hepatitis B. Biomed Res Int 2017;2017:4327385.
- Liu J, Chen T, Zhao Y. Telbivudine therapy for gravidas with chronic hepatitis B infection and patients at risk of renal impairment. J Viral Hepat 2017;24(S1):6-11.
- Tsai MC, Chen CH, Hung CH, et al. A comparison of efficacy and safety of 2 ‐ year telbivudine and entecavir treatment in patients with chronic hepatitis B: a match–control study. Clin Microbiol Infection 2014;20(2):O90-O100.
- Rodr í guez M, Pascasio JM, Fraga E, et al. Tenofovir vs lamivudine plus adefovir in chronic hepatitis B: TENOSIMP-B study. World J Gastroenterol 2017;23(41): 7459-69.
- Luo XD, Chen XF, Zhou Y, et al. Comparison of 208-week sequential therapy with telbivudine and entecavir in HBeAg-positive chronic hepatitis B patients with suboptimal responses to 24 weeks of Peg-IFN α-2a therapy: An open-labelled, r andomized, controlled, "real-life" trial. J Viral Hepat 2017;24(S1):36-42.
- Shang J, Wen Q, Wang CC, et al. Safety and efficacy of telbivudine for chronic hepatitis B during the entire pregnancy: Long-term follow-up. J Viral Hepat 2017;24(S1):43-8.
- Kayaaslan B, Guner R. Adverse effects of oral antiviral therapy in chronic hepatitis B. World J Hepatol 2017;9(5):227-41.
- Mauss S, Berger F, Filmann N, et al. Effect of HBV polymerase inhibitors on r enal function in patient with chronic hepatitis B. J Hepatol 2011;55:1235-40.
- Cho H, Cho Y, Cho EJ, et al. Tenofovir-associated nephrotoxicity in patients w ith chronic hepatitis B: two cases. Clin Mol Hepatol 2016;22(2):286-91.
- Riveiro-Barciela M, Tabernero D, Calleja JL, et al. Effectiveness and safety of entecavir or tenofovir in a Spanish cohort of chronic hepatitis B patients: validation of the Page-B Score to predict hepatocellular carcinoma. Dig Dis Sci 2 017;62(3):784-93.
- Agarwal K, Brunetto M, Seto WK, et al. 96 weeks treatment of tenofoviralafenamidevs.tenofovirdisoproxilfumarate for hepatitis B virus infection. J Hepatol 2018;68(4):672-81.
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017;67(2):370-398.
- Chan HLY, Chen YC, Gane EJ, et al. Randomized clinical trial: efficacy and safety of telbivudine and lamivudine in treatment-na ı ve patients with HBV-related d ecompensated cirrhosis. J Viral Hepat 2012;19:732–3.
- Gane EJ, Deray G, Liaw YF, et al. Telbivudine improves renal function in patients with chronic hepatitis B. Gastroenterology 2014;146(1):138-46.
- Wu IT, Hu TH, Hung CH, et al. Comparison of the efficacy and safety of ente- cavir and tenofovir in nucleos(t)ide analogue-naive chronic hepatitis B patients w ith high viraemia: a retrospective cohort study. Clin Microbiol Infect 2017;23(7):464–9.
- Zou XJ, Jiang XQ, Tian DY. Clinical features and risk factors of creatine kinase elevations and myopathy associated with telbivudine. J Viral Hepat 2011;18: 8 92–6.
- Matthew SJ. Telbivudine for the management of chronic hepatitis B virus infection. Clin Ther 2007;29:2635-53.
- Avila M, Goncalves S. Creatine kinase elevations during 4 years of continuous telbivudine treatment are transient and not predictive of uncommonly observed muscle related symptoms [abstract]. 60th Annual Meeting of the American Association for the Study of the Liver Diseases (AASLD); October 30 - November 3 2009; Boston, USA.
- Liaw YF, Gane E, Leung N, et al. 2-Year GLOBE trial results: telbivudine is superior to lamivudine in patients with chronic hepatitis B. Gastroenterology 2009;136(2):486-95.
- Wang Y, Thongsawat S, Gane E, et al. Efficacy and safety of continous 4 year telbivudine treatment in patients with chronic hepatitis B. J Viral Hep 2013;20: e37- e46.
- Ma WM, Lee XH, Liu Y, et al. Multivariate analysis of serum creatine kinase elevations during 3 years telbivudine therapy for 218 patients with chronic hepatitis B. Hepatology 2011;54(S4):1056A.
- Sogni P, Carrieri MP, Fontaine H, et al. The role of adherence in virological suppression in patients receiving anti-HBV analogues. Antivir Ther 2012;17(2):395- 400.
- Hongthanakorn C, Chotiyaputta W, Oberhelman K, et al. Discrepancy between virological breakthrough and confirmed genotypic resistance in chronic hepatitis B patients receiving nucleos(t)ide analogue therapy in clinical practice. Gastroentero logy 2010;138(5):793.
- Chotiyaputta W, Peterson C, Ditah FA, et al. Persistence and adherence to nucleos(t)ide analogue treatment for chronic hepatitis B. J Hepatol 2011;54(1):12-8.
- vanVlerken LG, Arends P, Lieveld FI, et al. Real life adherence of chronic hepatitis B patients to entecavir treatment. Dig Liver Dis 2015;47(7):577-83.
- Peng J, Yin J, Cai S, et al. Factors associated with adherence to nucleos(t)ide analogs in chronic hepatitis B patients: results from a 1-year follow-up study. Patient Prefer Adherence 2015;9:41-5.
- Chien RN, Peng CY, Kao JH, et al. Higher adherence with 3‐year entecavir treatment than lamivudine or telbivudine in treatment ‐ na ï ve Taiwanese patients with chronic hepatitis B. J Gastroenterol Hepatol 2014;29(1):185-92.
- Xu K, Liu LM, Farazi PA, et al. Adherence and perceived barriers to oral antiviral therapy for chronic hepatitis B. Glob Health Action 2018;11(1):1433987.
- W ó jcik K, Piekarska A, Jab ł onowska E. Adherence to antiviral therapy in HIV or HBV-infected patients. Przegl Epidemiol 2016;70(1):27-32.
- Tütüncü EE, G ü ner R, Gürbüz Y, et al. Adherence to nucleoside/nucleotide analogue treatment in patients with chronic hepatitis B. Balkan Med J 2017;34(6): 540-5.
- Giang L, Selinger CP, Lee AU. Evaluation of adherence to oral antiviral hepatitis B treatment using structured questionnaires. World J Hepatol 2012;4(2):43-9.
- Sheppard-Law S, Zablotska-Manos I, Kermeen M, et al. Factors associated with non-adherence to HBV antiviral therapy. Antivir Ther 2018;23(5):
