Влияние полиморфизма гена CES1 на антиагрегантный эффект блокатора P2Y12 рецепторов клопидогрела
Изучить ассоциацию носительства полиморфного маркера rs2244613 гена CES1 с резистентностью к клопидогрелу у пациентов, перенесших острый коронарный синдром (ОКС) и чрескожное коронарное вмешательство.
В исследовании приняли участие 81 пациент с диагнозом ОКС, получавших двойную антиагрегантную терапию ацетилсалициловой кислотой и клопидогрелом, и 136 здоровых добровольцев. Остаточную реактивность тромбоцитов измеряли на 2-5-е сутки ОКС с помощью метода оптической детекции агглютинации тромбоцитов Verify Now. Полиморфизм rs2244613 определяли с помощью полимеразной цепной реакции в режиме реального времени.
Генотип АА по полиморфизму rs2244613 гена CES1 был обнаружен у 37 (45,6%) пациентов с ОКС и 70 (51,5%) здоровых добровольцев, генотип AС – у 42 (51,8%) и 55 (40,4%), генотип CC – у 2 (2,6%) и 11 (8,1%), соответственно. Остаточная реактивность тромбоцитов у носителей полиморфного маркера rs2244613 была выше, чем у пациентов, не имеющих данный аллельный вариант: 183,23±37,24 и 154,3± 60,36 PRU, соответственно (p=0,01). Частота минорного аллеля С у пациентов с ОКС и здоровых добровольцев составила 28,4% и 28,3%, соответственно. Статистически значимых различий частоты носительства полиморфного маркера rs2244613 между здоровыми и пациентами с ОКС не обнаружено (p>0,05).
Нами была выявлена статистически значимая связь между носительством полиморфного маркера rs2244613 гена CES1 и уровнем остаточной агрегации тромбоцитов у пациентов, перенесших ОКС и чрескожное коронарное вмешательство. Данный полиморфизм одинаково часто встречалсся у здоровых людей и больных ОКС.
По данным ВОЗ [1] сердечно-сосудистые заболевания являются основной причиной смертности населения во всем мире. Чаще всего в основе развития острого коронарного синдрома (ОКС) лежит разрыв или эрозия атеросклеротической бляшки, которые приводят к тромбообразованию и развитию его клинических проявлений, таких как инфаркт миокарда (ИМ), инсульт и окклюзия периферических артерий. Клопидогрел и ацетилсалициловая кислота входят в состав двойной антиагрегантной терапии, которая является стандартом профилактики неблагоприятных сердечно-сосудистых исходов у пациентов, перенесших ОКС и чрескожное коронарное вмешательство (ЧКВ) [2]. Она направлена на предотвращение развития тромботических осложнений и развития рецидивов ишемической болезни сердца [3]. Эффективность двойной антитромбоцитарной терапии может снизиться при сохранении высокой остаточной реактивности тромбоцитов [4], которая может быть следствием вариабельности фармакологического ответа на антиагрегантные препараты, прежде всего, на клопидогрел. Причинами ее являются индивидуальные различия в скорости биотрансформации препарата под действием изоферментов цитохрома Р450, таких как CYP2C19, CYP3A4, а также печеночной карбоксилэстеразы-1 (CES1).
Примерно 85% дозы клопидогрела быстро гидролизируется в неактивное производное карбоновых кислот, которое далее метаболизируется путем связывания с глюкуроновой кислотой [5]. Гидролиз катализируется CES1. Носительство полиморфизма гена CES1 может оказать значительное влияние на метаболизм клопидогрела в организме и, соответственно, на его антиагрегантную активность. В исследовании PAPI было установлено, что носительство полиморфного маркера c.428G>A (rs71647871) гена CES1 связано с потерей каталитической активности фермента, что может стать причиной повышения плазменной концентрации активного метаболита клопидогрела и повышения антиагрегантного эффекта. У носителей аллельного варианта по полиморфизму rs71647871 были значительно выше уровни циркулирующего активного метаболита клопидогрела (30,3±6,1 против 19,0±0,4 нг/мл, соответственно, p=0,001), а также отмечено более выраженное ингибирование АДФ-стимулированной агрегации тромбоцитов по сравнению с таковой у неносителей (до 29% и 43% от исходного уровня, соответственно, р=0,003) [6].
Целью исследования было изучить ассоциацию носительства полиморфного маркера rs2244613 гена CES1 с резистентностью к клопидогрелу у пациентов, перенесших острый коронарный синдром (ОКС) и чрескожное коронарное вмешательство.
Материалы и методы
Клиническая часть исследования, включая все лабораторно-инструментальные исследования и измерение остаточной реактивности тромбоцитов, проводилась на базе Городской клинической больницы №1 имени Н.И. Пиро гова ДЗ г. Москвы. Генотипирование по полиморфизму c.1168-33A>C (rs2244613) гена CES1 у всех участников исследования проводилось на базе Научного исследовательского центра ГБОУ ДПО Российской медицинской академии непрерывного профессионального образования (РМАНПО). Протокол исследования был одобрен независимым этическим комитетом РМАНПО. Все участники дали письменное информированное согласие на участие в исследовании.
Изучаемая популяция. В исследование включали пациентов из русской этнической группы (г. Москва), поступивших с диагнозом ОКС, перенесших ЧКВ и получавших двойную антиагрегантную терапию ацетилсалициловой кислотой (АСК) и клопидогрелом. Контрольную группу составили здоровые добровольцы.
Лабораторные исследования. Для измерения остаточной реактивности тромбоцитов у пациентов с ОКС использовали метод оптической детекции агглютинации тромбоцитов. Забор цельной крови из локтевой вены для измерения агрегации тромбоцитов осуществлялся на 3-5-е сутки после ОКС и ЧКВ в вакуумные пробирки Greiner Bio-One Vacuette (Greiner Bio-One, Австрия) на 2 мл с 3,2% цитратом натрия. Исследование проводилось на тест-системе VerifyNow P2Y12 (Аccumetrics, США) в течение 1 ч после взятия образца цельной венозной крови. Значение PRU (P2Y12 Reaction Units, единицы реактивности тромбоцитов), равное 208, считается порогом резистентности к клопидогрелу [14,15] и, соответственно, может ассоциироваться с повышенным риском развития тромботических осложнений.
Генотипирование. Для генотипирования использовали венозную кровь, собранную на 2–5-е сутки после ЧКВ в вакуумные пробирки Vacuette (Greiner Bio-One, Австрия) с ЭДТА. Носительство полиморфного маркера гена CES1 выявляли методом полимеразной цепной реакции в режиме реального времени (Real-Time PCR) на приборах CFX96 Touch Real-Time PCR Detection System (Bio-Rad
Laboratories, Inc., USA). Для определения полиморфизма гена CES1 использовали набор "ГенТест CES1" (ООО "Номотек", Москва, Россия). Программа амплификации включала в себя этап инкубации при 95 °C в течение 3 мин, затем денатурации при 95 °C в течение 10 с и отжиг при 60 °C в течение 30 с на протяжении 50 циклов. Сигнал флуоресценции развивался по соответствующему каналу: FAM, HEX или FAM и HEX. ДНК выделяли из цельной крови с помощью реагентов "ДНК-ЭКСТРАН-1" (ЗАО "Синтол", Россия).
Статистический анализ. Статистическую обработку результатов проводили с помощью программы SPSS Statistics 20.0. Средние показатели представлены как М±SD, где М – среднее значение, SD – стандартное отклонение. Нормальность распределения проверяли с помощью критерия Колмогорова-Смирнова. Для оценки достоверности различий количественных показателей применяли t критерий для независимых выборок и критерий МаннаУитни. Для установления различий категориальных показателей использовали критерий хи-квадрат (χ2) Пирсона. Был проведен тест Харди–Вайнберга для подтверждения независимого распределения аллелей по изучаемому полиморфизму. Для оценки различий частоты аллелей по rs2244163 между пациентами с ОКС и здоровыми добровольцами использовали точный тест Фишера. Различия считали значимыми при р<0,05.
Результаты
В исследование были включены 81 пациент (64 мужчины и 17 женщин, средний возраст 63,9±10,9 лет) из русской этнической группы (г. Москва) с ОКС, в том числе 50 пациентов с ОКС с подъемом сегмента ST и 31 – с ОКС без подъема сегмента ST. У 50 больных диагностирован Q-образующий ИМ, у 17 – не-Q-образующий ИМ, у 10 – нестабильная стенокардия, у 4 – неуточненный ИМ. Все больные после ЧКВ получали двойную антиагрегантную терапию АСК (нагрузочная доза – 300 мг, поддерживающая – 100 мг) и клопидогрелом (нагрузочная доза – 300 мг, поддерживающая – 75 мг). У 11 пациентов клопидогрел применяли в нагрузочной дозе 300 мг, а у 2 – в поддерживающей дозе 150 мг. Контрольную группу составили 136 добровольцев без ОКС (26 мужчин и 110 женщин, средний возраст 42,1±11,9 лет) из русской этнической группы (г. Иркутск).
Распределение генотипов rs2244613 гена CES1 у пациентов с ОКС не соответствовало равновесию Харди-Вайнберга. Частота генотипов АА, АС и СС составила 45,6%, 51,8% и 2,6%, соответственно. Аллели А и С встречались у 71,6% и 28,4% пациентов, соответственно (табл. 1). У добровольцев распределение генотипов rs2244613 соответствовало равновесию Харди – Вайнберга. Частота носительства различных генотипов, а также аллелей А и С у пациентов с ОКС и добровольцев достоверно не отличалась (табл. 1).
| Группы | N | Генотипы, n (%) | Аллели, n (%) | Соответствие распределению
по закону Харди – Вайнберга |
Сравнение частоты
носительства аллелей |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
| АА | АС | СС | А | С | χ2 | р | р | ОШ (95% ДИ) | ||
| Примечание: ОШ – отношение шансов, ДИ – доверительный интервал | ||||||||||
| Пациенты с ОКС | 81 | 37 (45,6) | 42 (51,8) | 2 (2,6) | 116 (71,6) | 46 (28,4) | 6,131 | 0,046 | 1,000 | 1,004 |
| Здоровые добровольцы | 136 | 70 (51,5) | 55 (40,4) | 11 (8,1) | 195 (71,7) | 77 (28,3) | 0,002 | 0,965 | (0,652-1,546) | |
Остаточная реактивность тромбоцитов у пациентов с генотипом АА была достоверно ниже, чем у больных с генотипами АС + СС (p=0,01; рис. 1), т.е. носительство полиморфного маркера rs2244613 ассоциировалось с нарушением фармакологического ответа на терапию клопидогрелом. У пациентов с генотипом АА средняя степень ингибирования тромбоцитов была выше, чем у носителей аллельного варианта С (АС+СС) rs2244613 гена CES1(32,8±4,1% и 24,9±2,1%, соответственно), хотя разница между группами не достигла статистической значимости (отношение шансов 1,429; 95% доверительный интервал 0,491-4,160; p=0,109). Доля пациентов с "лабораторной" резистентностью к клопидогрелу (PRU>208) среди пациентов с генотипами АС + СС была выше, чем среди больных с генотипом АА: 27,2% и 18,9%, соответственно (отношение шансов 1,607; 95% доверительный интервал 0,559-4,624; p= 0,01).
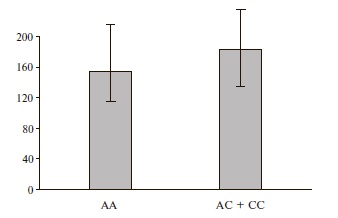
Пациенты с нормальным генотипом АА и носители аллельного варианта С (АС + СС) не отличались по клинико-демографическим показателям, сопутствующей терапии, а также лабораторным параметрам, в том числе уровням общего холестерина, липопротеидов низкой плотности, триглицеридов, креатинина и глюкозы (табл. 2).
| Параметры | Все пациенты (n=81) | Генотип АА (n=37) | Генотип АС + СС (n=44) | p |
|---|---|---|---|---|
| Возраст, лет | 63,9±10,9 | 64,3±12,2 | 63,7±9,8 | 0,803 |
| Диагноз, n (%) | ||||
| Нестабильная стенокардия | 10 (12,3) | 6 (7,4) | 4 (4,9) | 0,290 |
| Q-образующий ИМ | 50 (61,7) | 21 (25,9) | 29 (35,8) | |
| Не-Q-образующий ИМ | 17 (21,0) | 8 (9,8) | 9 (11,1) | |
| ИМ неуточненный | 4 (4,9) | 2 (2,45) | 2 (2,45) | |
| Сопутствующие заболевания, n (%) | ||||
| Сахарный диабет 2 типа | 16 (19,8) | 6 (7,4) | 10 (12,3) | 0,465 |
| Артериальная гипертония | 75 (92,5) | 35 (43,2) | 40 (49,3) | 0,637 |
| Анемия | 4 (4,9) | 2 (2,45) | 2 (2,5) | 0,862 |
| Ишемический инсульт в анамнезе | 5 (6,2) | 1 (1,2) | 4 (4,9) | 0,228 |
| Активное курение, n (%) | 17 (20,9) | 7 (8,6) | 10 (12,3) | 0,678 |
| Лабораторные показатели | ||||
| Тромбоциты, 109 клеток/л | 226,42±64,62 | 230,16±66,15 | 223,29±63,92 | 0,638 |
| Общий холестерин, ммоль/л | 5,10±1,20 | 5,20±1,07 | 5,10±1,32 | 0,614 |
| Липопротеиды низкой плотности, ммоль/л | 2,86±1,15 | 3,06±1,26 | 2,70±1,04 | 0,180 |
| Триглицериды, ммоль/л | 1,69±0,60 | 1,57±0,48 | 1,80±0,79 | 0,120 |
| Креатинин, мкмоль/л | 105,10±20,40 | 106,04±19,4 | 104,35±21,30 | 0,711 |
| Глюкоза, ммоль/л | 6,80±5,70 | 7,37±8,24 | 6,30±1,73 | 0,455 |
| Гематокрит, % | 42,16±6,80 | 41,80±7,80 | 42,45±5,88 | 0,679 |
| Сопутствующая терапия, n (%) | ||||
| Блокаторы кальциевых каналов | 5 (6,2) | 3 (3,7) | 2 (2,5) | 0,523 |
| Ингибиторы протонной помпы | 80 (98,8) | 37 (45,6) | 43 (53,2) | 0,323 |
| Бета-адреноблокаторы | 71 (89,9) | 33 (40,7) | 37 (45,6) | 0,114 |
| Ингибиторы АПФ | 53 (65,4) | 25 (67,6) | 28 (34,6) | 0,355 |
Обсуждение
Результаты исследования показали, что носительство аллельного варианта С по rs2244613 гена CES1 у пациентов с ОКС ассоциировано с более высокой остаточной реактивностью тромбоцитов, что может быть связано с повышением каталитической активности CES1 и уменьшением концентрации активного метаболита клопидогрела в организме. Частота носительства полиморфизма rs2244613 достоверно не отличалась у больных, перенесших ОКС, и здоровых добровольцев.
Клопидогрел представляет собой тиенопиридин, который превращается в фармакологически активный тиоловый метаболит через неактивный промежуточный 2-оксо-клопидогрел [5]. Реакция катализируется ферментами цитохрома P450, включая CYP2C19, CYP3A, CYP2B6, CYP1A2 и CYP2C9 [7]. Однако только 15% клопидогрела становится биодоступным [7]. Активный метаболит 5-тиол клопидогрел ингибирует индуцированную АДФ активацию и агрегацию тромбоцитов путем необратимого связывания с рецептором P2Y12 на поверхности клеток [8]. Примерно 85% клопидогрела быстро гидролизируется в неактивное производное карбоновых кислот, которое далее метаболизируется путем связывания с глюкуроновой кислотой [5]. Этот гидролиз катализирует CES1, которая в основном экспрессируется в печени [9]. Недавние исследования показали, что гидролиз клопидогрела под действием CES1 приводит к более чем 1000-кратному увеличению содержания неактивного производного карбоновых кислот в плазме по сравнению с концентрацией активного производного клопидогрела в крови [10], т.е. образование неактивного метаболита препарата происходит намного эффективнее, чем активного метаболита [11]. Это свидетельствует об огромном влиянии каталитической активности фермента CES1 на концентрацию клопидогрела в организме.
На ведущем ресурсе по фармакогенетике – pharmgkb.org [12] полиморфизму rs71647871 гена CES1 был присвоен уровень доказанности 2В, как и полиморфизму изофермента цитохрома P450 – CYP2C19, которому посвящено большее количество исследований. Полиморфизм rs71647871 гена CES1 ассоциирован со снижением каталитической активности фермента CES1 и увеличением концентрации активного метаболита клопидогрела в организме. Повышение уровня доказанности свидетельствует о том, что все больше исследований гена CES1 достоверно подтверждают ассоциацию носительства определенного полиморфизма с изменением каталитической активности фермента, которое может повлиять на эффективность терапии клопидогрелом. Дальнейшие исследования могут подтвердить целесообразность генотипирования по полиморфизмам гена CES1 в клинической практике. С. Xie и соавт. установили, что полиморфизм CES1P1 rs3785161 ассоциировался с ослаблением антиагрегантного эффекта клопидогрела у 162 пациентов с ишемической болезнью сердца, а полиморфизм rs8192950 был связан с уменьшением риска опасных осложнений, таких как рецидивирующая транзиторная ишемическая атака, инсульт, инфаркт миокарда и множество сосудистых заболеваний, при лечении клопидогрелом у пациентов со стенозом внечерепных или внутричерепных сосудов [13].
Мы впервые изучили влияние полиморфизма rs2244613 гена CES1 на антиагрегантную активность клопидогрела. Изменение гена CES1 в положении c.1168-33A>C может изменить фосфорилирование и вторичную структуру белка CES1 и его взаимодействие с лигандом. В исследовании PAPI было установлено, что носительство полиморфизма rs71647871 гена CES1 связано с потерей каталитической активности фермента, что может привести к повышению плазменной концентрации активного метаболита клопидогрела и повышения антиагрегантного эффекта. В нашем же исследовании полиморфизм rs2244613 гена CES1, который дает противоположный эффект, был связан с повышением остаточной реактивности тромбоцитов, возможно, за счет повышения каталитической активности CES1. Снижение антиагрегантной активности клопидогрела может способствовать повышению риска развития повторных тромботических осложнений. Разнообразие полиморфизмов гена CES1, которые могут оказывать противоположное влияние на каталитическую активность фермента CES1, обусловливает актуальность дальнейшего изучения этого гена.
Заключение
Нами выявлена статистически значимая ассоциация носительства полиморфного маркера rs2244613 гена CES1 с резистентностью к клопидогрелу у пациентов с ОКС. Данный полиморфизм одинаково часто встречалсся у здоровых людей и больных ОКС, что указывало на отсутствие связи изученного полиморфизма с заболеванием. Полученные результаты подтверждают целесообразность рассмотрения данного генетического маркера для прогнозирования фармакологического ответа на клопидогрел и оптимизации фармакотерапии ОКС на основе генотипирования по CES1, хотя эта гипотеза нуждается в подтверждении в проспективных фармакогенетических исследованиях. Следует также оценить совместное влияние ферментов CES1 и изоферментов цитохрома P450 на фармакокинетику и фармакодинамику клопидогрела и его клиническую эффективность и безопасность.
Используемые источники
- http://www.who.int/mediacentre/factsheets/fs310/ru/index1.html.
- Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. J Am Coll Cardiol 2018;71:e127-e248.
- Torpy JM, Lynm C, Glass RM. Percutaneous coronary intervention. JAMA 2004;291(6):778.
- Amin AM, Sheau Chin L, Azri Mohamed Noor D, et al. The personalization of сlopidogrel antiplatelet therapy: the role of integrative pharmacogenetics and pharmacometabolomics. Cardiol Res Pract. 2017;2017:8062796.
- Silvestro L, Gheorghe M, Iordachescu A, et al. Development and validation of an HPLC-MS/MS method to quantify clopidogrel acyl glucuronide, clopidogrel acid metabolite, and clopidogrel in plasma samples avoiding analyte back-conversion. Anal Bioanal Chem 2011;401(3):1023-34.
- Lewis JP, Horenstein RB, Ryan K, et al. The functional G143E variant of carboxylesterase 1 is associated with increased clopidogrel active metabolite levels and greater clopidogrel response. Pharmacogenet Genomics 2013;23(1):1-8.
- Xiao FY, Luo JQ, Liu M, et al. Effect of carboxylesterase 1 S75N on clopidogrel therapy among acute coronary syndrome patients. Sci Rep 2017;7(1):7244.
- Dansette PM, Rosi J, Bertho G, Mansuy D. Cytochromes P450 catalyze both steps of the major pathway of clopidogrel bioactivation, whereas paraoxonase catalyzes the formation of a minor thiol metabolite isomer. Chem Res Toxicol 2012;25(2):348-56.
- Casey Laizure S, Herring V, Hu Z, et al. The role of human carboxylesterases in d rug metabolism: Have we overlooked their importance? Pharmacotherapy 2013;33(2):210-22.
- Tarkiainen E.K., Backman J.T., Neuvonen M, et al. Carboxylesterase 1 polymorphism impairs oseltamivir bioactivation in humans. Clin Pharmacol Ther. 2 012;92:68-71.
- Bouman HJ, Sch ö mig E, van Werkum JW, et al. Paraoxonase-1 is a major determ inant of clopidogrel efficacy. Nat Med 2011;17(1):110-6.
- https://www.pharmgkb.org/chemical/PA449053/clinicalAnnotation/982030805.
- Xie C, Ding X, Gao J, et al. The effects of CES1A2 A(-816)C and CYP2C19 lossof-function polymorphisms on clopidogrel response variability among Chinese patients with coronary heart disease. Pharmacogenet Genomics 2014;24:204-10.
- Stone GW, Witzenbichler B, Weisz G, et al. Platelet reactivity and clinical outc omes after coronary artery implantation of drug-eluting stents (ADAPT-DES): a prospective multicentre registry study. Lancet 2013;382:614-23.
- Price MJ, Berger PB, Teirstein PS, et al. Standard- vs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAV- I TAS randomized trial. JAMA 2011;305(11):1097-105
