Активация системы комплемента при АНЦА-ассоциированных васкулитах: патогенетическая роль и перспективы для клинической практики
В течение длительного времени ведущим звеном патогенеза АНЦА-ассоциированных васкулитов (ААВ) считали опосредованную антителами к цитоплазме нейтрофилов (АНЦА) активацию нейтрофилов и моноцитов с после-дующим формированием активных форм кислорода и нейтрофильных внеклеточных ловушек. Однако в последние годы получено достаточное количество данных, свидетельствующих о значимой патогенетической роли активации системы комплемента, преимущественно по альтернативному пути, в развитии этой группы заболеваний. В обзоре проанализированы результаты экспериментальных и клинических исследований в этой области, а также представлены перспективные новые под-ходы к терапии ААВ в свете новых данных.
АНЦА-ассоциированные васкулиты (ААВ) – группа редких первичных васкулитов, характеризующихся некротизирующим воспалением стенки сосудов преимущественно мелкого калибра различной локализации и, как правило, появлением антител к цитоплазме нейтрофилов (АНЦА) в крови. АНЦА относятся к группе иммуноглобулинов класса G, мишенью которых являются первичные гранулы цитоплазмы нейтрофилов и лизосомы моноцитов. Согласно действующей классификации, принятой на конференции в Чапел Хилл в 2012 году, в группу ААВ входят гранулематоз с полиангиитом, микроскопический полиангиит, эозинофильный гранулематоз с полиангиитом и АНЦА-ассоциированный васкулит с изолированным поражением почек (АНЦА-ассоциированный гломерулонефрит) [1]. Длительное время ведущую роль в патогенезе ААВ отводили активации нейтрофилов и моноцитов, приводящей к развитию некротизирующего воспаления сосудистой стенки и инфильтрации окружающих тканей воспалительными клетками [2,3]. Следует отметить, что АНЦА, имеющие существенное значение для инициации каскада патологических реакций, удается выявить не у всех пациентов с ААВ. В частности, антитела в сыворотке крови не определяются у 60% пациентов с эозинофильным гранулематозом с полиангиитом и примерно у 10% пациентов с АНЦА-ассоциированным почечным васкулитом и системными формами гранулематоза с полиангиитом и микроскопического полиангиита [4-6]. Эти данные позволяют предполагать многофакторную природу патогенеза ААВ, реализация которого происходит с вовлечением нескольких патологических механизмов.
Хорошо известно значение активации и дисрегуляции системы комплемента в развитии системной красной волчанки, криоглобулинемического васкулита и ряда других системных заболеваний соединительной ткани. Однако ее вклад в патогенез ААВ в течение длительного времени недооценивался в виду преимущественно скудного отложения компонентов системы комплемента в биоптатах, прежде всего ткани почки, полученных от пациентов с ААВ, а также низкой частоты гипокомплементемии у таких больных. Однако накопленные за последнее десятилетие данные экспериментальных и клинических исследований, свидетельствующие об активации системы комплемента при ААВ и ее существенной роли в формировании повреждения органов и тканей, позволили существенно расширить представления о патогенезе этой группы заболеваний и создали возможность для разработки новых подходов к ее лечению.
Экспериментальные модели
Роль АНЦА в патогенезе ААВ доказана в экспериментах in vitro, а также на мышиных моделях системного васкулита, ассоциированного с антителами к миелопероксидазе (МПО-АНЦА), а в клинической практике подтверждается наблюдениями новорожденных с почечно-легочным синдромом, который развился в результате трансплацентарной передачи антител от матери с активным васкулитом [7,8]. АНЦА направлены против гранул цитоплазмы нейтрофилов, содержащих МПО, протеиназу-3 (ПР-3) и ряд других веществ. В последнем случае речь идет об “атипичных” АНЦА, например, к гликопротеину-2 мембраны лизосом (lysosome-associated membrane protein 2), возможность применения которых в клинической практике для диагностики и оценки активности ААВ до конца не установлена, несмотря на доказательство их участия в патогенезе заболевания [9]. Основная функция АНЦА заключается в активации нейтрофилов и моноцитов, что приводит к повреждению ткани за счет дегрануляции протеаз, образования активных форм кислорода и нейтрофильных внеклеточных ловушек, а также к увеличению концентрации интерлейкина-1. Приме ча тельно, что экспозиция нейтрофилов in vitro с провоспалительными молекулами, в том числе C5а компонентом системы комплемента, приводит к появлению на мембране нейтрофилов таргетных молекул для АНЦА (“прайминг нейтрофилов”), что делает возможным взаимодействие аутоантител с клеткамимишенями, активацию нейтрофилов и реализацию перечисленных патологических механизмов [10]. В свою очередь, активированные нейтрофилы высвобождают факторы P и B системы комплемента, что поддерживает активацию петли амплификации и приводит к избыточной продукции C5a, который, помимо прочего, является мощным хемоаттрактантом, привлекающим еще большее количество нейтрофилов в очаг воспаления [11].
Для изучения патогенеза ААВ в эксперименте обычно используют мышей, которым для индукции заболевания вводят МПО-АНЦА класса IgG, что у особей дикого типа приводит к развитию некротизирующего гломерулонефрита и легочного капиллярита [12]. Однако в более поздних работах Xiao и соавт. показали, что введение антител к МПО мышам, дефицитным по факторам комплемента В и C5, не вызывало развитие васкулита и гломерулонефрита с полулуниями, в отличие от мышей дикого типа и мышей, дефицитных по С4, что свидетельствует о ведущей роли в патогенезе заболевания именно альтернативного пути активации системы комплемента, а не классического или лектинзависимого [13]. В другом исследовании предварительное введение подопытным животным моноклональных антител к C5 препятствовало развитию некротизирующего гломерулонефрита с полулуниями, индуцированного МПО-АНЦА, а введение антител, блокирующих C5, после индукции васкулита существенно снижало активность заболевания [14]. Напротив, у линии мышей с дефицитом компонента C6 системы комплемента, необходимого для формирования мембраноатакующего комплекса C5b-9 (МАК) при индукции почечного васкулита, ассоциированного с МПО-АНЦА, в нефробиоптате выявляли такое же количество полулуний, что и у мышей дикого типа (4,2% и 5,2%, соответственно, p=0,63). Результаты исследования позволяют сделать вывод о том, что в патогенезе ААВ активность C5а компонента играет более значимую роль, чем терминальное звено каскада, необходимое для образования МАК [15].
Следует отметить, что каскадная активация комплемента, запускаемая нейтрофилами через взаимодействие с клеточной мембраной и образование микрочастиц [16], может отчасти быть индуцирована и через классический путь при помощи C1q, активированного нейтрофильными внеклеточными ловушками [17,18], однако его вклад в патогенез заболевания остается неясным.
Активация системы комплемента при ААВ: клинические данные
Принято считать, что характерным для ААВ патоморфологическим изменением является некротизирующее воспаление стенки сосуда без накопления иммунных депозитов или с незначительным их количеством. При этом уже более 20 лет назад были опубликованы первые клинические наблюдения пациентов с АНЦА-ассоциированным гломерулонефритом, у которых при иммуногистохимическом исследовании ткани почки было выявлено отложение иммунных депозитов, в том числе C3 компонента комплемента [19]. Однако в то время подобные находки не были в полной мере интерпретированы. Впоследствии различными исследователями при морфологическом исследовании были выявлены депозиты C5b-9, С3d в почечных клубочках при помощи иммунофлуоресценции и электронной микро скопии [20,21]. В небольшом исследовании в нефробиоптатах 7 пациентов с активным АНЦА-ассоциированным гломерулонефритом было обнаружено отложение C5b-9, С3d, фактора В, в то время как у пациентов с болезнью минимальных изменений и в здоровой ткани почки эти депозиты практически отсутствовали. При этом в биоптатах пациентов с активным АНЦА-ассоциированным гломерулонефритом отсутствовали отложения маннозо-связывающего лектина и С4d компонента комплемента [22].
Изучение исходов заболевания показало, что отложение С3 компонента комплемента в ткани почки имеет неблагоприятное прогностическое значение. Это заключение было сделано группой Chen и соавт. на основании результатов наблюдения 112 пациентов с первичным АНЦА-ассоциированным гломерулонефритом. У пациентов с отложением депозитов С3с в биоптате средние значения суточной протеинурии и концентрации креатинина в сыворотке были достоверно выше, а расчетная СКФ – достоверно ниже, чем в группе пациентов без отложения C3c в биоптате (табл. 1). Частота развития диализзависимой почечной недостаточности в дебюте заболевания также была выше в группе пациентов с отложением С3с депозитов в ткани почки (48,6%), чем у пациентов без депозитов С3с (28,0%) [23]. Следует отметить, что частота выявления отложений С3с компонента комплемента в ткани почки среди обследованных больных достигала 33%, что позволяет пересмотреть сложившиеся представления о “малоиммунном” характере АНЦА-ассоциированного гломерулонефрита.
| Показатель | Пациенты с С3с в нефробиоптате, n=37 | Пациенты без С3с в нефробиоптате, n=75 | p |
|---|---|---|---|
| Суточная протеинурия, г | 1,8 (0,0–10,0) | 0,93 (0,0–13,4) | 0,01 |
| Креатинин сыворотки, мкмоль/л | 491,2±305,9 | 354,8±320,8 | 0,05 |
| рСКФ, мл/мин/1,73 м2 | 9,9 (2,7–101,6) | 24,1 (1,87–153,6) | 0,05 |
При сравнении содержания компонентов комплемента в плазме у пациентов с активным ААВ (n=66) и в ремиссии (n=54) было выявлено, что концентрации С3а, C5а, растворимого C5b-9 и Bb были достоверно выше в первой группе, а концентрация пропердина в плазме – во второй. При этом имелись достоверные прямые корреляции между концентрацией компонента Bb в плазме крови и показателями активности заболевания, в частности количеством полулуний в нефробиоптате, величиной СОЭ и значением индекса Birmingham Vasculitis Activity Score (BVAS), а достоверные обратные корреляции – между концентрацией пропердина в плазме и количеством полулуний в нефробиоптате [24].
В другой работе было показано, что количество депозитов фактора Вb прямо коррелирует не только с процентом полулуний в нефробиоптате, но и выраженностью тубулоинтерстициального воспаления и фиброза [25]. При этом концентрация Bb в моче у пациентов с активным АНЦА-ассоциированным васкулитом была достоверно выше, чем у пациентов в ремиссии, а также прямо коррелировала с концентрацией креатинина сыворотки [25]. Сходные результаты были получены в более крупном исследовании, в котором было проанализировано 187 нефробиоптатов, полученных у пациентов с АНЦА-ассоциированным гломерулонефритом [26]. Отложение компонента C3d и пропердина в биоптате было ассоциировано скорее с формированием полулуний, нежели очаговым или смешанным типом гломерулонефрита, а отложение депозитов пропердина ассоциировалось с более высокой протеинурией. Примечательно, что при сопоставлении групп пациентов с различным серологическим профилем частота выявления депозитов С3с компонента комплемента была достоверно выше у пациентов с антителами к МПО (52,3%) по сравнению с таковой у носителей антител к ПР-3 (32,3%, р=0,006).
В исследовании Yuan и соавт. на мембранах нейтрофилов и макрофагов была выявлена экспрессия двух типов рецепторов к C5a: C5aR и C5L2. При этом у пациентов с активным ААВ экспрессия C5L2 была повышена, а экспрессия C5aR снижена, а ее выраженность имела обратную связь с концентрацией креатинина сыворотки и степенью интерстициального фиброза в ткани почки [27]. Предполагается, что этот феномен обусловлен эндоцитозом, которому подвергается C5aR после взаимодействия с C5a [28], что приводит к уменьшению его количества на клеточной мембране и служит косвенным свидетельством роли C5а в индукции воспалительных реакций [27].
Активность системы комплемента, в частности петли амплификации, в существенной степени определяется взаимодействием нескольких белков-регуляторов альтернативного пути (факторы H, I и др.). В частности, фактор H ингибирует амплификацию каскада комплемента в жидкой фазе и на поверхности клеток [29-31]. Количественный дефицит этого белка или нарушение его функции вследствие генетических мутаций или выработки блокирующих антител приводят к дисрегуляции альтернативного пути комплемента, что является одним из хорошо изученных механизмов развития тромботической микроангиопатии и C3-гломерулопатии [32,33]. Однако возможный вклад этого сценария в патогенез ААВ остается малоизученным. В одном исследовании было показано, что концентрация фактора Н в плазме у пациентов с активным ААВ (n=82) была ниже, чем у пациентов в ремиссии, а ее величина обратно коррелировала со значением индекса BVAS, концентрацией креатинина сыворотки в дебюте и количеством полулуний в биоптате [34]. Более того, сог ласно многофакторному анализу выживаемости, концентрация фактора H плазмы была независимым предиктором развития терминальной почечной недостаточности или летального исхода. Однако недостатки исследования, в частности его ретроспективный и обсервационный характер, не позволяют оценить причины снижения уровня фактора Н и обосновывают проведение дополнительных клинических исследований. В недавней работе in vitro те же авторы показали, что фактор H способствует миграции нейтрофилов и их адгезии к клеткам гломерулярного эндотелия человека, но при этом подавляет индуцируемую АНЦА активацию нейтрофилов в клеточной культуре и препятствует повреждению эндотелиальных клеток [35]. Однако у пациентов с активным ААВ эти свойства фактора H были ослаблены по сравнению с образцами, полученными у здоровых добровольцев. Таким образом, фактор H, по всей видимости, обладает протективными свойствами в отношении эндотелия капилляров клубочка, но утрачивает эти свойства у пациентов с активным ААВ.
В большинстве представленных исследований для оценки активности системы комплемента были использованы лабораторные и иммуногистохимические методы, которые до настоящего времени не вошли в повседневную практику. В обычной лечебной работе врачам доступно преимущественно определение уровня C3 и C4 компонентов системы комплемента или ее общей активности (CH50). В последние годы были опубликованы результаты исследований, в которых оценивалась взаимосвязь этих тестов с особенностями течения ААВ. Согласно полученным данным, гипокомплементемия может быть фактором риска тяжелого поражения внутренних органов и худшего прогноза. В ретроспективном исследовании у 81 пациента с ААВ оценивали частоту развития гипокомплементемии, которую диагностировали на основании снижения уровня хотя бы одного из показателей: С3, С4 или СН50. У 16 (20%) пациентов была выявлена гипокомплементемия в дебюте заболевания. Ее формирование по сравнению с группой пациентов с нормокомплементемией (n=65) было ассоциировано с достоверно более частым развитием геморрагического альвеолита (38% и 8%, соответственно, p=0,006) и тромботической микроангиопатии (19% и 0%, р=0,007) и снижением общей выживаемости (p =0,033) [36]. В другом исследовании снижение концентрации С3 компонента комплемента, выявленное у 20% пациентов с ААВ, также сопровождалось снижением почечной и общей выживаемости [37]. Взаимосвязь гипокомплементемии с тяжестью течения ААВ была изучена в исследовании Crnogorac и соавт., в котором 75 пациентов были разделены на две группы в зависимости от концентрации С3 сыворотки: в первую группу вошли пациенты со снижением уровня C3 (менее 0,9 г/л), во вторую – с нормальной концентрацией С3 (0,9-1,8 г/л). В группе пациентов с низкой концентрацией С3 сыворотки частота летального исхода была почти в четыре раза выше (относительный риск 4,315, 95% доверительный интервал 1,350-13,799; p=0,014), чем у пациентов с нормокомплементемией [38].
Взаимосвязь тромбоэмболических осложнений и системы комплемента при ААВ
Пациенты с ААВ находятся в группе высокого риска развития тромбоэмболических осложнений [39]. Стиму ляция нейтрофилов C5а и АНЦА приводит к образованию активных форм кислорода, дегрануляции тканевых факторов и формированию нейтрофильных ловушек, что, в свою очередь, индуцирует активацию свертывающей системы крови и формирование тромбина. Различные компоненты свертывающей и противосвертывающей систем крови, включая тромбин, факторы XIa, Xa, IXa, плазмин, могут расщеплять С3 и C5, высвобождая биологически активные С3а и C5а [40, 41]. Другим потенциальным механизмом реализации протромбогенного потенциала при ААВ является воздействие системы комплемента на тромбоциты [42], приводящее к их активации [43]. Тромбоциты экспрессируют рецепторы к компонентам C3a и C5a [44], а взаимодействие с комплексом C5b-9 может стимулировать высвобождение из клеток альфа-гранул и микрочастиц [45]. В свою очередь, активированные тромбоциты могут инициировать запуск системы комплемента путем повышения синтеза С3а, С3b и формирования C5b-9 [46]. В пользу этой гипотезы свидетельствует и высокая частота развития тромбоцитоза у пациентов с активными формами ААВ, а также взаимосвязь числа тромбоцитов с показателями активности заболевания [47].
Система комплемента – потенциальная мишень терапевтического воздействия
Использование стандартных схем иммуносупрессивной терапии, в частности циклофосфамида (ЦФ) в сочетании с высокими дозами глюкокортикостероидов (ГКС), привело к значительному увеличению 5-летней выживаемости больных с ААВ – примерно с 20% до 80% [48,49]. В качестве альтернативы возможно применение ритуксимаба (моноклональные антитела к CD20+ лимфоцитам) в сочетании с ГКС. Эффективность этой схемы индукционной терапии была сопоставимой с таковой ЦФ и ГКС в двух рандомизированных исследованиях (RAVE и RITUXVAS) [50,51].
Однако, несмотря на очевидные успехи в терапии ААВ, нельзя игнорировать тот факт, что в настоящее время в числе причин летального исхода осложнения иммуносупрессивной терапии по частоте не уступают проявлениям самого заболевания. Так, при ретроспективном анализе структуры причин смерти у пациентов с ГПА частота нежелательных эффектов проводимого лечения была сопоставима с вкладом поражения легких в рамках основного заболевания – 35,1% и 37,8%, соответственно, а в проспективной группе значительно превышала их – 47,1% и 17,6%, соответственно [52]. Основные нежелательные эффекты терапии ЦФ (инфекционные осложнения, гемор рагический цистит и рак мочевого пузыря, лимфопролиферативные заболевания, миелодисплазия, бесплодие) обусловлены его высокой токсичностью [52-54]. Применение ритуксимаба также сопряжено с высокой частотой нежелательных явлений (46%), в основном за счет развития инфекций [55]. При этом существенный вклад в развитие инфекционных осложнений вносит длительный прием и/или использование высоких доз ГКС. Поэтому одним из наиболее перспективных направлений является разработка новых схем лечения ААВ с использованием препаратов принципиально иного механизма действия, обладающих потенциальным стероидосберегающим эффектом.
В настоящее время существует несколько препаратов, способных подавлять активность системы комплемента при аутоиммунных заболеваниях. Одним из первых в клинической практике был использован экулизумаб для лечения пароксизмальной ночной гемоглобинурии и атипичного гемолитико-уремического синдрома. Однако эффективность этого препарата в лечении ААВ в клинических исследованиях не изучалась. Тем не менее, нами был описан опыт успешного использования экулизумаба в сочетании с иммуносупрессивной терапией у пациентки с сочетанием микроскопического полиангиита и атипичного гемолитико-уремического синдрома [56].
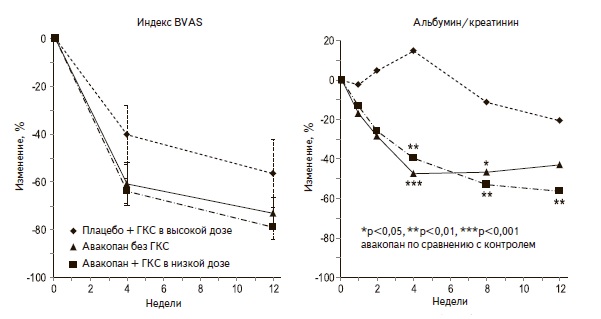
Непосредственно для лечения ААВ был разработан препарат для перорального использования, блоки рующий рецепторы C5а (ССХ168, авакопан), эффективность и безопасность которого изучались в много центровом клиническом исследовании CLEAR (NCT01363388) у 67 пациентов с ААВ. Одной из целей исследования было изучить возможность использования ССХ168 в сочетании с низкими дозами ГКС или без ГКС. Первичной конечной точкой было снижение активности васкулита (индекса BVAS по крайней мере на ≥50%) через 12 недель после начала терапии. Доля пациентов, достигших первичной конечной точки, была сопоставимой в группах пациентов, получавших авакопан в сочетании с низкими дозами ГКС и иммуносупрессивными препаратами (86,4%), авакопан в сочетании с иммуносупрессивными препаратами без ГКС (81,0%) и стандартную иммуносупрессивную терапию с высокими дозами ГКС (70,0%). У значительного числа пациентов, получавших ССХ168, была достигнута ранняя ремиссия уже на 4-й неделе лечения с сохранением низкой активности заболевания к 12-й неделе. В частности, альбуминурия снизилась у 47% пациентов, получавших препарат без ГКС, и у 40% пациентов, получавших препарат в сочетании с низкими дозами ГКС (рис. 1). Степень снижения СКФ была сопоставимой в обеих группах пациентов, получавших авакопан. Полученные данные позволили сделать вывод о стероидсберегающем эффекте препарата.
В исследовании CLASSIC (NCT02222155), в котором оценивали безопасность использования ССХ168 в дозах 10 мг и 30 мг два раза в день в сочетании с полной дозой ГКС и ЦФ или ритуксимаба в течение 12 недель, частота и структура нежелательных явлений не отличались от таковой в контрольной группе [57]. Таким образом, авакопан представляется перспективным препаратом, который, вероятно, позволит снизить бремя нежелательных явлений, ассоциированных с применением ГКС, у пациентов с ААВ при сохранении высокой эффективности терапии.
IFX-1 – это еще один экспериментальный ингибитор системы комплемента, который представляет собой моноклональное антитело к С5а. В экспериментальных исследованиях была продемонстрирована высокая селективность препарата в отношении данного фактора комплемента, что обеспечивает возможность формирования МАК как защитного механизма неспецифического иммунитета в связи с отсутствием ингибирования С5b. В настоящее время планируется двойное слепое, плацебо-контролируемое исследование с целью изучения стероидсберегающего эффекта IFX-1 на фоне стандартной терапии ЦФ или ритуксимабом у 80 пациентов с ААВ. В трех группах сравнения предполагается применение ГКС, IFX-1 в комбинации с ГКС в сниженной дозе или только IFX-1.
Заключение
Активация системы комплемента по альтернативному пути является одним из значимых звеньев патогенеза ААВ. При этом формируется порочный круг, предполагающий взаимное потенцирование патологических процессов, обусловленных привлечением и праймингом нейтрофилов под воздействием C5a с последующей опосредованной АНЦА активацией клеток, их дегрануляцией и высвобождением факторов, стимулирующих активацию альтернативного пути и образование еще большего количества C5a. В свою очередь, повреждение эндотелия и других тканей реализуется не только под действием активных форм кислорода и нейтрофильных внеклеточных ловушек, но и за счет образования МАК, а также опосредованной активации свертывающей системы крови. Принимая во внимание данные экспериментальных и клинических исследований, компоненты системы комплемента, в первую очередь, С3а, C5а, растворимый МАК и Bb в сыворотке крови и их депозиты в ткани почки, представляются перспективными маркерами для оценки активности и прогноза ААВ, заслуживающими дальнейшего изучения. В свою очередь, подавление активации системы комплемента, в частности путем блокады рецепторов C5а, открывает новые возможности терапии ААВ, что позволит существенно снизить применяемые дозы ГКС и уменьшить частоту ассоциированных нежелательных явлений.
Используемые источники
- Jennette JC. Overview of the 2012 Revised International Chapel Hill ConsensusConference Nomenclature of Vasculitides. Clin Exp Nephrol 2013;17(5):603-6.
- Falk RJ, Terrell RS, Charles LA, Jennette JC. Anti-neutrophil cytoplasmicautoantibodies induce neutrophils to degranulate and produce oxygen radicals invitro. Proc Natl Acad Sci U S A 1990;87(11):4115-9.
- Weidner S, Carl M, Riess R, Rupprecht HD. Histologic analysis of renal leuko-cyte infiltration in antineutrophil cytoplasmic antibody-associated vasculitis:importance of monocyte and neutrophil infiltration in tissue damage. ArthritisRheum 2004;50(11):3651-7.
- Eisenberger U, Fakhouri F, Vanhille P et al. ANCA-negative pauci-immune renalvasculitis: histology and outcome. Nephrol Dial Transplant 2005;20(7):1392-9.
- Zagvozdkina E, Novikov P, Moiseev S. THU0338 Clinical presentation and out-comes of eosinophilic granulomatosis with polyangiitis: ANCA-negative versusANCA-positive. Ann Rheum Dis 2017;76(Suppl 2):331.
- Pagnoux C. Updates in ANCA-associated vasculitis. Eur J Rheumatol 2016;3(3):122-33.
- Bansal PJ, Tobin MC. Neonatal microscopic polyangiitis secondary to transfer ofmaternal myeloperoxidase-antineutrophil cytoplasmic antibody resulting inneonatal pulmonary hemorrhage and renal involvement. Ann Allergy AsthmaImmunol 2004;93(4):398-401.
- Schlieben DJ, Korbet SM, Kimura RE et al. Pulmonary-renal syndrome in anewborn with placental transmission of ANCAs. Am J Kidney Dis 2005;45(4):758-761.
- Kain R, Rees AJ. What is the evidence for antibodies to LAMP-2 in the patho-genesis of ANCA associated small vessel vasculitis? Curr Opin Rheumatol 2013;25(1):26-34.
- Kettritz R. How anti-neutrophil cytoplasmic autoantibodies activate neutrophils.Clin Exp Immunol 2012;169(3):220-8.11. Schreiber A, Xiao H, Jennette JC et al. C5a receptor mediates neutrophil activa-tion and ANCA-induced glomerulonephritis. J Am Soc Nephrol 2009;20(2):289-98.
- Xiao H, Heeringa P, Hu P et al. Antineutrophil cytoplasmic autoantibodies spe-cific for myeloperoxidase cause glomerulonephritis and vasculitis in mice. J ClinInvest 2002;110(7):955-63.
- Xiao H, Schreiber A, Heeringa P et al. Alternative complement pathway in thepathogenesis of disease mediated by anti-neutrophil cytoplasmic autoantibodies.Am J Pathol 2007;170(1):52-64.
- Huugen D, van Esch A, Xiao H et al. Inhibition of complement factor C5 pro-tects against anti-myeloperoxidase antibody-mediated glomerulonephritis in mice.Kidney Int 2007;71(7):646-54.
- Xiao H, Dairaghi DJ, Powers JP et al. C5a receptor (CD88) blockade protectsagainst MPO-ANCA GN. J Am Soc Nephrol 2014;25(2):225-31.
- Camous L, Roumenina L, Bigot S et al. Complement alternative pathway acts asa positive feedback amplification of neutrophil activation. Blood 2011;117(4):1340-9.
- Leffler J, Martin M, Gullstrand B et al. Neutrophil extracellular traps that are notdegraded in systemic lupus erythematosus activate complement exacerbating thedisease. J Immunol 2012;188(7):3522-31.
- Wang H, Wang C, Zhao MH et al. Neutrophil extracellular traps can activatealternative complement pathways. Clin Exp Immunol 2015;181(3):518-27.
- Harris AA, Falk RJ, Jennette, JC. Crescentic glomerulonephritis with a paucity ofglomerular immunoglobulin localization. Am J Kidney Dis 1998;32(1):179-84.
- Haas M, Eustace JA. Immune complex deposits in ANCA-associated crescenticglomerulonephritis: a study of 126 cases. Kidney Int 2004;65(6):2145-52.
- Neumann I, Regele H, Kain, R et al. Glomerular immune deposits are associatedwith increased proteinuria in patients with ANCA-associated crescentic nephritis.Nephrol Dial Transplant 2003;18(3):524-31.
- Xing GQ, Chen M, Liu G et al. Complement activation is involved in renal dam-age in human antineutrophil cytoplasmic autoantibody associated pauci-immunevasculitis. J Clin Immunol 2009;29(3):282-91.
- Chen M, Xing GQ, Yu F et al. Complement deposition in renal histopathology ofpatients with ANCA-associated pauci-immune glomerulonephritis. Nephrol DialTransplant 2009;24(4):1247-52.
- Gou SJ, Yuan J, Chen M et al. Circulating complement activation in patientswith anti-neutrophil cytoplasmic antibody-associated vasculitis. Kidney Int2013;83(1):129-37.
- Gou SJ, Yuan J, Wang C et al. Alternative complement pathway activation prod-ucts in urine and kidneys of patients with ANCA-associated GN. Clin J Am SocNephrol 2013;8(11):1884-91.
- Hilhorst M, van Paassen P, van Rie H et al. Complement in ANCA-associatedglomerulonephritis. Nephrol Dial Transplant 2017;32(8):1302-13.
- Yuan J, Gou SJ, Huang J et al. C5a and its receptors in human anti-neutrophilcytoplasmic antibody (ANCA)-associated vasculitis. Arthritis Res Ther2012;14(3):R140.
- Huey R, Hugli TE. Characterization of a C5a receptor on human polymorphonu-clear leukocytes (PMN). J Immunol 1985;135(3):2063-8.
- Walport MJ. Complement. First of two parts. N Engl J Med 2001;344:1058-66.
- Walport MJ. Complement. Second of two parts. N Engl J Med 2001;344(15):1140-4.
- Ricklin D, Reis ES, Lambris JD. Complement in disease: a defence system turn-ing offensive. Nat Rev Nephrol 2016;12(7):383-401.
- Noris M, Remuzzi G. Atypical hemolytic-uremic syndrome. N Engl J Med 2009;361(17):1676-87.
- Servais A, Noel LH, Roumenina LT et al. Acquired and genetic complementabnormalities play a critical role in dense deposit disease and other C3 glomeru-lopathies. Kidney Int 2012;82(4):454-64.
- Chen SF, Wang FM, Li ZY et al. Plasma complement factor H is associated withdisease activity of patients with ANCA-associated vasculitis. Arthritis Res Ther2015;1 7:129.
- Chen SF, Wang FM, Li ZY et al. Complement factor H inhibits anti-neutrophilcytoplasmic autoantibody-induced neutrophil activation by interacting with neu-trophils. Front Immunol 2018;9:559.
- Fukui S, Iwamoto N, Umeda M et al. Antineutrophilic cytoplasmic antibody-associated vasculitis with hypocomplementemia has a higher incidence of seriousorgan damage and a poor prognosis. Medicine (Baltimore) 2016;95(37):e4871.
- Molad Y, Tovar A, Ofer-Shiber S. Association of low serum complement C3 withreduced patient and renal survival in antimyeloperoxidase-associated small-vesselvasculitis. Nephron Clin Pract 2014;126(1):67-74.
- Crnogorac M, Horvatic I, Kacinari P et al. Serum C3 complement levels inANCA associated vasculitis at diagnosis is a predictor of patient and renal out-come. J Nephrol 2018;31(2):257-62.
- Макаров Е.А., Новиков П.И., Шевцова Т.П. с соавт. Венозные тромбоэм-болические осложнения при АНЦА-ассоциированных васкулитах. Клинфармакол тер 2017;26(3):37-42 [Makarov EA, Novikov PI, Shevtsova TP et al.Venous thromboembolic compications and ANCA-associated vasculitis. ClinPharmacol Ther = Klinicheskaya farmakologiya i terapiya 2017;26(3):37-42 (InRuss.)].
- Ekdahl KN, Teramura Y, Hamad OA et al. Dangerous liaisons: complement,coagulation, and kallikrein/kinin cross-talk act as a linchpin in the events leadingto thromboinflammation. Immunol Rev 2016;274(1):245-69.
- Huber-Lang M, Sarma JV, Zetoune FS et al. Generation of C5a in the absence ofC3: a new complement activation pathway. Nat Med 2006;12(6):682-7.
- Speth C, Rambach G, Wurzner R et al. Complement and platelets: Mutual inter-ference in the immune network. Mol Immunol 2015;67(1):108-18.
- Lood C, Tyden H, Gullstrand B et al. Platelet activation and anti-phospholipidantibodies collaborate in the activation of the complement system on platelets insystemic lupus erythematosus. PLoS One 2014;9(6):e99386.
- Martel C, Cointe S, Maurice P et al. Requirements for membrane attack complexformation and anaphylatoxins binding to collagen-activated platelets. PLoS One2011;6(4):e18812.
- Sims PJ, Wiedmer T. Induction of cellular procoagulant activity by the membraneattack complex of complement. Semin Cell Biol 1995;6(5):275-82.
- Del Conde I, Cruz MA, Zhang H et al. Platelet activation leads to activation andpropagation of the complement system. J Exp Med 2005;201(6):871-79.
- Willeke P, Kumpers P, Schluter B et al. Platelet counts as a biomarker in ANCA-associated vasculitis. Scand J Rheumatol 2015;44(4):302-8.
- Mukhtyar C, Flossmann O, Hellmich B et al. Outcomes from studies of antineu-trophil cytoplasm antibody associated vasculitis: a systematic review by theEuropean League Against Rheumatism systemic vasculitis task force. Ann RheumDis 2008;67(7):1004-10.
- Flossmann O, Berden A, de Groot K et al Long-term patient survival in ANCA-associated vasculitis. Ann Rheum Dis 2011;70(3):488-94.
- Jones RB, Cohen Tervaert JW, Hauser T et al. Rituximab versus cyclophos-phamide in ANCA-associated renal vasculitis. N Engl J Med 2010;363(3):211-20.
- Stone JH, Merkel PA, Spiera R et al. Rituximab versus cyclophosphamide forANCA-associated vasculitis. N Engl J Med 2010;363(3):221-32.
- Novikov PI, Moiseev SV, Kuznetsova EI et al. Changing patterns of clinicalseverity and risk of mortality in granulomatosis with polyangiitis over four decades:the Russian experience. Rheumatol Int 2015;35(5):891-8.
- Faurschou M, Sorensen IJ, Mellemkjaer L et al. Malignancies in Wegener's gran-ulomatosis: incidence and relation to cyclophosphamide therapy in a cohort of293 patients. J Rheumatol 2008;35(1):100-5.
- Hoffman GS, Kerr GS, Leavitt RY et al. Wegener granulomatosis: an analysis of158 patients. Ann Intern Med 1992;116(6):488-98.
- Новиков П.И., Зыкова А.С., Смитиенко И.О., Моисеев С.В. ЛечениеАНЦА-ассоциированных васкулитов: рекомендации EULAR/ERA-EDTA2016 года. Клин фармакол тер 2017:26(1):80-7 [Novikov PI, Zykova AS,Smitienko IO, Moiseev SV. Treatment of ANCA-associated vasculitis: EULAR/ERA-EDTA 2016 guidelines. Clin Pharmacol Ther = Klinicheskaya farmako -logiya i terapiya 2017;26(1):80-7 (In Russ.)].
- Буланов Н.М., Козловская Н.Л., Моисеев С.В. с соавт. Сочетание АНЦА-ассоциированного васкулита и атипичного гемолитико-уремического син-дрома у пациентки с мутацией гена диацилглицеролкиназы-эпсилон(клинический разбор). Нефрология и диализ 2018;20(2):212-24 [BulanovNM, Kozlovskaya NL, Moiseev SV. ANCA-associated vasculitis and atypicalhemolytic uremic syndrome in a patients with mutations of the diacylglycerolkinase-epsilon gene. Nephrology Dialysis = Nefrologiya i dializ 2018;20(2)212-24(In Russ.)].
- Jayne DR, Bruchfeld AN, Harper L et al. Randomized trial of C5a receptorinhibitor avacopan in ANCA-associated vasculitis. J Am Soc Nephrol 2017;28(9):2756-67.
