Хронический гепатит дельта: современное состояние проблемы и перспективы лечения
Вирус гепатита дельта (HDV) представляет собой вирус-сателлит, которым инфицированы около 5% больных хроническим гепатитом В.Считается, что в мире имеется около 15-20 млн больных хроническим гепатитом D, который представляет собой одно из самых тяжелых заболеваний печени с высоким риском развития цирроза и рака печени. Пегилированный интерферон-a остается единственным препаратом, одобренным для лечения хронического гепатита D, хотя он характеризуется низкой эффективностью и высокой частотой нежелательных явлений. Изучение основных механизмов репликации HDV привело к созданию новых классов препаратов, блокирующих вход вируса в клетку и сборку его вириона. В настоящее время эти препараты изучаются в исследованиях II и III фазы.
В 1977 г. М. Rizzetto и соавт. описали новый антиген, случайно обнаруженный методом прямой иммунофлюоресценции в ядрах гепатоцитов HBsAg (+) больных. Антитела к названному впоследствии "дельта-антигеном" белку определялись в ткани печени больных активным хроническим гепатитом/циррозом печени и отсутствовали при остром гепатите В и неактивном носительстве HBsAg [1]. В дальнейшем было установлено, что этот белок является структурным компонентом нового вируса, получившего название вируса гепатита D (HDV).
Хроническая HDV-инфекция представляет собой одно из самых тяжелых и быстропрогрессирующих заболеваний печени с высоким риском развития цирроза печени и гепатоцеллюлярной карциномы. Несмотря на большое количество исследований, посвященных этой инфекции, ряд вопросов, в первую очередь патогенез, особенности естественного течения и эффективные методы лечения HDV-инфекции, остаются от крытыми.
Строение и свойство вируса
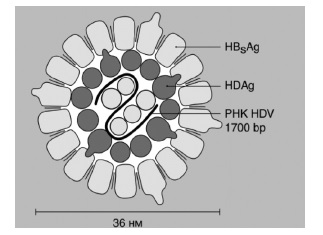
HDV представляет собой сферическую частицу диаметром от 28 до 39 мм, покрытую поверхностным антигеном HBV (рис. 1), внутри которой находится нуклеокапсид диаметром 19 нм, содержащий РНК вируса [2]. Нуклеокапсид состоит из 60 молекул дельта-антигена, который представлен двумя формами: длинной [L] (214 аминокислот), размером 27 кДа, и короткой [S] (195 аминокислот), размером 24 кДа. Длинный антиген образуется путем присоединения дополнительных 19-20 аминокислот на уровне нуклеотида 1012 малого антигена [3]. Ген, кодирующий HDAg, был успешно клонирован с помощью обратной транскриптазы и полимеразной цепной реакции [4]. HDV-S антиген необходим для репликации вируса, в то время как HDV-L антиген, наоборот, обладает способностью подавлять репликацию, но играет ключевую роль в механизмах сборки и секреции вирусной частицы.
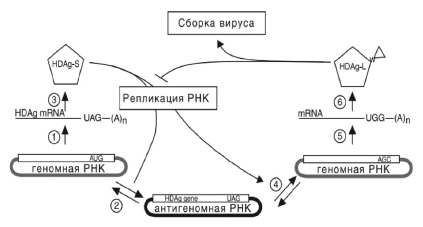
Геном РНК вируса представлен комплементарной одноцепочечной циркулярной нитью длиной в 1679 нуклеотидных оснований и является наименьшим из РНК-вирусов, поражающих человека. В геноме HDV имеется 6 открытых рамок считывания, из которых только одна рамка, участвующая в транскрипции, находится на позитивной стороне нити генома HDV RNA [5]. Ме ха низм репликации РНК вируса в своем роде уникальный и происходит путем так называемого симметричного двойного повторяющегося цикла (рис. 2). В процессе репликации в клетке присутствуют три формы вирусной РНК: геномная РНК (отрицательной полярности), антигеномная РНК (положительной полярности) и информационная РНК, наименьшая по размеру (примерно 900 нуклеотидов), которая содержит открытую рамку считывания для синтеза антигенов вируса. Репликация HDV автономна от HBV, но, будучи вирусом-сателлитом, HDV использует HBsAg для сборки вириона, секреции из гепатоцита и инфицирования других гепатоцитов.
Одним из важных направлений исследований генома HDV является изучение его стабильности. Эти исследования позволили выявить изменения состава РНК вируса в течение болезни у одного и того же пациента, которые могут быть одной из причин спонтанной реактивации хронического гепатита дельта. В исследовании китайских ученых было установлено, что более выраженные мутации обнаруживались при тяжелых обострениях [6]. Подобные исследования, возможно, помогут в будущем пролить свет на закономерности спонтанной реактивации HDV и своевременно реагировать на них, предотвращая реактивацию инфекции.
Эпидемиология
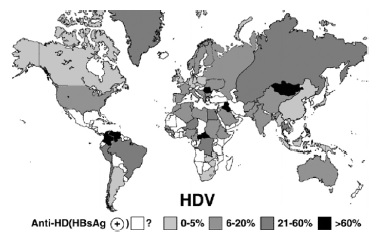
HDV распространен повсеместно. Считается, что около 5% больных хроническим гепатитом В инфицированы HDV (15-20 млн) [7]. Несмотря на одинаковые механизмы инфицирования и статус HDV как сателлитного вируса, реализующего свой потенциал только в присутствии HBsAg, зоны наибольшего распространения дельта-инфекции не повторяют в точности таковые HBV-инфекции. HDV высоко эндемичен в странах Средиземноморья, на Ближнем Востоке, в Центральной Африке, Центральной Азии и в северных частях Южной Америки. В США, Канаде и в странах Северной Европы (Дании, Швеции, Норвегии) значительное распространение HDV-инфекции отмечено в группах повышенного риска, в первую очередь у наркоманов. В настоящее время в мире выделяют регионы с низкой (0-5%), умеренной (6-20%), высокой (21-59%) и очень высокой (более 60%) частотой обнаружения маркеров HDV у лиц, инфицированных HBV (рис. 3).
Больные с гемофилией и другими состояниями, нуждающиеся в регулярных трансфузиях, составляли основную группу инфицированных в 80-х годах, однако со временем их доля постепенно уменьшается, что, по-видимому, связано с введением массовой вакцинации населения против HBV и рутинного скрининга продуктов крови на HBsAg.
За последние два десятилетия прошлого века отмечено значительное снижение распространенности HDV-инфекции, в первую очередь в странах Западной Европы, Юго-Восточной Азии и Турции. По данным итальянского многоцентрового исследования, распространенность HDV среди носителей HBsAg в 1997 г. равнялась 8,3% (69 из 834), что значительно ниже показателей 1992 и 1987 гг. (14% и 23%, соответственно). В период с 1987 г. по 1997 г. распространенность гепатита дельта в Италии снижалась на 1,5% ежегодно, в связи с чем авторы пришли к выводу, что в течение ближайших нескольких лет удастся установить полный контроль над распространением вируса гепатита дельта в итальянской популяции [9]. Аналогичную картину демонстрировали наблюдения и из других европейских стран, что позволило в конце 90-х годов рассматривать гепатит дельта как исчезающее заболевание, но в новых эпидемиологических исследованиях отмечено изменение ситуации в течение последнего десятилетия. В Италии частота обнаружения маркеров HDV среди носителей HBsAg после длительного периода снижения (с 24,6% в 1978–1981 гг. до 8,3% в 1997 г.) в настоящее время остается достаточно высокой – 8,1% в 2007 г. [10]. В Германии, где в 90-е годы наблюдалось снижение распространенности гепатита дельта с 18,6% до 6,8%, с 1999 г. она сохраняется на стабильно высоком уровне (8-14%) [11].
Причиной вновь возросшей распространенности HDV-инфекции, скорее всего, является миграция населения из неблагополучных и эндемичных по гепатиту дельта регионов, что подтверждается высоким уровнем носительства HDV среди некоренного населения. К примеру, распространенность HDV-инфекции в Швей царии составляет 5,9%, а среди мигрантов достигает 38,0% [12].
Одной из причин сохраняющейся распространенности HDV-инфекции наряду с миграцией населения можно назвать снижение настороженности врачей. При проверке лабораторий муниципальных клиник Лондона выяснилось, что в течение последних нескольких лет рутинное тестирование носителей HBsAg на маркеры HDV проводилось не во всех случаях [13]. Аналогичные данные были получены в Чехии, Италии, Франции и Германии [14,15]. В исследовании, проведенном в клинике им. Е.М.Тареева, у 16 (31%) из 64 больных диагноз "хронический гепатит D" был впервые установлен спустя длительное время (до 10 лет), хотя эти больные наблюдались в других лечебных учреждениях с диагнозом хронического гепатита В; при этом им ни разу не проводили исследование сыворотки на маркеры дельтаинфекции [16]. Это еще раз подчеркивает необходимость обязательного тестирования всех больных с HBsAg на HDV, особенно при высокой активности воспаления и наличии цирроза печени.
В России оценка частоты выявления маркеров HDV среди носителей HBsAg проводилась в нескольких регионах. В европейской части России антитела к HDV определялись у 1,3-5,5% HBsAg (+) лиц [17]. Энде мич ным по HDV-инфекции регионом признана Рес пуб лика Саха (Якутия), где доля хронического гепатита дельта в этиологической структуре хронических вирусных гепатитов составила 24,5%, в отдельных районах доля больных с антителами к HDV среди HBsAg (+) лиц достигала 31% [18,19]. Существенный уровень носительства HDV-инфекции был отмечен также в Рес пуб лике Тыва [20]. Необычно высокий уровень распространенности HDV-инфекции регистрировался в Астраханской области, где среди 151 больного с хроническим заболеванием печени у 66,9% был обнаружен HBsAg, а у 74,5% из них определялись маркеры HDV. В то же время среди пациентов с острым гепатитом В частота выявления антител к HDV составила только около 10% [21]. В исследовании, проведенном в клинике им. Е.М. Таре ева в Москве, за период с 2002 г. по 2014 г. маркеры активной дельта-инфекции (антиHDV-IgM и/или HDV RNA) были выявлены у 118 (21,7%) из 543 больных с HBsAg [22]. Обращает на себя внимание вспышка HDV-инфекции в конце 90-х годов в Самар ской области, где частота обнаружения HDV у HBsAg (+) лиц достигала 39%, что, вероятно, объясняется большим числом наркоманов в эпидемиологической выборке [23].
Очень высокий уровень инфицированности HDV отмечен во Вьетнаме, Гренландии, Индии, Иране, Мавритании, Монголии, Нигерии, Пакистане, Таджи ки стане, Тунисе [23-33].
Пути передачи HDV аналогичны таковым HBV: преимущественно парентеральный, реже половой и перинатальный. У обследованных нами 118 пациентов с хроническим гепатитом D, факторы риска инфицирования HDV распределились следующим образом: оперативные вмешательства (включая стоматологические) – 51%, гемотрансфузии – 20%, наркомания – 18%, возможный внутрисемейный путь передачи – 17%. У 10% больных путь передачи инфекции установить не удалось [22]. Контагиозная активность HDV значительно ниже по сравнению с HBV, поэтому половой, перинатальный и бытовой пути передачи не столь очевидны, хотя в эндемичных по HDV регионах они могут играть более важную роль [34]. По данным итальянского исследования, члены семьи больного с HDV-инфекцией имели 12,9-кратный риск инфицирования вирусом по сравнению с таковым в общей популяции [35].
В настоящее время выделяют 8 различных генотипов HDV в зависимости от нуклеотидной последовательности и географической распространенности, хотя последний фактор частично утратил свое значение в силу миграции населения. Различные генотипы HDV отличаются друг от друга не более чем на 30 нуклеотидов по длине генома, но различия в нуклеотидной последовательности могут доходить до 30% [36].
Первый генотип наиболее распространен и встречается повсеместно, особенно в странах Средиземно мор ского региона, Африке, Европе и Северной Америке. Хронический гепатит, вызванный вирусом 1-го генотипа, характеризуется вариабельным течением (от мягких до быстропрогрессирующих форм). В исследовании, проведенном в клинике им. Е.М.Таре ева, у всех обследованных больных с HDV-инфекцией был выявлен 1-й генотип, преимущественно подтип 1b (в 85% случаев) [16]. Данный подтип наиболее близок к последовательностям молдавских и болгарских изолятов HDV [37]. Второй и 4-й генотипы встречаются преимущественно на Дальнем Востоке, в том числе в России [38], характеризуются, как правило, мягким, медленно прогрессирующим (по сравнению с 1-м генотипом), редко – тяжелым (прежде всего 4-й генотип) течением заболевания. Третий генотип встречается в северной части Южной Америки (Колумбия, Вене су эла, Перу, Эквадор), а гепатит, вызванный вирусом этого генотипа, имеет наиболее тяжелое, часто фульминантное течение заболевания с быстрым исходом в цирроз печени. Другие генотипы были идентифицированы относительно недавно в Африке и недостаточно изу чены.
Патогенез
В настоящее время не существует единой точки зрения на патогенез HDV-инфекции, обсуждается как иммуноопосредованное [39-41], так и прямое цитопатическое действие вируса на печень [42].
Показано, что периферические мононуклеарные клетки пациентов с неактивным хроническим гепатитом D (стабильно нормальный уровень АЛТ и отсутствие анти-HDV IgM) демонстрировали специфичную в отношении HDAg пролиферацию in vitro [43]. Отсут ствие аналогичных проявлений у сопоставимых пациентов с активным печеночным процессом, видимо, отражает то, что в данном случае именно клеточный иммунный ответ позволял контролировать течение HDV-инфекции.
HDV ингибирует не только систему эндогенных ИФН-a, активирующихся в ответ на вирус [47], но и блокирует сигнальные пути JAK-STAT, необходимые для индукции противовирусного ответа [48]. Данное свойство HDV может быть одной из причин низкой эффективности противовирусной терапии ИФН-α.
Первые данные о возможном цитопатическом эф фекте HDV были получены в ходе наблюдения за вспышками тяжелых случаев вирусного гепатита дельта в бассейне реки Амазонка, которые были обусловлены третьим генотипом HDV [49]. При этом в ткани печени определялись выраженный мелкокапельный стеатоз и эозинофильный некроз на фоне умеренных лобулярных изменений. Подобные гистологические проявления наблюдались также при фульминантном гепатите дельта у жителей регионов Экваториальной Африки [50].
Открытым остается вопрос о защитной роли антител к HDV, которые выявляют у всех больных, имевших контакт с вирусом, но не ассоциируются с развитием иммунитета. Повторное инфицирование шимпанзе, перенесших острый гепатит дельта, тем же вирусом, сопровождалась менее выраженной виремией, чем при первом инфицировании [51]. Это позволяет предполагать, по крайней мере, частичную защитную функцию вирус-специфичных антител, ограничивающую репликацию вируса.
Диагностика
Для диагностики HDV-инфекции определяют антитела к вирусу и RNA HDV в сыворотке крови. Антитела к HDV (анти-HDV) суммарные выявляют более чем в 90% случаев в течение 3–8 нед после инфицирования. При острой цикличной HDV-инфекции титр антиHDV IgM, как правило, невысокий, и они исчезают из крови в течение нескольких месяцев. При хронической HDV-инфекции (как правило, при суперинфекции) титр очень высокий и сохраняется на протяжении длительного времени. Анти-HDV IgG выявляют как при острой (в сочетании с преходящими анти-HDV IgM), так и при хронической (в сочетании со стойко персистирующими анти-HDV IgM) HDV-инфекции.
В настоящее время основным маркером репликативной активности HDV считают обнаружение RNA HDV в сыворотке крови методом ПЦР. С началом применения ПЦР для определения RNA HDV в крови роль анти-HDV IgM значительно снизилась. Однако, с учетом вариабельности генома HDV и отсутствия стандартизации тест-систем тестирование анти-HDV IgM может быть оправдано при подозрении на ложно-отрицательный результат ПЦР.
Рутинное количественное определение RNA HDV в настоящее время нецелесообразно, так как отсутствуют данные о корреляции уровня виремии и выраженности печеночного процесса [52]. Таким образом, единственной целью количественного определения RNA HDV представляется контроль эффективности противовирусной терапии [53].
Естественное течение и прогноз гепатита дельта
Острый гепатит дельта. Выделяют два варианта острого гепатита дельта, существенно отличающихся по течению и исходам: коинфекция и суперинфекция. При коинфекции оба вируса (HDV и HBV) попадают в организм одновременно, при этом наблюдаются, как правило, две волны активности гепатита (возможно, с желтушным компонентом): первая обусловлена HBV, вторая (через 2–4 нед) – HDV. Инкубационный период при коинфекции составляет в среднем от 3 до 7 нед [7].
При коинфекции в подавляющем большинстве случаев (более 95%) заболевание имеет циклическое течение и заканчивается спонтанным выздоровлением и элиминацией как маркеров HBV (HBsAg, DNA HBV), так и HDV (анти-HDV IgM, RNA HDV). При этом течение острого гепатита D обычно клинически и гистологически неотличимо от острого гепатита В (в ряде случаев описаны две волны обострения заболевания или желтухи). Менее чем в 5% случаев возможно развитие хронического гепатита D, а также фульминантной печеночной недостаточности [23,29,54,55].
При суперинфекции HDV попадает в организм человека с хронической HBV-инфекцией. Более чем в 90% случаев отмечается развитие хронического гепатита D [57]. У шимпанзе гистологические изменения в печени при суперинфекции HDV были значительно более выраженными, чем при коинфекции HDV или суперинфекции носителей HBV вирусом гепатита С [58]. Менее чем в 10% случаев суперинфекция HDV может разрешиться самостоя тельно с сохранением или даже элиминацией HBV (клиренсом HBsAg) [59]. При суперинфекции HDV значительно чаще развивается фульминантная печеночная недостаточность [57,60]. При отсутствии данных о существующем гепатите В суперинфекция HDV может быть ошибочно диагностирована как острый гепатит В [61].
Хронический гепатит дельта. В настоящее время выделяют 3 фазы течения HDV-инфекции в зависимости от вирусологического профиля: острая фаза с выраженной репликацией HDV, высокой активностью АЛТ и супрессией HBV; хроническая фаза, характеризующаяся уменьшением активности HDV, реактивацией HBV и умеренным повышением активности АЛТ; третья фаза с развитием цирроза печени и гепатоцеллюлярной карциномы в результате репликации одного из вирусов или ремиссии в исходе значительного уменьшения активности обоих вирусов [62]. Стадийность течения может быть прослежена у большинства больных хроническим гепатитом D. Однако, как показали клинические исследования, течение заболевания может отличаться в зависимости от популяции и генотипа HDV [63].
Имеющиеся данные о естественном течении хронического гепатита D, прогнозе и риске развития цирроза печени и его осложнений противоречивы. На наш взгляд, подобные значительные расхождения могут быть объяснены следующими причинами:
1. В большей части опубликованных наблюдений отсутствует четкое разделение пациентов на группы с отдельным анализом каждой из них. Это приводит к тому, что статистическая обработка и анализ проводятся в выборках больных, находящихся на разных стадиях заболевания, – от хронического гепатита до декомпенсированного цирроза печени.
2. Наблюдения последнего десятилетия позволили отметить изменение "характера" заболевания, в том числе за счет уменьшения числа новых случаев острого гепатита. Все чаще наблюдается преобладание вялотекущих стабильных форм заболевания и реже встречаются агрессивные формы хронического гепатита, которые в течение короткого времени приводят к развитию цирроза печени и его осложнений. Именно они определяли грозный облик болезни в конце прошлого века.
В итальянском многоцентровом исследовании авторы сравнили две группы больных, наблюдавшихся в 1977-1986 гг. (n=122) и 1987-1996 гг. (n=162) [64]. Агрессивное течение хронического гепатита D в первой декаде отмечалось значительно чаще (65%), чем во второй (17%). Аналогичные результаты были получены в ряде других итальянских работ [65,66]. По данным испанского исследования, доля больных с острым гепатитом D агрессивного течения в 1983-1995 гг. значительно превышала таковую в 1996-2008 гг. [67]. Двадцатилетняя выживаемость больных хроническим гепатитом D в одном исследовании составляла 86% [65].
Риск развития цирроза печени в итальянском исследовании у больных, инфицированных HDV 1-го генотипа (77% мужчин, средний возраст 30 лет, цирроз печени у 35%), составлял около 4% в год, что значительно выше, чем при моноинфекции вирусами гепатита В или С [65]. В этом же исследовании частота спонтанной сероконверсии HBsAg равнялась 0,25% в год и была выше у больных с длительной ремиссией заболевания и стабильно нормальной активностью АЛТ. Сероконверсия HBsAg, тем не менее, не гарантировала отсутствие осложнений. У 2 из 22 пациентов с сероконверсией отмечено развитие гепатоцеллюлярной карциномы. Последнее, вероятно, отражает длительность печеночного процесса и сопряженных с этим нарушений в геноме гепатоцитов.
У значительной части больных хроническим гепатитом D в момент установления диагноза выявляют стадию цирроза печени. Это, по-видимому, отражает более тяжелое течение заболевания по сравнению с таковым при моноинфекции вирусами гепатита В и С. Так, доля больных с циррозом печени среди пациентов с хронической HDV-инфекцией в крупных исследованиях составляла от 27% до 82% [13,16,42,65,67].
Декомпенсация и развитие печеночной недостаточности остаются главными причинами смертности при хронической HDV-инфекции. В многоцентровом ретроспективном исследовании у 200 больных с компенсированным (класс А по шкале Чайлд-Пью) циррозом печени в исходе HBV- и HDV-инфекции из нескольких клиник Западной Европы развитие печеночной недостаточности и гепатоцеллюлярной карциномы в течение 80 мес было отмечено у 31% и 13% больных гепатитом D, соответственно [68]. Риск декомпенсации, развития гепатоцеллюлярной карциномы и печеночной смерти при HDV-инфекции превышал таковой в сопоставимой группе больных с HBV-инфекцией в 2,2, 3,2 и 2,0 раза, соответственно. Риск декомпенсации был выше у больных пожилого возраста, а также пациентов с гипоальбуминемией и гипергаммаглобулинемией.
В другом крупном исследовании именно развитие печеночной недостаточности, а не гепатоцеллюлярной карциномы определяло выживаемость HDV-инфицированных больных с компенсированным циррозом печени (n=166) [69]. 1, 2 и 5-летняя выживаемость составила 94,3%, 82,5% и 51,5%, соответственно.
В нашем исследовании в течение в среднем 4,1 года (от 1 до 9 лет) умерли 24 из 118 больных хроническим гепатитом D (у 66% имелся цирроз печени). Причины смерти включали печеночную кому (у 12), гепатоцеллюлярную карциному (у 9), кровотечения из варикознорасширенных вен пищевода (у 2) [22].
Данные об онкогенном потенциале HDV противоречивы. В некоторых ранних работах [70,71] не было выявлено достоверного увеличения риска развития гепатоцеллюлярной карциномы при HDV-инфекции по сравнению с таковым при HBV-инфекции. Однако многие авторы склонны объяснять этот факт тем, что больные с HDV-инфекцией часто умирают от прогрессирующей печеночной недостаточности и других осложнений цирроза печени, не доживая до гепатоцеллюлярной карциномы [7]. В исследовании, проведенном в Греции, было показано, что у больных хроническим гепатитом D, которые не погибли от печеночной недостаточности, риск развития гепатоцеллюлярной карциномы в течение 12 лет составил почти 42% [72]. При длительном наблюдении (в среднем 7 лет) больных вызванным HDV циррозом печени в итальянской популяции развитие гепатоцеллюлярной карциномы было отмечено в 25% случаев, риск опухолевой трансформации составлял 2,8% в год [65]. Аналогичные данные приводятся в исследовании из Германии (n=67, длительность наблюдения 7 лет), по данным которого ежегодный риск развития гепатоцеллюлярной карциномы у больных с циррозом печени, вызванным HDV, составил 2,7% [73].
Клинические проявления
Печеночные и внепеченочные проявления хронического гепатита D существенно не отличаются от таковых при заболевании печени, обусловленном вирусом гепатита В [16,42,74,75]. При хроническом гепатите D, как правило, отмечается более высокая активность печеночного процесса по сравнению с таковой при хроническом гепатите В. Обращают на себя внимание значительно более высокая гипергаммаглобулинемия, преимущественно за счет IgG, наличие ревматоидного фактора и криоглобулинов в сыворотке крови при хроническом гепатите D, которые отражают, по-видимому, выраженность аутоиммунных нарушений. HDV, как правило, подавляет активность HBV (лишь у 10-20% больных определяется DNA HBV в сыворотке крови). При этом не было выявлено более высокой активности хронического гепатита D у больных с сохранением виремии HBV [7].
Лечение
Уникальный механизм репликации HDV, отсутствие собственных полимераз и высокий патогенный потенциал делают вирус трудной мишенью для противовирусной терапии. В течение последних трех десятилетий были предприняты неоднократные попытки использования различных препаратов для лечения хронического гепатита D, однако только некоторые из них сохраняют актуальность в настоящее время.
Рекомбинантный интерферонa. Первые попытки противовирусной терапии хронического гепатита дельта относятся к середине 80-х годов [76]. В 10 рандомизированных клинических исследованиях, в которых изучался рекомбинантный ИФН-a, устойчивый вирусологический ответ (УВО) был отмечен всего у 17,4% больных [77]. Гистологическое улучшение и нормализация активности АЛТ в результате лечения ИФНa были достигнуты у 27,2% и 34,8% пациентов, соответственно, однако через 6 месяцев после завершения терапии активность АЛТ оставалась в пределах нормы только у 11,9% больных. В двух клинических исследованиях, в которых сравнивали эффективность высоких и низких доз ИФН-a (9 или 3 млн МЕ 3 раза в нед), был показан отчетливый дозозависимый эффект препарата – УВО был достигнут в 23,3% и 10,0% случаев, соответственно.
В итальянском исследовании 90 больных (72% из них с циррозом печени) получали рекомбинантный ИФН-a в дозе 6-9 млн МЕ [65]. У 72% больных проведен один курс лечения (продолжительностью в среднем 17 месяцев, у 24% – два курса, у 4% – три курса. УВО был достигнут и сохранялся в течение 36 месяцев наблюдения у 25 (27,8%) больных, в том числе у 15 (60%) – на стадии хронического гепатита.
В долгосрочном исследовании американских ученых у пациентов, получавших рекомбинантный ИФН-a в дозе 9 млн МЕ в течение 48 недель, биохимический ответ, достигнутый к концу терапии у половины больных, сохранялся в течение всех 14 лет наблюдения. Особого внимания заслуживает тот факт, что у пациентов со стабильно нормальным уровнем АЛТ и клиренсом анти-HDV IgM и повторно гистологически верифицированным активным циррозом печени (после завершения лечения и через год) в ходе долгосрочного наблюдения было обнаружено полное разрешение фиброза печени [78]. В другом длительном исследовании клиренса HDV и HBV и полного разрешения гистологически верифицированного цирроза печени удалось добиться у пациента, получавшего рекомбинантный ИФН-a в дозе 5 млн МЕ ежедневно в течение 12 лет [79]. Еще в одном наблюдении отмечена элиминация вирусов гепатита В и D при длительном лечении в течение 12 лет малыми дозами интерферона a-2b [80].
Нуклеоз(т)идные аналоги. Важное значение HBsAg для процесса сборки HDV, риск ускоренного прогрессирования фиброза при активной репликации HBV у больных хроническим гепатитом D, а также недостаточная эффективность рекомбинантного ИФН-a оправдывали попытки применения нуклеоз(т)идных аналогов. Однако использование фамцикловира [81], ламивудина [79], рибавирина [82], клевудина [63] и адефовира [83] не позволяло подавить репликацию HDV. На основании этих наблюдений сформировалось мнение, что нуклеоз(т)идные аналоги не эффективны против HDV, а их применение оправдано лишь при наличии активной репликации HBV у больных хроническим гепатитом дельта. Однако следует отметить, что все вышеперечисленные исследования ограничивались наблюдением в течение двух лет, хотя доказано, что нуклеоз(т)идные аналоги при длительном применении способны снижать уровень cccDNA и HBsAg, что лишает HDV субстрата для экспрессии и таким образом может опосредованно ингибировать репликацию вируса. Наглядно продемонстрировать этот механизм позволило наблюдение 16 больных с хроническим гепатитом D и коинфекцией ВИЧ, которым проводилась высокоактивная антиретровирусная терапия (ламивудин в сочетании с тенофовиром и/или эмтрицитабином) в течение 6 лет [84]. У 3 (18,8%) больных были достигнуты авиремия RNA HDV и нормализация уровня АЛТ, у остальных 13 (81,2%) – снижение виремии и активности АЛТ. Успех длительного применения тенофовира в лечении хронического гепатита D вызвал закономерный интерес, и в июне 2009 г. был начато многоцентровое европейское исследование HIDIT II, предполагавшее применение пегилированного ИФН a-2а в комбинации с плацебо или тенофовиром в течение 96 недель у больных хроническим гепатитом D и последующее наблюдение в течение 6 лет. Таким образом, в настоящее время точкой приложения современных мощных нуклеотидных аналогов в лечении хронического гепатита D можно считать случаи c активной репликацией HBV, а эффективность длительного лечения с целью ингибирования cccDNA HBV требует дальнейших исследований с большим количеством больных.
Пегилированный интерферонa-α. В настоящее время пегилированный ИФН-a является препаратом выбора в лечении хронического гепатита D, что обосновывается результатами трех клинических исследований, проведенных во Франции, Германии и Италии [82,85,86]. УВО (авиремия HDV RNA через 24 недели после завершения терапии) был достигнут в среднем у четверти из 64 больных хроническим гепатитом D, получавших пегилированный ИНФ a-2b в дозе 1,5 мкг/кг в течение 48-72 недель. Во французской выборке (14 больных) только авиремия HDV на 24-й неделе терапии была признана достоверным предиктором УВО (р=0,021) [85].
Альтернативные методы лечения. Среди наиболее перспективных альтернативных методов лечения можно выделить ингибитор пренилирования (фарнесилтрансферазы и геранилгеранилтрансферазы) лонафарниб, preS-производный ингибитор входа HBV мирклюдекс-B и полимеры нуклеиновых кислот REP-2139, которые блокируют синтез и секрецию HBsAg. Механизм действия ингибиторов пренилирования заключается в ингибировании присоединения белков фарнесила или геранилгеранила к цистеиновому остатку на С-конце молекулы HDV-L-антигена, что препятствует связи нуклеокапсида HDV с HBsAg, тем самым блокируя сборку полноценного вируса гепатита дельта [87]. Эффективные модели ингибирования пренилирования были продемонстрированы как in vitro [88], так и in vivo на мышах. В этих исследованиях авиремии HDV удавалось достичь уже через 7 дней терапии ингибитором фарнесилтрансферазы [89]. В исследованиях II фазы была установлена эффективность лонафарниба в сочетании с ритонавиром и пегилированным интерфероном-a [90, 91]. В исследовании LOWR-HDV-4 15 больных хроническим гепатитом D получали лонафарниб в дозе 50-75-100 мг в сочетании с ритонавиром 100 мг/сут. К концу лечения уровень RNA HDV снизился в среднем на 1,52 log10 МЕ/мл, а нормализация АЛТ отмечена в 53% случаев [90].
Пилотные исследования показали более выраженное подавление репликативной активности HDV при лечении мирклюдексом-B в сочетании с пегилированным ИФН a-2а [92] или тенофовиром [93].
Наиболее впечатляющие результаты получены при лечении полимером нуклеиновых кислот REP-2139 (внутривенно в дозе 500 и 250 мг 1 раз в нед в течение 30 нед) в сочетании с пегилированным ИФН a-2а. У 7 (58%) и 9 (75%) из 12 больных (без цирроза печени) через год после окончания лечения сохранялись авиремия (RNA HDV <15 МЕ/мл) и нормализация активности АЛТ, соответственно [94]. У 5 (42%) боль ных наблюдалась сероконверсия HBsAg. Необ хо ди мо отметить, что эффективность и безопасность REP-2119 у больных циррозом печени еще предстоит оценить.
В последние годы также обсуждается применение при хроническом гепатите D пегилированного интерферона-l, который, как показали исследования, отличается от пегилированного ИФН-a меньшей частотой нежелательных явлений (прежде всего, гриппоподобных реакций и цитопении) [95].
Все эти препараты планируется оценить в клинических исследованиях III фазы.
Трансплантация печени
В первых наблюдениях трансплантации печени при гепатите дельта, опубликованных с 1987 г., отмечали высокий риск реактивации HDV, несмотря на комбинированную профилактику с применением иммуноглобулина человека и вакцины против HBV [96]. В последующем стало очевидно, что риск реинфекции после трансплантации печени при HDV-инфекции ниже, чем при моноинфекции вирусами гепатита В и С [97]. Немаловажно также, что в отличие от моноинфекции HBV, частота реинфекции HDV после трансплантации печени оставалась стабильно низкой на протяжении длительного времени – 15,3% в течение 14 лет наблюдения [98].
Длительное время обсуждалась возможность "латентного" течения HDV-инфекции у больных после трансплантации печени при отсутствии маркеров HBV-инфекции. Следует отметить, что большинство исследований, выявивших данный феномен, относились к 1990-м годам, когда тест-системы не позволяли определять минимальные титры вируса. К тому же, по данным Smedile и соавт., вирион HDV, выделенный у больных с виремией после трансплантации печени, был покрыт поверхностным антигеном HBV и содержал в себе полноценный геном HDV, являясь идентичным дотрансплантационному образцу, тем самым исключая возможность репликации вируса при отсутствии HBV [99]. Наличие HDAg в гепатоцитах больных после трансплантации печени при отсутствии признаков репликации HBV, скорее всего, следует объяснять отсроченной элиминацией вирусов, даже на фоне лечения иммуноглобулином человека против HBV [100].
Комбинированная профилактика реинфекции с применением человеческого иммуноглобулина против вируса гепатита В и нуклеоз(т)идного аналога в настоящее время считается оптимальным и общепринятым методом. Монопрофилактика как ламивудином, так и иммуноглобулином человека ассоциировалась с высоким риском реинфекции HBV [101,102]. Таким образом, комбинированная профилактика реинфекции HBV после трансплантации печени позволила достичь сразу несколько целей:
- одновременное воздействие на различные регионы генома HBV: preS/S через иммуноглобулин человека и ген полимеразы через нуклеоз(т)идные аналоги;
- высокая эффективность;
- относительно низкая себестоимость терапии за счет экономии иммуноглобулина человека.
Используемые источники
- Rizzetto M, Canese MG, Arico S, et al. Immunofluorescence detection of new antigen-antibody system (delta/anti-delta) associated to hepatitis B virus in liver and in serum of HBsAg carriers. Gut 1977;18(12):997–1003.
- Bonino F, Heermann KH, Rizzetto M, et al. Hepatitis delta virus: protein composition of delta antigen and its hepatitis B virus-derived envelope. J Virol 1986;58:945-50.
- Casey JL, Bergmann KF, Brown TL, Gerin JL. Structural requirements for RNA editing in hepatitis delta virus: evidence for a uridine-to-cytidine editing mechanism. Proc Nat Acad Sci 1982;89:7149-53.
- Рыжова Е.В., Иванюшина В.А., Грудинин М.П. и др. Выделение и клонирование антигена вируса гепатита дельта. Использование рекомбинантного антигена для серодиагностики дельта-инфекции. Мол ген микробиол вирусол 1998;2:29-32 [Ryzhova EV, Ivanyushina VA, Grudinin MP, et al. Isolation of hepatitis D virus antigen for diagnosis of delta-infection. Mol Gen Microbiol Virusol 1998;2:29-32 (In Russ.)].
- Wang KS, Choo QL, Weiner AJ, et al. Structure, sequence and expression of the hepatitis delta (d) viral genome. Nature 1986;323:508-14.
- Lee CM, Bih FY, Chao YC. et al. Evolution of hepatitis delta virus RNA during chronic infection. Virology 1992;188(1):265-73.
- Абдурахманов Д.Т. Хронический гепатит В и D. М: ГЭОТАР-Медиа; 2010. [Abdurakhmanov DT. Chronic hepatitis B and D. Moscow, 2010 (In Russ.)].
- Knipe DM, Howley PM, Griffin DE. et al. Fields Virology, 5th edition. Lip pin cott Williams & Wilkins; 2007.
- Gaeta GB, Stroffolini T, Chiaramonte M, et al. Chronic hepatitis D: a vanishing Disease? An Italian multicenter study. Hepatology 2000;32(4 Pt 1):824-7.
- Gaeta GB, Stroffolini T, Smedile A, et al. Hepatitis delta in Europe: vanishing or refreshing? Hepatology 2007;46( 4):1312-13.
- Wedemeyer H, et al. Hepatitis D virus infection – not a vanishing disease in Europe! Hepatology 2007;45(5):1331-32.
- Genne D., Rossi I. Hepatitis delta in Switzerland: a silent epidemic. Swiss Med Wkly 2011;18:141.
- Cross TJ, Rizzi P, Horner M. et al. The increasing prevalence of hepatitis delta virus (HDV) infection in South London. J Med Virol 2008;80(2):277-82.
- Rehak V. Устное выступление на моноконференции EASL "Гепатит дельта", Стамбул, Турция, 24-26.09.2010.
- Raimondo G, Isgri G, Caccamo G, et al. Is there a downgrading in the alert about the hepatitis B virus infection in Italy? Dig Liver Dis 2007;39(3):257-61.
- Абдурахманов Д.Т., Крель П.Е., Лопаткина Т.Н. и др. Хронический гепатит D: клиническая характеристика, течение и прогноз. Клиническая гепатология 2009;1:47-50 [Abdurakhmanov DT, Krel PE, Lopatkina TN, et al. Chronic hepatitis D: clinical feature, course and prognosis. Klinicheskaya Gepatologia 2009;1:47-50].
- Шахгильдян И.В., Онищенко Г.Г., Хухлович П.А. и др. Результаты исследования и нерешенные проблемы эпидемиологии и профилактики парентеральных вирусных гепатитов в России. Журнал микробиологии, эпидемиологии и иммунологии 1994;5:26-32 [Shakhgildian IV, Onishenko GG, Khukhlovitch PA, et al. Results of study and the unresolved issues of epidemiology and prevention of parenteral viral hepatitis in Russia. Zhurnal microbiologii, epidemiologii i immunologii 1994;5:26-32 (In Russ.)].
- Семенов С.И. Эпидемиологические особенности и клиническая характеристика вирусных гепатитов В, С и дельта в Республике Саха (Якутия). Автореферат дисс. докт. мед. наук. М.; 2007. [Semenov SI. Epidemiologic properties and clinical characteristic of viral hepatitis B, C and D in Sakha Republik. Moscow, 2007 (In Russ.)].
- Кузин С.Н., Павлов Н.Н., Семенов С.И. и др. Вирусные гепатиты в различных популяционных группах в Республике Саха (Якутия). Журнал микробиологии, эпидемиологии и иммунобиологии 2004;1:18-22. [Kuzin SN, Pavlov NN, Semenov SI, et al. Virus hepatitis in the different population groups in Saha Republick (Yakutia). Zhurnal mikrobiologii, ehpidemiologii i immunobiologii 2004;1:18-22 (In Russ.)].
- Ильченко Л.Ю. и др. Клиническая характеристика гепатита дельта у лиц, проживающих в Республике Тыва. Пятнадцатая Российская конференция "Гепатология сегодня" (Москва, 15-17 марта 2009 г.). [Ilchenko LYu et al. Clinical features of hepatitis delta in Tyva Republick. Hepatology Today, Moscow, March 15-17, 2009 (In Russ.)].
- Левитан Б.Н., Дедов А.В. Дельта-гепатит. Астрахань: АГМА; 2001. [Levitan BN, Dedov AV. Hepatitis delta. Astrakhan, 2001 (In Russ.)].
- Abdurakhmanov DT, Yesmembetov KI, Rozina TP, et al. Liver-related mortality in hepatitis delta patients: Russian single center experience. Dig Liv Dis 2018;50:867-8.
- Flodgren E, Bengtsson S, Knutsson M, et al. Recent high incidence of fulminant hepatitis in Samara, Russia: molecular analysis of prevailing hepatitis B and D virus strains. J Clin Microbiol 2000;38:3311–6.
- Nguyen VT, McLaws ML, Dore GJ. Highly endemic hepatitis B infection in rural Vietnam. J Gastroenterol Hepatol 2007;22(12):2093-100.
- Bоrresen ML, Olsen OR, Ladefoged K. et al. Hepatitis D outbreak among children in a hepatitis B hyper-endemic settlement in Greenland. J Viral Hepat 2010;17(3):162-70.
- Acharya SK, Madan K, Dattagupta S, Panda SK. Viral hepatitis in India. Natl Med J India 2006;19(4):203-17.
- Roshandel G, Semnani S, Abdolahi N. et al. Prevalence of hepatitis D virus infection in HBsAg positive subjects in Iran. Pak J Biol Sci 2007;10(10):1751-4.
- Mansour W, et al. Impact of hepatitis B and Delta viruses coinfection on liver disease in Mauritania. Poster for EASL monoconference, Istanbul, Turkey, 2010.
- Tsatsralt-Od B, Takahashi M, Nishizawa T, et al. High prevalence of dual or triple infection of hepatitis B, C, and delta viruses among patients with chronic liver disease in Mongolia. J Med Virol 2005;77:491–9.
- Nwokediuko SC, Ijeoma U. Seroprevalence of antibody to HDV in Nigerians with hepatitis B virus-related liver diseases. Niger J Clin Pract 2009;12(4):439-42.
- Moatter T, Abbas Z, Shabir S, Jafri W. Clinical presentation and genotype of hepatitis delta in Karachi. World J Gastroenterol 2007;13:2604–507.
- Khan A, Kurbanov F, Tanaka Y. et al. Epidemiological and clinical evaluation of hepatitis B, hepatitis C, and delta hepatitis viruses in Tajikistan. J Med Virol 2008; 80(2):268-76.
- Djebbi A, Rebai WK, Bahri O. et al. Serological markers, viral RNA and genotype of hepatitis delta virus in HBs antigen positive Tunisian patients. Pathol Biol (Paris) 2009;57(7-8):518-23.
- Niro GA. Intrafamilial transmission of hepatitis delta virus: molecular evidence. J Hepatol 1999;30:564-9.
- Sagnelli E, Stroffolini T, Ascione A. et al. The epidemiology of hepatitis delta infection in Italy over the last 18 years. In: Hadziyannis SJ, Taylor JM, Bonino F, editors. Hepatitis Delta Virus. NY: Wiley-Liss; 1993. 287-94.
- Deny P. Hepatitis virus genetic variability: from genotypes I, II, III to eight major clades. Hepatitis Virus. Heidelberg, Germany: Springer; 2006, 151-171.
- Круглов И.В. Особенности гуморального иммунного ответа при гепатитах А, С, дельта и из значение для клиники и диагностики. Автореф. дисс. д.м.н., М., 2006. [Kruglov IV. Humoral immunological response in hepatits A, C, delta and its clinical and diagnostical significance. Moscow, 2006 (In Russ.)].
- Ivaniushina V, Radjef N, Alexeeva M, et al. Hepatitis delta virus genotypes I and II cocirculate in an endemic area of Yakutia, Russia. J General Virol 2001; 82:2709–18.
- Roingeard P, Dubois F, Marcellin P, et al. Persistent delta antigenaemia in chronic delta hepatitis and its relation with human immunodeciency virus infection. J Med Virol 1992,38:191–4.
- Guilhot S, Huang S-N, Xia YP, et al. Expression of hepatitis delta virus large and small antigens in transgenic mice. J Virol 1994;68:1052–8.
- Zachou K, Yurdaydin C, Drebber U, et al. Quantitative HBsAg and HDV-RNA levels in chronic delta hepatitis. Liver Int 2010;30:430-7.
- Блохина Н.П. Хронический гепатит дельта (клиника, диагностика, лечение). Автореф. дисс. д.м.н., Москва, 1999 г. [Blokhina NP. Chronic hepatitis delta (clinical picture, diagnosis and treatment. Moscow, 1999 (In Russ.)].
- Nisini R, Paroli M, Accapezzato D, et al. Human CD41T-cell response to hepatitis delta virus: identification of multiple epitopes and characterization of T-helper cytokine profiles. J Virol 1997;71:2241–51.
- Grabowski J, Yurdaydin C, Zachou K, et al. Hepatitis D virus-specific cytokine responses in patients with chronic hepatitis delta before and during interferon alfatreatment. Liver Int 2011;31:1395-405.
- Aslan N, Yurdaydin C, Wiegand J. et al. Cytotoxic CD4 T cells in viral hepatitis. J Viral Hepat 2006;13:505-14.
- Дедов А.В. Клинико-патогенетическое значение антигенов HLA и бета-2 микроглобулина при хронических диффузных заболеваниях печени вирусной этиологии. Автореф. дисс. к.м.н., Астрахань. 1995. [Dedov AV. Clinical signficiance of HLA antigens and beta-2 microglobulin in viral chronic liver diseases. Astrakhan, 1995 (In Russ.)].
- Чишиева Е.М. Клинико-патогенетическое значение противовирусной активности эндогенного интерферона при хронических диффузных заболеваниях печени. Автореф. дисс. к.м.н. Астрахань. 2001. 22 с. [Chishieva EM. Clinical significance of antiviral activity of endogenous interferon in chronic liver diseases. Astrakhan, 2001 (In Russ.)].
- Pugnale P, Pazienza V, Guilloux K, Negro F. Hepatitis delta virus inhibits alpha interferon signaling. Hepatology 2009;49(2):398-406.
- Nakano T, Shapiro CN, Hadler SC et al. Characterization of hepatitis D virus genotype III among Yucpa Indians in Venezuela. J Gen Virol 2001;82(9):2183-9.
- Andrade Z, Lesbordes JL, Ravisse P. et al. Acute severe hepatitis with microvesicular steatosis. Rev Sot Bras Med Tropical 1992;25:1555-60.
- Negro F, Shapiro M, Satter eld W, et al. Reappearance of hepatitis D virus (HDV) replication in chronic hepatitis B virus carrier chimpanzees rechallenge with HDV. J Infect Dis 1989;4:567–71.
- Zachou K, Yurdaydin C, Dienes HR. et al. Significance of HDV-RNA and HBsAg levels in delta hepatitis: First data of the HEP-NET/International HDV Intervention Trial. J Hepatol 2006;44:178.
- Mauss S, Berg T, Rockstroh JK, et al. Hepatology – A Clinical Textbook. Second Edition. Dusseldorf; 2010.
- Smedile A, Rizzetto M, Gerin JL. Advances in hepatitis D virus biology and disease. In: Boyer JL, Okner RK, editors. Progress in liver disease, vol. 12. Philadelphia: WB Saunders; 1994. 157–75.
- Casey JL, Niro GA, Engle RE. et al. Hepatitis B virus (HBV)/hepatitis D virus (HDV) coinfection in outbreaks of acute hepatitis in the Peruvian Amazon basin: the roles of HDV genotype III and HBV genotype F. J Infect Dis 1996;174(5):31 920-6.
- Smedile A, Ciancio A, Rizzetto M, et al. Clinical virology. Washington DC: ASM Press; 2002, 1227–1240.
- Кузнецов П.Л. Клинико-лабораторные особенности течения фульминантной формы вирусных гепатитов B и D с учетом связывающей способности сывороточного альбумина. Автореф. дисс. к.м.н. Екатеринбург, 2005. [Kuznetsov PL. Clinical and laboratory features of fulminant viral hepatitis B and D. Ekaterinburg, 2005 (In Russ.)].
- Dienes HP, et al. The significance of infections with two types of viral hepatitis demonstrated by histologic features in chimpanzees. J Hepatol 1990;10(1):77-84.
- Niro GA, Gravinese E, Martini E, et al. Clearance of hepatitis B surface antigen in chronic carriers of hepatitis delta antibodies. Liver 2001;21:254–59.
- Saracco G, Macagno S, Rosina F, Rizzetto M. Serologic markers with fulminant hepatitis in persons positive for hepatitis B surface antigen. A worldwide epidemiologic and clinical survey. Ann Intern Med 1988;108:380–3.
- Farci P, Smedile A, Lavarini C, et al. Delta hepatitis in inapparent carriers of hepatitis B surface antigen. A disease simulating acute hepatitis B progressive to chronicity. Gastroenterology 1983;85:669–73.
- Wu JC, Chen TZ, Huang YS, et al. Natural history of hepatitis D viral superinfection: significance of viremia detected by polymerase chain reaction. Gastroenterology 1995;108(3):796-802.
- Yurdayd n C, Idilman R, Bozkaya H, Bozdayi AM. Natural history and treatment of chronic delta hepatitis. J Viral Hepat 2010;17(11):749-56.
- Rosina F, Conoscitore P, Cuppone R, et al. Changing pattern of chronic hepatitis D in Southern Europe. Gastroenterology 1999;117(1):161-6.
- Romeo A, de Ninno E, Rumi M, et al. 28-year study of the course of HDV infection – A risk factor for cirrhosis and HCC. Gastroenterology 2009;136:1629–38.
- Niro GA, Smedile A, Ippolito AM, et al. Outcome of chronic delta hepatitis in Italy: a long-term cohort study. J Hepatol 2010;53(5):834-40.
- Buti M, Homs M, Rodriguez-Frias F, et al. Clinical outcome of acute and chronic hepatitis delta over time: a long-term follow-up study. J Viral Hepat 2011; 18(6):434-42.
- Fattovich G, Giustina G, Christensen E, et al. Infuence of hepatitis delta virus infection on morbidity and mortality in compensated cirrhosis type B. Gut 2000;46:420–6.
- Gheorghe L, Iacob S, Simionov I, et al. Natural history of compensated viral B and D cirrhosis. Rom J Gastroenterol 2005;14(4):329-35.
- Davies SE, Lau JY, O'Grady JG, et al. Evidence that hepatitis D virus needs hepatitis B virus to cause hepatocellular damage. Am J Clin Pathol 1992;98:554-8.
- Huo TI, Wu JC, Lai CR, et al. Comparison of clinico-pathological features in hepatitis B virus-associated hepatocellular carcinoma with or without hepatitis D virus superinfection. J Hepatol 1996;25(4):439-44.
- Hadziyannis SJ. Review: hepatitis delta. J Gastroenterol Hepatol 1997;12:289-98.
- Erhardt A, Hoernke M, Heinzel-Pleines U, et al. Retrospective analysis of chronic hepatitis D in a West German University Clinic over two decades: migratory pattern, prevalence and clinical outcome. Z Gastroenterol 2010;48(8):813-7.
- Сюткин В.Е. Клиническая характеристика хронических диффузных заболеваний печени, обусловленных сочетанной инфекцией вирусами гепатита В, С и/или дельта. Автореф. дисс. к.м.н., Москва, 1999. [Syutkin VE. Clinical features of chronic liver diseases related to HBV, HCV and/or HDV co-infection. Moscow, 1999 (In Russ.)].
- Рахимова Х.К. Хронические диффузные поражения печени дельта-вирусной этиологии (некоторые аспекты вирусологии и иммунопатологии). Автореф. дисс. к.м.н., Душанбе, 2007. [Rakhimova KhK. Chronic liver diseases induced by delta virus. Dushanbe, 2007 (In Russ.)].
- Rizzetto M, Rosina F, Saracco G, et al. Treatment of chronic delta hepatitis with alpha 2 recombinant interferon. J Hepatol 1986;3(2):229–33.
- Abbas Z, Khan MA, Salih M, Jafri W. Interferon for chronic hepatitis D: a systematic review. EASL monoconference "Delta hepatitis". Istanbul, Turkey, 2426.09.2010. Poster #2.
- Farci P, Chessa L, Peddis G, et al. Influence of alpha interferon (IFN) on the natural history of chronic hepatitis D: dissociation of histologic and virologic response. Hepatology 2000;32:222.
- Lau DT, et al. Resolution of chronic delta hepatitis after 12 years of interferon alfa therapy. Gastroenterology 1999;117:1229–33.
- Burnevich E, Moiseev S, Mukhin N. Letter: cure of chronic hepatitis B and d after 12 years of treatment with low-dose standart interferon alfa-2b. Aliment Pharmacol Ther 2016;44:649-50.
- Yurdaydin C, Bozkaya H, Gorel S, et al. Famciclovir treatment of chronic delta hepatitis. J Hepatol 2002;37:266–71.
- Niro GA, Ciancio A, Gaeta GB, et al. Pegylated interferon alpha-2b as monotherapy or in combination with ribavirin in chronic hepatitis delta. Hepatology 2006;44(3):713-20.
- Wedemeyer H, Yurdaydin C, et al. Peginterferon plus adefovir versus either drug alone for hepatitis delta. N Engl J Med 2011;364(4):322-31.
- Sheldon J, Ramos B, Toro C, et al. Does treatment of hepatitis B virus (HBV) infection reduce hepatitis delta virus (HDV) replication in HIV-HBV-HDV-coinfected patients? Antivir Ther 2008;13(1):97-102.
- Castelnau C, Le Gal F, Ripault MP, et al. Efficacy of peginterferon alpha-2b in chronic hepatitis delta: relevance of quantitative RT-PCR for follow-up. Hepatology 2006;44(3):728-35.
- Erhardt A, Gerlich W, Starke C, et al. Treatment of chronic hepatitis delta with pegylated interferon-alpha2b. Liver Int 2006;26(7):805-10.
- Zhang FL, Casey PJ. Protein prenylation: molecular mechanisms and functional consequences. Annu Rev Biochem 1996;65:241–69.
- Glenn JS, Watson JA, Havel CM, White JM. Identification of a prenylation site in delta virus large antigen. Science 1992;256:1331–3.
- Bordier BB, Ohkanda J, Liu P, et al. In vivo antiviral efficacy of prenylation inhibitors against hepatitis delta virus. J Clin Invest 2003;112:407–14.
- Wedemeyer H, Port K, Deterding K, Wranke A. A phase 2 dose-escalation study of lonafarnib plus ritonavir in patients with chronic hepatitis D: final results from the Lonafarnib with ritonavir in HDV-4 (LOWR HDV-4) study. J Hepatol 34 2017;66(Suppl 1),S24.
- Yurdaydin C, Keskin O, Kalkan K, et al. Optimizing lonafarnib treatment for the management of chronic delta hepatitis: The LOWR HDV-1 study. Hepatology 2018;67(4):1224-36.
- Bogomolov P, Alexandrov A, Voronkova N, et al. Treatment of chronic hepatitis D with the entry inhibitor Myrcludex B: first results of a phase Ib/IIa study. J Hepatol 2016;65(3):490-8.
- Wedemeyer H, Bogomolov P, Blank A, et al. Final results of a multicenter, openlabel phase 2b clinical trial to assess safety and efficacy of Myrcludex B in combination with tenofovir in patients with chronic HBV/HDV infection. J Hepatol 2018;68:S3.
- Bazinet M, Pa ntea V, Cebotarescu V, et al. Safety and efficacy of REP 2139 and pegylated interferon alfa-2a for treatment-naive patients with chronic hepatitis B virus and hepatitis D virus co-infection (REP 301 and REP 301-LTF): a non-randomised, open-label, phase 2 trial. Lancet Gastroenterol Hepatol 2017;2:87789.
- Donnelly RP, Kotenko SV. Interferon-lambda: a new addition to an old family. J Interferon Cytokine Res 2010;30(8):555-64.
- Rizzetto M, Macagno S, Chiaberge E. et al. Liver transplantation in hepatitis delta virus disease. Lancet 1987;2(8557):469-71.
- Samuel D, Muller R, Alexander G, et al. Liver transplantation in European patients with the hepatitis B surface antigen. N Engl J Med 1993;329(25):1842-7.
- Roche B, Feray C, Gigou M. et al. HBV DNA persistence 10 years after liver transplantation despite successful anti-HBS passive immunoprophylaxis. Hepatology 2003;38(1):86-95.
- Smedile A, Casey JL, Cote PJ. et al. Hepatitis D viremia following orthotopic liver transplantation involves a typical HDV virion with a hepatitis B surface antigen envelope. Hepatology 1998;27(6):1723-9.
- Mederacke I, Filmann N, Yurdaydin C. et al. Rapid early HDV RNA decline in the peripheral blood but prolonged intrahepatic hepatitis delta antigen persistence after liver transplantation. J Hepatol 2012;56(1):115-22.
- Jiang L, Jiang LS, Cheng NS, Yan LN. Current prophylactic strategies against hepatitis B virus recurrence after liver transplantation. World J Gastroenterol 2009;15(20):2489-99.
- Faria LC, Gigou M, Roque-Afonso AM, et al. Hepatocellular carcinoma is associated with an increased risk of hepatitis B virus recurrence after liver transplantation. Gastroenterology 2008;134(7):1890-9.
