Перспективные направления терапии системных васкулитов: в фокусе авакопан, пероральный селективный ингибитор С5а рецептора
На основе данных литературы обсуждаются перспективы нового направления терапии системных васкулитов (СВ), ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА), основанного на селективном ингибировании С5а рецептора компонента комплемента. В рандомизированном плацебо-контролируемом клиническом исследовании II фазы CLEAR у пациентов с АНЦА-СВ включение перорального селективного ингибитора С5а рецептора авакопана (CCX168) в схему индукционной терапии циклофосфамидом или ритуксимабом как в сочетании с низкими дозами глюкокортикоидов (ГК), так и без ГК позволяло достичь ремиссии через 12 недель чаще (86% и 81%, соответственно), чем при индукционной терапии циклофосфамидом или ритуксимабом в сочетании с высокими дозами ГК и плацебо (70%, р≤0,01). Профиль безопасности авакопана был удовлетворительным. Случаев смерти в группах сравнения не зарегистрировали, а частота серьезных инфекций варьировалась в пределах 4-5%. В группах авакопана отмечено снижение частоты нежелательных реакций, обусловленных приемом ГК. Необходимы дальнейшие исследования, направленные на уточнение отдаленной эффективности и безопасности применения ингибитора С5а рецептора в качестве стероидсберегающего средства для индукции и поддержания ремиссии у пациентов с АНЦА-СВ.
За последние десятилетия наблюдается существенное изменение целей терапии системных васкулитов (СВ), ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА), в соответствии с современной концепцией лечения "до достижения цели" (Treat to target) [1]. В настоящее время они включают в себя не только сохранение жизни пациентов, но и поддержание стабильной ремиссии АНЦА-СВ, снижение риска нежелательных эффектов лечения, контроль сопутствующих заболеваний и достижение высокого качества жизни. Улучшение результатов терапии АНЦА-СВ стало возможным благодаря появлению инновационных лечебных стратегий.
Прогресс в лечении АНЦА-СВ прежде всего связан с внедрением анти-В-клеточной терапии ритуксимабом (РТМ), который имеет определенные преимущества перед циклофосфамидом (ЦФ) как по эффективности, так и безопасности [2]. Вместе с тем, неотъемлемой частью индукционной и поддерживающей терапии АНЦА-СВ, в том числе с применением РТМ, остаются глюкокортикоиды (ГК), в том числе в сверхвысоких дозах, которые во многом определяют спектр нежелательных эффектов лечения. Следует подчеркнуть, что монотерапия ГК не оказывает существенного влияния на прогноз АНЦА-СВ [3]. Например, по данным К. Sada и соавт. [4], во всех случаях летального исхода, обусловленного активностью АНЦА-СВ, пациенты получали ГК без ЦФ. Частота и сроки развития рецидива АНЦА-СВ не зависят от дозы ГК [5,6]. Тем не менее, ГК способны быстро подавлять воспалительные реакции, предотвращать необратимое повреждение органов и создавать "коридор возможностей" для эффектов ЦФ и РТМ, реализующихся постепенно. Одновременно ГК существенно повышают риск инфекционных и других осложнений, таких как сахарный диабет, остеопороз, катаракта, сердечно-сосудистые заболевания и желудочно-кишечные осложнения [3,7].
У пациентов с АНЦА-СВ по сравнению с общей популяцией повышен риск развития инфекций, включая септицемию различной этиологии (отношение рисков [ОР] 3,49-4,55), пневмонию (ОР 3,27), острые инфекции верхних дыхательных путей (ОР 8,88), поражение кишечника, вызванное Clostri dium difficile (ОР 5,35), кожные инфекции (ОР 5,35) [8]. Большинство инфекционных осложнений развиваются в первые месяцы лечения [8,9], когда используются более агрессивные схемы, включающие сверхвысокие дозы ГК. При АНЦА-СВ высокие кумулятивные дозы ГК и ЦФ относят к основным факторам риска инфекционных нежелательных реакций [10,11].
На фоне стандартной терапии ЦФ и высокими дозами ГК риск смерти больных АНЦА-СВ повышен в 2,6 раза по сравнению с общей популяцией. В течение первого года основной причиной смерти являются инфекции (48%), в дальнейшем с ними конкурируют сердечно-сосудистые заболевания и опухоли (10%, 26% и 22%, соответственно) [12]. При применении РТМ среди нежелательных реакций также преобладают инфекции, прежде всего респираторные (38-70%) [1315]. Так, по данным А. Kronbichler и соавт. [14], обобщивших опыт лечения РТМ у 192 больных АНЦА-СВ со средней длительностью наблюдения 22 месяца, частота серьезных инфекционных нежелательных реакций составила 25,5% (26 на 100 пациентов-лет).
Важность снижения доз ГК при лечении АНЦА-СВ подчеркивают данные крупного европейского исследования, в котором была выявлена зависимость индекса VDI (vasculitis damage index), отражающего выраженность необратимого поражения внутренних органов и тканей, от длительности применения ГК, наряду с возрастом пациентов, тяжестью АНЦА-СВ и частотой рецидивов [7]. На фоне поддерживающего лечения преднизолоном в дозе >5 мг/сут отмечено достоверное повышение частоты инфекционных нежелательных реакций (р<0,0001) по сравнению с таковой у пациентов, у которых через 6 месяцев доза преднизолона была менее 5 мг/сут [5]. По данным многоцентрового исследования [6], у 104 пациентов в возрасте старше 65 лет с различными СВ (включая 94 больных АНЦА-СВ) применение модифицированной схемы индукционной терапии, предполагавшей назначение низкой дозы ЦФ (внутривенно 500 мг) и прием ГК в течение менее 9 месяцев, по сравнению со стандартной схемой способствовало снижению частоты серьезных нежелательных реакций (60% и 78%, соответственно; р=0,04) и летальных исходов (17% и 24%, р=0,41), но не влияло на частоту достижения ремиссии (89% и 86%, р=0,71). При этом в обеих группах частота рецидивов АНЦА-СВ в течение 3 лет оставалась высокой (44% и 29%, р=0,15).
Таким образом, ключевым направлением современных клинических исследований при АНЦА-СВ становится поиск терапевтических стратегий, направленных на минимизацию применения ГК для индукции и поддержания ремиссии.
Механизм действия авакопана
За последние годы в ходе фундаментальных и клинических исследований были выявлены новые потенциальные молекулы-мишени, включая рецептор C5a компонента комплемента, интерлейкин-6, фактор активации B-клеток. В качестве наиболее перспективного направления стероид-сберегающей стратегии можно рассматривать применение авакопана (CCX168) [16-19], являющегося пероральным низкомолекулярным селективным ингибитором С5а рецептора (рис. 1). C5a компонент комплемента представляет собой небольшой пептид, отщепляемый в процессе активации комплемента от молекул-предшественников. После связывания с рецептором C5a (CD88) он проявляет себя как мощный медиатор воспаления [20], хемоаттрактант, активатор нейтрофилов, способствующий повышению экспрессии на клеточной мембране нейтрофильных протеиназы-3 (ПР3) и миелопероксидазы (МПО), против которых направлены АНЦА. C5a способен активировать эндотелиальные клетки и повышать проницаемость капилляров [21,22].
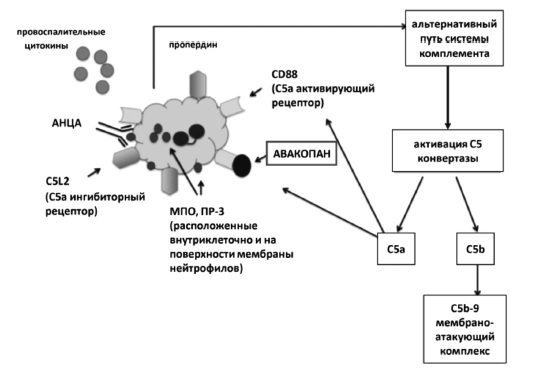
Активация альтернативного пути комплемента приводит к расщеплению C5 и образованию анафилотоксина C5a и субкомпонента C5b, инициирующего формирование мембрано-атакующего комплекса (MAК) за счет последовательного присоединения к C5b C6, C7, C8 и дальнейшего связывания образующегося комплекса с C9, что катализирует полимеризацию C9. В результате в клеточной мембране образуются трансмембранные каналы, нарушающие целостность ее структуры и пропускающие в клетку низкомолекулярные компоненты цитоплазмы [23], что приводит к повреждению клеток иммунной системы или их активации с высвобождением арахидоновой кислоты, усилением окислительного метаболизма, дегрануляцией и продукцией провоспалительных цитокинов.
Получены убедительные доказательства участия системы комплемента в патогенезе АНЦА-СВ. Взаимодействие АНЦА с соответствующим антигеном сопровождается активацией альтернативного пути комплемента, приводящей к повышению уровня С5а [24]. При иммуногистологическом исследовании биоптатов почек больных АНЦА-СВ с гломерулонефритом (ГН) в большинстве случаев обнаруживали C3d, C4d, C5b-9, при этом в биоптатах, которые окрашивались на C3d и пропердин, наблюдалось больше клеточных полулуний и меньше неповрежденных клубочков, чем в образцах, в которых отсутствовали реакции на C3d и пропердин (р<0,05) [25]. Установлено, что у C5-дефицитных мышей, в отличие от С4-дефицитных, не развивается ГН с полулуниями при введении IgG антител к МПО [26].
Обсуждая патогенез АНЦА-СВ, для которых свойственно развитие ГН с полулуниями вследствие некротизирующего васкулита мелких сосудов клубочков, патогенетически обусловленного АНЦА, следует подчеркнуть, что активация комплемента по альтернативному пути усугубляет повреждение почек. В частности, компоненты комплемента могут присутствовать в просвете канальцев, генерировать продукты активации и МАК, способствуя тубулоинтерстициальному повреждению [27,28], которое у больных АНЦА-СВ может сопутствовать ГН с полулуниями. Установлено, что альтернативный путь ответственен за активацию комплемента на щеточной каемке проксимальных канальцев [29]. Отложение C5b-9 в канальцах почек ассоциируется с инфильтрацией моноцитами интерстиция [30], что при фокальном сегментарном гломерулосклерозе может содействовать перитубулярной аккумуляции миофибробластов [31]. При этом у пациентов с неселективной протеинурией нефротического уровня, которая характерна для АНЦА-ассоциированного ГН, отмечается наиболее высокая экскреция C5b-9 с мочой [27]. Интересно, что инги бирование C5 и C5a в экспериментальных моделях приводит к уменьшению тубулоинтерстициального повреждения [28]. В экспериментальных моделях АНЦА-СВ на животных показано, что блокада С5а и нейтрофильного рецептора С5а предотвращает развитие МПО-ассоциированного ГН с полулуниями [32].
Клинические исследования авакопана
За последние годы опубликованы результаты двух рандомизированных плацебо-контролируемых клинических исследований авакопана при АНЦА-СВ, включая микроскопический полиангиит (МПА) и гранулематоз с полиангиитом (ГПА). В исследование II фазы CLEAR были включены 67 больных АНЦА-СВ, которые на фоне индукционной терапии ЦФ или РТМ получали авакопан в течение 12 недель в сочетании с ГК или плацебо [18]. В исследовании II фазы CLASSIC [19] у 42 пациентов с активным АНЦА-СВ изучали профиль безопасности различных доз авакопана, который присоединяли на 12 недель к индукционной терапии РТМ или ЦФ. В 2019 г планируется завершение 26-недельного исследования III фазы ADVOCATE [33], в котором у 300 больных АНЦА-СВ сравнивается эффективность авакопана в комбинации с РТМ или цитостатиками (ЦФ, азатиоприн) и ГК в сочетании с РТМ или цитостатиками.
| Группы | ЦФ или РТМ + плацебо + преднизолон 60 мг/сут (n=23) | ЦФ или РТМ + авакопан 60 мг/сут + преднизолон 20 мг/сут (n=22) | ЦФ или РТМ + авакопан 60 мг/сут + плацебо (n=22) |
|---|---|---|---|
| Клинический ответ через 12 недель | 70 | 86 | 81 |
| Отсутствие АНЦА через 12 недель | 9 | 23 | 27 |
| Серьезные инфекции | 4 | 5 | 5 |
| Летальный исход | 0 | 0 | 0 |
Ключевое значение для понимания роли альтернативного пути активации комплемента в развитии АНЦА-СВ, в том числе с поражением почек, имеют результаты исследования CLEAR [18]. Критериями включения в это исследование были дебют или обострение АНЦА-СВ (ГПА или МПА), возраст старше 18 лет, скорость клубочковой фильтрации (СКФ) >20 мл/мин. У подавляющего большинства больных имелся ГН (97%). Число пациентов с ГПА или МПА было одинаковым, хотя доля пациентов, у которых определялись антитела к МПО, несколько превышала долю больных с антителами к ПР3 (52% и 43%, соответственно). У всех пациентов индукционная терапия включала ЦФ (5 внутривенных инфузий 15 мг/кг с интервалом в 2-4 недели и последующим назначением азатиоприна 2 мг/кг/сут) или РТМ (4 внутривенных инфузии 375 мг/м2 с интервалом в 1 неделю). При назначении индукционного лечения пациенты были рандомизированы на три группы: (1) плацебо в сочетании преднизолоном в стартовой дозе 60 мг/сут (контрольная группа); (2) авакопан (30 мг два раза в сутки) в сочетании с преднизолоном в сниженной до 20 мг/сут дозе; (3) авакопан (30 мг два раза в сутки) без преднизолона. Длительность лечения составила 12 недель. Первичной конечной точкой исследования было снижение индекса активности BVAS (Birmingham Vasculitis Activity Score) ≥50% от исходного уровня. Основные результаты CLEAR представлены в табл. 1 и на рис. 2.
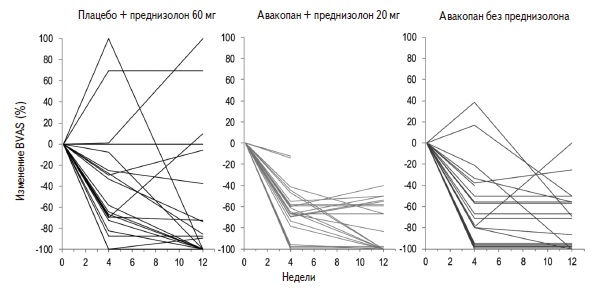
В ходе рандомизированного плацебо-контролируемого исследования CLEAR была достигнута первичная конечная точка и установлено, что применение перорального ингибитора рецептора C5a в качестве компонента индукционного лечения АНЦА-СВ эффективно, безопасно и способно заменить высокие дозы ГК. Применение авакопана как в сочетании с низкими дозами глюкокортикоидов (ГК), так и без ГК позволило достичь ремиссии через 12 недель чаще (86% и 81%, соответственно), чем при индукционной терапии циклофосфамидом или ритуксимабом в сочетании с высокими дозами ГК и плацебо (70%, р<0,01). Как показал анализ динамики индекса BVAS, у некоторых пациентов лечение авакопаном может способствовать усилению клинического эффекта индукционной терапии. Кроме того, в результате терапии авакопаном прекращение гиперпродукции АНЦА через 12 недель отмечалось чаще, чем в контрольной группе (23-27% и 9%, соответственно). Авакопан способствовал достоверному стойкому снижению альбуминурии, которая ухудшает почечный прогноза при АНЦА-СВ [34,35]. О быстром снижении активности ГН в группах авакопана свидетельствовало более значительное снижение в моче уровня моноцитарного хемоаттрактантного протеина-1 (MCP-1, monocyte chemoattractant protein-1), маркера активного воспалительного повреждения почек. СКФ и гематурия улучшились в одинаковой степени в трех группах. Полученные данные позволяют обсуждать нефропротективный потенциал авакопана.
Важным результатом исследования CLEAR является удовлетворительный профиль безопасности Авакопана. Летальные исходы отсутствовали во всех группах, а частота серьезных инфекционных нежелательных реакций варьировалась в пределах 4-5%. В группах пациентов, получавших авакопан, по сравнению с контрольной группой отмечено снижение частоты нежелательных эффектов ГК, таких как впервые возникший/прогрессирующий сахарный диабет (5-0% и 17%, сответственно), психические расстройства (5-9% и 26%), увеличение массы тела >10 кг (0-5% и 9%), переломы (0% и 4%), катаракта (0% и 4%). Интересно, что лимфопения при лечении авакопаном без ГК встречалась чаще (28%), чем при применении авакопана в комбинации с ГК (9%) или ГК без авакопана (4%), что, видимо, объясняется смягчением под действием ГК цитопении, вызываемой ЦФ и РТМ.
В рандомизированное плацебо-контролируемое исследование II фазы CLASSIC [19] были включены 42 пациента с активным АНЦА-СВ, которые при назначении индукционной терапии РТМ (в 93% случаев) или ЦФ (7%) были рандомизированы на три группы: (1) плацебо; (2) авакопан 10 мг два раза в сутки; (3) авакопан 30 мг два раза в сутки. В течение 12 недель лечения частота серьезных нежелательных реакций в трех группах составила 15%, 15% и 19%, соответственно. Клиническая эффективность зависела от дозы препарата: ранняя полная ремиссия на 4-й неделе терапии была достигнута, соответственно, у 15%, 8% и 31% пациентов. Оптимальной схемой дозирования авакопана названо пероральное применение 30 мг два раза в сутки.
При предварительной оценке безопасности авакопана (30 мг два раза в сутки) у здоровых добровольцев также отмечена его удовлетворительная переносимость [32]. Cерьезные нежелательные реакции отсутствовали, наблюдались случаи диареи, головокружения, тошноты, болей в нижней части живота и в горле.
Заключение
Результаты применения авакопана открывают новую эру в лечения АНЦА-СВ, предполагающую существенное ограничение применения ГК или полный отказ от их назначения. Необходимы дальнейшие исследования, направленные на уточнение отдаленной эффективности и безопасности применения ингибиторов С5а рецептора в качестве стероид-сберегающей стратегии для индукции и поддержания ремиссии при АНЦА-СВ.
Используемые источники
- Luqmani RA. Treat-to-target in vasculitis: is this a sensible approach? Clin ExperRheumatol 2012; 30 (Suppl. 73):149–53.
- Yates M, Watts RA, Bajema IM, et al. EULAR/ERA-EDTA recommendationsfor the management of ANCA-associated vasculitis. Ann Rheum Dis 2016;75(9):1583-94..
- Семенкова Е.Н. Системные некротизирующие васкулиты. М.: Русскийврач, 2001, 95 с. [Semenkova EN. Systemic necrotizing vasculitides. M., 2011, 95p. (In Russ.)].
- Sada KE, Yamamura M, Harigai M, et al. Different responses to treatment acrossclassified diseases and severities in Japanese patients with microscopic polyangiitisand granulomatosis with polyangiitis: a nationwide prospective inception cohortstudy. Arthritis Res Ther 2015;17:305.
- McGregor JG, Hogan SL, Hu Y, et al. Glucocorticoids and relapse and infectionrates in anti-neutrophil cytoplasmic antibody disease. Clin J Am Soc Nephrol2012;7(2):240-7.
- Pagnoux C, Quеmеneur T, Ninet J, et al. Treatment of systemic necrotizing vas-culitides in patients aged sixty-five years or older: results of a multicenter, open-label, randomized controlled trial of corticosteroid and cyclophosphamide-basedinduction therapy. Arthritis Rheumatol 2015;67(4):1117-27.
- Robson J, Doll H, Suppiah R, et al. Glucocorticoid treatment and damage in theanti-neutrophil cytoplasm antibody-associated vasculitides: long-term data fromthe European Vasculitis Study Group trials. Rheumatology (Oxford) 2015;54(3):471-81.
- Mohammad AJ, Segelmark M, Smith R, et al. Severe infection in antineutrophilcytoplasmic antibody-associated vasculitis. J Rheumatol 2017;44:1468–75
- McGregor JG, Negrete-Lopez R, Poulton CJ, et al. Adverse events and infectio-us burden, microbes and temporal outline from immunosuppressive therapy inantineutrophil cytoplasmic antibody-associated vasculitis with native renal func-tion. Nephrol Dial Transplant 2015;30(Suppl 1):i171–81.
- Kronbichler A, Jayne DR, Mayer G. Frequency, risk factors and prophylaxis ofinfection in ANCA-associated vasculitis. Eur J Clin Invest 2015;45(3):346-68.
- Charlier C, Henegar C, Launay O, et al. Risk factors for major infections inWegener granulomatosis: analysis of 113 patients. Ann Rheum Dis 2009;68:658–63.
- Flossmann O, Berden A, de Groot K, et al. Long-term patient survival in ANCA-associated vasculitis. Ann Rheum Dis 2011;70(3):488-94.
- Harper L, Savage CO. ANCA
