Сравнительный анализ эффективности различных препаратов сурфактанта в лечении респираторного дистресс-синдрома у недоношенных новорожденных
Респираторный дистресс-синдром – это одна из основных причин смертности недоношенных новорожденных. Для лечения респираторного дистресс-синдрома применяют препараты сурфактанта в сочетании с респираторной поддержкой. Нативные препараты сурфактанта получают из ткани легких свиней (порактантальфа) или телят (берактант, сурфактант БЛ) или лаважной жидкости телят (бовактант). По данным мета-анализа рандомизированных контролируемых исследований берактант и бовактант не отличались по эффективности в лечении респираторного дистресс-синдрома у новорожденных, в то время как порактант альфа имел достоверные преимущества перед берактантом. В российском ретроспективном исследования была показана более высокая эффективность порактанта альфа по сравнению с сурфактантом БЛ. Возможность введения порактанта альфа в высокой дозе и в небольшом объеме делает его препаратом выбора при использовании стратегии LISA, когда сурфактант вводится с помощью катетера на фоне СРАР. Стратегии малоинвазивного применения препаратов сурфактантов (INSURE, LISA) позволяют уменьшить нежелательные эффекты механической вентиляции легких на новорожденных.
Детскую смертность (в возрасте до 5 лет) считают одним из ключевых демографических показателей общего состояния здоровья и уровня жизни населения страны или региона, а ее снижение относят к числу приоритетных задач здравоохранения. На долю новорожденных (в первые 28 дней жизни), особенно родившихся недоношенными, приходится 40% всех случаев смерти детей в возрасте до 5 лет. В 2010 г. недоношенными (т.е. до 37 недель гестации) в мире родились около 15 млн детей, из которых умерли более 1 млн [1]. Важную роль в структуре причин смерти недоношенных детей играет респираторный дистресссиндром новорожденных (РДСН). Если во время беременности не проводится профилактика глюкокортикостероидными гормонами, частота РДСН у новорожденных детей, родившихся на сроке гестации <30 недель и 30-34 недели, достигает 65% и 25%, соответственно. У недоношенных детей, родившихся на более поздних сроках гестации, частота РДСН не зависит от пренатальной профилактики и составляет менее 5% [2].
В 1929 году немеций физиолог Kurt von Neergaard, работавший в Швейцарии, показал, что легочный сурфактант снижает поверхностное натяжение альвеол и препятствует спадению альвеол во время выдоха [3], а несколько десятилетий спустя было установлено, что дефицит сурфактанта является непосредственной причиной развития РДСН [4]. Легочный сурфактант – это поверхностно активный липопротеидный комплекс, который синтезируется пневмоцитами II типа плода с 20-24-й недели внутриутробного развития и образует на поверхности альвеол тонкую пленку, снижающую поверхностное натяжение. Кроме того, сурфактант оказывает бактерицидное, иммуномодулирующее и мембраностабилизирующее действие. Главная функция сурфактанта опосредуется входящими в его состав фосфолипидами, прежде всего ди паль митоилфосфатидилхолином, в то время как сурфактантные белки (SP) необходимы для адсорбции и распределения фосфолипидов (SP-B и SP-C) или определяют защитные свойства сурфактанта (SP-A и SP-D) [5].
Эффективность экзогенного сурфактанта в лечении РДСН установлена в многочисленных клинических исследованиях [6]. Например, в систематизированном обзоре Cochrane в 2009 году были обобщены результаты 13 рандомизированных клинических исследований, в которых изучались нативные препараты сурфактанта (животного происхождения) у новорожденных с РДСН [7]. Лечение сурфактантом привело к значительному снижению риска смерти (на 32%), в том числе госпитальной (на 37%), и частоты развития бронхолегочной дисплазии или смерти в течение 28 дней (на 17%), а также риска других осложнений, включая пневмоторакс (на 57%) и интерстициальную эмфизему легких (на 55%).
При наличии симптомов РДСН недоношенным детям показано раннее введение сурфак танта, которое более эффективно, чем позднее его применение [8]. По данным мета-анализа 6 рандомизированных контролируемых исследований, раннее введение сурфактанта по сравнению с отложенным ассоциировалось с достоверным снижением риска смерти (на 16%) и хронического поражения легких (на 31%), а также снижением частоты острого повреждения легких, включая пневмоторакс и интерстициальную эмфизему легких, и тенденцией к снижению риска бронхолегочной дисплазии или смерти через 28 дней [9].
С целью дальнейшего улучшения результатов лечения РДСН в настоящее время разработаны менее инвазивные методы введения сурфактанта [10], например стратегия INSURE (intubation – surfactant – extubation), которая предполагает интубацию недоношенных детей, введение сурфактанта в трахею и после кратковременной вентиляции легких экстубацию и перевод больного на NСРАР (nasal continuous positive airway pressure – назальная вентиляция с постоянным положительным давлением в дыхательных путях). Применение этой стратегии позволяет избежать длительной механической вентиляции легких, которая оказывает повреждающее действие на легкие новорожденного. Недостаток метода – необходимость в интубации трахеи эндотрахеальной трубкой, которая может повредить гортань и трахею.
При использовании малоинвазивного метода применения сурфактанта (less invasive surfactant administration – LISA) ребенку, находящемуся на СРАР, препарат вводят под контролем прямой ларингоскопии через тонкий катетер болюсно в течение 5 минут. J. Aldana-Aguirre и соавт. провели мета-анализ 6 рандомизированных клинических исследований, в которых у 895 новорожденных сравнивали результаты LISA и введения сурфактанта через интубационную трубку [11]. При ме нение метода LISA сопровождалось достоверным снижением частоты комбинированной конечной точки, включавшей себя смерть или бронхолегочную дисплазию на 36-й неделе (относительный риск [ОР] 0,75; 95% доверительный интервал [ДИ] 0,59-0,94; p=0,01), а также необходимости в механической вентиляции легких в течение 72 ч после родов (ОР=0,71; 95% ДИ 0,530,96, p=0,02) и во время пребывания в отделении интенсивной терапии (ОР=0,66; 95% ДИ 0,47-0,93; p=0,02), хотя достоверной разницы смертности между группами сравнения не выявили.
Препараты сурфактанта
Выделяют синтетические и природные (нативные) сурфактанты. Синтетические сурфактанты, в частности колфосерил (Экзосурф), получают из фосфолипидов, которые также могут быть синтетическими или имеют природное происхождение. По эффективности синтетические препараты уступают природным [12], поэтому в настоящее время колфосерил не применяется. Природные препараты сурфактанта получают из лаважной жидкости или ткани легких свиней или телят или амниотической жидкости рожениц. В отличие от синтетических препаратов, они содержат различные фосфолипиды, а также сурфактантные белки, в частности SP-B и SP-C, которые частично опосредуют биофизические свойства сурфактанта. Природные препараты сурфактанта разделяют на модифицированные и немодицированные. Берактант (Сюрванта) выделяют из ткани легкого телят, бовактант (Альвеофакт) – из лаважной жидкости телят, а порактант альфа (Куросурф) – из легкого свиньи. Последний, в отличие от других природных сурфактантов, содержит только фосфолипиды и сурфактантные белки (SP-B и SP-C), так как в процессе модификации нейтральные липиды и холестерин удаляют при хроматографии. Благодаря этому порактант альфа характеризуется самой высокой концентрацией кислых фосфолипидов среди нативных препаратов сурфактанта. Это позволяет вводить порактант альфа в более эффективной высокой дозе (200 мг/кг) и в меньшем объеме, чем другие сурфактанты, что может привести к снижению риска блокады эндотрахеальной трубки и других нежелательных явлений. Кроме того, порактант альфа лучше всего подходит для неинвазивного применения, учитывая возможность введения большой дозы в малом объеме. Препарат оказывает быстрое действие и уменьшает фракцию вдыхаемого кислорода (FiO2) у новорожденных с РДСН в течение 5 минут. При этом он характеризуется более длительным интервалом дозирования по сравнению с берактантом (12 и 6 ч, соответственно), что нередко дает возможность ограничиться однократным введением дозы 200 мг/кг. В рандомизированном многоцентровом исследовании у 293 новорожденных с РДСН введение одной дозы сурфактанта оказалось достаточным, соответственно, у 73% и 50% детей, получавших порактант альфа и берактант (p<0,002) [13]. Порактант альфа вызывал более быстрое и выраженное снижение FiO2, разница которой между группами была статистически значимой во всех точках (p<0,05).
Сравнительный анализ эффективности различных препаратов сурфактанта
Различные природные препараты сурфактанта изу чались в рандомизированных клинических исследованиях, которые в 2015 г. были обобщены в систематизированном обзоре и мета-анализе, выполненном экспертами Cochrane [14]. В мета-анализ вклю чали клинические исследования, в которых изучалась эффективность профилактического и лечебного применения сурфактанта, соответственно, у недоношенных детей (менее 32 недель гестации) с угрозой развития РДСН и недоношенных детей (менее 37 недель гестации), у которых имелись клинические и рентгенологические признаки РДСН. Первичными конечными точками были неонатальная летальность (в возрасте до 28 дней), госпитальная летальность и хроническое поражение легких (необходимость в оксигенотерапии в возрасте 28-30 дней или постменструальном возрасте 36 недель). Кроме того, оценивали различные вторичные конечные точки, включая дозы сурфактанта, пневмоторакс, легочное кровотечение, открытый артериальный проток и др. В целом в мета-анализ были включены 16 рандомизированных клинических исследований.
Сравнение препаратов сурфактанта, выделенных из лаважной жидкости (калфактант или бовактант) или ткани легких (берактант или сурфактант ТА) телят. Эффективность различных препаратов бычьего сурфактанта сравнивали в 9 исследованиях (профилактика – 2, лечение – 7). Достоверной разницы частоты неблагоприятных исходов между группами сравнения выявлено не было, в частности риск смерти или развития хро нического поражения легких не отличался при при менении различных бычьих сурфактантов как с профилактической (относительный риск [ОР] 1,02; 95% доверительный интервал [ДИ] 0,89-1,17; n=1123), так и с лечебной целью (ОР 0,95; 95% ДИ 0,86-1,07; n=2009). Риск отдельных первичных и вторичных конечных точек также был сопоставимым при назначении препаратов сурфактанта, выделенных из лаважной жидкости или ткани легких телят.
Сравнение препаратов сурфактанта, выделенных из ткани легких телят (берактант или сурфактант ТА) или свиней (порактант альфа). Сравнительных исследований профилактической эффективности бычьего и свиного сурфактантов авторы не выявили, однако в 9 исследованиях сравнивали эффективность их лечебного применения у недоношенных детей с РДСН. В этих исследованиях введение берактанта ассоциировалось с более высоким риском госпитальной смертности (ОР 1,44, 95% ДИ 1,04-2,00; n=901, рис. 1), смерти или потребности в кислороде в постменструальном возрасте 36 недель (ОР 1,30, 95% ДИ 1,04-1,64; n=448) и открытого артериального протока, потребовавшего лечения (ОР 1,86, 95% ДИ 1,28-2,70). Вероятность введения более одной дозы препарата также была выше при применении бычьего сурфактанта (ОР 1,57, 95% ДИ 1,291,92). Частота других конечных точек достоверно не отличалась между группами сравнения. При анализе подгрупп, выделенных с учетом стартовой дозы сурфактанта, преимущества порактанта альфа перед берактантом были выявлены только у детей, которым свиной сурфактант вводили в более высокой стартовой дозе (>100 мг/кг). В этой выборке при применении берактанта отмечалось достоверное увеличение риска смерти перед выпиской (ОР 1,62, 95% ДИ 1,11-2,38) и смерти или потребности в кислороде в постменструальном возрасте 36 недель (ОР 1,39, 95% ДИ 1,08-1,79) по сравнению с таковым у детей, получавших порактант альфа.
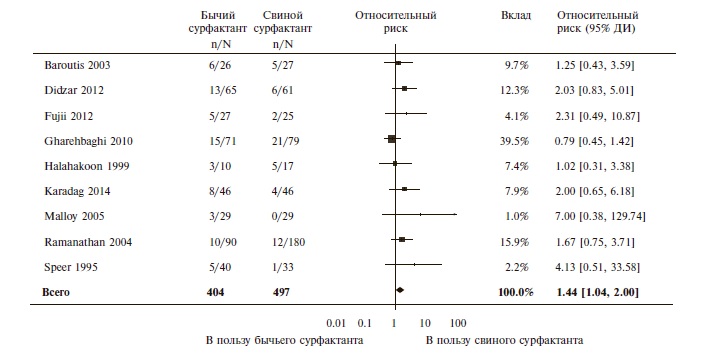
Таким образом, результаты мета-анализа показали, что препараты сурфактанта, выделенные из лаважной жидкости или ткани легких телят, достоверно не отличались по эффективности в лечении или профилактике РДСН у недоношенных новорожденных. В то же время лечебное введение порактанта альфа по сравнению с берактантом привело к достоверному снижению риска ряда неблагоприятных исходов, включая госпитальную смерть, смерть или потребность в кислороде в постменструальном возрасте 36 недель или открытый артериальный проток, потребовавший лечения. При применении порактанта альфа достоверно реже требовалось повторное введение сурфактанта. Преимущества порактанта альфа перед берактантом могли быть следствием различий биофизических или биохимических свойств сурфактантов или введения первого препарата в более высокой дозе. Подтвер ждением второй гипотезы был тот факт, что разница частоты неблагоприятных исходов между группами сравнения была выявлена только у детей, которым порактант альфа вводили в более высокой стартовой дозе (более 100 мг/кг). Кроме того, ранее было установлено, что порактант альфа в дозе 200 мг/кг дает более выраженный эффект, чем в дозе 100 мг/кг. Однако результаты мета-анализа не позволили исключить или подтвердить преимущества более низкой стартовой дозы порактанта альфа, так как выборка таких пациентов была небольшой. Следует отметить, что только порактант альфа может вводиться в дозе 200 мг/кг, в то время как однократные дозы других препаратов сурфактанта не превышают 100 мг/кг. Результаты настоящего систематизированного обзора согласуются с данными других авторов. Например, при мета-анализе 5 исследований, в которых сравнивали препараты сурфактанта разного происхождения у детей с РДСН, также было выявлено достоверное снижение госпитальной летальности при введении порактанта альфа в высокой дозе по сравнению с таковой при применении берактанта [15].
Российский опыт сравнения препаратов сурфактанта
В Российской Федерации среди природных препаратов сурфактанта разрешены для клинического применения порактант альфа (Куросурф; Кьези Фармацевтичи, Италия), бовактант (Альвеофакт; Лиомарк, Германия), берактант (Сюрванта; Эббви, США) и сурфактант БЛ (ООО Биосурф, Россия). Рекомендуемая стартовая доза порактанта альфа составляет 100-200 мг/кг, при этом доза 200 мг/кг по эффективности превосходит дозу 100 мг/кг. При необходимости препарат можно ввести повторно в дозе не менее 100 мг/кг. Рекомендуемая стандартная доза бовактанта – 50 мг/кг. При этом лечебная доза бовактанта 100 мг/кг превосходит по эффективности дозу 50 мг/кг. Рекомендуемая стартовая доза берактанта составляет 100 мг/кг, сурфактанта БЛ – 50-75 мг/кг. В дозе 200 мг/кг бовактант, берактант и сурфактант БЛ не изучались, а использование их в такой дозировке у недоношенных новорожденных проблематично из-за большого объема раствора.
В Российской Федерации рандомизированные контролируемые исследования различных препаратов сурфактанта не проводились. Крупные клинические исследования, посвященные изучению эффективности препарата Сурфактант БЛ, отсутствуют. В связи с этим эффективность препарата при лечении детей с РДСН остается на сегодняшний день малоизученной и сомнительной [2]. Опубликованы результаты ретроспективного анализа опыта применения порактанта альфа и сурфактанта БЛ для лечения РДСН у недоношенных детей [16]. Критериями включения в исследование были тяжелая степень РДСН (механическая вентиляция с фракцией ингаляционного кислорода FiO2≥0,6), масса тела новорожденного от 700 до 2000 г, срок гестации до 32 недель, постнатальный возраст 2-15 ч. Из исследования исключали детей со значительными врожденными аномалиями развития.
В исследование были включены 45 детей, которых распределили на три группы. Дети первой группы (n=18) получали терапию порактантом альфа, который вводили однократно болюсно в дозе около 100 мг/кг, отсоединяя пациента от контура аппарата. Возраст новорожденных на момент введения составлял 9,8±7,1 ч. Вторую группу составили новорожденные (n=13), получавшие отечественный сурфактант БЛ однократно в дозе в среднем 100 мг/кг в возрасте 12,0±6,2 ч. Инстилляция препарата производилась в течение 1,5-3 ч на фоне продолжающейся искусственной вентиляции легких (ИВЛ). Дети контрольной группы (n=14) не получали препараты сурфактанта. По основным клиническим показателям три группы были сопоставимы (табл. 1). Средняя масса тела при рождении во всех группах составляла около 1400 г, длина тела – около 39 см, срок гестации – 29 недель. Доля мальчиков и девочек была примерно одинаковой.
| Параметры | Порактант альфа
(n=18) |
Сурфактант БЛ
(n=13) |
Контроль
(n=14) |
|---|---|---|---|
| Мужской пол, n (%) | 9 (50,0) | 6 (46,2) | 6 (42,9) |
| Масса тела
при рождении, г |
1401,0±282,0 | 1400,3±305,5 | 1368,6±330,6 |
| Длина тела
при рождении, см |
39,7±2,7 | 39,8±3,1 | 38,9±4,4 |
| Срок гестации, недели | 29,5±2,0 | 29,5±2,4 | 29,4±2,2 |
| Индекс Апгар, баллы | |||
| 1-я минута | 5,3±1,6 | 5,6±2,0 | 5,2±1,3 |
| 5-я минута | 7,1±0,8 | 7,2±1,3 | 7,1±0,3 |
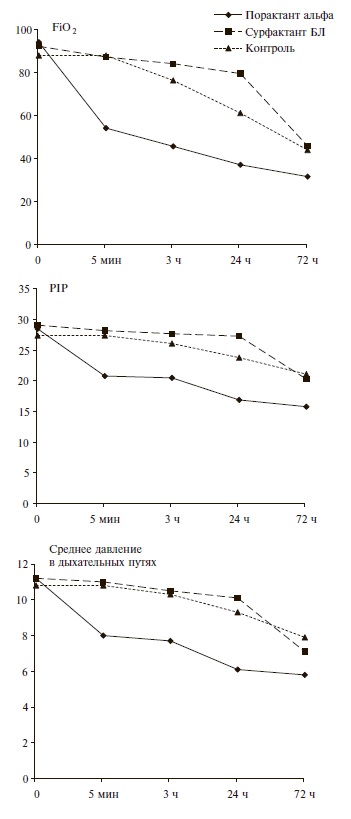
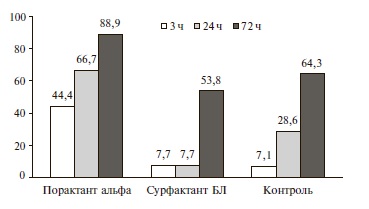
Исходные параметры ИВЛ в трех группах были практически одинаковыми и носили достаточно “жесткий” характер. Введение порактанта альфа уже через 5 мин привело к значительному снижению основных параметров ИВЛ, в том числе FiO2, давления на вдохе (PIP) и среднего давления в дыхательных путях, в то время как при применении сурфактанта БЛ их динамика была сопоставимой с таковой в контрольной группе (рис. 2). Например, FiO2 через 5 мин уменьшилась с 0,94 до 0,54 в группе порактанта альфа и с 0,92 до 0,87 в группе сурфактанта БЛ. Через 3 и 24 ч после введения порактанта альфа доля детей, у которых FiO2 составляла ≤0,4, увеличилась до 44,4% и 66,7%, соответственно, в то время как в группе сурфактанта БЛ в те же сроки их доля была значительно ниже – около 8% и фактически не отличалась от таковой в контрольной группе (рис. 3). Сходные результаты были получены и при изучении изменений среднего давления в дыхательных путях и инспираторного давления, которые также удавалось достаточно быстро снизить в первые сутки после введения порактанта альфа. Динамика этих параметров ИВЛ у новорожденных, получавших сурфактант БЛ, и детей контрольной группы достоверно не отличалась. При ме нение порактанта альфа привело к сокращению длительности ИВЛ, кислородной зависимости и сроков пребывания в палате интенсивной терапии по сравнению с таковыми в двух других группах (табл. 2).
Среди осложнений в настоящем исследовании чаще всего встречались пневмоторакс, пневмония, внутрижелудочковые кровоизлияния. Частота их в группе порактанта альфа была ниже, чем в группах сравнения, хотя разница достигла статистической значимости только для частоты внутрижелудочковых кровоизлияний между группами детей, получавших порактант альфа и не получавших препараты сурфактанта (табл. 2). Отсут ствие достоверной разницы частоты различных исходов между группами, вероятно, отражало небольшое число больных, включенных в исследование. Летальность в группе порактанта также была недостоверно ниже, чем в группе сурфактанта БЛ и контрольной группе.
| Параметры | Порактант
альфа (n=18) |
Сурфактант
БЛ (n=13) |
Контроль
(n=14) |
|---|---|---|---|
| Примечание: ПИТ - палата интенсивной терапии. Достоверные различия были выявлены только при сравнении частоты внутрижелудочковых кровоизлияий между группой порактанта альфа и контрольной группой (р<0,001) | |||
| ИВЛ, сут | 12,2±9,9 | 17,1±16,8 | 21,1±14,6 |
| Оксигенотерапия, сут | 20,4±15,0 | 27,3±20,6 | 35,4±40,7 |
| Койко-день в ПИТ | 15,8±10,2 | 20,5±19,4 | 23,0±14,5 |
| Осложнения*, n (%) | |||
| Пневмоторакс | 0 | 3 (23,1) | 2 (14,3) |
| Пневмония | 7 (38,9) | 7 (53,8) | 10 (71,4) |
| Внутрижелудочковые кровоизлияния | 2 (11,1) | 5 (38,5) | 10 (71,4) |
| Летальность, n (%) | 2 (11,1) | 5 (38,5) | 3 (21,4) |
Проведенное исследование имеет очевидные ограничения, в том числе ретроспективный дизайн и отсутствие рандомизации. Тем не менее, оно показало преимущество порактанта альфа перед сурфактантом БЛ и контролем по эффективности в лечении тяжелого РДСН у недоношенных детей, находившихся на ИВЛ. Введение порактанта альфа позволяло быстрее и эффективнее восстановить механику легких и сократить длительность ИВЛ и оксигенотерапии. Кроме того, применение порактанта альфа ассоциировалось с тенденцией к снижению частоты осложнений и летальности новорожденных. Для улучшения состояния новорожденных оказалось достаточным однократного введения порактанта альфа.
Заключение
Заместительное введение сурфактанта в сочетании с респираторной поддержкой остается основным методом лечения РДСН у недоношенных детей. Результаты систематизированного обзора и мета-анализа Cochrane свидетельствуют о том, что наибольшей эффективностью в лечении РДСН обладает сурфактант свиного происхождения – порактант альфа (Куросурф), который имел достоверные преимущества перед сурфак тантом бычьего происхождения – берактантом. В российском ретроспективном исследования была показана более высокая эффективность порактанта альфа по сравнению с сурфактантом БЛ. который получают из ткани легких телят. Следует отметить, что эффективность последнего в лечении РДСН сомнительная, так как в адекватных исследованиях этот препарат, в отличие от других сурфактантов, не изучался. Пора ктант альфа характеризуется самой высокой концентрацией кислых фосфолипидов, что позволяет вводить препарат в более эффективной дозе 200 мг/кг и в меньшем объеме, чем другие сурфактанты. Возмож ность введения порактанта альфа в небольшом объеме делает его препаратом выбора при использовании стратегии LISA, когда сурфактант вводится с помощью тонкого катетера на фоне СРАР. Стратегии малоинвазивного применения пре паратов сурфактантов (INSURE, LISA) позволяют уменьшить нежелательные эффекты механической вентиляции легких на новорожденных.
Используемые источники
- Blencowe H, Cousens S, Oestergaard MZ, et al. National, regional, and world-wide estimates of preterm birth rates in the year 2010 with time trends since 1990for selected countries: a systematic analysis and implications. Lancet 2012;379:2162-72.
- Российская ассоциация специалистов перинатальной медицины. Принципы ведения новорожденных с респираторным дистресс-синдромом.Методические рекомендации под ред. акад. РАМН Н.Н.Володина. Москва,2016, 1-24. [Russian Association of Perinatologists. Management of newbornswith respiratory distress syndrome. Ed. N.N.Volodin. Moscow, 2016, 1-24 (InRuss.)].
- Von Neergaard K. Neue auffassungen uber einen grundbegriff der atemmechanik.Die retraktionskraft der lunge, abhangig von der oberflachenspannung in den alve-olen. Z Gesamt Exp Med 1929;66:373–94.
- Avery ME, Mead J. Surface properties in relation to atelectasis and hyaline mem-brane disease. Am J Dis Child 1959;97:517–23.
- Parra E, Pérez-Gil J. Composition, structure and mechanical properties defineperformance of pulmonary surfactant membranes and films. Chem Phys Lipids2015; 185:153-75.
- Ионов О.В., Моисеев С.В. Фармакологические свойства препаратов сур-фактанта и их эффективность в лечении респираторного дистресс-синдромановорожденных. Клин фармакол тер 2015;24(5):81-5. [Ionov OV, Moiseev SV.Pharmacological properties of different surfactants and their efficacy in the treat-ment of respiratory distress syndrome in preterm infants. KlinicheskayaFarmacologia Terapia = Clinical Pharmacology and Therapy 2015;24(5):81-5 (InRuss.)].
- Seger N, Soll R. Animal derived surfactant extract for treatment of respiratory dis-tress syndrome. Cochrane Database Syst Rev 2009;2:CD007836.
- Sweeta D, Carnielli V, Greisenc G: et al. European consensus guidelines on themanagement of neonatal respiratory distress syndrome in preterm infants – 2010Update. Neonatology 2010;97:402–17.
- Bahadue FL, Soll R. Early versus delayed selective surfactant treatment forneonatal respiratory distress syndrome. Cochrane Database Syst Rev 2012;11:CD001456.
- Sardesai S, Biniwale M, Wertheimer F, et al. Evolution of surfactant therapy forrespiratory distress syndrome: past, present, and future. Pediatr Res 2017;81(1-2):240-8.
- Aldana-Aguirre JC, Pinto M, Featherstone RM, Kumar M. Less invasive surfac-tant administration versus intubation for surfactant delivery in preterm infants withrespiratory distress syndrome: a systematic review and meta-analysis. Arch DisChild Fetal Neonatal Ed 2017;102(1):F17-23.
- Ardell S, Pfister RH, Soll R. Animal derived surfactant extract versus protein freesynthetic surfactant for the prevention and treatment of respiratory distress syn-drome. Cochrane Database Syst Rev 2015;8:CD000144.
- Ramanathan R., Rasmussen M., Gerstmann D et al.; North American StudyGroup. A randomized, multicenter masked comparison trial of poractant alfa(Curosurf) versus beractant (Survanta) in the treatment of respiratory distress syn-drome in preterm infants. Am J Perinatol 2004;21:109-19.
- Singh N, Halliday HL, Stevens TP, et al. Comparison of animal-derived surfac-tants for the prevention and treatment of respiratory distress syndrome in preterminfants. Cochrane Database Syst Rev 2015;12:CD010249.
- Singh N, Hawley KL, Viswanathan K. Efficacy of porcine versus bovine surfac-tants for preterm newborns with respiratory distress syndrome: systematic reviewand metaanalysis. Pediatrics 2011;128(6):e1588–95.
- Карпова А.Л., Царева Т.В., Жерлицына Л.Г. и др. Опыт применения нату-рального сурфактанта в терапии респираторного дистресс-синдрома в г.Ярославле. Интенсивная терапия 2006;4. http://icj.ru/journal/number-4-2006/89-retrospektivnyy-analiz-lecheniya-nedonoshennyh-novorozhdennyh-kurosurfom-i-surfaktantom-bl.html. Karpova AL, Tsareva TV, Zherlytsina LG, etal. The use of natural surfactan for the treatment of respiratory distress syndromein Yaroslval. Intensivnaya terapia 2006;4 (In Russ.)].
