Тройная терапия двумя длительно действующими бронходилататорами и ингаляционным глюкокортикостероидом при ХОБЛ
Пациентам с тяжелым и очень тяжелым течением хронической обструктивной болезнилегких (ХОБЛ) и высоким риском обострений,не отвечающим на лечение двумя длительно действующими бронходилататорами или бронходилататором в комбинации сингаляционным глюкокортикостероидом (ИГКС), рекомендуется тройная терапия длительно действующим антихолинергическим препаратом (ДДАХ), длительно действующим b2-агонистом (ДДБА) и ИГКС. В рандомизированных клинических исследованиях тройная терапия вызывала достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ, уменьшение степени бронхиальной обструкции и улучшение качества жизни по сравнению со всеми другими схемами терапии. Приведены результаты нескольких крупных контролируемых исследований (TRILOGY, TRINITY, TRIBUTE), в которых были установлены эффективность и безопасность фиксированного комбинированного препарата, содержащего экстра мелкодисперсный беклометазона дипропионат, формотерола фумарат и гликопиррония бромид у больных ХОБЛ тяжелого и очень тяжелого течения.
Хроническая обструктивная болезнь легких (ХОБЛ) остается одной из ведущих причин заболеваемости и смертности во всем мире [1], причем в ближайшие десятилетия ожидается дальнейший рост распространенности этого заболевания за счет продолжающегося воздействия факторов риска и постарения населения [2]. По данным программы Burden of Obstructive Lung Diseases (BOLD) и других крупных эпидемиологических исследований, расчетное число случаев ХОБЛ в мире в 2010 году составило 384 млн, а распространенность – 11,7% [3]. Ежегодно от ХОБЛ умирают около 3 млн человек [4], а по прогнозу ВОЗ к 2030 году этот показатель может увеличиться до 4,5 млн человек [5]. В странах Европейского Союза и США прямые затраты системы здравоохранения, связанные с ХОБЛ, достигают 39 млрд евро и 32 млрд долларов, соответственно [6,7]. Основной причиной экономического бремени ХОБЛ являются обострения заболевания, доля которых в структуре общих затрат достигает 40-75% [8,9].
Обострения ХОБЛ
Обострение ХОБЛ характеризуется острым ухудшением респираторных симптомов, которое выходит за рамки их обычных колебаний и приводит к изменению проводимой терапии [10,11]. Выделяют легкие (могут быть купированы самим пациентом с помощью короткодействующих бронходилататоров), средне-тяжелые (необходимо лечение короткодействующими бронходилататорами и антибиотиками и/или пероральными глюкокортикостероидами) и тяжелые (требуется госпитализация или обращение за неот ложной помощью) обострения. Следует отметить, что существующие критерии диагностики обострения ХОБЛ неспецифичны, поэтому некоторые авторы, помимо нарастания одышки (на 5 и более по визуальной аналоговой шкале от 0 до 10), предлагают учитывать дополнительные признаки, такие как снижение сатурации кислородом по крайней мере на 4% по сравнению с исходной, повышение числа нейтрофилов (≥9000 в мм3) или эозинофилов (≥2%) в крови и концентрации С-реактивного белка (≥3 мг/л) при отсутствии признаков пневмонии или отека легких на рентгенограммах грудной клетки [12]. Частота и тяжесть обострений увеличиваются по мере прогрессирования ХОБЛ. Например, в проспективном исследовании ECLIPSE (n=2138) по крайней мере два средне-тяжелых или тяжелых обострения в течение первого года наблюдения отмечались у 22%, 33% и 47% пациентов со 2, 3 и 4 стадиями ХОБЛ, соответственно [13]. Самым надежным предиктором обострений была их частота в анамнезе.
Результаты некоторых исследований свидетельствуют о том, что эозинофилия крови может ассоциироваться с увеличением риска обострений ХОБЛ и позволяет предсказать эффективность ингаляционных глюкокортикостероидов (ИГКС) в их профилактике. Например, в датском исследовании более чем у 7000 пациентов с ХОБЛ увеличение числа эозинофилов в крови сопровождалось почти двукратным повышением риска тяжелых обострений заболевания [14]. При анализе post hoc результатов клинических исследований было показано, что более высокое число эозинофилов в крови сочеталось с увеличением частоты обострений у больных ХОБЛ, получавших длительно действующие агонисты b2-адренорецепторов (ДДБА), а эффективность комбинированной терапии ДДБА/ИГКС была выше у пациентов с эозинофилией крови [15,16]. В то же время в когортном исследовании SPIROMICS ассоциация между эозинофилией крови и частотой или тяжестью обострений ХОБЛ отсутствовала, однако эозинофилия мокроты позволяла выделить пациентов с более тяжелым течением заболевания, частыми обострениями и более выраженной эмфиземой [17]. S. Cheng провел мета-анализ 5 исследований в целом у 12496 пациентов со средне-тяжелой и тяжелой ХОБЛ, у 60% из которых число эозинофилов в крови составляло ≥2% [18]. У пациентов с эозинофилией крови лечение ИГКС привело к снижению частоты обострений ХОБЛ на 17% (р=0,03), но ассоциировалось с двукратным увеличением риска пневмонии. В целом имеющиеся данные свидетельствуют о том, что эозинофилия крови является перспективным биомаркером у больных ХОБЛ, хотя ее роль как предиктора ответа на ИГКС необходимо подтвердить в проспективных клинических исследованиях [19].
Повторные обострения ХОБЛ приводят к ухудшению показателей функции дыхания и газообмена, более быстрому прогрессированию заболевания, снижению качества жизни больных и увеличению смертности, поэтому профилактика обострений является одной из основных целей лечения [20].
Стратегия медикаментозной терапии ХОБЛ
В настоящее время нет убедительных доказательств того, что какие-либо лекарственные средства позволяют замедлить прогрессирующее снижение объема форсированного выдоха за 1 с (ОФВ1) или снижают смертность больных ХОБЛ, однако медикаментозная терапия уменьшает симптомы заболевания, снижает частоту и тяжесть обострений, улучшает толерантность к физи чес кой нагрузке и качество жизни [10,11]. Препаратами выбора в лечении ХОБЛ остаются ингаляционные бронходилататоры, в том числе ДДБА и длительно действующие антихолинергические препараты (ДДАХ). ИГКС при ХОБЛ назначают только в дополнение к терапии длительно действующими бронхолитиками. Теофиллин и рофлумиласт, ингибирующий фосфоди эс те разу-4 и обладающий противовоспалительной активностью, применяют относительно редко (при неэффективности стандартной терапии). Эффект ДДБА продолжается в течение 12 ч (формотерол, салметерол) или 24 ч (индакатерол, олодатерол, вилантерол). ДДАХ также оказывают действие в течение около 12 ч (аклидиний) или 24 ч (гликопирроний, тиотропий, умеклидиний).
В настоящее время широко используются ком би ни рованные ингаляционные препараты, в состав которых входят ДДБА/ИГКС или ДДБА/ДДАХ (табл. 1). Разработаны также тройные комбинированные препараты, содержащие ДДБА/ДДАХ/ИГКС, в том числе беклометазона дипропионат/формотерол/гликопир роний и вилантерол/флутиказона фуроат/умеклидиний (в Российской Федерации они пока не зарегистрированы). В состав первого, как и фиксированной ком би нации беклометазона дипропионата и формотерола, входит экстра мелко дис персный беклометазона дипропионат (средний аэродинамический диаметр частиц 1,1 мкм). Основные преимущества ингаляции частиц лекарственного вещества малого размера – увеличение их отложения в легких (30-35% против 10-20% при применении стандартных ингаляторов) и уменьшение депозиции в ротоглотке. Доза экстрамелкодисперсного ИГКС в составе препарата (100 мкг) в 2,5 раза ниже стандартной дозы в неэкстрамелкодисперсных препаратах (250 мкг). Результаты ряда исследований у пациентов с бронхиальной астмой подтверждают, что применение экстрамелкодисперсных аэрозолей позволяет улучшить доставку препарата в малые дыхательные пути и повысить эффективность лечения, а также снизить суточную дозу ИГКС [21,22].
| Группы | Препараты |
|---|---|
| Короткодействующие | Сальбутамол |
| β2-агонисты | Фенотерол |
| Длительно действующие | Вилантерол |
| β2-агонисты (ДДБА) | Индакатерол |
| Салметерол | |
| Олодатерол | |
| Формотерол | |
| Короткодействующие антихолинергические препараты (КДАХ) | Ипратропий |
| Длительно действующие | Аклидиний |
| антихолинергические препараты | Гликопирроний |
| Умеклидиний | |
| Ингаляционные | Беклометазона дипропионат |
| глюкокортикостероиды (ИГКС) | Будесонид |
| Мометазон | |
| Флутиказона пропионат | |
| Флутиказона фуроат | |
| Циклесонид | |
| Фиксированные комбинации | Гликопирроний/индакатерол |
| ДДАХ/ДДБА | Тиотропий/олодатерол |
| Умеклидиний/вилантерол | |
| Аклидиния бромид/формотерол | |
| Фиксированные комбинации | Беклометазона |
| ИГКС/ДДБА | дипропионат/формотерол |
| Будесонид/формотерол | |
| Флутиказона пропионат/ | |
| салметерол | |
| Флутиказона пропионат/ вилантерол | |
| Фиксированные комбинации | Беклометазона дипропионат/ |
| ИГКС/ДДБА/ДДАХ | формотерол/гликопирроний |
| Вилантерол/флутиказона | |
| фуроат/умеклидиний | |
| Ингибиторы фосфодиэстеразы-4 | Рофлумиласт |
| Другие | Теофиллин |
Лечение стабильной ХОБЛ обычно начинают с монотерапии бронходилататором длительного действия (ДДАХ или ДДБА). В двух прямых сравнительных исследованиях ДДАХ превосходил ДДАБ по эффективности в профилактике обострений ХОБЛ [23,24], поэтому в рекомендациях GOLD 2019 года у пациентов с высоким риском обострений (группа С) предпочтение отдается препаратам первой группы [10]. При наличии выраженных симптомов и повторных обострений (по крайней мере 2 среднетяжелых обострения в течение 1 года или хотя бы 1 тяжелое обострение, потребовавшее госпитализации) (группа D) возможна стартовая комбинированная терапия ДДАХ/ДДБА [10]. У пациентов с ХОБЛ, сочетающейся с бронхиальной астмой, обоснована комбинированная терапия ДДБА/ИГКС. Доводом в пользу применения ИГКС в составе двойной терапии может также служить высокое число эозинофилов крови. При недостаточной эффективности ДДБА/ ДДАХ или ДДБА/ИГКС рекомендуется тройная терапия двумя длительно действующими бронходилататорами и ИГКС, которая может проводиться с использованием фиксированной комбинации ДДАХ/ ДДБА и отдельного ингалятора ИГКС или фиксированной комбинации ДДБА/ИГКС и отдельного ингалятора ДДАХ. Как указано выше, разработаны также фиксированные комбинация всех трех препаратов.
Эффективность и безопасность тройной комбинированной терапии у пациентов с ХОБЛ
В последние годы опубликованы результаты крупных контролируемых клинических исследований, которые подтвердили преимущества тройной комбинированной терапии экстрамелкодисперсным беклометазона дипропионатом/формотерола фумаратом/гликопиррония бро мидом (БДП/ФФ/ГБ) перед другими схемами лечения у пациентов с ХОБЛ тяжелого и очень тяжелого течения.
TRILOGY. Целью двойного слепого, рандомизированного контролируемого исследования TRILOGY было сравнение эффективности и безопасности фиксированной комбинации БДП/ФФ/ГБ и фиксированной комбинации БДП/ФФ у 1368 пациентов с ХОБЛ, у которых отмечались тяжелая бронхиальная обструкция (ОФВ1 после ингаляции бронходилататора <50%), выраженные симптомы и по крайней мере одно среднетяжелое или тяжелое обострение ХОБЛ за предыдущий год несмотря на лечение различными бронходила таторами ± ИГКС [25]. До исследования более 70% пациентов получали ИГКС/ДДБА. Пациентов рандомизировали на две группы (1:1) и в течение 52 недель проводили терапию БДП/ФФ/ГБ или БДП/ФФ два раза в день, на фоне которой оценивали динамику бронхиальной обструкции (ОФВ1 до и через 2 ч после ингаляции), выраженности одышки, качества жизни (вопросник SGRQ) и частоты обострений ХОБЛ. Через 26 недель тройная терапия по сравнению с двойной привела к значительному увеличению ОФВ1 до ингаляции (средняя разница между двумя группами – 0,081 л, 95% доверительный интервал [ДИ] 0,052-0,109; p<0,001) и через 2 ч после ингаляции (средняя разница – 0,117 л, 95% ДИ 0,086-0,147, p<0,001) (рис. 1). Достигнутый эффект сохранялся до конца исследования. Как через 26 недель, так и 52 недели доля пациентов, у которых ОФВ1 увеличился по крайней мере на 100 мл, в основной группе почти в два раза превышала таковую в группе сравнения (p<0,001). Выраженность одышки уменьшилась в обеих группах в сопоставимой степени. Достоверное преимущество БДП/ФФ/ГБ перед БДП/ ФФ (p<0,01) было отмечено только при первых двух визитах (4 и 12 недель). Клинически значимое уменьшение одышки наблюдалось более чем у половины больных в двух группах, а через 26 недель вероятность ответа на лечение была выше при проведении тройной комбинированной терапии (отношение шансов 1,28, р=0,027). Терапия БДП/ФФ/ГБ привела к более значительному улучшению качества жизни, которое оценивали с помощью суммарного индекса SGRQ, а также к достоверному увеличению доли пациентов, у которых указанный индекс снизился по крайней мере на 4 балла. Кроме того, у больных, получавших тройную фиксированную комбинацию, было отмечено достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ на 23% (р=0,005) и увеличение времени до первого обострения (р=0,020). Как и следовало ожидать, более выраженное снижение частоты обострений (на 33%) при лечении БДП/ФФ/ГБ по сравнению с БДП/ФФ наблюдалось у пациентов, перенесших по крайней мере два обострения ХОБЛ в течение предыдущего года.
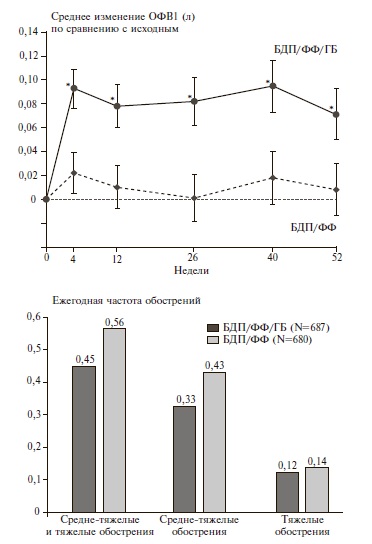
Переносимость двух схем терапии была сопоставимой, а частота пневмонии была низкой (3%) и не отличалась между двумя группами. Таким образом, у больных с ХОБЛ тяжелого или очень тяжелого течения и высоким риском обострений комбинированная терапия БДП/ФФ/ГБ достоверно превосходила терапию БДП/ФФ по бронходилатирующему действию, влиянию на качество жизни и эффективности в профилактике средне-тяжелых и тяжелых обострений и не отличалась по безопасности. Резуль таты исследования TRILOGY обосновывают присоединение ДДАХ к терапии ИГКС/ДДБА в случае недостаточной эффективности последней.
TRINITY. В двойном слепом, рандомизированном клиническом исследовании TRINITY были сопоставлены эффективность и безопасность фиксированной комбинации БДП/ФФ/ГБ, монотерапии длительно действующим ДДАХ тиотропием и комбинации БДП/ФФ с тиотропием у 2691 пациента с ХОБЛ [26]. В исследование включали пациентов с выраженными бронхиальной обструкцией (ОФВ1 после ингаляции бронходилататора <50%) и симптомами, перенесших по крайней мере одно средне-тяжелое или тяжелое обострение ХОБЛ в течение предыдущего года несмотря на лечение бронходилататорами ± ИГКС. Более 70% пациентов до включения в исследование получали комбинированную терапию ИГКС/ДДБА. Больных рандомизировали на три группы в соотношении 2:2:1 и в течение 52 недель проводили терапию БДП/ФФ/ГБ (n=1078), тиотропием (n=1075) или БДП/ФФ и тиотропием (n=538). Третья группа была выделена для того, чтобы доказать по крайней мере сопоставимую эффективность фиксированной комбинации трех препаратов и “свободной” комбинации БДП/ФФ и ДДАХ. Первич ной конечной точкой служила частота обострений ХОБЛ.
Частота средне-тяжелых и тяжелых обострений ХОБЛ при тройной комбинированной терапии БДП/ ФФ/ГБ достоверно снизилась по сравнению с таковой при лечении тиотропием на 20% (р=0,0025) и существенно не отличалась от частоты обострений при лечении БДП/ФФ и тиотропием. Достоверное улучшение результатов лечения при применении БДП/ФФ/ГБ было отмечено при анализе частоты как средне-тяжелых, так и тяжелых обострений ХОБЛ (снижение частоты на 16% и 32%, соответственно) (рис. 2). В выборке больных с числом эозинофилов в крови ≥2% тройная терапия БДП/ФФ/ГБ привела к снижению частоты обострений ХОБЛ на 30% по сравнению с тиотропием (отношение рисков 0,70, 95% ДИ 0,58-0,85), в то время как у пациентов с числом эозинофилов в крови <2% преимущество тройной терапии перед монотерапией тиотропием было менее значительным (отношение рисков 0,93, 95% ДИ 0,75-1,17). Фиксированная тройная комбинация превосходила свободную комбинацию трех препаратов по эффективности в профилактике обострений только в выборке пациентов, перенесших более одного обострения ХОБЛ в течение предыдущего года (отношение рисков 0,71, 95% ДИ 0,51-1,00). Лечение БДП/ФФ/ГБ вызывало также значительное увеличение времени до первого средне-тяжелого и тяжелого обострения ХОБЛ по сравнению с монотерапией тиотропием (отношение рисков 0,70, 95% ДИ 0,52–0,95, p=0,0208).
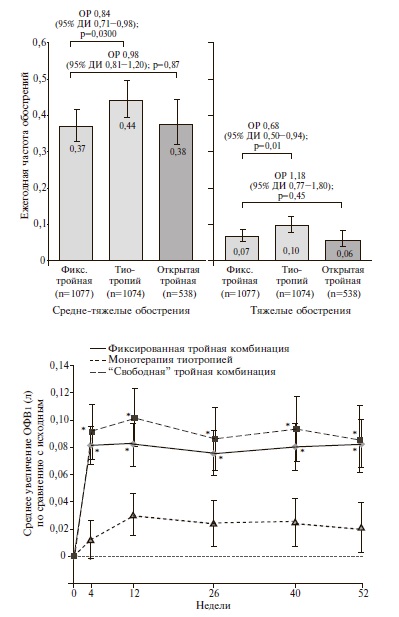
При лечении фиксированной комбинацией БДП/ ФФ/ГБ через 52 недели было выявлено достоверное увеличение ОФВ1 до ингаляции бронходилататора в среднем на 0,061 л по сравнению с монотерапией тиотропием (p<0,0001; рис. 2). Динамика степени бронхиальной обструкции не зависела от числа эозинофилов в крови. Как через 26 недель, так и 52 недели вероятность ответа на лечение (увеличение ОФВ1 по крайней мере на 100 мл по сравнению с исходным) в группе пациентов, получавших БДП/ФФ/ГБ, была достоверно выше, чем в группе тиотропия (отношение шансов 1,61 и 1,62, соответственно; p<0,0001).
Сходные результаты были получены при анализе динамики качества жизни, которое оценивали с помощью суммарного индекса SGRQ. Фиксированная тройная комбинированная терапия сопровождалась достоверным улучшением этого показателя по сравнению с монотерапией тиотропием во всех точках исследования (за исключением недели 26). При этом доля пациентов, у которых наблюдалось клинически значимое снижение индекса SGRQ (≥4 баллов), при тройной терапии достоверно превышала таковую при монотерапии ДДАХ как через 26 недель (р=0,0024), так и 52 недели (р=0,0019). В то же время две схемы тройной терапии существенно не отличались друг от друга по бронходилатирующей эффективности и влиянию на качество жизни.
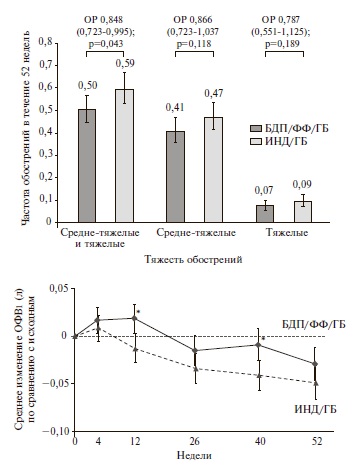
Частота нежелательных явлений (в основном легких или средне-тяжелых) была сопоставимой в трех группах. Как и в исследовании TRILOGY, пневмония на фоне тройной терапии развивалась редко (2%), а частота ее была сопоставимой с таковой в группах сравнения (1-2%).
Таким образом, результаты исследования TRINITY показали, что тройная комбинация двух бронходилататоров и ИГКС имеет достоверные преимущества перед монотерапией ДДАХ по эффективности в профилактике средне-тяжелых и тяжелых обострений ХОБЛ, бронходилатирующей активности и влиянию на качество жизни. Более значительного преимущества тройной терапии по эффективности в профилактике обострений можно ожидать у пациентов с числом эозинофилов в крови ≥2%. Кроме того, полученные данные свидетельствовали о том, что переход с монотерапии тиотропием на комбинацию трех препаратов не приводит к ухудшению безопасности лечения, в частности увеличению риска развития пневмонии.
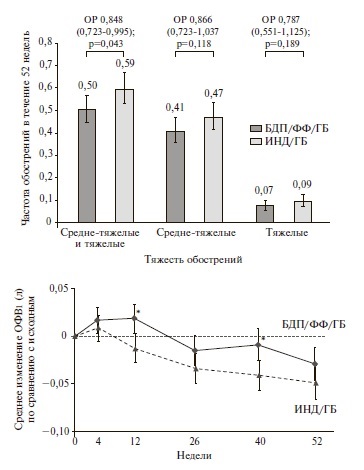
TRIBUTE. В двойном слепом, рандомизированном исследовании TRIBUTE были сопоставлены эффективность и безопасность терапии БДП/ФФ/ГБ и фиксированной двойной терапии индакатеролом (ИНД)/ГБ у 1532 пациентов с ХОБЛ тяжелого или очень тяжелого течения, перенесших по крайней мере одно среднетяжелое или тяжелое обострение в течение предыдущего года несмотря на ингаляционную терапию [27]. Комбинация ИНД/ГБ была выбрана в качестве препарата сравнения, так как в предыдущих исследованиях она по эффективности превосходила монотерапию ДДАХ или комбинированную терапию ИГКС/ДДБА [28,29]. Длительность исследования составила 52 недели. Скорректированная частота средне-тяжелых и тяжелых обострений в группах БДП/ФФ/ГБ и ИНД/ГБ равнялась 0,50 и 0,59 на пациента в год, соответственно. Снижение частоты обострений при тройной терапии составило 15% (отношение рисков 0,848, 95% ДИ 0,723–0,995; p=0,043). Тройная терапия привела к снижению частоты средне-тяжелых и тяжелых обострений на 13% и 21%, соответственно, хотя разница между группами не достигла статистической значимости (рис.3). Наиболее выраженное снижение частоты обострений (на 25%) было отмечено у пациентов с хроническим бронхитом, в то время как у пациентов с преобладающей эмфиземой или эмфиземой/бронхитом тройная терапия не имела существенных преимуществ перед ИНД/ГБ. Кроме того, лечение БДП/ФФ/ГБ вызывало достоверное снижение частоты обострений (на 19%) у пациентов с числом эозинофилов в крови ≥2%.
В обеих группах после недели 12 было отмечено снижение ОФВ1, однако негативная динамика этого показателя была менее выраженной на фоне тройной терапии. Кроме того, терапия БДП/ФФ/ГБ привела к достоверному улучшению среднего индекса SGRQ при всех визитах, хотя доля пациентов, у которых отмечалось клинически значимое улучшение качества жизни, достоверно не отличалась между двумя группами.
Частота нежелательных явлений, которые в основном были легкими или средне-тяжелыми, оказалась сопоставимой в двух группах. Частота пневмонии также была одинаковой (4%).
Таким образом, в исследовании TRIBUTE тройная терапия БДП/ФФ/ГБ вызывала достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ по сравнению с двойной терапией ДДАХ/ДДБА и не сопровождалась увеличением риска нежелательных явлений, в том числе пневмонии. Полученные данные свидетельствуют о том, что присоединение ИГКС к терапии двумя ингаляционными бронходилататорами позволяет улучшить результаты лечения у пациентов с тяжелой или очень тяжелой ХОБЛ, особенно при наличии хронического бронхита или повышенного числа эозинофилов в крови (≥2%).
Мета-анализ. Y. Zheng и соавт. провели мета-анализ 21 рандомизированного контролируемого исследования длительностью от 8 до 52 недель, в которых сравнивали эффективность и безопасность тройной терапии и других схем терапии у больных с ХОБЛ [30]. Тройная терапия двумя бронходилататорами и ИГКС привела к достоверному снижению частоты средне-тяжелых и тяжелых обострений ХОБЛ по сравнению с монотерапией ДДАХ (отношение рисков 0,71, 95% ДИ 0,600,95), комбинированной терапией ДДАХ/ДДБА (относительный риск 0,78, 95% ДИ 0,70-0,88) и ИГКС/ ДДБА (относительный риск 0,77, 95% ДИ 0,66-0,91). Кроме того, тройная терапия по сравнению с другими схемами терапии вызывала достоверное уменьшение степени бронхиальной обструкции и улучшение качества жизни. Достоверной разницы смертности между группами сравнения выявлено не было. Профиль безопасности тройной терапии был благоприятным. Риск пневмонии при тройной терапии увеличился в клинических исследованиях, в которых ее сравнивали с комбинированной терапии ДДАХ и ДДБА (относительный риск 1,53, 95% ДИ 1,25-1,87), в то время как в других исследованиях риск развития пневмонии был сопоставимым в группах сравнения.
Место тройной терапии в рекомендациях GOLD2019 года
В рекомендациях GOLD 2019 года выделен специальный раздел, посвященный тройной терапии, в котором указано, что она позволяет улучшить функцию легких и исходы, регистрируемые пациентами, в частности снизить риск обострений, по сравнению с монотерапией ДДАХ или комбинированной терапией ДДБА/ДДАХ [10]. Возможные алгоритмы перехода на тройную терапию при неэффективности терапии двумя препаратами изображены на (рис. 4.)
Заключение
В рекомендациях GOLD 2019 года пациентам с тяжелым и очень тяжелым течением ХОБЛ и высоким риском обострений, не отвечающим на лечение двумя длительно действующими бронходилататорами или бронходилататором в комбинации с ИГКС, предлагается назначать тройную терапию ДДАХ, ДДБА и ИГКС. Результаты рандомизированных клинических исследований и их мета-анализа показали, что тройная терапия приводит к достоверному снижению частоты среднетяжелых и тяжелых обострений ХОБЛ, степени бронхиальной обструкции и улучшению качества жизни по сравнению со всеми другими схемами терапии. Более выраженного снижения частоты обострений при присоединении ИГКС к двум длительно действующим бронходилататорами, по-видимому, можно ожидать у пациентов с числом эозинофилов в крови ≥2%. Перспективным представляется применение фиксированных комбинированных препаратов, таких как экстрамелкодисперсный БДП/ФФ/ГБ, эффективность которого была доказана в нескольких крупных контролируемых исследованиях (TRILOGY, TRINITY, TRI BUTE). Включение ИГКС в схему терапии может ассоциироваться с увеличением риска развития пневмонии, хотя при применении БДП/ФФ/ГБ не было отмечено повышения частоты этого нежелательного явления, в том числе по сравнению с комбинированной терапией ДДАХ/ДДБА или монотерапией ДДАХ.
Используемые источники
- Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for theGlobal Burden of Disease Study 2010. Lancet 2012;380:2095-128.
- Mathers CD, Loncar D. Projections of global mortality and burden of diseasefrom 2002 to 2030. PloS Med 2006;3(11):e442.
- Adeloye D, Chua S, Lee C, et al. Global and regional estimates of COPD preva-lence: Systematic review and meta-analysis. J Global Health 2015;5(2):020415.
- Global Burden of Disease Study Collaborators. Global, regional, and nationalage-sex specific all-cause and cause-specific mortality for 240 causes of death,1990-2013: a systematic analysis for the Global Burden of Disease Study 2013.Lancet 2015;385:117-71.
- World Health Organization. Projections of mortality and causes of death, 2015and 2030. http://www.who.int/healthinfo/globalburdendisease/projections/en/.
- American Thoracic Society Foundation. The Global Burden of Lung Disease.2014. http://foundation.thoracic.org/news/global-burden.php.
- Guarascio AJ, Ray SM, Finch CK, Self TH. The clinical and economic burden ofchronic obstructive pulmonary disease in the USA. CEOR 2013;5:235-45.
- Hilleman D, Dewan N, Malesker M, Friedman M. Pharmacoeconomic evalua-tion of COPD. Chest 2000;118(5):1278–85.
- Teo W, Tan WS, Chong W, et al. Economic burden of chronic obstructive pul-monary disease. Respirology 2012;17(1):120–6.
- Global Strategy for the Diagnosis, Management, and Prevention of ChronicObstructive Pulmonary Disease. 2019 Report. https://goldcopd.org/wp-content/uploads/2018/11/GOLD-2019-v1.7-FINAL-14Nov2018-WMS.pdf.
- Российское респираторное общество. Хроническая обструктивная болезньлегких. Клинические рекомендации, 2016.
- Kim V, Aaron SD. What is a COPD exacerbation? Current definitions, pitfalls,challenges and opportunities for improvement. Eur Respir J 2018;52(5). pii:1801261.
- Hurst JR, Vestbo J, Anzueto A, et al; Evaluation of COPD Longitudinally toIdentify Predictive Surrogate Endpoints (ECLIPSE) Investigators. Susceptibilityto exacerbation in chronic obstructive pulmonary disease. N Engl J Med2010;363(12):1128-38.
- Vedel-Krogh S, Nielsen SF, Lange P, et al. Blood eosinophils and exacerbationsin chronic obstructive pulmonary disease. The Copenhagen General PopulationStudy. Am J Respir Crit Care Med 2016;193(9):965-74.
- Pascoe S, Locantore N, Dransfield M, et al. Blood eosiophil counts, exacerba-tions, and response to the addition of inhaled fluticasone furoate to vilanterol inpa tients with chronicobstructive pulmonary disease: a secondary analysis of datafrom two parrallel randomised controlled trials. Lancet Respir Med 2015;3:435-42.
- Siddiqui SH, Guasconi A, Vestbo J, et al. Blood eosinophils: a biomarker ofresponse to extrafine beclomethasone/formoterol in chronic obstructive pul-monary disease. Am J Respir Crit Care Med 2015;192(4):523-5.
- Hastie AT, Martinez FJ, Curtis JL, et al. Association of sputum and bloodeosinophil concentrations with clinical measures of COPD severity: an analysis ofthe SPIROMICS cohort. Lancet Respir Med 2017;5(12):956-67.
- Cheng SL. Blood eosinophils and inhaled corticosteroids in patients with COPD:systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis2018;13:2775-84.
- Brusselle G, Pavord ID, Landis S, et al. Blood eosinophil levels as a biomarker inCOPD. Respir Med 2018;138:21-31.
- Halpin DM, Decramer M, Celli B, et al. Exacerbation frequency and course ofCOPD. Int J Chron Obstruct Pulmon Dis 2012;7:653–61.
- Моисеев С.В. Поражение малых дыхательных путей при бронхиальнойастме. Клин фармакол тер 2012;21(5):5-10.
- Княжеская Н.П., Черняк А.В. Бронхиальная астма и малые дыхательныепути. Роль экстрамелкодисперсной фиксированной комбинации в противо-воспалительной терапии. Consilium Medicum, Болезни органов дыхания,2011:22-27.
- Vogelmeier C, Hederer B, Glaab T, et al. Tiotropium versus salmeterol for theprevention of exacerbations of COPD. N Engl J Med 2011;364(12):1093-103.
- Decramer ML, Chapman KR, Dahl R, et al. Once-daily indacaterol versustiotropium for patients with severe chronic obstructive pulmonary disease(INVIGORATE): a randomised, blinded, parallel-group study. Lancet RespirМed 2013;1(7):524-33.
- Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaledcorticosteroid plus long-acting β2-agonist therapy for chronic obstructive pul-monary disease (TRILOGY): a double-blind, parallel group, randomised con-trolled trial. Lancet 2016;388:963–73.
- Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versuslong-acting muscarinic antagonist therapy for chronic obstructive pulmonary dis-ease (TRINITY): a double-blind, parallel group, randomised controlled trial.Lancet 2017;389:1919–29.
- Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dualbronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): adouble-blind, parallel group, randomised controlled trial. Lancet 2018;391(10125):1076-84.
- Wedzicha JA, Banerji D, Chapman KR, et al. Indacaterol-glycopyrronium versussalmeterol-fluticasone for COPD. N Engl J Med 2016;374:2222–34.
- Wedzicha JA, Decramer M, Ficker JH, et al. Analysis of chronic obstructive pul-monary disease exacerbations with the dual bronchodilator QVA149 comparedwith glycopyrronium and tiotropium (SPARK): a randomised, double-blind, par-allel-group study. Lancet Respir Med 2013;1:199–209.
- Zheng Y, Zhu J, Liu Y, et al. Triple therapy in the management of chronicobstructive pulmonary disease: systematic review and meta-analysis. BMJ2018;363:k4388.
