Пневмококковый менингит: современные аспекты диагностики и лечения
Бактериальный менингит характеризуется высокими показателями летальности и инвалидизации. Streptococcus pneumoniae является одним из самых частых возбудителем гнойного менингита у детей и взрослых. Раннее назначение антимикробной терапии улучшает результаты лечения бактериального менингита, но эффективность антибиотикотерапии снижается в связи с формированием лекарственной устойчивости микроорганизмов. В качестве адъювантных средств применяют глюкокортикостероиды, обладающие противовоспалительными свойствами, хотя пользу их применения признают не все исследователи. В настоящее время активно изучаются новые направления в лечении бактериальных менингитов, такие как нейропротективная терапия. В обзоре литературы обсуждаются эпидемиологические аспекты заболевания, методы диагностики бактериального менингита, выбор этиотропной антибактериальной терапии с учетом чувствительности возбудителей и роль существующих и новых вспомогательных методов лечения.
Бактериальный гнойный менингит (БГМ) – это группа заболеваний, ха рак теризующихся развитием воспалительного процесса в мягких мозговых оболочках в ответ на инвазию различных бактериальных агентов и имеющих общие патоморфологические и клинические проявления. БГМ представляет собой острую нейроинфекцию, проявляющуюся повышением температуры тела, интоксикацией, симптомами повышения внутричерепного давления (головная боль, рвота) и раздражения мозговых оболочек (менингеальные симптомы). БГМ представляет собой одну из наиболее тяжелых форм инфекционной патологии и отличается высокой летальностью и развитием грубых остаточных неврологических нарушений в психоэмоциональных и двигательных сферах.
После введения в практику вакцинации от менингококковой, пневмококковой и гемофильной инфекций заболеваемость БГМ несколько снизилась и в настоящее вре мя составляет 2-10 случаев на 100 000 населения [1]. Однако смертность от БГМ существенно не изменилась за последние 20 лет и находится в диапазоне от 15% до 25% в развитых странах и достигает 54-70% в странах с ограниченными ресурсами здравоохранения. У многих выживших пациентов сохраняются серьезные остаточные неврологические и психические расстройства, которые нередко служат причиной инвалидизации (5-40% случаев) [2-6].
Эпидемиология
Данные об эпидемиологии БГМ приведены в табл. 1 и 2 [7]. Среди возбудителей БГМ преобладает Streptococcus pneumoniae, который занимает первое место в этиологии у взрослых и второе – у детей. Именно пневмококк вызывает развитие БГМ у людей трудоспособного возраста, поэтому пневмококковый менингит остается тяжелым бременем для здравоохранения. S. pneumoniae, устойчивый к пенициллину и цефалоспоринам третьего поколения, представляет собой растущую проблему для Европы, хотя чувствительность патогена к антибиотикам варьируется в широких пределах в разных странах. По данным Европей ского центра профилактики и контроля заболеваемости, в 2011 г. доля штаммов, устойчивых к пенициллину, в Нидерландах, Англии, Дании и Германии составляла менее 1%, а в Испа нии, Франции и Румынии – 20-50% [3].
| Возбудители | Число случаев
на 100 000 населения |
Доля от всех случаев менингита, % |
Летальность, % |
|---|---|---|---|
| S. agalactiae | 0,25 | 5 | - |
| L. monocytogenes | 0,05 | 8 | 15-29 |
| S. pneumoniae | 0,81 | 61 | 19-26 |
| N. meninigitidis | 0,19 | - | 3-13 |
| H. influenzae | 0,08 | 7 | 3-6 |
| Другая грамотрицательная флора | - | - | 7-27 |
| Возбудители | Дети до 3 мес | Дети и взрослые | Взрослые (>50 лет) |
|---|---|---|---|
| S. agalactiae | +++ | - | - |
| E. coli | ++ | - | - |
| L. monocytogenes | + | - | + |
| S. pneumoniae | - | +++ | +++ |
| H. influenzae | - | редко | - |
| Другая грамотрицательная флора | - | - | + |
Патогенез
Выделяют первичный и вторичный менингит. Пер вичный менингит возникает у здоровых людей, в то время как вторичный менингит развивается при распространении гнойного процесса в организме (отит, синусит, мастоидит) или инфицировании мягких мозговых оболочек в результате открытых травм головного мозга. Входными воротами инфекции при первичном БГМ является эпителий верхних дыхательных путей, поверхность которого, как правило, колонизирована различными микроорганизмами. Менингит часто развивается после перенесенной ОРВИ. В результате гибели бактерий происходит выброс микробных токсинов, которые вызывают "цитокиновый взрыв" с последующим формированием системной воспалительной реакции. Повышается проницаемость гематоэнцефалического барьера и становится возможным попадание микроорганизмов в ЦНС. Бактерии проникают в субарахноидальное пространство и активно размножаются. К тому же в спинномозговой жидкости (СМЖ) практически полностью отсутствуют механизмы противоинфекционной защиты. В табл. 3 представлены основные звенья патогенеза БГМ [7,8].
| Стадии инфекционного процесса | Факторы защиты хозяина | Факторы бактериальной патогенности |
|---|---|---|
| Колонизация слизистой оболочки | Торможение выработки секреторного IgA, антител к капсулам бактерий | Фимбрии, полисахаридная капсула, протеазы |
| Проникновение в кровоток | Плотные межэпителиальные соединения | Прорыв межэпителиальных соединений с помощью эндоцитоза |
| Бактериемия | Нейтрофильный фагоцитоз, система комплемента, выработка специфических антител | Полисахаридная капсула |
| Проникновение через ГЭБ | ГЭБ | Фимбрии, поверхностный протеин OmpA, рецептор PAF (фактора активации тромбоцитов), |
| Проникновение в субарахноидальное пространство | Воспаление мозговых оболочек/слабая активация системы комплемента, лейкоциты СМЖ | Полисахаридная капсула |
| Воспаление в субарахноидальном пространстве | Образование воспалительных цитокинов и хемокинов (ИЛ-1, ФНО, фактор активации тромбоцитов), отек мозга, повышение проницаемости ГЭБ | Пептидогликан для грамположительных бактерий, липо-олигосахариды для грамотрицательных бактерий |
| Повышенная проницаемость ГЭБ | Воспалительные цитокины | Липо-олигосахариды |
Токсины бактерий активируют выработку противовоспалительных цитокинов эндотелием мозговых капилляров. В ответ на воспалительный процесс происходит прогрессирование внутричерепной гипертензии, нарушается кровоток и метаболизм головного мозга. Для гнойного менингита характерна гипер продукция и гипорезорбция СМЖ. Возникает гипернатриемия вследствие повышенной секреции антидиуретического гормона. В результате нарушения секреции и резорбции ликвора нарастает внутричерепная гипертензия и развивается отек мозга. В ткани головного мозга происходят гипоксически-ишемические процессы, активируется анаэробный гликолиз, развивается гипогликемия и лактатацидоз. Образование свободных радикалов и продуктов оксида азота, накопление глутамата приводят к апоптозу и гибели нейронов, а паренхиматозное повреждение мозга проявляется разнообразными двигательными, сенсорными и когнитивными нарушениями [9].
Лабораторная и инструментальная диагностика
В настоящее время в Российской Федерации отсутствуют клинические рекомендации по диагностике и лечению БГМ у взрослых, однако в 2013 г. были утверждены Федеральные рекомендации по диагностике и лечению БГМ у детей. Согласно этим рекомендациям больному с подозрением на БГМ необходимо провести следующее обследование: клинический анализ крови, биохимический анализ крови (мочевина, креатинин, билирубин, АЛТ, АСТ, электролиты, глюкоза, С-реактивный белок), посев и микроскопию крови, исследование крови методом ПЦР на основные возбудители БГМ, клиническое и биохимическое исследование СМЖ, посев и микроскопию СМЖ, исследование СМЖ методом ПЦР, общий анализ мочи, посев мазка из носоглотки на менингококк, коагулограмму, определение уровня прокальцитонина, компьютерную томографию (КТ) или магнитно-резонансную томографию (МРТ) головного мозга [10].
Лабораторно подтвердить диагноз БГМ можно только на основании исследования СМЖ. Если нет противопоказаний, то для подтверждения диагноза следует выполнить люмбальную пункцию до начала антибактериальной терапии и провести исследование СМЖ (микроскопия с окраской мазков по Граму, посев, определение ДНК или РНК возбудителей методом ПЦР, число лейкоцитов, концентрации белка и глюкозы) [11,12]. Характерным признаком БГМ является нейтрофильный плеоцитоз более 1000 в мкл, хотя в пунктате, полученном в первые часы после появления симптомов, число нейтрофилов может быть менее 1000 в мкл или даже нормальным. В одном исследовании у 5% из 153 пациентов с культурально-подтвержденным пневмококковым менингитом плеоцитоз СМЖ составлял менее 10 в мкл, а у 17% пациентов – менее 100 в мкл [11]. Уровень белка в СМЖ обычно повышен (1-6 г/л). Характерно повышение ликворного давления более 200 мм вод. ст. Установлено, что уровень глюкозы менее 1,9 ммоль/л, белка выше 2,2 г/л и число лейкоцитов более 2000 в мкл являются диагностическими критериями БГМ. В проспективном исследовании наличие хотя бы одного из этих факторов с вероятностью 82-94% указывало на бактериальный менингит [13]. У пациентов с иммунодефицитом и положительными результатами посева плеоцитоз ликвора может быть невысоким. Если исследование ликвора проводится на фоне антибактериальной терапии, то отличить вирусный менингит от бактериального по уровню плеоцитоза бывает невозможно.
Доказано, что тяжесть заболевания не коррелирует с уровнем плеоцитоза. Неблагоприятными прогностическими факторами считают наличие бактериоррахии при низком плеоцитозе, повышение уровня белка более 2 г/л при снижении концентрации глюкозы в ликворе менее 2 ммоль/л (или отношение концентрации глюкозы в СМЖ/крови менее 0,4).
Европейское общество по микробиологии и инфекционным заболеваниям рекомендует определять концентрацию лактата в СМЖ в качестве диагностического экспресс-теста [11]. При концентрации лактата в СМЖ выше 3,5 ммоль/л следует думать о бактериальной природе менингита. Было проведено два мета-анализа с целью изучения роли лактата в СМЖ в дифференциальной диагностике бактериального менингита от других типов менингита. Один мета-анализ включал 25 исследований у 1692 пациентов (взрослые и дети) [14], а другой – 31 исследование у 1885 пациентов (взрослые и дети) [15]. Полученные данные показали, что диагностическая точность определения уровня лактата превышает таковую числа лейкоцитов в СМЖ. У пациентов, получавших антибиотикотерапию перед люмбальной пункцией, концентрация лактата в СМЖ была ниже (49%), чем у больных, не получавших антибактериальные препараты (98%). При наличии других заболеваний ЦНС, например, герпетического энцефалита или судорог, концентрация лактата в ликворе также может быть повышена. В связи с этим у пациентов, получавших антибактериальную терапию и/или страдающих другими заболеваниями ЦНС, определение уровня лактата для дифференциальной диагностики нецелесообразно [14-16].
Исследование СМЖ с помощью ПЦР является наиболее быстрым и специфичным методом определения этиологии БГМ. Специфичность ПЦР для всех микроорганизмов составляет 95-100%. Это исследование имеет особое значение у пациентов, получавших антибактериальную терапию до люмбальной пункции, поскольку посев СМЖ в таких случаях часто отрицательный. Недостатками ПЦР по сравнению с культуральным методом исследования СМЖ является невозможность определения чувствительности микробов к антибиотиков и подтипов возбудителя [17].
Дополнительными, но не обязательными методами диагностики БГМ, которые позволяют в некоторых случаях ускорить уточнение диагноза, являются латексагглютинация и иммунохроматографическое исследование. Исследование СМЖ с помощью латексной агглютинации позволяет получить результат в течение 15 минут и особенно полезно при отрицательных результатах окраски по Граму, если люмбальная пункция была выполнена после введения антибиотиков. Чувствительность данного исследования при пневмококковом менингите составляет 59-100% [18]. Однако, в ретроспективном исследовании у 28 пациентов с гнойным менингитом и отрицательным посевом СМЖ чувствительность латекс-агглютинации составила всего 7% [19]. В третьем исследовании результаты латекс-агглютинации были положительными только в 7 из 478 протестированных образцов СМЖ [18]. Соответственно, данный тест не может быть использован для исключения БГМ [20]. По данным исследования у 450 пациентов, чувствительность и специфичность иммунохроматографического исследования для определения антигенов S. рneumoniae в СМЖ достигали 100% [21]. Доказано, что иммунохроматографическое исследование СМЖ превосходит латекс-агглютинацию по диагностической точности [11].
Российские и зарубежные ученые рекомендуют определять пациентам с БГМ уровни С-реактивного белка (СРБ) и прокальцитонина. Данные показатели являются маркерами любого бактериального воспалительного процесса в организме и, как правило, повышены при БГМ. Уровни СРБ и прокальцитонина могут помочь в дифференциальной диагностике вирусного и бактериального менингита, хотя их повышение не является специфичным признаком БГМ.
Посев крови входит в перечень обязательных исследований при диагностике БГМ. Он помогает установить этиологическую природу заболевания, особенно при отрицательном результате посева СМЖ или невозможности провести люмбальную пункцию. При пневмококковом менингите положительную культуру крови удается выделить в 75% случаев. Антибиотикотерапия снижает диагностическую точность исследования на 20% [11].
При подозрении на БГМ всем пациентам рекомендована офтальмоскопия с оценкой состояния глазного дна.
КТ/МРТ при БГМ проводят для дифференциальной диагностики с другими заболеваниями ЦНС, при наличии очаговой симптоматики, для оценки состояния мозгового кровотока, церебральных структур, своевременного выявления интракраниальных осложнений. Проведение этих исследований возможно только при стабильной гемодинамике. На ранних сроках заболевания патологические изменения иногда отсутствуют, однако они могут появиться позднее.
С целью раннего выявления сенсоневральной тугоухости пациентам с БГМ, особенно пневмококковой этиологии, рекомендовано исследование акустических стволовых вызванных потенциалов.
Новые методы диагностики бактериального менингита
В последнее десятилетие активно изучаются новые биохимические маркеры повреждения головного мозга, такие как нейрон-специфическая енолаза (NSE), белок S100B, глиофибриллярный кислый протеин (GFAP), основной белок миелина (МВР), нейротрофический фактор головного мозга (BDNF) и другие. В качестве диагностических маркеров при БГМ наиболее изученными являются NSE и белок S100B.
У пациентов с бактериальным менингитом и менингоэнцефалитом повышены сывороточные концентрации NSE и S100B, отражающие нейрональную деструкцию и глиальное повреждение, соответственно [22,23]. Повы шение концентрации этих маркеров было также выявлено в экспериментальном исследовании у кроликов в течение 12 ч после развития пневмококкового менингита. Концентрация S100B достигала пика через 20 ч после заражения и оставалась высокой на протяжении всего эксперимента [22]. При БГМ у детей концентрация S100B коррелировала с тяжестью течения менингита и была независимым предиктором неблагоприятного исхода [24,25].
В когортном исследовании у 21 взрослого пациента с острым бактериальным менингитом (у 86% из них был диагностирован пневмококковый менингит) было показано, что концентрация NSE в большей степени отражает воспалительные изменения в головном мозге, чем S100B, однако белок S100B был более точным маркером степени некроза головного мозга. Сохранение высокой концентрации S100B и NSE в сыворотке свидетельствует о продолжающихся процессах повреждения головного мозга [23,26]. Требуются дальнейшие исследования перечисленных маркеров повреждения головного мозга при БГМ с целью подтверждения возможности их применения в клинической практике.
Лечение
Лечение БГМ необходимо проводить только в условиях стационара. Основные цели лечения – подавление инфекции и предотвращение дальнейшего распространения патологического процесса и развития осложнений.
Антибактериальная терапия. Если у пациентов с предполагаемым БГМ люмбальная пункция задерживается, например, при наличии противопоказаний или вследствие КТ, эмпирическую антибактериальную терапию следует начинать немедленно (в течение 1 ч) на основании предварительного диагноза, даже если окончательный диагноз еще не установлен. Поздняя антибиотикотерапия при БГМ ассоциируется с увеличением риска развития неблагоприятного исхода. Путь введения антибактериальных препаратов только парентеральный. В 75-90% случаев антимикробную терапию приходится назначать эмпирически.
| Препараты выбора, суточная
доза, кратность приема |
Альтернативные препараты,
суточная доза, кратность приема |
|---|---|
| Цефалоспорины IV поколения | Пенициллины |
| цефметазол 1–2 г 2 р/сут | ампициллин 8–12 г 4 р/сут |
| цефпиром 2 г 2 р/сут | бензилпенициллин 20–30 млн |
| цефокситим 3 г 4 р/сут | ЕД 6-8 р/сут |
| Цефалоспорины III поколения | оксациллин 12–16 г 4 р/сут |
| цефотаксим 8–12 г 4 р/сут | Аминогликозиды |
| цефтриаксон 2–4 г 1-2 р/сут | гентамицин 12–16 г 4 р/сут |
| цефтазидим 6 г 3 р/сут | амикацин 15 мг/кг; в/в в 200 |
| цефуроксим 6 г 3 р/сут | мл изотонического раствора |
| Карбапенемы | натрия хлорида со скоростью |
| меропенем 6 г 3 р/сут | 60 кап/мин 3 р/сут |
Как указано выше, в Российской Федерации отсутствуют клинические рекомендации по диагностике и лечению БГМ у взрослых. В 2014 г. утверждены клинические рекомендации по оказанию скорой медицинской помощи при менингите, согласно которым стартовую антибиотикотерапию предлагается начинать с цефалоспоринов третьего поколения (табл. 4) [27]. В соответствии с рекомендациями Европейского общества по микробиологии и инфекционным заболеваниям 2016 г. выбор эмпирической антибактериальной терапии зависит от возраста пациента и чувствительности пневмококка к пенициллину и цефалоспоринам третьего поколения в данном регионе (табл. 5) [11,28].
| Группы
пациентов |
S. pneumoniae с низкой
чувствительностью к пенициллину |
S. pneumoniae, чувствительный
к пенициллину |
Дозы для внутривенного введения |
|---|---|---|---|
| До 1 мес | Амоксициллин/ампициллин/ пенициллин + цефотаксим или амоксициллин/ампициллин + аминогликозиды | - | Возраст менее 1 нед: цефотаксим 50 мг/кг каждые 8 ч; ампициллин/амоксициллин 50 мг/кг каждые 8 ч; гентамицин 2,5 мг/кг каждые 12 ч. Возраст 1-4 нед: ампициллин 50 мг/кг каждые 6 ч; цефотаксим 50 мг/кг каждые 6-8 ч; гентамицин 2,5 мг/кг каждые 8 ч; тобрамицин 2,5 мг/кг каждые 8 ч; амикацин 10 мг/кг каждые 8 ч |
| 1 мес – 18 лет | Цефотаксим или цефтриаксон + ванкомицин или рифампицин | Цефотаксим или цефтриаксон | Ванкомицин 10-15 мг/кг каждые 6 ч до достижения концентрации в крови 15-20 мг/мл; гентамицин 10 мг/кг каждые 12 ч до 600 мг/сут; цефотаксим 75 мг/кг каждые 6-8 ч; цефтриаксон 50 мг/кг каждые 12 ч (макс. 2 г каждые 12 ч). |
| 18-50 лет | Цефотаксим или цефтриаксон + ванкомицин или рифампицин | Цефотаксим или цефтриаксон | Цефтриаксон 2 г каждые 12 ч или 4 г/сут; цефотаксим 2 г каждые 4-6 ч; ванкомицин 10-20 мг/кг каждые 8-12 ч до достижения концентрации 15-20 мг/мл; рифампицин 300 мг каждые 12 ч. |
| Старше 50 лет или 18-50 лет с риском развития БГМ, вызванного L. monocytogenes | Цефотаксим или цефтриаксон + ванкомицин или рифампицин + амоксициллин/ ампициллин/пенициллин G | Цефотаксим или цефтриаксон + амоксициллин/ампициллин/ пенициллин G | Цефтриаксон 2 г каждые 12 ч или 4 г/сут; цефотаксим 2 г каждые 4-6 ч; ванкомицин 10-20 мг/кг каждые 8-12 ч до достижения концентрации 15-20 мг/мл; рифампицин 300 мг каждые 12 ч; ампициллин или амоксициллин 2 г каждые 4 ч. |
Пневмококки на территории Российской Федерации в основном сохраняют чувствительность к пенициллину (90-95%) и амоксициллину (99-100%), что позволяет шире использовать эти препараты. Но за период с 1999 по 2005 г. доля штаммов пневмококка со сниженной чувствительностью к пенициллинам повысилась с 11,5% до 18,2% в Южном округе, с 8,6% до 10,0% – в Центральном, с 7,1% до 22,3% – в Уральском, с 4,5% до 14,0% – в Москве [29]. Поэтому препаратами выбора для эмпирической антибактериальной терапии у взрослых пациентов с БГМ на догоспитальном этапе и в условиях стационара считают цефалоспорины третьего поколения, в том числе цефотаксим или цефтриаксон.
Золотым стандартом лечения БГМ является этиотропная антибактериальная терапия, которая возможна после получения результатов микробиологического исследования или ПЦР (в среднем через 24-72 ч). Европейское общество по микробиологии и инфекционным заболеваниям рекомендует выбрать антимикробный препарат для стартовой этиотропной терапии в зависимости от чувствительности выделенного штамма пневмококка (табл. 6) [10].
| Микроорганизм | Препараты выбора | Альтернативные препараты |
|---|---|---|
| Чувствительный к пенициллину (МПК<0,1 мкг/мл) | Пенициллин или амоксициллин/ ампициллин | Цефтриаксон, цефотаксим, хлорамфеникол |
| Резистентный к пенициллину (МПК>0,1 мкг/мл), чувствительный к цефалоспоринам III поколения (МПК<2 мкг/мл) | Цефтриаксон или цефотаксим | Цефепим, меропенем, моксифлоксацин |
| Резистентный к цефалоспоринам III поколения (МПК≥2 мкг/мл) | Ванкомицин + рифампицин или ванкомицин + цефтриаксон или цефотаксим или рифампицин + цефтриаксон или цефотаксим | Ванкомицин + моксифлоксацин, линезолид |
Относительно лечения БГМ, вызванного резистентным к цефалоспоринам третьего поколения штаммом пневмококка, российские и европейские рекомендации совпадают. В данном случае следует добавлять к цефалоспоринам третьего поколения ванкомицин или рифампицин. Также согласно европейским рекомендациям можно использовать комбинацию ванкомицина и рифампицина. В клинических исследованиях польза присоединения ванкомицина или рифампицина к цефалоспоринам третьего поколения при БГМ, вызванным устойчивым к последним штаммом пневмококка, не изучалась, однако в опытах на животных комбинированная терапия цефтриаксоном с ванкомицином или рифампицином вызывала санацию СМЖ в течение 24 ч чаще, чем монотерапия цефтриаксоном [30]. В другом исследовании сочетание цефтриаксона с рифампи цином или рифампицина с ванкомицином имело преимущество перед комбинацией ванкомицина с цефтриаксоном [31]. Результаты исследований на животных обосновывают применение цефалоспоринов третьего поколения с ванкомицином или рифампицином при пневмококковом менингите [31].
Цефепим относится к цефалоспоринам четвертого поколения и обладает более высокой устойчивостью к бета-лактамазам, чем цефалоспорины третьего поколения. Результаты экспериментальных и некоторых клинических исследований показали более высокую активность цефепима в СМЖ при менингите, вызванном пенициллиноустойчивым штаммом S. pneumoniae, по сравнению с цефтриаксоном. Цефепим рекомендуется в качестве альтернативной терапии при пневмококковом менингите [11,32].
Среди β-лактамов самым широким спектром активности в отношении грамположительных и грамотрицательных бактерий in vitro обладают карбапенемы. Меропенем проникает через гематоэнцефалический барьер лучше, чем имипенем и дорипенем [33]. В 4 контролируемых исследованиях у 448 детей и 58 взрослых с пневмококковым менингитом меропепем по эффективности и безопасности был сопоставим с цефотаксимом и цефтриаксоном [34]. Данный антибиотик является препаратом второй линии при лечении пневмококкового менингита. Рекомендуемая продолжительность лечения составляет 10-14 дней [11,32,35].
Критериями эффективности антибактериального лечения являются нормализация температуры тела, улучшение состояния пациента (отсутствие жалоб, менингеальных симптомов), отсутствие плеоцитоза СМЖ. Если состояние пациента не улучшается в течение 48-72 ч от начала терапии, проводят повторную люмбальную пункцию с целью коррекции лечения. Согласно рекомендациям Европейского общества по микробиологии и инфекционным заболеваниям при отчетливой положительной динамике повторную люмбальную пункцию после завершения антибактериальной терапии проводить необязательно.
Массивная воспалительная реакция при развитии пневмококкового менингита играет ключевую роль в развитии повреждения головного мозга и последующих неблагоприятных исходов [36]. Выраженность воспалительной реакции определяется степенью бактериального лизиса. Чем больше выброс продуктов клеточного распада, тем массивнее область повреждения нейронов. Эти наблюдения способствовали изучению эффективности небактериолитических антимикробных препаратов, в том числе даптомицина, рифампицина и моксифлоксацина, в лечении БГМ [37].
Фторхинолоны, такие как гатифлоксацин и моксифлоксацин, хорошо проникают через гематоэнцефалический барьер и обладают высокой активностью в отношении грамположительных бактерий. Некоторые исследователи рекомендуют моксифлоксацин в качестве альтернативы цефалоспоринам третьего поколения и ванкомицину при лечении менингита, вызванного штаммами пневмококка, устойчивыми к пенициллину и цефалоспоринам третьего поколения. Другие эксперты не рекомендуют монотерапию этим антибиотиком и предлагают сочетать его с другим антибактериальным препаратом, например, ванкомицином или цефалоспорином третьего поколения, учитывая отсутствие клинических исследований, подтверждающих эффективность монотерапии моксифлоксацином [3]. Согласно рекомендациям Европейского общества по микробиологии и инфекционным заболеваниям 2016 г. моксифлоксацин является альтернативным препаратом при лечении пневмококкового менингита [11].
Даптомицин – это липопетидный антибиотик, эффективность которого в лечении пневмококкового менингита, установлена в исследованиях у животных. Лечение даптомицином по сравнению с монотерапией цефтриаксоном приводило к снижению уровня воспалительных цитокинов и уменьшению степени повреждения коры головного мозга и нейронов [38].
Рифампин ингибирует синтез белка в бактериальной клетке и уменьшает образование продуктов распада клеточной стенки пневмококка in vitro. Исследования на кроликах показали, что кратковременное применение рифампина перед цефтриаксоном уменьшало выброс продуктов распада клеточной стенки пневмококка, воспаление и повреждение нейронов по сравнению с таковым при лечении одним цефтриаксоном [39]. Результаты ретроспективного когортного исследования, проводившегося во Франции (2004-2008 г.) у 175 взрослых пациентов с БГМ, свидетельствуют о пользе комбинации рифампина с цефалоспоринами третьего поколения при лечении БГМ. По мнению авторов, данная комбинация может быть использована у пациентов с пневмококковым БГМ [40].
Моксифлоксацин уже включен в официальные клинические рекомендации Европейского общества по микробиологии и инфекционным заболеваниям 2016 г., в то время как эффективность даптомицина и рифампина нуждается в дополнительном изучении.
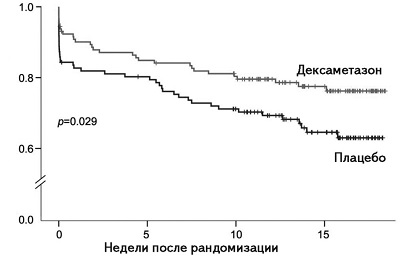
Адьювантная глюкокортикостероидная терапия. В экспериментальных исследованиях на животных вероятность неблагоприятного исхода при БГМ зависела от выраженности воспаления в субарахноидальном пространстве [41,42], поэтому взрослым пациентам перед первой дозой антибиотика рекомендуют вводить дексаметазон. Препарат уменьшает воспалительную реакцию в субарахноидальном пространстве и, следовательно, ограничивает повреждение клеток. У взрослых пациентов с БГМ применение дексаметазона улучшало выживаемость в острую фазу заболевания и в более поздние сроки (рис. 1) [43]. Проведено 25 рандомизированных контролируемых клинических исследований, в которых дексаметазон сравнивали с плацебо у 4121 пациента (2511 детей и 1517 взрослых) с бактериальным менингитом. При введении глюкокортикостероидов было выявлено статистически значимое снижение риска снижения слуха (относительный риск 0,74, 95% доверительный интервал [ДИ] 0,63-0,87) и развития неврологических осложнений (0,83, 95% ДИ 0,69-1,00), однако летальность в целом не изменилась. Снижение летальности при применении глюкокортикостероидов наблюдалось у пациентов с БГМ пневмококковой, но не другой этиологии [44]. Польза адьювантной глюкокортикостероидной терапии при неонатальном менингите изучалась только в одном клиническом исследовании, в котором дексаметазон оказывал положительное влияние на течение заболевания. Однако исследование было небольшим, а группы сравнения были несбалансированными по возрасту и этиологии [45].
Лечение дексаметазоном рекомендуется у взрослых (10 мг каждые 6 ч в течение 4 дней) и детей (0,15 мг/кг каждые 6 ч в течение 4 дней) с острым БГМ. Если внутривенная антибактериальная терапия уже начата, то дексаметазон можно назначить в течение 4 ч после введения первой дозы антибиотика. Важное значение имеет введение первой и последующих доз препарата не менее чем за 20-30 мин до антибиотика [11,46].
Следует учитывать, что терапия глюкокортикостероидами способствует уменьшению выраженности воспалительных изменений в оболочках мозга и снижению проницаемости гематоэнцефалического барьера для антибактериальных препаратов, что приводит к снижению их концентрации в субарахноидальном пространстве. Данный факт имеет особое значение при лечении ванкомицином у пациентов с пневмококковым менингитом. Длительное применение глюкокортикостероидов у больных с БГМ приводит к иммуносупрессии и повышению риска развития вторичных бактериальных инфекции и активации вирусных инфекций [46].
Симптоматическая терапия. Ниже рассматриваются другие вспомогательные методы лечения, назначение которых зависит от клинических проявлений.
Осмотическая терапия. Осмотические диуретики традиционно применяют для уменьшения внутричерепного давления. Наиболее изученным препаратом у больных бактериальным менингитом является глицерол, эффективность которого при БГМ изучалась в 4 рандомизированных плацебо-контролируемых клинических исследованиях. Мета-анализ этих исследований не подтвердил эффективность глицерола у пациентов с БГМ [47]. Эффективность других осмотических диуретиков, таких как маннитол и гипертонический раствор, у пациентов с БГМ в клинических исследованиях не изучалась [11,48]. Тем не менее, в российских рекомендациях по лечению БГМ у детей указана возможность применения маннитола в дозе 0,25-0,5 мг/кг для уменьшения внутричерепного давления.
Гипотермия. Данный метод изучался в качестве способа нейропротекции при травмах головного мозга и посттравматической гипоксии. При изучении эффективности гипотермии в лечении БГМ было выявлено увеличение смертности в основной группе [49], поэтому применение этого метода не рекомендуется.
Противоэпилептическая терапия. При развитии судорог согласно клиническим рекомендациям по лечению БГМ у детей предлагается назначать диазепам 0,1-0,15 мг/кг либо мидазолам 0,1-0,3 мг/кг, при эпилептическом статусе – препараты вальпроевой кислоты для внутривенного введения в дозе 6-10 мг/кг за 5 мин с последующим введением 1 мг/кг/мин. При некупирующихся судорогах больного следует перевести на искусственную вентиляцию легких с последующим введением 20% раствора натрия оксибутирата в дозе 50-150 мг/кг или 1% раствора тиопентала натрия в дозе 510 мг/кг/ч. Следует помнить, что совместное назначение препаратов вальпроевой кислоты и меропенема приводит к резкому снижению концентрации вальпроатов в крови. В клинических исследованиях различные противоэпилептические препараты у пациентов с БГМ не изучались.
Иммунотерапия. При развитии бактериального ме нин гита в организме человека запускается целый каскад иммуновоспалительных реакций. У пациентов с сепсисом происходит выброс противоспалительных цитокинов. Это приводит к развитию иммуносупрессии и способствует развитию вторичных инфекций, которые сопровождаются увеличением смертности [50,51]. Некоторые исследования показали быстрое снижение цитоза в СМЖ у пациентов с БГМ при лечении иммуноглобулинами. Однако клиническая эффективность внутривенных иммуноглобулинов в качестве адьювантной терапии при БГМ не была подтверждена в клинических исследованиях [11]. В российских клинических рекомендациях по лечению БГМ у детей 2013 г. указано, что внутривенные иммуноглобулины могут быть использованы при развитии сепсиса. Возможно введение внутривенных иммуноглобулинов, обогащенных IgM (например, пентаглобина в дозе 5 мл/кг/сут). Польза иммунотерапии при лечении БГМ нуждается в изучении в дальнейших клинических исследованиях.
Антикоагулянты. Было выдвинуто предположение об эффективности применения гепарина как препарата для адьювантной терапии при БГМ. Однако при проведении клинических исследований отмечались высокая частота развития кровотечений и высокая летальность. Поэтому гепарин в качестве препарата адьювантной терапии при БГМ не рекомендуется [11].
Нейропротективная терапия. Неврологические ос лож нения – основная причина смерти у молодых пациентов с БГМ. У пожилых пациентов основной причиной смерти является декомпенсация сопутствующей патологии. У 50% выживших развиваются резидуальные неврологические нарушения, в том числе когнитивные [3,52,53]. Некоторые исследования показывают, что окислительный стресс может быть связан с когнитивными нарушениями при пневмококковом менингите [54,55]. Эффективная нейропротективная терапия может улучшить исход БГМ.
Согласно клиническим рекомендациям по лечению БГМ у детей в острый период рекомендуют использовать цитофлавин в дозе 0,6 мл/кг/сут у детей и 10 мл/сут у взрослых в течение 3-5 дней. Препарат обладает антигипоксическим и антиоксидантным эффектами. Возможно назначение энергокорректоров, донаторов АТФ (левокарнитин в дозе 50-70 мг/кг/сут).
Также в клинической практике используются ноотропные препараты, агонисты ГАМК-рецепторов, обладающие нейропротективным, нейрометаболическим, нейротрофическим, седативным и противосудорожным действием. Однако в клинических исследованиях эти препараты при БГМ не изучались.
При бактериальной инфекции в больших количествах образуются промежуточные формы активных форм кислорода и азота. Антиоксиданты ослабляют степень неврологического повреждения при БГМ и являются перспективной стратегией в лечении заболевания [54]. В экспериментальном исследовании анти окси дант N-ацетилцистеин способствовал уменьшению воспалительной реакции в головном мозге, степени окислительного повреждения корковых нейронов, отека головного мозга, снижал вероятность потери слуха у животных с пневмококковым менингитом [57]. Одновременная продукция кислород- и азотсодержащих свободных радикалов способствует образованию токсичного метаболита пероксинитрита, который цитотоксичен, вызывает перекисное окисление липидов и индуцирует поломки нитей ДНК. Повреждение ДНК активирует поли(АДФ-рибоза) полимеразу (PARP) и запускает энергоемкий процесс, сопровождающийся потреблением огромного количества клеточной энергии и ресурсов и приводящий к гибели клетки. Ингибиторы пироксинитрита и PARP могут быть эффективными в лечении БГМ [58-60].
Каспазы представляют собой семейство протеаз, активно участвующих в процессах воспаления и апоптоза. Подавление процессов апоптоза при блокаде каспазы-1 теоретически может оказать благоприятное влияние на течение менингита. В перспективе эффективность лечения БГМ можно повысить путем фармакологического вмешательства в воспалительный каскад на нескольких уровнях [56,61,62]. В экспериментальном исследовании было показано, что эритропоэтин уменьшает выраженность остаточных когнитивных расстройств у пациентов с пневмококковым менингитом [63]. Изучение и поиск новых нейропротективных препаратов представляет собой перспективную и многообещающую область для экспериментальных и клинических исследований.
Заключение
Несмотря на возможность вакцинации от пневмококковой, менингококковой и гемофильной инфекций и наличие высокоэффективных антибиотиков, заболеваемость и смертность от бактериальных менингитов остаются неприемлемо высокими. В настоящее время большинство эпизодов бактериального менингита у взрослых и детей обусловлены S. pneumoniaе. Эф фек тивные стратегии лечения больных пневмококковым менингитом включают в себя антибактериальную терапию, которую назначают немедленно, и применение глюкокортикостероидов с целью уменьшения выраженности воспалительной реакции в субарахноидальном пространстве. Лечение бактериального менингита следует начинать с антибиотиков широкого спектра действия. В последующем антимикробная терапия может быть скорректирована после выделения возбудителя из ликвора. Во всем мире растет лекарственная устойчивость микроорганизмов к антибактериальным препаратам, поэтому эмпирическую антибактериальную терапию следует выбирать с учетом чувствительности бактерий к антибиотикам в данном регионе.
В Российской Федерации отсутствуют клинические рекомендации по лечению БГМ у взрослых, в то время как клинические рекомендации по лечению и диагностике БГМ у детей, опубликованные в 2013 г., нуждаются в обновлении. Мнения российских и зарубежных ученых в отношении препаратов выбора для эмпирической антибактериальной терапии совпадают. Как у детей, так и взрослых лечение следует начинать с цефалоспоринов третьего поколения, которые обладают высокой активностью в отношении S. pneumoniae. Этиотропная терапия пневмококкового менингита более подробно представлена в рекомендациях Европейского общества по микробиологии и инфекционным заболеваниям. В данные рекомендации включены линезолид и моксифлоксацин, которые пока не входят в российские клинические рекомендации. Среди препаратов адьювантной терапии доказанной эффективностью, подтвержденной клиническими исследованиями, обладает дексаметазон, применяемый с противовоспалительной целью. Назначение антикоагулянтов и проведение гипотермии пациентам с бактериальным менингитом Европейское общество по микробиологии и инфекционным болезням не рекомендует. Другие методы адьювантной терапии (осмотические диуретики, противосудорожные препараты, внутривенные иммуноглобулины) широко используются в клинической практике во всем мире, хотя их эффективность при БГМ в масштабных клинических исследованиях не изучалась. Адьювантная нейропротективная терапия может улучшить исходы бактериального менингита и представляется перспективным методом лечения.
Используемые источники
- McIntyre PB, O’Brien KL, Greenwood B, van de Beek D. Effect of vaccines on bacterial meningitis worldwide. Lancet 2012;380:1703–11.
- Busl KM, Bleck TP. Bacterial infections of the central nervous system. Curr Infect Dis Rep 2013;15(6):612–30.
- van de Beek D, Brouwer MC, Thwaites GE, et al. Advances in treatment of bacterial meningitis. Lancet 2012;380:1693–702.
- Wall EC, Cartwright K, Scarborough M, et al. High mortality amongst adolescents and adults with bacterial meningitis in Sub-Saharan Africa: an analysis of 715 cases from Malawi. PLoS ONE 2013;8(7).
- Erdem H, Elaldi N, Oztoprak N, et al. Mortality indicators in pneumococcal meningitis: therapeutic implications. Int J Infect Dis 2014;19:13–9.
- Miranda J, Tunkel AR. Strategies and new developments in the management of bacterial meningitis. Infect Dis Clin North Am 2009;23:925–43.
- Putz K, Hayani K, Zar FA. Meningitis. Primary Care. Clinics in Office Practice 2013;40(3):707–26.
- Heckenberg SG, Brouwer MC, van der Ende A, et al. Hearing loss in adults surviving pneumococcal meningitis is associated with otitis and pneumococcal serotype. Clin Microbiol Infect 2012;18:849–55.
- Barichello T, Fagundes GD, Generoso JS, et al. Brain-blood barrier breakdown and pro-inflammatory mediators in neonate rats submitted meningitis by Streptococcus pneumoniae. Brain Res 2012;1471:162–8.
- Скрипченко Н.В., Вильниц А.А., Иванова М.В. Федеральные рекомендации (протоколы) по диагностике и лечению бактериальных гнойных менингитов у детей. 2013 г.
- Van de Beek D, Cabellos C, Dzupova O, et al. ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clin Microbiol Infect 2016;22:S37–62.
- Brouwer MC, Thwaites GE, Tunkel AR, et al. Dilemmas in the diagnosis of acute community-acquired bacterial meningitis. Lancet 2012;380:1684–92.
- Heckenberg SG, Brouwer MC, van der Ende A, et al. Adjunctive dexamethasone in adults with meningococcal meningitis. Neurology 2012;79:1563–9.
- Huy NT, Thao NT, Diep DT, et al. Cerebrospinal fluid lactate concentration to distinguish bacterial from aseptic meningitis: a systemic review and meta-analysis. Crit Care 2010;14:R240.
- Sakushima K, Hayashino Y, Kawaguchi T, et al. Diagnostic accuracy of cerebrospinal fluid lactate for differentiating bacterial meningitis from aseptic meningitis: a meta-analysis. J Infect 2011;62:255–62.
- Brouwer MC, van de Beek D. Management of bacterial central nervous system infections. Handb Clin Neurol 2017;140:349–64.
- Boving MK, Pedersen LN, Moller JK. Eight-plex PCR and liquid-array detection of bacterial and viral pathogens in cerebrospinal fluid from patients with suspected meningitis. J Clin Microbiol 2009;47:908–13.
- Brouwer MC, Tunkel AR, van de Beek D. Epidemiology, diagnosis, and antimicrobial treatment of acute bacterial meningitis. Clin Microbiol Rev 2010;23: 467–92.
- Tarafdar K, Rao S, Recco RA, et al. Lack of sensitivity of the latex agglutination test to detect bacterial antigen in the cerebrospinal fluid of patients with culturenegative meningitis. Clin Infect Dis 2001;33:406–8.
- Mount HR, Boyle SD. Aseptic and bacterial meningitis: evaluation, treatment, and prevention. Am Fam Physician 2017;96(5):314-22.
- Saha SK, Darmstadt GL, Yamanaka N, et al. Rapid diagnosis of pneumococcal meningitis: implications for treatment and measuring disease burden. Pediatr Infect Dis J 2005;24:1093–8.
- Schmidt H, Gerber J, Stuertz K, et al. S100B in the cerebrospinal fluid – a marker for glial damage in the rabbit model of pneumococcal meningitis. Neuroscience Letters 2010;475(2):104–7.
- Bartek J, Thelin EP, Ghatan, PH, et al. Neuron-specific enolase is correlated to compromised cerebral metabolism in patients suffering from acute bacterial meningitis. PLOS One 2016;11(3).
- Peng QL, Tao SH, Zhou XZ, Peng, et al. Elevated levels of cerebrospinal fluid S100B are associated with brain injury and unfavorable outcomes in children with central nervous system infections. Intern J Neurosc 2016;127(1):1–9.
- Hamed SA, Hamed EA, Zakary MM. Oxidative stress and S-100B protein in children with bacterial meningitis. BMC Neurology 2009;9(1).
- Jung K, Goerdt C, Lange P, et al.The Use of S100B and Tau protein concentrations in the cerebrospinal fluid for the differential diagnosis of bacterial meningitis: A retrospective analysis. Europ Neurolo 2011;66(3):128-32.
- Баранцевич Е.Р. Клинические рекомендации (протоколы) по оказанию скорой медицинской помощи при менингите. 2014 г.
- Molyneux E, Nizami SQ, Saha S, et al. 5 versus 10 days of treatment with ceftriaxone for bacterial meningitis in children: a double-blind randomised equivalence study. Lancet 2011;377:1837–45.
- Таточенко В.К., Бакрадзе М.Д. Значение лекарственной устойчивости микроорганизмов в педиатрической практике. Практика педиатра, 2009, 5-11. [Tatochenko VK, Bakradze MD. The importance of drug resistance of microorganisms in pediatric practice. Pediatric practice, 2009, 5-11 (In Russ.)].
- Suntur BM, Yurtseven T, Sipahi OR, et al. Rifampicin + ceftriaxone versus vancomycin + ceftriaxone in the treatment of penicillinand cephalosporin-resistant pneumococcal meningitis in an experimental rabbit model. Int J Antimicrob Agents 2005;26:258–60.
- Erdem H, Elaldi N, Oztoprak N, et al. Mortality indicators in pneumococcal meningitis: therapeutic implications. Int J Infect Dis 2014;19:13–9.
- Brouwer MC, Thwaites GE, Tunkel AR, et al. Dilemmas in the diagnosis of acute community-acquired bacterial meningitis. Lancet 2012;380:1684–92.
- Nalda-Molina R, Dokoumetzidis A, Charkoftaki G, et al. Pharmacokinetics of doripenem in CSF of patients with non-inflamed meninges. J Antimicrob Chemother 2012;67:1722–29.
- Nau R, Sorgel F, Eiffert H. Penetration of drugs through the blood–cerebrospinal fluid/blood–brain barrier for treatment of central nervous system infections. Clin Microbiol Rev 2010;23:858–83.
- Karageorgopoulos DE, Valkimadi PE, Kapaskelis A, Rafailidis,et al. Short versus long duration of antibiotic therapy for bacterial meningitis: a meta-analysis of randomised controlled trials in children. Arch Dis Child 2009;94:607–14.
- Koedel U, Klein M, Pfister HW. New understandings on the pathophysiology of bacterial meningitis. Current Opinion in Infectious Diseases 2010;23(3):217–23.
- Barichello T, Savi GD, Silva GZ, et al. Antibiotic therapy prevents, in part, the oxidative stress in the rat brain after meningitis induced by Streptococcus pneumoniae. Neurosci Lett 2010;478:93–6.
- Egermann U, Stanga Z, Ramin A, et al. Combination of daptomycin plus ceftriaxone is more active than vancomycin plus ceftriaxone in experimental meningitis after addition of dexamethasone. Antimicrob Agents Chemother 2009;53:3030–33
- Spreer A, Lugert R, Stoltefaut V, et al. Short-term rifampicin pretreatment redu ces inflammation and neuronal cell death in a rabbit model of bacterial meningitis. Crit Care Med 2013;37(7):2253–8.
- Bretonnière C, Jozwiak M, Girault C, et al. Rifampin use in acute communityacquired meningitis in intensive care units: the French retrospective cohort ACAM-ICU study. Crit Care 2015;19(1).
- Brouwer MC, McIntyre P, Prasad K, et al. Corticosteroids for acute bacterial meningitis. Cochrane Database Syst Rev 2013;(6):CD004405.
- Bodilsen J, Dalager-Pedersen M, Schonheyder HC, et al. Dexamethasone treatment and prognostic factors in community-acquired bacterial meningitis: a Danish retrospective population-based cohort study. Scand J Infect Dis 2014;46:418–25.
- Fritz D, Brouwer MC, van de Beek D. Dexamethasone and long-term survival in bacterial meningitis. Neurology 2012;79(22):2177–9.
- Brouwer MC, McIntyre P, Prasad K, et al. Corticosteroids for acute bacterial meningitis. Cochrane Database Syst Rev 2015;(9):CD004405.
- Mathur NB, Garg A, Mishra TK. Role of dexamethasone in neonatal meningitis: a randomized controlled trial. Indian J Pediatr 2013;80:102–7.
- van de Beek D, Farrar JJ, de Gans J, et al. Adjunctive dexamethasone in bacterial meningitis: a meta-analysis of individual patient data. Lancet Neurol 2010; 9:254–63.
- Wall EC, Ajdukiewicz KM, et al. Osmotic therapies added to antibiotics for acute bacterial meningitis. Cochrane Database Syst Rev 2013;3: CD008806.
- Kawaza K, Phiri A, Chimalizeni Y, et al. Glycerol and acetaminophen as adjuvant therapy did not affect the outcome of bacterial meningitis in Malawian children. Pediatr Infect Dis J 2014;33:214–6.
- Mourvillier B, Tubach F, van de Beek D, et al. Induced hypothermia in severe bacterial meningitis: a randomized clinical trial. JAMA 2013;310:2174–83.
- Koppe U, Suttorp N, Opitz B. Recognition of Streptococcus pneumoniae by the 92 innate immune system. Cell Microbiol 2012;14:460–6.
- Martin NG, Sadarangani M, Pollard AJ, et al. Hospital admission rates for meningitis and septicaemia caused by Haemophilus influenzae, Neisseria meningitidis, and Streptococcus pneumoniae in children in England over five decades: a population-based observational study. Lancet Infect Dis 2014;14:397–405.
- Okike IO, Johnson AP, Henderson KL, et al. Incidence, etiology, and outcome of bacterial meningitis in infants aged <90 days in the United Kingdom and Republic of Ireland: prospective, enhanced, national population-based surveillance. Clin Infect Dis 2014;59:e150–7.
- Saha SK, Khan NZ, Ahmed AS, et al. Neurodevelopmental sequelae in pneumococcal meningitis cases in Bangladesh: a comprehensive follow-up study. Clin Infect Dis 2009;48:S90–6.
- Bargui F, D’Agostino I, Mariani-Kurkdjian P, et al. Factors influencing neurological outcome of children with bacterial meningitis at the emergency department. Eur J Pediatr 2012;171:1365–71.
- Barichello T, Santos AL, Savi GD, et al. Antioxidant treatment prevents cognitive impairment and oxidative damage in pneumococcal meningitis survivor rats. Metab Brain Dis 2012;27:587–93.
- Mook-Kanamori BB, Geldhoff M, van der Poll T, et al. Pathogenesis and pathophysiology of pneumococcal meningitis. Clin Microbiol Rev 2011;24:557–91.
- Högen T, Demel C, Giese A, et al. Adjunctive N-acetyl-l-cysteine in treatment of murine pneumococcal meningitis. Antimicrob Ag Chemother 2013;57:4285-30.
- Rom S, Zuluaga-Ramirez V, Dykstra H, et al. Poly(ADP-ribose) polymerase-1 inhibition in brain endothelium protects the blood-brain barrier under physiologic and neuroinflammatory conditions. J Cerebr Blood Flow Metab 2014;35(1):28-36.
- Rouphael N, Steyn S, Bangert M, et al. Use of 2 pneumococcal common protein real-time polymerase chain reaction assays in healthy children colonized with Streptococcus pneumoniae. Diagn Microbiol Infect Dis 2011;70:452–4.
- Coutinho LG, de Oliveira AHS, Witwer M, et al. DNA repair protein APE1 is involved in host response during pneumococcal meningitis and its expression can be modulated by vitamin B6. J Neuroinflam 2017;14(1):243.
- Edberg M, Furebring M, Sjolin J, et al. Neurointensive care of patients with severe community-acquired meningitis. Acta Anaesthesiol Scand 2011;55:732–9.
- Woehrl B, Brouwer MC, Murr C, et al. Complement component 5 contributes to poor disease outcome in humans and mice with pneumococcal meningitis. J Clin Invest 2011;121:3943–53.
- Barichello T, Simões LR, Generoso JS, et al. Erythropoietin prevents cognitive impairment and oxidative parameters in Wistar rats subjected to pneumococcal meningitis. Translat Res 2014;163(5):503–13.
