Улучшение функции печени у больных с декомпенсированным циррозом печени после элиминации вируса гепатита С
Изучение показателей белково-синтетической функции печени и портальной гипертензии у больных хроническим гепатитом С (ХГС) с декомпенсированным циррозом печени (ЦП) после успешного лечения препаратами прямого противовирусного действия.
В проспективное исследование были включены 50 больных ХГС с декомпенсированным ЦП, получавших препараты прямого противовирусного действия и достигших устойчивого вирусологического ответа (УВО). Оценивали параметры функции печени, портальной гипертензии, в том числе индексы модели терминальной стадии заболевания печени (MELD) и Чайлд-Пью, до и каждые 3-6 месяцев после противовирусной терапии (ПВТ). Медиана продолжительности наблюдения после окончания ПВТ составила 18 (6–42) месяцев.
К концу наблюдения снижение индексов MELD и Чайлд-Пью отмечено у 72% и 74% больных, соответственно. У 52% больных наблюдалась компенсация ЦП (переход в класс А по Чайлд-Пью), у 89% больных с ЦП класса С – уменьшение выраженности декомпенсации (переход в класс B), у 7,3% – ухудшение состояния (переход в класс С). Активность аланинаминотрансферазы (АЛТ) нормализовалась у 90% пациентов, у половины из них активность аспартатаминтрансферазы (АСТ) оставалась повышенной. Число тромбоцитов достоверно увеличилось (р=0,016). Асцит был купирован или уменьшился у 57% больных. По результатам многофакторного регрессионного анализа Кокса мужской пол (отношение шансов [ОШ] 5,19, p=0,003) и исходный уровень альбумина менее 32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска, ассоциировавшимися с отсутствием компенсации ЦП к концу наблюдения.
Эрадикация вируса гепатита С приводит к снижению индексов MELD и ЧайлдПью у большинства больных с декомпенсированным ЦП и компенсации заболевания у половины из них.
Вирус гепатита С (ВГС) является одной из основных причин цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК) и трансплантации печени в мире. Ежегодный риск декомпенсации ЦП (кровотечение из варикозно расширенных вен пищевода и желудка, асцит, печеночная недостаточность, печеночная энцефалопатия) и развития ГЦК составляет около 3–6% [1,2]. Смертность у таких пациентов достигает 60% в течение 5 лет [3,4]. Ранее было показано, что у больных с компенсированным ЦП эрадикация ВГС в результате лечения препаратами интерферона-альфа и рибавирина приводит к снижению риска прогрессирования заболевания и улучшению выживаемости [5-7].
Препараты с прямым противовирусным действием значительно увеличили эффективность и безопасность лечения ХГС, в том числе у больных с декомпенсированным ЦП, которым ранее лечение не проводилось из-за низкой эффективности и высокой частоты развития серьезных нежелательных явлений, обусловленных интерферономальфа [8-10]. Наряду с высокой частотой устойчивого вирусологического ответа (УВО; 80-90% случаев), у значительной части больных с декомпенсированным ЦП, в том числе находящихся в листе ожидания трансплантации печени, отмечается улучшение функции печени, включая снижение баллов по шкале Чайлд-Пью и индекса модели терминальной стадии заболевания печени (MELD) [11-14]. Тем не менее, данных о долгосрочном влиянии элиминации ВГС на течение и прогноз при декомпенсированном ЦП недостаточно.
Целью исследования было изучение основных показателей белково-синтетической функции печени и портальной гипертензии, в том числе динамики индексов MELD и Чайлд-Пью, у пациентов с декомпенсированным ЦП после эрадикации ВГС.
Материал и методы
В исследование включали больных ХГС с декомпенсированным ЦП (класс В и С по Чайлд-Пью), получавших препараты прямого противовирусного действия с сентября 2014 г. по июль 2018 г. и достигших УВО (неопределяемый уровень РНК ВГС в сыворотке крови методом полимеразной цепной реакции через 12 недель после окончания терапии).
Критериями исключения были следующие: класс А по Чайлд-Пью, другие сопутствующие причины поражения печени, наличие ГЦК или рака другого типа и локализации на момент начала ПВТ, перенесенная трансплантация печени. Демографические, клинико-лабораторные и ин стру ментальные характеристики изучали у каждого пациента не более чем за 3 месяца до начала ПВТ. У каждого пациента определяли генотип ВГС и вирусную нагрузку, показатели общего анализа крови, активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ), уровень альбумина, общего и прямого билирубина сыворотки, протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО), альфа-фетопротеин. Всем больным выполняли эзофагогастродуоденоскопию, ультразвуковое исследование органов брюшной полости и/или контрастные методы визуализации (КТ, МРТ печени с контрастным усилением).
После достижения УВО у пациентов каждые 3-6 месяцев изучали параметры функции печени, портальной гипертензии и динамику баллов по шкале Чайлд-Пью и MELD. Результаты представлены в трех временных интервалах: до лечения, на момент достижения УВО и последнего обследования.
Статистический анализ выполнен с помощью программ IBM SPSS Statistics (version 21) и GraphPad Prism 8. Количественные переменные представлены в виде медианы (диапазона), категориальные – в виде числа и процента. Изучение динамики показателей проведено с помощью tкритерия Стьюдента, критериев Вилкоксона и МакНемара. Сравнительный анализ двух независимых групп проводился при помощи t-критерия Стьюдента для количественных показателей, U-критерия Манна-Уитни – для категориальных. Для сравнения качественных признаков использовали критерий c2. Регрессионный анализ Кокса применяли для выявления независимых факторов риска наступления событий. Достоверным считали уровень значимости р<0,05.
Результаты
В исследование были включены 50 больных ХГС с декомпенсированным ЦП (табл. 1). Тридцать (60%) пациентов получали софосбувир + даклатасвир, 5 (10%) – даклатасвир + асунапревир, 5 (10%) – софосбувир/ ледипасвир, 5 (10%) – софосбувир/велпатасвир, 2 (4%) – паритапревир/ритонавир/омбитасвир + дасабувир, 1 (2%) – софосбувир + симепревир, 2 (4%) – софосбувир + рибавирин, 24 (48%) – дополнительно рибавирин. Продолжительность лечения составила от 12 до 24 недель, медиана продолжительности наблюдения после окончания ПВТ – 18 (6–42) месяцев.
| Параметр | Значение |
|---|---|
| Мужчины, n (%) | 29 (58) |
| Возраст, лет (диапазон) | 53,5 (33–79) |
| Индекс массы тела, кг/м2(диапазон) | 27,3 (19,0–39,2) |
| Сахарный диабет, n (%) | 7 (14) |
| Злоупотребление алкоголем, n (%) | 10 (20) |
| 1 генотип вируса, n (%) | 36 (72) |
| РНК ВГС, МЕ/мл (диапазон) | 2,7×104 [5600-6,8×106] |
| Не получали ранее ПВТ, n (%) | 38 (76) |
| Софосбувир-содержащие схемы, n (%) | 43 (86) |
| Рибавирин, n (%) | 24 (48) |
| Класс по Чайлд-Пью, n (%) | |
| В | 41 (82) |
| С | 9 (18) |
| Эластометрия печени, кПа, (диапазон), | 28,7 (14,6-70,0) |
| n=20 |
Биохимический ответ. Нормализация активности АЛТ и АСТ на момент последнего осмотра отмечена у 90% и 51% больных, соответственно (табл. 2). Медиана снижения активности АЛТ и АСТ к окончанию наблюдения составила 53 Ед/л и 43 Ед/л, соответственно.
| Показатели | Исходно | УВО | В конце наблюдения | р* | p** |
|---|---|---|---|---|---|
| Примечание: *достоверность различий показателей на момент УВО по сравнению с исходным, ** достоверность различий показателей в конце наблюдения по сравнению с исходными. ВРПВ - варикозное расширение вен пищевода | |||||
| Класс по Чайлд-Пью, n (%) | |||||
| A | 0 | 18 (36) | 26 (52) | <0,001 | <0,001 |
| B | 41 (80) | 24 (48) | 20 (40) | ||
| C | 9 (18) | 8 (16) | 4 (8) | ||
| Сумма баллов Чайлд-Пью (диапазон) | 8 (7-11) | 7 (5-11) | 6 (5-11) | <0,001 | <0,001 |
| Индекс MELD (диапазон) | 15 (8-21) | 14 (6-21) | 13 (8-19) | 0,001 | <0,001 |
| Тромбоциты, ×109/л (диапазон) | 69 (30-190) | 70 (34-187) | 74 (32-172) | 0,262 | 0,016 |
| Тромбоциты ≤90 ×109/л, n (%) | 40 (80) | 37 (74) | 33 (66) | 0,072 | 0,024 |
| Альбумин, г/л (диапазон) | 32 (21-40) | 34 (24-43) | 36,8 (23-47) | <0,001 | <0,001 |
| Альбумин ≤35 г/л, n (%) | 44 (88) | 35 (70) | 18 (36) | <0,001 | <0,001 |
| Общий билирубин, мкмоль/л (диапазон) | 33,5 (12,5-70,6) | 29,8 (7,5-70,0) | 25,2 (7,1-70,0) | 0,005 | 0,004 |
| Общий билирубин ≥21мкмоль/л, n (%) | 40 (80) | 34 (68) | 31 (62) | 0,018 | 0,007 |
| Холинэстераза, ед/л (диапазон) | 3553,5 (1014-6031) | 4117 (1240-6513) | 4477 (1274-8486) | 0,001 | <0,001 |
| Холинэстераза ≤3650 Ед/л, n (%) | 25 (50) | 19 (38) | 13 (26) | <0,001 | <0,001 |
| ПТИ, % (диапазон) | 59 (40-105) | 62 (43-105) | 66 (50-92) | 0,493 | 0,008 |
| ПТИ ≤70%, n (%) | 38 (76) | 33 (66) | 30 (60) | 0,083 | 0,020 |
| АЛТ, МЕ/л (диапазон) | 64 (24-266) | 28 (10-78) | 24 (7-78) | <0,001 | <0,001 |
| АЛТ ≥49 Ед/л, n (%) | 32 (64) | 11 (22) | 4 (8) | <0,001 | <0,001 |
| АСТ, МЕ/л (диапазон) | 75 (22-255) | 35 (20-104) | 33 (14-92) | <0,001 | <0,001 |
| АСТ ≥34 Ед/л, n (%) | 47 (94) | 28 (56) | 24 (48) | <0,001 | <0,001 |
| Асцит, n (%) | 35 (70) | 21 (42) | 21 (42) | <0,001 | <0,001 |
| Энцефалопатия, n (%) | 18 (35) | 17 (33) | 14 (28) | 0,218 | 0,139 |
| ВРВП, степень 2/3, n (%) | 33 (66) | 33 (66) | 35 (70) | 0,411 | 0,248 |
Белково-синтетическая функция печени. Сыво ро точ ный уровень альбумина повысился с 32 г/л [20,5-39,8] до 36,8 г/л [23,3-46,6] (p <0,001), медиана изменения составила +5,5 г/л. Уровень альбумина сыворотки нормализовался к концу наблюдения у 26 (59%) из 44 больных.
Уровень общего билирубина снизился с 33,5 [12,570,6] до 25,2 [7,1-70,0] мкмоль/л (p=0,004), медиана снижения составила 7,9 мкмоль/л. Уровень общего билирубина на момент последнего осмотра нормализовался 9 (22,5%) из 40 больных.
Активность холинэстеразы сыворотки увеличилась с 3554 [1014-6031] Ед/л до 4477 [1274-8486] Ед/л (р <0,001), медиана изменения составила +580 Ед/л. Уровень холинэстеразы нормализовался к концу наблюдения у 12 (48%) из 25 пациентов.
ПТИ увеличился с 59% [40-105] до 66% [50-92] (р=0,008), медиана изменения составила +10%. ПТИ нормализовался в 10 (26,3%) из 38 случаев.
Проявления портальной гипертензии. У 16 (45%) и 4 (11%) из 35 пациентов отмечено купирование и уменьшение выраженности асцита, соответственно (p <0,001). Количество тромбоцитов повысилось с 69 [30-190] ×109/л до 74 [32-175] ×109/л (p=0,016), медиана изменения составила +7,5×109/л. Достоверных различий в частоте и степени выраженности печеночной энцефалопатии и варикозно расширенных вен пищевода по сравнению с исходными данными не отмечено.
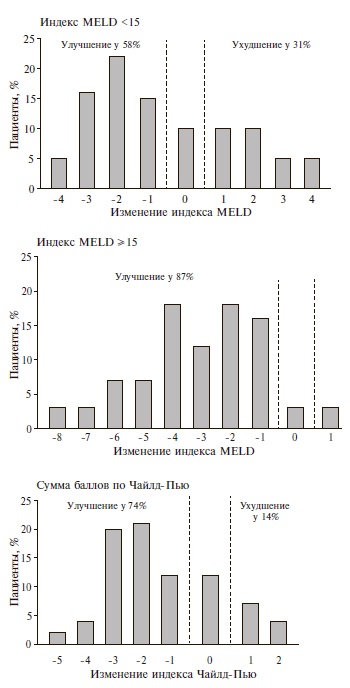
Изменения индекса MELD и Чайлд-Пью. Индекс MELD снизился у 39 (72%) пациентов, в среднем на 3 балла (от 1 до 7), увеличился – у 7 (16%), в среднем на 1,5 балла (от 1 до 6), и не изменился у 4 (12%). У 25 (80,6%) из 31 больного с исходным индексом MELD>15 баллов отмечено улучшение и у 3 (9,7%) – ухудшение показателя MELD (рис. 1).
У 26 (52%) больных отмечена компенсация заболевания (переход в класс А), у 8 (89%) больных с ЦП класса С по Чайлд-Пью – уменьшение выраженности декомпенсации (переход в класс B), у 3 (7,3%) больных – ухудшение состояния (переход в класс С). В целом, у 37 (74%) больных отмечено снижение суммы баллов по Чайлд-Пью, у 6 (12%) – увеличение, еще у 7 (14%) сумма баллов не изменилась (рис. 1).
Мужской пол (р=0,001), злоупотребление алкоголем (р=0,033), более высокие исходные значения индекса Чайлд-Пью (p <0,001) и MELD (p=0,002) и исходно низкий уровень альбумина (p=0,025) достоверно коррелировали с отсутствием компенсации ЦП.
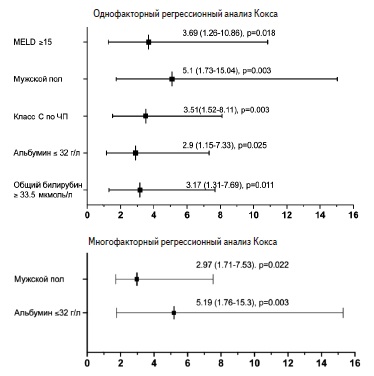
По данным однофакторного регрессионного анализа Кокса, мужской пол (отношение шансов [ОШ] 5,1, р=0,003), класс С по Чайлд-Пью (ОШ 3,51, р=0,003), индекс MELD ≥15 (ОШ 3,69, р=0,018), уровень альбумина ≤32 г/л (ОШ 2,9, р=0,025), общего билирубина ≥33,5 мкмоль/л (ОШ 3,17, р=0,011) достоверно ассоциировались с отсутствием компенсации ЦП при последнем осмотре (рис. 2). По данным многофакторного регрессионного анализа Кокса, мужской пол (ОШ 5,19, р=0,003) и уровень альбумина ≤32 г/л (ОШ 2,97, р=0,022) оказались независимыми факторами риска отсутствия компенсации ЦП (рис. 2).
Обсуждение
В данной работе мы представили результаты проспективного наблюдения за пациентами с декомпенсированным ЦП в течение от 6 до 42 мес (медиана 18 мес) после успешного лечения препаратами прямого противовирусного действия. Снижение индексов MELD и Чайлд-Пью отмечено у 72% и 74% больных, соответственно, компенсация ЦП – у 52%. Полученные результаты согласуются с рядом аналогичных работ. В частности, в исследовании Kozbial и соавт. через 48 недель после окончания лечения компенсация ЦП была достигнута у 54% из 76 больных, индекс MELD снизился в среднем с 12,3±2,2 до 10,6±2,3 (p <0,001) [15]. В другом исследовании снижение индекса MELD через 12 недель и в среднем через 48 недель после ПВТ наблюдалось, соответственно, у 68,1% и 83,4% из 25 больных с исходным его значением>14 [16]. В работе Essa и соавт. у 75 больных с декомпенсированным ЦП (класс В по Чайлд-Пью у 77,3%) через 6 месяцев после успешного лечения индекс MELD снизился в среднем на 1,73 балла (p <0,001), индекс Чайлд-Пью – с 8,37±1,19 до 7,14±1,58 (р<0,001), а у 40% пациентов отмечена компенсация ЦП. При этом среди 75 больных (класс В по Чайлд-Пью у 76,0%), не получавших ПВТ, индекс MELD ухудшился в среднем на 11,8 баллов, сумма баллов по Чайлд-Пью увеличилась с 8,41±1,22 до 10,16±2,64, а 26% пациентов перешли в класс С по Чайлд-Пью к концу наблюдения [17]. Компенсация ЦП после элиминации вируса в исследовании Gentile и соавт. отмечена в 61,8% случаев [18], а в крупном многоцентровом ретроспективном исследовании у 622 пациентов с декомпенсированным ЦП – только в 28% случаев [19]. Выявленные отличия в частоте компенсации ЦП в нашем и других исследованиях, вероятно, прежде всего, обусловлены разным количеством больных с исходно более тяжелым поражением печени (класс С по Чайлд-Пью), а также разной длительностью наблюдения после окончания лечения. Мы отметили улучшение большинства параметров функции печени в каждый контрольный момент времени и увеличение количества пациентов с компенсацией ЦП с 36% (на момент УВО) до 52% (к концу наблюдения), что может указывать на сохраняющийся потенциал улучшения печеночной функции в отдаленном периоде времени у некоторых пациентов после элиминации ВГС.
Заключение
В нашем исследовании активность АЛТ нормализовалась у 90% больных, однако у половины из них активность АСТ оставалась повышенной, что, вероятно, связано с нарушением функции синусоидальных клеток печени при ЦП и, как следствие, снижением захвата АСТ, а также наличием у этих больных более тяжелого повреждения гепатоцитов и высвобождением в кровоток, наряду с цитоплазматической, митохондриальной фракции АСТ [20-22]. Аналогичные результаты получены в другом исследовании, в котором среди 80 Эрадикация ВГС привела к снижению индексов MELD и Чайлд-Пью у большинства больных с декомпенсированным ЦП и компенсации заболевания (переход в класс А по Чайлд-Пью) у половины из них. Несмотря на нормализацию АЛТ у большинства больных, примерно в половине случаев АСТ оставалась повышенной. Установлено достоверное улучшение ряда параметров портальной гипертензии у большинства пациентов к концу наблюдения (повышение количества тромбоцитов, купирование или уменьшение асцита). Мужской пол и исходный уровень альбумина менее 32 г/л оказались независимыми факторами риска отсутствия компенсации ЦП. Таким образом, наше исследование демонстрирует эффективность и безопасность ПВТ у больных ХГС и декомпенсированным ЦП. Однако, требуется дальнейшее изучение влияния эрадикации вируса на прогноз и выживаемость у данной группы пациентов в рамках более крупных и длительных исследований.
Используемые источники
- Sangiovanni A, Prati GM, Fasani P, et al. The natural history of compensated cirrhosis due to hepatitis C virus: a 17-year cohort study of 214 patients. Hepa to logy 2006;43(6):1303-10.
- Toshikuni N, Izumi A, Nishino K, et al. Comparison of outcomes between patients with alcoholic cirrhosis and those with hepatitis C virus-related cirrhosis. J Gastroenterol Hepatol 2009;24:1276–83.
- McDonald SA, Innes HA, Aspinall E, et al. Prognosis of 1169 hepatitis C chronically infected patients with decompensated cirrhosis in the predirect-acting antiviral era. J Viral Hepat 2017;24(4):295-30.
- Planas R, Balleste B, Alvarez M, et al. Natural history of decompensated hepatitis C virus related cirrhosis: a study of 200 patients. J Hepatol 2004;40:823–30.
- Shiratori Y, Ito Y, Yokosuka O, et al. Antiviral therapy for cirrhotic hepatitis C: association with reduced hepatocellular carcinoma development and improved survival. Ann Int Med 2005;142(2):105-14.
- Bruno S, Stroffolini T, Colombo M etal. Sustained virological response to interferon-alpha is associated with improved outcome in HCV related cirrhosis: a retrospective study. Hepatology 2007;45:579–87.
- Aleman S, Rahbin N, Weiland O, et al. A risk for hepatocellular carcinoma persists long-term after sustained virologic response in patients with hepatitis C – associated liver cirrhosis. Clin Infect Dis 2013;57:230-6.
- Charlton M, Everson GT, Flamm SL, et al. Ledipasvir and sofosbuvir plus ribavirin for treatment of HCV infection in patients with advanced liver disease. Gastroenterology 2015;149:649–59.
- Manns M, Samuel D, Gane EJ, et al. Ledipasvir and sofosbuvir plus ribavirin in patients with genotype 1 or 4 hepatitis C virus infection and advanced liver disease: a multicentre, open-label, randomised, phase 2 trial. Lancet Infect Dis 2016;16:685–97.
- Poordad F, Schi ER, Vierling JM, et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation recurrence. Hepatology 2016;63:1493–505.
- Curry MP, O’Leary JG, Bzowej N, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015;373:2618–28.
- Deterding K, Honer zu Siederdissen C, Port K, et al. Improvement of liver function parameters in advanced HCV – associated liver cirrhosis by IFN-free antiviral therapies. Aliment Pharmacol Ther 2015;42:889–901.
- Foster GR, Irving WL, Cheung MC, et al. Impact of direct acting antiviral therapy in patients with chronic hepatitis C and decompensated cirrhosis. J Hepatol 2016;64:1224–31.
- Pascasio JM, Vinaixa C, Ferrer MT, et al. Clinical outcomes of patients undergoing antiviral therapy while awaiting liver transplantation. J Hepatol 2017;67(6): 1168-76.
- Kozbial K, Moser S., Al-Zoairy R, et al. Follow-up of sustained virologic responders with hepatitis C and advanced liver disease after interferon/ribavirin-free treatment. Liver Int 2018;38(6):1028-35.
- Mazzarelli C, Carey I, Childs K, et al. Predictors of clinical improvement among HCV patients with advanced liver disease treated with DAA: a single center experience. J Hepatol 2018;68(1):S537.
- Sabry A, Abdelsameea E, Tharwa E, et al. Impact of new direct-acting antiviral drugs on hepatitis C virus-related decompensated liver cirrhosis. Eur J Gastro ente rol Hepatol 2019;31(1):53-8.
- Gentile I, Scotto R, Coppola C, et al. Treatment with direct-acting antivirals improves the clinical outcome in patients with HCV-related decompensated cirrhosis: results from an Italian real-life cohort (Liver Network Activity-LINA cohort). Hepatol Int 2019;13(1):66-74.
- El-Sherif O, Gordon Jiang Z, Tapper EB, et al. Baseline factors associated with improvements in decompensated cirrhosis after direct-acting antiviral therapy for hepatitis C virus infection. Gastroenterol 2018;154:2111-21.
- Giannini E, Botta F, Fasoli A, et al. Progressive liver functional impairment is associated with an increase in AST/ALT ratio. Dig Dis Sci 1999;44(6):1249-53.
- Sheth SG, Flamm SL, Gordon FD, et al. AST/ALT ratio predicts cirrhosis in patients with chronic hepatitis C virus infection. Am J Gastroenterol 1998;93: 44–8.
- Park GJ, Lin BP, Ngu MC, et al. Aspartate aminotransferase: alanine aminotransferase ratio in chronic hepatitis C infection: is it a useful predictor of cirrhosis? J Gastroenterol Hepatol 2000;15:386–90.
- Romano J, Sims OT, Richman J, et al. Resolution of ascites and hepatic encephalopathy and absence of variceal bleeding in decompensated hepatitis C virus cirrhosis patients. JGH Open 2018;2(6):317-21.
