Клиническое значение атипичных антинейтрофильных антител у пациентов с АНЦА-ассоциированными васкулитами
Определить частоту выявления и клиническое значение атипичных антинейтрофильных цитоплазматических антител (АНЦА) к лизосомальному мембранному гликопротеину 2 (LAMP2) у пациентов с АНЦА-ассоциированными васкулитами (ААВ).
В исследование были включены 59 пациентов (22 мужчины и 37 женщин, средний возраст 52,5±14,3 лет) с впервые диагностированным ААВ (n=35) или рецидивом заболевания (n=24). Диагноз заболевания устанавливали в соответствии с критериями Американской коллегии ревматологов и/или определением, принятом на конференции в Чапел-Хилле в 2012 г. Дополнительным критерием включения была величина суммарного балла BVAS (v.3) ≥3. Контрольную группу составили 36 здоровых добровольцев, сопоставимых по полу и возрасту. Концентрацию АНЦА к протеиназе-3, миелопероксидазе и LAMP-2 определяли с помощью иммуноферментного анализа.
На основании анализа концентрации антител к LAMP-2 в контрольной группе был установлен верхний порог референсных значений, равный 48,9 нг/мл. Медиана концентрации антител к LAMP-2 в группе пациентов с ААВ (42,1 нг/мл) была достоверно выше, чем в контрольной группе (37,1 нг/мл, p<0,001), однако она превышала пороговое значение только у 6 (10,1%) из 59 пациентов. После достижения ремиссии ААВ концентрация антител к LAMP-2 достоверно не изменилась (p=0,079). В то же время, АНЦА к протеиназе-3 и миелопероксидазе были выявлены у 89,8% пациентов с ААВ.
Полученные данные демонстрируют низкую информативность концентрации атипичных АНЦА к LAMP-2 в оценке активности ААВ.
Васкулиты, ассоциированные с антителами к цитоплазме нейтрофилов (AНЦА), представляют собой группу системных аутоиммунных заболеваний, характерными чертами которых являются некротизирующее поражение стенок преимущественно мелких сосудов и наличие AНЦA к протеиназе-3 (ПР3) или миелопероксидазе (MПO) в циркуляции. АНЦА активируют праймированные нейтрофилы, которые оказывают повреждающее действие на мелкие сосуды, что считают одним из ключевых этапов патогенеза АНЦА-ассоциированных васкулитов (ААВ) [1]. У части пациентов с ААВ, прежде всего с локальным вариантом гранулематоза с полиангиитом и эозинофильным гранулематозом с полиангиитом, обнаружить АНЦА в сыворотке крови не удается. Кроме того, концентрация антител плохо коррелирует с активностью заболевания и не позволяет надежно прогнозировать рецидивы ААВ. Помимо ПР3 и МПО, AНЦА могут быть направлены против других молекул, входящих в состав нейтрофилов, в том числе эластазы, дефензина, лактоферрина, α-енолазы, азуроцидина, бактерицидного белка, повышающего проницаемость, катепсина G и лизосомального мембранного гликопротеина-2 (LAMP-2). Патогенетическое значение этих аутоантител (так называемых атипичных АНЦА) остается неясным.
Основные функции LAMP-2, гликозилированного мембранного белка, экспрессируемого в лизосомах и на поверхности нейтрофилов и эпителия почечного клубочка, – поддержание целостности лизосом, регуляция молекулярного транспорта через мембраны лизосом и слияния лизосом с фагосомой, опосредованная шапероном аутофагия и презентация [2]. Генетический дефицит LAMP-2 у пациентов с болезнью Данона приводит к тяжелому поражению сердца и мышечной ткани, опосредованному дисфункцией лизосом. Антитела к LAMP-2 были первоначально обнаружены Kain и соавт. у 13 из 15 пациентов с активным ААВ и малоиммунным гломерулонефритом с полулуниями [3]. В экспериментальных работах было показано, что пассивная иммунизация рекомбинантным кроличьим иммуноглобулином G к LAMP-2 или активная иммунизация рекомбинантным FimH, бактериальным адгезивным белком грамотрицательных бактерий, имеющим один общий с LAMP-2 эпитоп, могут индуцировать развитие малоиммунного гломерулонефрита с полулуниями у крыс, что подтверждает участие антител к LAMP-2 в патогенезе заболевания [4]. Однако результаты клинических исследований, в которых изучалось значение антител к LAMP-2 у пациентов с ААВ, оказались противоречивыми.
Целью исследования было изучение частоты выявления и клинического значения антител к LAMP-2 у пациентов с активным ААВ.
Материал и методы
В исследование включали пациентов с впервые диагностированным ААВ или рецидивом заболевания, у которых суммарный Бирмингемский индекс активности васкулита (BVAS, v.3) составлял по крайней мере 3 балла. Диагноз гранулематоза с полиангиитом (ГПА) и микроскопического полиангиита (МПА) устанавливали в соответствии с критериями Американской коллегии ревматологов (1990 г.) и/или определением, принятом на конференции в ЧапелХилле в 2012 г. [5,6]. Пациентов с эозинофильным гранулематозом с полиангиитом в исследование не включали. Все пациенты были набраны в Клинике им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова (г. Москва) и Влади мирской областной клинической больнице. Контрольную группу составили 36 здоровых добровольцев, в том числе 9 мужчин и 27 женщин в возрасте в среднем 55,7±12,4 года. Все участники исследования дали письменное информированное согласие, одобренное локальным этическим комитетом Первого МГМУ им. И.М. Сеченова.
У всех пациентов основной и контрольной групп были взяты образцы сыворотки крови, которые хранили при температуре -80° С. У 28 пациентов исследуемой группы забор сыворотки крови повторили через 3-38 мес. (медиана 16 мес.) после достижения ремиссии заболевания. Коли чест венное определение АНЦА проводили методом иммуноферментного анализа (ИФА; АНЦА к ПР3 и МПО). Концентрацию антител к LAMP-2 определяли с использованием коммерческого набора ИФА (Wuhan Fine Biotech Co., Ltd., КНР) в соответствии с инструкцией производителя. Оптическую плотность определяли при 450 нм с использованием планшет-ридера для микротитрования. Для определения концентрации (нг/мл) неизвестного образца была использована стандартная кривая. Чувстви тельность коммерческого набора составляла 1,0 нг/мл.
Серопозитивность к антителам LAMP-2 определяли как значение, превышающее верхнюю границу доверительного интервала (97,5-й процентиль) контрольной группы после логарифмического преобразования первичных данных [7].
Статистический анализ проводился с использованием статистической программы IBM SPSS Statistics версии 18.0. Нормальность распределения тестировали при помощи критерия Шапиро-Уилка. Данные для количественных показателей с нормальным распределением представлены в виде среднего арифметического и стандартного отклонения (М±m). Данные для количественных показателей с распределением , отличавшимся от нормального, приведены в виде медианы и межквартильного размаха. Данные для показателей с номинальным (качественным) типом шкалы представлены в виде абсолютных частот и доли в группе в процентах. Оценку значимости различий при отклонении распределения от нормального в группах для независимых количественных переменных проводили при помощи критерия Манна-Уитни, для связанных количественных переменных – при помощи критерия Уилкоксона. Значимыми считали различия при p<0,05.
Результаты
Характеристика больных. В исследование были включены 59 пациентов, в том числе 22 мужчины и 37 женщин (средний возраст 52,5±14,3 лет), с впервые диагностированным ААВ или рецидивом заболевания (табл. 1). У 6 пациентов с АНЦА-негативным локализованным вариантом ГПА диагноз был подтвержден при морфологическом исследовании. У всех пациентов имелся активный васкулит, а медиана индекса BVAS составила 16,5. У 35 больных ААВ был диагностирован впервые. У 23 из них к моменту забора сыворотки крови уже была начата иммуносупрессивная терапия глюкокортикостероидами и иммуносупрессивными препаратами по месту жительства (табл. 1), в то время как 12 пациентов не получали лечение до момента забора биообразцов. Двадцать четыре пациента с рецидивом ААВ продолжали поддерживающую иммуносупрессивную терапию глюкокортикостероидами и/или цитостатиками на момент обследования.
| Показатели | Величина |
|---|---|
| Примечание: *Медиана дозы преднизолона – 12 (13; 22) мг. **Индукционная терапия: ритуксимаб (n=4), циклофосфамид (n=20), метотрексат (n=3) или микофенолата мофетил (n=1). ***Поддерживающая терапия: монотерапия глюкокортикоидами (n=12), азатиоприн (n=8), метотрексат (n=2) или микофенолата мофетил (n=2). | |
| Женщины, n (%) | 37 (62,7) |
| Средний возраст, лет | 52,5±14,3 |
| Диагноз, n (%) | |
| ГПА | 41 (69,5) |
| МПА | 18 (30,5) |
| Впервые диагностированный ААВ, n (%) | 35 (59,3) |
| Висцеральные поражения, n (%) | |
| Легкие | 29 (49,1) |
| Почки | 37 (62,7) |
| ЛОР-органы | 38 (64,4) |
| Орган зрения | 14 (23,7) |
| АНЦА, n (%) | |
| ПР3 | 36 (61,0) |
| МПО | 13 (22,0) |
| Неизвестной специфичности | 4 (6,8) |
| Отрицательные | 6 (10,2) |
| Предшествующая иммуносупрессия, n (%) | 47 (79,7) |
| Глюкокортикостероиды* | 47 |
| Индукционная терапия** | 23 |
| Поддерживающее лечение*** | 24 |
| Лабораторные показатели | |
| Креатинин сыворотки, мкмоль/л | 105,2 (95,7, 200,7) |
| СОЭ, мм/ч | 55,0 (38,0, 64,0) |
| С-реактивный белок, мг/л | 10,2 (9,8, 36,7) |
| BVAS | 16,5 (13,6, 16,9) |
Результаты определения антител к LAMP-2. У пациентов с AAВ медиана концентрации антител к LAMP-2 (42,1 нг/мл) была достоверно выше, чем в контрольной группе (37,1 нг/мл, р<0,001; рис. 1). Используя данные контрольной группы, верхнее пороговое референсное значение концентрации антител к LAMP-2 было установлено на уровне 48,9 нг/мл. Концентрация антител к LAMP-2 превышала пороговое значение только у 6 (10,1%) из 59 пациентов с активным ААВ, причем лишь у одного из них повышение концентрации было выраженным (рис. 1). В то же время концентрации АНЦА к ПР3 или MПO были повышенными у 53 (89,8%) пациентов с активным ААВ.
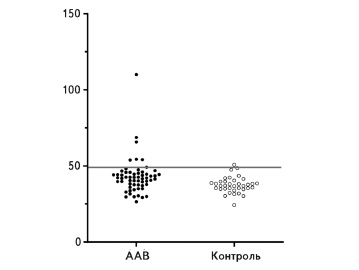
Все пациенты, у которых был повышен уровень антител к LAMP-2, были серопозитивными по ПР3АНЦА. Однако медиана концентрации антител к LAMP-2 была сопоставимой у пациентов с ПР3-АНЦА (41,4 нг/мл) и МПО-АНЦА (44,2 нг/мл, p=0,884). Ни у одного из шести АНЦА-негативных пациентов не было обнаружено повышения антител к LAMP-2. Кроме того, среди 12 пациентов с впервые установленным диагнозом AAВ, которые не получали какую-либо иммуносупрессивную терапию, антитела к LAMP-2 были обнаружены только в 1 (8,3%) случае.
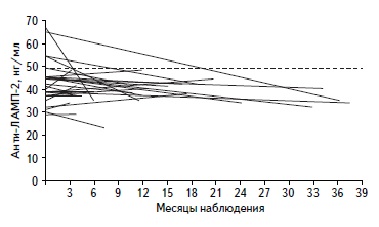
Результаты повторного определения антител к LAMP-2. У 28 пациентов c ААВ концентрацию антител к LAMP-2 определяли повторно через 3-38 мес. (медиана 16 мес.) после достижения ремиссии заболевания на фоне иммуносупрессивной терапии. В целом медиана концентрации антител к LAMP-2 достоверно не отличалась в активную фазу и в фазу ремиссии ААВ: 44,0 (38,76, 45,41) и 39,8 (35,96, 43,38) нг/мл, соответственно (p=0,079). У всех 6 пациентов с ААВ, серопозитивных по антителам к LAMP-2, концентрация антител нормализовалась после достижения ремиссии, однако у одного серонегативного пациента она увеличилась после достижения ремиссии и при контрольном обследовании превысила пороговое значение (рис. 2).
Обсуждение
Результаты нашего исследования свидетельствуют о том, что антитела к LAMP-2 не могут быть использованы для оценки активности ААВ и, по всей видимости, играют незначительную роль в патогенезе заболевания. Хотя медиана концентрации антител к LAMP-2 в основной группе достоверно превышала таковую в контрольной группе, уровни антител были выше референсного значения лишь у 10,6% пациентов с рецидивирующим AAВ и у 8,3% пациентов с впервые диагностированным васкулитом. Кроме того, даже у этих пациентов степень повышения концентрации антител к LAMP-2 была умеренной, в то время как АНЦА к ПР3 и МПО были обнаружены в высоких титрах у 90% пациентов с активным AAВ. Антитела к LAMP-2 также не имели диагностической ценности у пациентов с АНЦА-отрицательным вариантом AAВ. После достижения ремиссии наблюдалось статистически незначимое изменение средних уровней антител к LAMP-2, хотя у 6 серопозитивных пациентов была отмечена нормализация их концентрации.
В отличие от нашего исследования, в работе Kain и соавт. антитела к LAMP-2 были обнаружены у 80-91% из 64 пациентов с впервые диагностированным AAВ, причем была показана высокая частота совпадения результатов их определения (80,5%) тремя различными методами, включая ИФА, вестерн-блоттинг и реакцию непрямой иммунофлюоресценции [8]. Частота выявления антител к LAMP-2 была сопоставимой у пациентов с антителами к МПО и ПР3. Уровень антител к LAMP2 быстро снижался после начала иммуносупрессивной терапии и нередко вновь нарастал во время рецидива заболевания. Следует отметить, что антитела к LAMP-2 не были выявлены у всех пациентов с другими заболеваниями почек и у 90% пациентов с системной красной волчанкой. В более позднем исследовании Peschel и соавт. обнаружили антитела к LAMP-2 у 8 (73%) из 11 пациентов с АНЦА-отрицательным малоиммунным фокальным некротизирующим гломерулонефритом [9]. В нашей работе индукционная иммуносупрессивная терапия также приводила к быстрому снижению концентрации антител к LAMP-2 ниже порогового значения у серопозитивных пациентов, но в то же время у одного пациента повышение концентрации антител к LAMP-2 было зарегистрировано после достижения ремиссии. При этом предшествующая иммуносупрессия не может объяснить отсутствие антител к LAMP-2 при активном ААВ, учитывая очень низкую частоту их выявления и у пациентов с впервые диагностированным AAВ.
Результаты исследования Kain и соавт. не были подтверждены в работе Roth и соавт., которые определяли антитела к LAMP-2 у 671 пациента из двух американских центров с помощью коммерческого набора ИФА [10]. Референсный диапазон концентрации антител был установлен на основании результатов обследования контрольной группы здоровых добровольцев. Антитела к LAMP-2 были обнаружены у 21% из 329 АНЦА-позитивных пациентов с малоиммунным гломерулонефритом с полулуниями, у 29% из 104 АНЦА-негативных пациентов с малоиммунным гломерулонефритом с полулуниями и у 16% из 104 пациентов с инфекцией мочевых путей, вызванной FimH-положительными бактериями. В целом титры антител к LAMP-2 были низкими, значимо не различались у пациентов с ПР3-АНЦА или МПО-АНЦА и не коррелировали с показателями активности заболевания. Кроме того, наличие антител к LAMP-2 не было подтверждено методом вестерн-блоттинга или в реакции непрямой иммунофлюоресценции. У крыс линии Wistar Kyoto, которым вводили антитела к LAMP-2, не было отмечено развития гломерулонефрита. Последнее представляется немаловажным, поскольку роль МПО-АНЦА в патогенезе ААВ была доказана в том числе благодаря успешным экспериментам на мышиных моделях [11].
Различные методики определения антител могут по крайней мере частично объяснить противоречивые результаты разных исследований [12]. Kain и Rees предположили, что наблюдаемые противоречия могут быть разрешены после разработки надежных стандартизованных методов определения антител к LAMP-2, которые пока отсутствуют [2]. Тем не менее, результаты исследования Roth и соавт. [10] и нашего исследования свидетельствуют о том, что антитела к LAMP-2 не имеют существенного значения у пациентов с ААВ. Хорошо известно, что результаты более половины научных исследований не подтвержаются в последующих работах [13]. Причем следует учитывать, что исследования с отрицательными результатами публикуются реже и спустя больший промежуток времени, чем работы с положительными результатами [14].
Наше исследование имеет ряд ограничений. Количество пациентов было относительно небольшим, однако выборка была достаточной для проведения статистического анализа и репрезентативной по отношению к общей популяции пациентов с AAВ, поскольку включала в себя пациентов с МПО-АНЦА и ПР3АНЦА, рецидивирующим или недавно диагностированным AAВ и АНЦА-отрицательным вариантом заболевания. Более того, почти у половины пациентов определение антител было выполнено повторно после индукции ремиссии с использованием различных иммунодепрессантов. Учитывая очень низкую частоту выявления антител к LAMP-2, вряд ли, следует ожидать иных результатов в более крупных исследованиях.
Заключение
Результаты нашего исследования свидетельствуют о том, что антитела к LAMP-2 не следует использовать для оценки активности заболевания у пациентов с AAВ.
Используемые источники
- Nakazawa D, Masuda S, Tomaru U, Ishizu A. Pathogenesis and therapeutic interventions for ANCA-associated vasculitis. Nat Rev Rheumatol 2019;15:91-101.
- Kain R, Rees AJ. What is the evidence for antibodies to LAMP-2 in the pathogenesis of ANCA associated small vessel vasculitis? Curr Opin Rheumatol 2013;25:26-34.
- Kain R, Matsui K, Exner M, et al. A novel class of autoantigens of antineutrophil cytoplasmic antibodies in necrotizing and crescentic glomerulonephritis: the lysosomal membrane glycoprotein h-lamp-2 in neutrophil granulocytes and a related membrane protein in glomerular endothelial cells. J Exp Med 1995;181:585-97.
- Kain R, Exner M, Brandes R, et al. Molecular mimicry in pauci-immune crescentic glomerulonephritis. Nat Med 2008;14:1088-96.
- Leavitt RY, Fauci AS, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener's granulomatosis. Arthritis Rheum 1990;33:1101-7.
- Jennette JC. Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides. Clin Exp Nephrol 2013;17:603-6.
- Sasse EA, Doumas BT, Miller WG, et al. How to define and determine reference intervals in the clinical laboratory: approved guideline – second edition. NCCLS document C28-A2. NCCLS, USA 2000:13-21.
- Kain R, Tadema H, McKinney EF, et al. High prevalence of autoantibodies to hLAMP 2 in anti-neutrophil cytoplasmic antibody-associated vasculitis. J Am Soc Nephrol 2012;23:556-66.
- Peschel A, Basu N, Benharkou A, et al. Autoantibodies to hLAMP-2 in ANCAnegative pauci-immune focal necrotizing GN. J Am Soc Nephrol 2014;25:455-63.
- Roth AJ, Brown MC, Smith RN, et al. Anti LAMP 2 antibodies are not prevalent in patients with antineutrophil cytoplasmic autoantibody glomerulonephritis. J Am Soc Nephrol 2012;23:545-55.
- Xiao H, Heeringa P, Hu P, et al. Antineutrophil cytoplasmic autoantibodies specific for myeloperoxidase cause glomerulonephritis and vasculitis in mice. J Clin Invest 2002;110:955–63.
- Fervenza F, Specks U. Will LAMP enlighten us about ANCA-associated vasculitis? Nat Rev Nephrol 2012;8:318-20.
- Begley CG, Ellis LM. Drug development: Raise standards for preclinical cancer research. Nature 2012;483:531-3.
- Hopewell S, Loudon K, Clarke MJ, et al. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database Syst Rev 2009;1:MR000006.
