«Терапевтическое окно» лабораторной эффективности антитромбоцитарной терапии результаты субанализа регистра острого Коронарного синдрома реальной клинической практики (КАРДИО-ЦКБ)
Определить оптимальные границы эффективности и безопасности значений агрегации тромбоцитов у больных c острым коронарным синдромом (ОКС), получающих двойную антитромбоцитарную терапию.
В рамках одноцентрового проспективного когортного регистра (КАРДИО-ЦКБ) у 425 больных с подтвержденным ОКС определяли функциональную активность тромбоцитов (ФАТ) с помощью световой агрегатометрии (Chrono-Log Corporation, США). Исходы заболевания фиксировали в 30-дневный срок после индексного события и сопоставляли с результатами исследования ФАТ. Полученные данные использовали для определения границ "терапевтического окна" на фоне применения антиагрегантов.
Верхняя граница "терапевтического окна" значений агрегации тромбоцитов, отражающая допустимый предел риска событий ишемической природы, составил 45%. При определении нижней границы терапевтического окна, отражающей предел в отношении геморрагического риска, следует ориентироваться на значение 30%. Нижний предел границы "терапевтического окна" требует дальнейших дополнительных исследований.
Оптимальное значение "терапевтического окна" показателей агрегации тромбоцитов у больных ОКС находится в диапазоне 30–45%.
Опубликовано большое количество проспективных и обсервационных исследований, в которых изучалась связь функциональной активности тромбоцитов (ФАТ) с частотой неблагоприятных исходов болезни [1-9]. По данным четырех независимых мета-анализов, высокая остаточная реактивность тромбоцитов (ВОРТ) ассоциирована с повышенным риском нефатального инфаркта миокарда (ИМ), определенного или предполагаемого тромбоза стента и сердечно-сосудистой смерти [1013]. Однако мнения исследователей по поводу ВОРТ остаются противоречивыми, что тормозит внедрение методов ее оценки в клиническую лабораторную практику [14].
Имеющиеся данные показывают, что клинические результаты определения ФАТ на фоне приема антитромбоцитарного препарата/препаратов зависят от используемого лабораторного метода. В исследовании POPULAR проводилось сравнение 8 лабораторных методов исследования ФАТ у 1069 пациентов, получающих клопидогрел после чрескожного вмешательства на коронарных артериях (ЧКВ). Только 4 метода (LTA 5 и 20 мкмоль АДФ, VerifyNow, PlateletWorks) позволяли определить ВОРТ, которая была связана с риском развития неблагоприятных сердечно-сосудистых событий [6].
Значимым параметром, влияющим на результат и его ассоциацию с клиническими исходами, является доза индуктора для открытых тест-систем [15]. Считается, что использование высокой концентрации индуктора (20 мкмоль) не позволяет провести оценку “тонких" параметров ФАТ, но приемлемо для определения остаточной активности тромбоцитов на фоне приема антиагреганта и обладает более высокой воспроизводимостью и низкой вариабельностью при повторном выполнении исследования [16].
Исследование ФАТ в первые несколько часов после получения больными с ОКС нагрузочных доз препарата несет высокий риск получения ложноположительного результата, так как большое количество пациентов попадает в зону ВОРТ [15,17]. Однако показано, что у таких больных в течение от 24 ч до пяти суток отмечается значимое снижение ФАТ по сравнению с исходным показателем, зарегистрированным в первые часы после начала заболевания [17].
Клиническая характеристика исследуемой группы больных имеет большое значение при исследовании ФАТ. Средний уровень ФАТ в популяции здоровых добровольцев и пациентов с различными сердечнососудистыми заболеваниями, имеет существенные различия. Средний исходный уровень (до назначения антитромботической терапии) АДФ-индуцированной агрегации тромбоцитов у пациентов с ИМ был достоверно выше, чем у здоровых добровольцев [18]. Можно ожидать различий в показателях ФАТ и среди больных ОКС в зависимости от доли лиц с состоявшимся ИМ, типа ИМ, стратегии лечения (инвазивная/консервативная) и других факторов. Иными словами, в идеальных условиях для каждой группы сердечно-сосудистого риска необходимо иметь свое целевое значение ФАТ.
Целью исследования было определение оптимальных границ эффективности и безопасности значений агрегации тромбоцитов у больных c ОКС, получающих двойную антитромбоцитарную терапию.
Материал и методы
Исследование является частью одноцентрового проспективного когортного регистра “КАРДИО-ЦКБ" и прово дилось в Центральной клинической больнице с поликлиникой Управления делами Президента РФ в период с 22 декабря 2012 по 30 декабря 2015 года. В исследование включались все последовательно поступавшие в клинику больные с ОКС. Решение о выборе инвазивного или консервативного метода ведения пациента принималось лечащим врачом. Схема исследования представлена на рис. 1. Исследование проводилось в соответствии с этическими принципами Хельсинской декларации Всемирной Медицинской Ассоциации (в редакции 2008 г.), правилами Надлежащей клинической практики, принятыми на Международной конференции по гармонизации технических требований, предъявляемых к фармацевтическим продуктам для применения у человека (ICH GCP), национальным стандартом о Надлежащей клинической практике (ГОСТ Р 52379-2005) и другими нормативными требованиями в РФ [24].
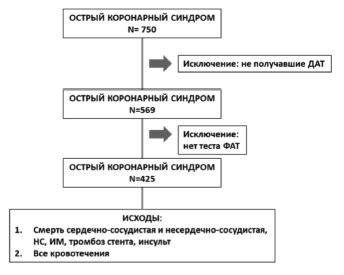
Критерии отбора. В исследование включали пациентов с ОКС с подъемом сегмента ST и без подъема сегмента ST с давностью последних симптомов заболевания не более 24 ч до момента госпитализации. Также допускалось включение пациентов, соответствующих критериям ИМ, но отнесенных к категориям ИМ 2 типа по классификации III универсального определения ИМ [19].
Конечные точки. Оценка исходов проводилась на 30-й день от индексного события. К первичным конечным точкам относили случаи смерти вследствие cердечно-сосудистых и несердечно-сосудистых причин, определенный и/или предполагаемый тромбоз стента, нефатальный ИМ с подъемом сегмента ST или без подъема сегмента ST рецидивирующего течения, эпизод нестабильной стенокардии, ишемический инсульт. К предполагаемому тромбозу стента относили все подозрительные случаи, соответствующие критериям Консорциума по академическим исследованиям ARC [20]. Кроме этого, все случаи ИМ были распределены и оценены в соответствие с классификацией III универсального определения ИМ [19].
К первичной конечной точке безопасности относили все случаи кровотечений, возникшие во время первичной госпитализации. Кроме этого, была проведена дополнительная оценка риска развития больших кровотечений, соответствовавших типу 3 и 5 по шкале BARC (Bleeding Academic Research Consortium) [21].
Определение ФАТ. Для определения ФАТ использовали метод световой трансмиссионной агрегатометрии, имеющей статус “золотого стандарта". Методика была стандартизирована в соответствие с действующими регламентами. Основываясь на результатах предыдущих работ, были выбраны оптимальные сроки для забора крови – от 24 ч до 5 суток [17,18]. Исследование агрегации тромбоцитов проводилось на агрегометре Chronolog 700 (CHRONO-LOG Corporation, США) с использованием дозы индуктора АДФ 20 мкмоль, обеспечивающей высокую воспроизводимость теста. Методика исследования соответствовала Рекомен дациям по стандартизации световой трансмиссионной агрегатометрии Международного общества по тромбозу и гемостазу 2013 года и Североамериканским рекомендациям для медицинских лабораторий, определяющих и интерпретирующих ФАТ, 2010 года [22,23]. Исследование агрегации тромбоцитов проводили в течение 6 минут. Ориенти ровались на показатель максимальной агрегации тромбоцитов.
Статистический анализ. Результаты приведены в виде средних значений и стандартных отклонений или медианы с верхним и нижним квартилем в случае нормального и асимметричного распределения данных. Для проведения многофакторного логистического регрессионного анализа и выявления независимых факторов риска развития неблагоприятных событий использовали переменные, полученные с помощью однофакторного логистического регрессионного анализа. Анализ кумулятивной выживаемости осуществляли по методу Каплана-Мейера, различия между кривыми выживаемости определяли с помощью критерия log-rank. Для выявления независимых факторов, ассоциированных с риском неблагоприятных событий, использовали регрессионную модель Кокса с пошаговой селекцией независимых переменных. Статистически значимыми считали межгрупповые различия и значения коэффициентов регрессии при показателе р<0,05. Статистический анализ выполнялся с помощью программного пакета SPSS Statistics версии 23.0 (SPSS Inc., USA) и STATISTICA версии 10 (Stat Soft. Inc., USA).
Результаты
ФАТ определяли у 425 (74,6%) из 569 пациентов, принявших участие в исследовании (табл. 1). Средний возраст обследованных пациентов составил 71,2±13,2 года. Больные были разделены на группы со значением ФАТ в ответ на 20 мкмоль АДФ на фоне приема двойной антитромбоцитарной терапии ≤45% (n=308) и >45% (n=117). Причины выбора такого порогового значения обсуждаются ниже. У значительной части больных, составивших обе группы, в анамнезе имелись сердечнососудистые заболевания, в том числе цебероваскулярные события (10,6%), сахарный диабет (15,2%), реваскуляризация (40,0%), что указывало на высокий риск неблагоприятных исходов.
| Параметр | ФАТ≤45% (n=308) |
ФАТ>45% (n=117) |
p |
|---|---|---|---|
| Примечание: ИМТ - индекс массы тела, АКШ - аорто-коронарное шунтирование. | |||
| Возраст, лет, | 68,54±0,71 | 73,16±1,29 | 0,001 |
| Мужчины, n (%) | 116 (37,7) | 85 (72,6) | 0,64 |
| ИМТ, кг/м2 | 28,52±0,24 | 28,97±0,40 | 0,32 |
| Сердечно-сосудистые заболевания, % |
|||
| ИМ | 32,0 | 41,3 | 0,69 |
| ИМ с подъемом ST | 18,4 | 15,5 | 0,27 |
| ИМ с кардиогенным шоком | 1,3 | 2,6 | 0,61 |
| ЧКВ | 36,5 | 34,9 | 0,44 |
| Нестабильная стенокардия | 5,8 | 5,1 | 0,70 |
| Анамнез АКШ | 9,3 | 10,3 | 0,83 |
| Фибрилляция предсердий | 11,6 | 22,4 | 0,08 |
| Артериальная гипертония | 88,9 | 90,5 | 0,91 |
| Сердечная недостаточность | 17,7 | 33,6 | 0,06 |
| Баллы по шкале GRACE | 126,4 | 126,9 | 0,89 |
| Баллы по шкале CRUSADE | 10,4 | 11,5 | 0,27 |
Для определения верхних пороговых значений агрегации, отделяющей зону повышенного ишемического риска, были построены гистограммы частоты распределения больных в зависимости от степени ФАТ (рис. 2). С учетом агрегации больные распределяются компактно и слегка асимметрично с положительным коэффициентом асимметрии, что позволяет использовать методы параметрический статистики для анализа этой переменной. Использование ROC-модели с последующим построением кривых чувствительности и специфичности позволило определить верхнее пороговое значение показателя агрегации тромбоцитов для прогнозирования неблагоприятных сердечно-сосудистых событий.
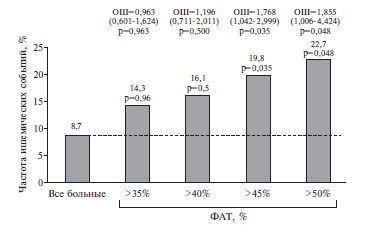
В качестве оптимального критического значения, т.е. значения, разделяющего прогнозы на “благоприятный" и “неблагоприятный", использовался критерий по равенству чувствительности и специфичности. Критическое значение ФАТ у пациентов, у которых были зарегистрированы неблагоприятные сердечнососудистые исходы, составило 48,8% с площадью под ROC-кривой 75,8%. Полученное значение характеризуется высокой степенью достоверности (p=0,005). Критическое пороговое значение агрегации, соответствующее нечувствительности к двойной антитромбоцитарной терапии, составило 44,5%. Однако при разделении пациентов на квартили по уровню ФАТ (>35%, >40%, >45%, >50%) было установлено, что достоверное повышение частоты событий происходит при уровне ФАТ >45%. В группе больных с таким показателем отмечается увеличение частоты развития неблагоприятных событий в 2,27 раза по сравнению с таковой во всей когорте больных. При уровне агрегации более 50% отмечается сходная динамика. Частота раз вития неблагоприятных событий у таких пациентов достоверно увеличивается в 2,6 раза (рис. 3). Пред ставленный график свидетельствует о том, что существует четкая ассоциация между повышением ФАТ и риском сердечно-сосудистых событий.
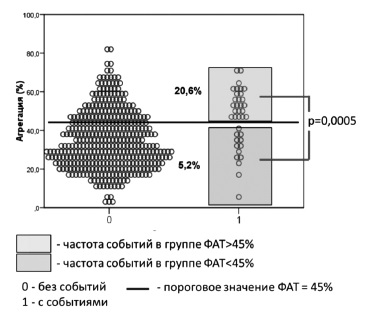
Если критическим пороговым значениям для стратификации больных в зависимости от уровня ФАТ можно считать 44,5%, за оптимальное пороговое значение, подходящее для возможного принятия решения о коррекции терапии следует считать точку статистически значимого изменения частоты событий, лежащую ниже определенного критического порогового значения. Такой точкой, исходя из выше рассчитанного, является ФАТ, равная 45%. При таком пороговом значении с высокой степенью достоверности отмечаются различия в частоте наступления неблагоприятных сердечно-сосудистых событий (рис. 4). При уровне ФАТ менее 45% частота развития исходов составила 5,2%, а при ФАТ более 45% – 20,6% (p=0,0005).
Определение нижнего критического порогового значения ФАТ необходимо для сведения к минимуму риска геморрагических осложнений. Общая частота геморрагических осложнений у всех больных составила 1,88%. В виду малого количества событий, полученный результат не достиг статистической значимости (p=0,9). Пороговое значение составило 35% с площадью под кривой 45,9%. По степени агрегации риск наступления кровотечения в данном исследовании предсказать не удалось. Однако, при разделении всех случаев возникновения геморрагических осложнений по квартилям в зависимости от уровня ФАТ (<30%, <25%, <20%, <15%), прослеживается тенденция к увеличению частоты событий по мере снижении ФАТ (рис. 5).
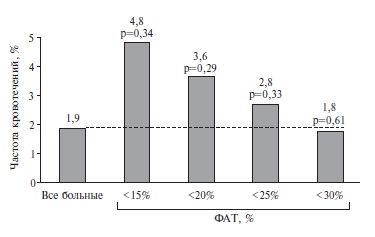
Проведенный сравнительный анализ частоты кровотечений в зависимости от ФАТ позволил выделить пороговое значение, при котором происходит увеличение риска кровотечения. Среди лиц с агрегацией тромбоцитов менее 30% частота развития кровотечений сопоставима с таковой во всей группе больных. Однако, при уровне ФАТ <25% наблюдается повышение количества кровотечений. Такая же тенденция отмечается при ФАТ <20%. Самая высокая частота кровотечений зарегистрирована при уровне ФАТ <15%. Необходимо отметить, что несмотря на отсутствие статистической достоверности (p=0,34), именно в последнем квартиле оказались больные с самым высоким риском развития кровотечений, который в 2,66 раза превышал таковой во всей когорте пациентов.
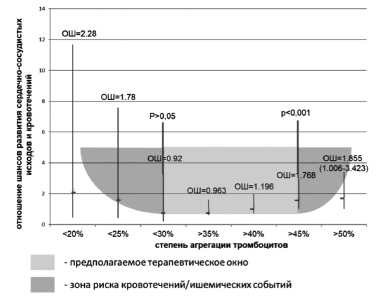
Полученные данные позволили определить верхнюю границу терапевтического окна эффективности применения двойной антиагрегантной терапии и ориентиры для его нижней границы у больных ОКС. Для этого был построен график отношения шансов развития неблагоприятных ишемических сердечно-сосудистых событий и кровотечений в зависимости от ФАТ (рис. 6).
Обсуждение
Предполагаемая “зона эффективности и безопасности" ФАТ для пациентов, получающих двойную антитромбоцитарную терапию, находится в диапазоне от 30% до 45%. Необходимо отметить, что исследование имело статистическую мощность только для расчета верхнего порогового значения ФАТ. Имея высокие показатели статистической достоверности, мы можем быть уверены в верности верхнего “ишемического порога". Учитывая отсутствия статистической достоверности для геморрагических событий из-за малого их количества, можно говорить только о тенденции к повышению риска, который начинает расти при уровне агрегации 30% и менее.
Во многих работах по персонификации антитромбоцитарной терапии, основанной на измерении ФАТ, резистентность к антитромбоцитарному препарату трактовалась как его неспособность подавить агрегационную способность тромбоцитов у данного больного. В более ранних исследованиях для выявления больных с недостаточным эффектом антитромбоцитарных препаратов рассчитывали степень ингибирования тромбоцитов, т.е. разницу (дельта) между исходным значением агрегации тромбоцитов и значением после начала терапии [6,25]. Такой подход не оправдал себя по целому ряду объективных причин.
Во-первых, определение ФАТ до назначения антитромбоцитарного препарата в реальной клинической практике представляется сложной задачей из-за высокой частоты использования антитромбоцитарных препаратов на догоспитальном этапе при первом медицинском контакте и частого применения антиагрегантов к моменту индексного события.
Во-вторых, определение ФАТ имеет клинический смысл для выявления больных с высоким риском наступления неблагоприятных сердечно-сосудистых событий. Речь идет о маркере/предикторе клинической эффективности, который должен быть определен для конкретной клинической ситуации. Учитывая это, американские эксперты пришли к выводу о необходимости использования абсолютного значения ФАТ, т.е. показателя на фоне приема антиагрегантов без учета того, каким он был до назначения лечения [26].
При лечении больных с ОКС результаты исследований агрегации тромбоцитов имеет смысл рассматривать не с позиции фармакодинамического эффекта антиагрегантов, а прежде всего с точки зрения выхода показателей ФАТ из границ “терапевтического окна", который можно расценивать как фактор риска осложнений ишемической (ИМ, инсульт, тромбоз стента) или геморрагической природы (любые кровотечения).
Однако абсолютное значение агрегации может быть рассчитано разными способами. Наиболее распространенным подходом в последнее время стало определение верхнего порогового значения (cut-off) с максимальным уровнем чувствительности/специфичности на основание построения ROC-модели [26]. Такой подход имеет право на существование, однако не представляется идеальным.
Так, в большинстве исследований, в которых изучалась связь ФАТ с неблагоприятными исходами, отмечается общая тенденция: высокая отрицательная прогностическая ценность при очень низкой положительной прогностической значимости. Это позволяет отнести ВОРТ на фоне приема антиагрегантов к числу значимых факторов, определяющих вероятность неблагоприятных событий. При этом необходимо помнить, что ФАТ не является единственной причиной развития неблагоприятных событий [26,30]. Верхнее пороговое значение для определения эффективности антитромбоцитарных препаратов по сути отделяет чувствительных пациентов от нечувствительных.
Результаты исследований TRITON и PLATO свидетельствуют о том, что подавление ФАТ с использованием более мощных по сравнению с клопидогрелом ингибиторов пуриновых рецепторов приводит к значимому снижению частоты сердечно-сосудистых событий [27,28]. Однако этот эффект достигается ценой увеличения риска кровотечений, которые часто связаны с чрезмерным подавлением ФАТ.
Абсолютное значение ФАТ, соответствующее эффективности и безопасности проводимой антитромботической терапии (net clinical benefit), находится по середине между верхним пороговым значением, определяющим ВОРТ, и нижним пороговым значением, определяющим низкую остаточную активность тромбоцитов, ассоциированную с риском развития кровотечений. Напрашивается параллель с измерением уровня международного нормализованного отношения (МНО) у пациентов, получающих варфарин, для которых не вызывает сомнения польза использования терапевтического окна для персонификации терапии и снижения риска развития кровотечения и тромбоэмболических осложнений. Одним из возможных подходов для определения абсолютного значения ФАТ при выборе терапии может быть агрегация выше или ниже пороговых значений, т.е. выходящая за рамки “терапевтического окна". Именно такой подход был использован в данном исследовании.
Одной из первых работ по определению “терапевтического окна", в которой была предпринята попытка определения значения ФАТ, ассоциированного с прогнозом у больных, перенесших ЧКВ, можно считать исследование PREPARE POST-STENTING. Было показано, что в квартиле больных с уровнем АДФ-индуцированной агрегации тромбоцитов (20 мкмоль) менее 50% количество ишемических событий минимальное. При этом пороговое значение АДФ-индуцированной агрегации тромбоцитов характеризовалось достаточной специфичностью (79%), но низкой чувствительностью (37%) [29]. В другом исследовании агрегацию тромбоцитов в ответ на 20 мкмоль АДФ оценивали у 1051 больного, перенесшего ЧКВ. Только половина пациентов перенесли ИМ. Пороговое значение ФАТ (cut-off) составило 64,5%. Наименьшее отношение рисков наступления неблагоприятных сердечно-сосудистых событий отмечено при ФАТ <45,4% [6]. Последний показатель соответствует данным исследования PREPARE POST-STENTING.
В отношении риска кровотечения идея состоит в том, чтобы разработать стратегию как можно большего подавления активности тромбоцитов с минимальным риском геморрагических осложнений [30]. Необходимо учитывать, что на первые 30 дней после индексного события приходится основное количество неблагоприятных сердечно-сосудистых и тромботических событий, а реализация геморрагических рисков происходит на более поздних сроках от начала терапии [31-33]. В исследованиях TOPIC и TROPICAL-ACS продемонстрирована эффективность перевода больных ОКС с более сильного ингибитора P2Y12 рецепторов на менее агрессивный в отношении подавления ФАТ (деэскалация) в сроки более недели после индексного события. Это приводило к снижению числа кровотечений у больных без повышения риска неблагоприятных сердечнососудистых событий [32,33].
На сегодняшний день одной из важных задач персонификации антиагрегантной терапии в ранние сроки после индексного события является необходимость “нащупать дно" риска геморрагических осложнений. Исследования в этой области опубликованы в достаточном количестве, однако подходы к определению порогового значения агрегации, после которого достоверно возрастает риск кровотечений, значительно различаются и носят противоречивый характер [34].
Используемые источники
- Geisler T, Langer H, Wydymus M, et al. Low response to clopidogrel is associated with cardiovascular outcome after coronary stent implantation. Eur Heart J 2006;27(20):2420–25.
- Hochholzer W, Trenk D, Bestehorn H, et al. Impact of the degree of peri-interventional platelet inhibition after loading with clopidogrel on early clinical outcome of elective coronary stent placement. JACC 2006;48(9):1742–50.
- Angiolillo D, Bernardo E, Sabate M, et al. Impact of platelet reactivity on cardiovascular outcomes in patients with type 2 diabetes mellitus and coronary artery disease. JACC 2007;50:1541–7.
- Gurbel P, Antonino M, Bliden K, et al. Platelet reactivity to adenosine diphosphate and long-term ischemic event occurrence following percutaneous coronary intervention: a potential antiplatelet therapeutic target. Platelets 2008;19(8): 595–604.
- Cuisset T, Frere C, Quilici J, et al. Predictive values of post-treatment adenosine diphosphate-induced aggregation and vasodilator-stimulated phosphoprotein index for stent thrombosis after acute coronary syndrome in clopidogrel-treated patients. Am J Cardiol 2009;104(15):1078–82.
- Breet N, van Werkum J, Bouman H, et al. Comparison of platelet function tests in predicting clinical outcome in patients undergoing coronary stent implantation. JAMA 2010;303(8):754-62.
- Aradi D, Komocsi A, Vorobcsuk A, et al. Prognostic significance of high onclopidogrel platelet reactivity after percutaneous coronary intervention: systematic review and meta-analysis. Am Heart J 2010;160:543–51.
- Parodi G, Marcucci R, Valenti R, et al. High residual platelet reactivity after clopidogrel loading and long-term cardiovascular events among patients with acute coronary syndromes undergoing PCI. JAMA 2011;306 (11):1215–23.
- Freynhofer M, Hein-Rothweiler R, Haller P, et al. Diurnal variability of on-treatment platelet reactivity in clopidogrel versus prasugrel treated acute coronary syndrome patients: A pre-specified TROPICAL-ACS sub-study. Thromb Haemost 2019;119(4):660-7.
- Combescure C, Fontana P, Mallouk N, et al. CLOVIS study group. Clinical implications of clopidogrel non‐response in cardiovascular patients: a systematic review and meta‐analysis. J Thromb Haemost 2010;8(5):923–33.
- Sofi F, Marcucci R, Gori A, et al. Clopidogrel nonresponsiveness and risk of cardiovascular morbidity. An updated meta-analysis. Thromb Haemost 2010;103 (4):841–48.
- Brar S, ten Berg J, Marcucci R, et al. Impact of platelet reactivity on clinical outcomes after percutaneous coronary intervention. A collaborative meta-analysis of individual participant data. JACC 2011;58(19):1945–54.
- D'Ascenzo F, Barbero U, Bisi M, et al. The prognostic impact of high on-treatment platelet reactivity with aspirin or ADP receptor antagonists: systematic review and meta-analysis. Biomed Res Int 2014;Article ID 610296.
- Gremmel T, Michelson AD, Frelinger AL, Bhatt DL. Novel aspects of antiplatelet therapy in cardiovascular disease. Research Practice Thromb Haemost 2018;2(3):439-49.
- Gurbel P, Bliden K, Hiatt B, O`Connor C. Clopidogrel for coronary stenting response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation 2003;107(23):2908-13.
- Peace A, Egan K, Kavanagh G, et al. Reducing intra-individual variation in platelet aggregation: implications for platelet function testing. J Thromb Haemost 2009;7(11):1941-3.
- Alexopoulos D, Xanthopoulou I, Davlouros P, et al. Pretreatment platelet reactivity contribution to residual, post-treatment platelet reactivity in prasugrel-treated and ticagrelor-treated patients. J Thromb Haemost. 2013;11(2):381-4.
- Serebruany V, Gurbel P, Shustov A, et al. Heterogeneity of platelet aggregation and major surface receptor expression in patients with acute myocardial infarction. Am Heart J 1998;136(3):398-405.
- Thygesen K, Alpert J, Jaffe A, et al, Writing Group on behalf of the Joint ESC/ACCF/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction. Third Universal Definition of Myocardial Infarction. Circulation 2012;126(16):2020 –35.
- Cutlip D, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation 2007;115(17):2344-51.
- Mehran R, Rao S, Bhatt D, et al. Standardized bleeding definitions for cardiovascular clinical trials a consensus report from the Bleeding Academic Research Consortium. Circulation 2011;123 (23):2736– 47.
- Cattaneo M, Cerletti C, Harrison P, et al. Recommendations for the standardization of light transmission aggregometry: a Consensus of the Working Party from the Platelet Physiology Subcommittee of SSC/ISTH. J Thromb Haemost 2013;11(6):1183-9.
- Hayward C, Moffat K, Raby A, et al. Development of North American consensus guidelines for medical laboratories that perform and interpret platelet function testing using light transmission aggregometry. Am J Clin Pathol 2010;134(6):95563.
- Директива 2001/20/ЕС Европейского Парламента и Совета от 4 апреля 2001 года по сближению законодательств, правил и административных постановлений стран-участниц ЕС, касающихся реализации качественной клинической практики при проведении клинических исследований лекарственных средств для применения у людей. Official J Eur Communities 2001; L 311/67. Gurbel P, Becker R, Mann K, et al. Platelet function monitoring in patients with coronary artery disease. JACC 2007;50(19):1822–34.
- Bonello L, Tantry U, Marcucci R, et al. Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. JACC 2010;56(12):919-33.
- Wallentin L, Becker R, Budaj A, et al; PlATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361(11):1045-57.
- Wiwiott S, Braunwald E, McCabe C, et al. TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007;357(20):2001-15.
- Gurbel P, Bliden K, Guyer K, et al. Platelet reactivity in patients and recurrent events post-stenting: results of the PREPARE POSTSTENTING Study. JACC 2005;46(10):1820–6.
- Tantry U, Gurbel P. Assessment of oral antithrombotic therapy by platelet function testing. Nat Rev Cardiol 2011;8:572–9.
- Geisler T, Zürn C, Simonenko R, et al. Early but not late stent thrombosis is influenced by residual platelet aggregation in patients undergoing coronary interventions. Eur Heart J 2010;31(1):59-66.
- Guisset T, Deharo P, Quilici J, et al. Benefit of switching dual antiplatelet therapy after acute coronary syndrome: the TOPIC (timing of platelet inhibition after acute coronary syndrome) randomized study. Eur Heart J 2017;38(41):3070–8.
- Sibbing D, Aradi D, Jacobshagen C, et al. Guided de-escalation of antiplatelet trearment in patients with acute coronary syndrome undergoing percutaneous coronary intervention (TROPICAL-ASC): a randomized, open-label, multicenter trials. Lancet 2017;390(10104):1747-57.
- Collet J, Silvain J, Landivier A, et al. Dose effect of clopidogrel reloading in patients already on 75-mg maintenance dose: the Reload with Clopidogrel Before Coronary Angioplasty in Subjects Treated Long Term with Dual Antiplatelet Therapy (RELOAD) study. Circulation 2008;118 (12):1225-33.
