Достаточно ли обоснованы цели, к которым мы стремимся?
Среди многочисленных факторов риска формирования атеросклероза наиболее важную роль играют возрастные инволютивные изменения. С учетом данного обстоятельства в статье обсуждаются наиболее дискуссионные вопросы гиполипидемической терапии атеросклероза и ассоциированных с ним заболеваний.
Роль возрастных инволютивных изменений в патогенезе атеросклероза
Среди многочисленных причин смерти на Земле двумя главными на протяжении последних десятилетий остаются обусловленные атеросклерозом ишемическая болезнь сердца (ИБС) и инсульт. По данным Всемирной организации здравоохранения (ВОЗ), в 2012 году в мире умерли 55 843 142 человека, в том числе от инфекционных болезней – 12 821 070 и от неинфекционных – 37 878 046. От ИБС умерли 7 352 705 человек (около 12,8% всех случаев смерти в мире), от инсульта – 6 669 383 (около 10,8%) и от артериальной гипертонии – 1 140 304 [http://www.who.int/healthinfo/morttables]. В подавляющем большинстве случаев смерть от данных заболеваний отмечается в зрелом возрасте. В этом же возрасте люди чаще умирают и от онкологических заболеваний, а также сахарного диабета.
В прошлом выдвигался большой ряд гипотез о механизмах возникновения и прогрессирования атеросклероза, однако общепринятого представления по данному вопросу нет до настоящего времени. Наибольшее распространение получили инфильтрационная теория Н.Н. Аничкова и гипотеза R. Ross "ответа на эндотелиальное повреждение" [1,2]. Авторы инфильтрационной теории считали, что в основе возникновения атеросклероза лежит накопление холестерина (ХС) в сосудистой стенке, в то время как гипотеза "ответа на эндотелиальное повреждение" в качестве основной причины предполагала первичное нарушение защитных свойств эндотелия и выделение его медиаторов.
С учетом данных литературы и резуль татов собственных исследований нами пред ложена примерная схема патогенеза атеросклероза [3]. Суть ее заключается в том, что в норме у здорового человека обмен липопротеинов, в частности низкой плотности (ЛНП), не сопровождается их проникновением в субэндотелиальное пространство. Проникновение ЛНП под эндотелий воз можно в результате их модификации и модификации эндотелия. Повреждать липопротеины и эндотелий могут различные биологические субстраты, включая многочисленные медиаторы воспаления и продукты апоптоза. Наличие множества причин модификации липопротеинов и эндотелиоцитов, вероятно, является главной причиной существования многочисленных гипотез патогенеза атеросклероза. Этим можно объяснить и тот факт, что липидные пятна и полоски можно обнаружить уже у грудных детей. Модификация ЛНП возможна и при увеличении продолжительности их циркуляции в крови, что может быть обусловлено увеличением вязкости клеточных мембран в результате увеличения в них количества насыщенных жирных кислот. До 50-55 лет накопление ХС ЛНП в субэндотелии происходит медленно (доклиническая стадия атеросклероза). Стремительное увеличение содержания ЛНП в крови у мужчин отмечается в возрасте старше 55 лет [4], после чего могут регистрироваться клинические признаки ИБС, цереброваскулярной болезни и других заболеваний, ассоциированных с атеросклерозом. Данный факт свидетельствует об особой роли возраста в патогенезе полигенного атеросклероза.
Чтобы понять и объяснить данный факт, следует учитывать, что в биологии различают два типа клеточной смерти: апоптоз и некроз. Считается, что выделение этих типов в чистом виде возможно лишь in vitro. В реальной же жизни в различных тканях может одновременно протекать и апоптоз, и некроз. Апоптоз – это процесс программируемой клеточной смерти, или регулируемой самоликвидации на клеточном уровне. Апоптоз существует на протяжении всей жизни человека. При этом ежедневно у здорового человека возникает от 50 до 70 миллиардов новых клеток, и такое же количество их гибнет за счет апоптоза. За год обновляется столько клеток, что их общая масса равна массе тела.
В отличие от апоптоза, при некрозе смерть клетки наступает в результате "насильственных" действий внешних патогенных факторов. Гибель клетки сопровождается необратимыми биохимическими и структурными изменениями. Этот вид гибели клеток генетически не контролируется. Важным отличием некроза от апоптоза является и тот факт, что некроз – это смерть группы клеток, прежде всего, вследствие их повреждения внешними по отношению к клеткам повреждающими агентами [5]. При этом некроз сопровождается воспалительной реакцией.
В 1961 г. L. Hayflick и P. Moorhead опубликовали данные о том, что при пересевах клеток фибробласты эмбриона человека способны делиться только ограниченное число раз (50±10). После этого их способность к пролиферации исчерпывается, и в таком неделящемся состоянии клетки способны находиться достаточно длительное время [6,7]. После появления работ L. Hay flick было установлено, что все клеточные культуры можно разделить на две группы: с ограниченным пролиферативным потенциалом (смертные, мортальные) и иммортальные (бессмертные). Последняя фаза жизни клеток в культуре была уподоблена клеточному старению, а сам феномен получил по имени автора название "предела Хейфлика". Установлено, что с увеличением возраста донора число делений, которые были способны совершить клетки организма, существенно уменьшалось. Это позволило предположить существование гипотетического счетчика делений, ограничивающего общее их число [8].
Изучением механизма функционирования указанного счетчика деления клеток занималось множество специалистов из разных стран. К настоящему времени установлено, что роль "молекулярных часов" выполняют теломеры линейных хромосом эукариотических клеток. В 2009 г. за работы в области исследования механизмов старения клеток и защиты хромосом от деградации при помощи теломер и фермента теломеразы Элизабет Блэкберн, Джек Шостак и Кэрол Грейдер были награждены Нобелевской премией. Авторы установили, что концы линейных хромосом с 3'-конца ДНК заканчиваются повторяющимися последовательностями нуклеотидов, получившими название теломер, которые синтезируются специальным ферментом теломеразой. Теломераза – сложный рибонуклеопротеид, достраивающий в клетках эукариот теломерные концы хромосом, укорачивающиеся из-за недорепликации ДНК. Активность теломеразы не проявляется в соматических клетках и тканях человека. За редким исключением структура теломер у всех позвоночных одинаковая и оканчивается последовательностью (TTAGGG)n, повторенной в теломерах сотни и тысячи раз [9,10]. Основным предназначением теломерного повтора является защита хромосом от деградации и склеивания [11,12]. С каждым делением число нуклеотидных последовательностей теломера уменьшается (минимум на 3050 пар при каждом делении) и, достигнув определенной критической точки, укороченные фрагменты теломер больше не препятствуют склеиванию хромосом. В результате склеивания хромосом происходит повреждение генетического материала и остановка клеточного деления, что приводит к естественной гибели клетки – апоптозу. Таким образом, длина теломер может служить мерой пролиферативного потенциала клеток [13]. Важно подчеркнуть, что по мере старения, с накоплением возрастных инволютивных изменений, стремительно растет и количество многочисленных модифицирующих факторов.
К настоящему времени нет общепринятого представления о механизмах старения. Имеются сторонники точки зрения, согласно которой старение является результатом функционирования "молекулярных часов", сопряженных с процессом укорочения теломер. Другие авторы считают, что клеточное старение возможно при участии различных факторов окружающей среды. У каждой из двух версий есть весомые аргументы. В то же время возникает вопрос, а почему они должны противопоставляться друг другу? Наиболее логичным представляется объяснение, учитывающее роль обоих факторов. В таком случае становится понятно, что скорость угасания теломеразной активности определяет потенциально возможные сроки старения различных тканей, в том числе и общую, теоретически возможную, продолжительность жизни. Однако в реальной жизни на человека действует огромное количество факторов окружающей среды, которые, разумеется, вносят существенные изменения в эту изначально заложенную программу. Нет сомнений в том, что в течение жизни каждый человек или животное неоднократно сталкиваются с факторами, которые в определенной ситуации могут играть более важную и даже роковую роль в механизме смерти человека. Они способны радикально сокращать потенциально возможную продолжительность жизни. Но при этом средняя продолжительность жизни популяции все же определяется степенью теломеразной активности, выступающей в роли "молекулярных часов". Таким образом, сочетание генетически обусловленных и внешних факторов в конечном счете определяет индивидуальную продолжительность жизни человека и всех живых существ.
В первые 30-40 лет жизни, несмотря на наличие многочисленных, но преходящих по продолжительности действия факторов риска, атеросклероз прогрессирует достаточно медленно. Это может объясняться тем, что количество погибших в результате апоптоза клеток восполняется адекватным количеством вновь образованных. При этом количество модифицирующих факторов, прежде всего, свободных радикалов и продуктов свободнорадикального и перекисного окисления различных клеточных субстратов, в том числе липопротеинов, находится на минимальном уровне. Эстрогены, повышающие уровень ЛВП, прямо и/или опосредованно действуют как антиоксиданты и, таким образом, замедляют прогрессирование атеросклероза [3].
После 40-50 лет, на фоне угасания теломеразной активности, клетки во многих тканях переходят в качественно новое состояние – "предел Хейфлика". Они достаточно продолжительное время сохраняют жизнеспособность и адекватную функциональную активность. Но абсолютное количество живых клеток прогрессивно уменьшается [3]. Апоптоз без адекватного восполнения погибших клеток сопровождается накоплением значительного количества активных форм кислорода (АФК) и других модифицирующих факторов. В активно регенерирующих тканях АФК эффективно нейтрализуются системой антиоксидантной защиты [14]. При прогрессивном же уменьшении количества живых клеток увеличение содержания прооксидантов в организме не уравновешивается адекватным ростом антиоксидантной активности. АФК и другие прооксиданты способствуют модификации всех типов липопротеинов и мембран эндотелиоцитов. С началом системных инволютивных изменений в организме активность прооксидантов неуклонно растет, а антиоксидантной защиты – неуклонно падает. Особенно ярко это изменения проявляются у женщин. С наступлением менопаузы, на фоне угасания активности и прекращения функционирования яичников, уровень эстрогенов в организме, а, следовательно, уровень ЛВП и степень антиоксидантной защиты снижаются до минимума. Обратно пропорционально степени снижения содержания эстрогенов в крови растет содержание прооксидантов и многочисленных других факторов, модифицирующих липопротеины и эндотелиоциты. Инволютивные изменения в различных тканях, в том числе и в яичниках, начинаются не одновременно, но в близкие временные отрезки. В практическом плане это означает, что по мере прогрессирования инволютивных изменений прооксидантная активность в крови и тканях начинает расти лавинообразно, в геометрической прогрессии. На этом фоне резервы антиоксидантной защитной системы очень быстро истощаются, после чего накопление в интиме аорты и артерий модифицированных ЛНП и прогрессирование атеросклероза приобретают стремительный характер. Модифицированные ЛНП после поглощения макрофагами и гладкомышечными клетками расщепляются лизосомальными ферментами этих клеток. Поскольку в организме человека отсутствуют ферментные системы, разрушающие гетероциклическую структуру холестерина, последний, после гибели макрофагов, накапливается в интиме артерий, сначала в виде липидных пятен и полосок, а, затем в виде фиброзных бляшек. С наступлением климакса течение атеросклероза у женщин так же, как и у мужчин приобретает неуклонно прогрессирующий характер. Поскольку эстрогены являются мощным фактором защиты организма, продолжительность жизни женщин примерно на 10,5-13,5 лет больше, чем у мужчин. За последнее время у женщин отмечено снижение смертности от сердечно-сосудистых болезней, за исключением женщин моложе 50 лет [3].
С учетом изложенного узловые этапы патогенеза полигенного атеросклероза кратко можно сформулировать следующим образом:- Формированию липидных пятен, полосок и фиброзных бляшек способствует предшествующая модификация липопротеинов (прежде всего ЛНП) и эндотелиоцитов.
- Повреждать липопротеины и эндотелий могут самые различные биологические субстраты, включая многочисленные медиаторы воспаления и продукты апоптоза, поэтому формирование липидных пятен и полосок возможно уже у грудных младенцев.
- Главная же роль в формировании и прогрессировании атеросклероза принадлежит возрастным инволютивным изменениям, поскольку именно на этом этапе жизни накапливается максимальное количество субстратов, модифицирующих ЛНП и эндотелиоциты [3].
Общие принципы медикаментозной гиполипидемической терапии
При атеросклерозе холестерин, накапливающийся в стенках артерий, играет роль "мусора", в связи с чем фармакологи и клиницисты постоянно ведут активный поиск немедикаментозных и медикаментозных способов снижения содержания холестерина в интиме. Опосредованно на обмен липидов в крови влияют самые различные группы препаратов (ингибиторы и блокаторы ренин-ангиотензин-альдостероновой системы, антагонисты кальция, антагонисты альдостероновых рецепторов, блокаторы β-адренорецепторов, гипогликемические препараты, диуретики и др.). Однако в данной статье обсуждаются только препараты, которые влияют преимущественно на метаболизм липидов и используются для лечения полигенных дислипидемий. К основным липидкорригирующим медикаментозным средствам относятся ингибиторыГМГ-КоА-редуктазы (статины), ингибитор кишечной абсорбции холестерина (эзетимиб), ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9), фибраты, препараты, содержащие ω-3 полиненасыщенные жирные кислоты. Рамки использования секвестрантов желчных кислот и никотиновой кислоты замедленного высвобождения значительно уже, к тому же они отсутствуют в Российской Федерации.
В конце 2013 г. были опубликованы рекомендации экспертов American College of Cardiology и American Heart Association по контролю холестерина крови (далее – АСС/АНА, 2013) [15]. В них предложено отказаться от достижения целевых значений ЛНП. В то же время отмечено, что повторные исследования липидного спектра необходимы, так как врачи должны учитывать целевые значения как важнейший показатель приверженности к лечению. В рекомендациях американских экспертов указано, что уровень доказательной базы нестатиновых гиполипидемических препаратов в настоящее время является низким (лишь IIb/C).
Для каждой из 4 приведенных ниже групп пациентов предусмотрена определенная "интенсивность" терапии статинами, которая необходима для достижения относительного снижения уровня ХС ЛНП [15]:- Пациентам с клиническими проявлениями атеросклероза рекомендована терапия статинами высокой интенсивности – розувастатин 20-40 мг/сут или аторвастатин 40-80 мг/сут – с целью снижения исходного уровня ХС ЛНП по крайней мере на 50%;
- Пациентам с повышением концентрации ХС ЛНП ≥190 мг/дл (≥5,0 ммоль/л), т.е. по существу больным с семейной гиперхолестеринемией, предпочтительно назначать терапию статинами высокой интенсивности с целью достижения снижения уровня ХС ЛНП по крайней мере на 50%.
- Пациентам в возрасте 40–75 лет с сахарным диабетом и уровнем ХС ЛНП в крови от 70 до 189 мг/дл (от 1,8 до 4,9 ммоль/л), у которых отсутствуют клинические проявления атеросклеротического поражения сосудов, рекомендована терапия статинами средней интенсивности, обеспечивающая снижение уровня ХС ЛНП на 3050%. • Пациентам без клинических проявлений атеросклероза и сахарного диабета 2 типа, у которых уровень ХС ЛНП составляет от 70 до 189 мг/дл (от 1,8 до 4,9 ммоль/л), а ожидаемый риск развития клинических проявлений заболевания в течение 10 лет – 7,5% и более, рекомендован умеренно интенсивный режим приема статинов с целью снижения концентрации ХС ЛНП на 30-50%.
Подсчет ожидаемого 10-летнего риска развития сердечно-сосудистого заболевания, связанного с атеросклерозом, проводится с помощью специального калькулятора, доступного online (http://my.americanheart.org/cvriskcalculator). При этом риск возникновения сердечно-сосудистого заболевания, связанного с атеросклерозом, ≥7,5% соответствует риску сердечно-сосудистой смертности в течение 10 лет ≥2,5%, рассчитанному по шкале SCORE. Обращает на себя вниманиие, что необходимость в терапии статинами с целью первичной профилактики у пациентов последней группы предполагает пожизненное применение этих препаратов у очень широкого круга лиц, начиная с 40 лет. В данной ситуации врачу и пациенту желательно иметь твердую уверенность в том, что при подобном режиме гиполипидемической терапии частота побочных эффектов не будет возрастать. При использовании статинов рекомендуется контролировать их возможное токсическое действие на поперечнополосатые мышцы и печень, а также развитие сахарного диабета.
Важным элементом рекомендаций последних лет можно считать выделение группы лиц, у которых в соответствии с имеющимися данными нет оснований для приема статинов. К ним относят следующих пациентов:- 1) лица старше 75 лет, у которых отсутствуют клинические проявления сердечно-сосудистого заболевания, обусловленного атеросклерозом;
- 2) больные, находящиеся на лечении гемодиализом;
- 3) больные с сердечной недостаточностью II-IV функциональных классов по классификации НьюЙоркской ассоциации сердца (NYHA) [15].
С учетом рекомендаций АСС/АНА (2013) в 2016 г. были сформулированы европейские, а в 2017 г. российские рекомендации по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза [16,17]. Рекомендуемые российские целевые уровни ХС ЛНП, в зависимости от категории риска, несколько отличаются от европейских, но в целом являются сходными. Узловые моменты предлагаемой стратегии европейских и российских рекомендаций можно сформулировать следующим образом. При общем риске развития смерти от сердечно-сосудистых заболеваний, рассчитанном с помощью индекса SCORE, <5% лечение может не потребоваться или его следует начать с изменения образа жизни и лишь при необходимости подключать лекарственную терапию. При высоком (от >5 до <10 %) и очень высоком общем риске (≥10%) изменение образа жизни можно сразу сочетать с медикаментозной терапией.
Следует отметить, что обсуждая параметры снижения уровня липопротеинов, мы до настоящего времени не имеем убедительного обоснования возможности безопасного снижения уровня ЛНП в крови до какой-то определенной величины.
По мнению большинства российских экспертов, практикующим врачам достигать целевых уровней ХС ЛНП следует, используя статины в дозах, предлагаемых в американских рекомендациях. В таком случае лечение статинами в адекватных дозировках, в первую очередь оригинальными аторвастатином и розувастатином, позволит бόльшему количеству пациентов достичь целевых уровней ХС ЛНП. Необходимо учитывать, что каждое гиполипидемическое средство имеет свой предел степени снижения уровня ХС ЛНП. В связи с тем, что терапия статинами может оказаться недостаточной, необходимо помнить о возможности комбинированной лекарственной терапии (табл. 1) [15,18].
| Низкая интенсивность ↓ХС ЛНП на <30% | Умеренная интенсивность ↓ХС ЛНП на 30–49% | Высокая интенсивность ↓ХС ЛНП на 50–60% | Очень высокая интенсивность ↓ХС ЛНП на >60% |
|---|---|---|---|
| Симвастатин 10 мг | Аторвастатин 10–20 мг | Аторвастатин 40–80 мг | - |
| Правастатин 10–20 мг | Розувастатин 5–10 мг | Розувастатин 20–40 мг | |
| Ловастатин 10–20 мг | Симвастатин 20–40 мг | ||
| Флувастатин 40 мг | Правастатин 40-80 мг | ||
| Питавастатин 1 мг | Ловастатин 40 мг | ||
| Флувастатин XL 80 мг | |||
| Питавастатин 2–4 мг | |||
| Эзетимиб 10 мг | Эзетимиб 10 мг в сочетании со статинами: | Эзетимиб 10 мг в сочетании со статинами: | Эзетимиб 10 мг в сочетании со статинами: |
| Симвастатин 10 мг | Симвастатин 20–40 мг | Аторвастатин 40–80 мг | |
| Ловастатин 20 мг | Ловастатин 40 мг | ||
| Флувастатин 40 мг | Флувастатин 80 мг | ||
| Питавастатин 1 мг | Питавастатин 2–4 мг | ||
| Аторвастатин 10–20 мг | |||
| Розувастатин 5–10 мг |
В 2018 г. Научной сессией AHA предложены новые рекомендации по коррекции уровня холестерина [19]. Структура новых рекомендаций в целом соответствует предложенным в 2013 г., однако ряд базовых положений документа существенно пересмотрен и детализирован:
1. Подчеркивается, что в основе профилактики возникновения заболеваний, обусловленных атеросклерозом, лежит соблюдение здорового образа жизни. Приверженность к здоровому образу жизни снижает риск сердечно-сосудистых осложнений независимо от возраста. Улучшение образа жизни лежит в основе первичной профилактики метаболического синдрома независимо от возраста.
2. Пациентам с клиническими 2. Пациентам с клиническими проявлениями заболеваний, обусловленных атеросклерозом, показано снижение уровня ЛНП с помощью интенсивной терапии статинами (аторвастатин 40-80 мг или розувастатин 2040 мг). Чем ниже уровень ЛНП, тем ниже риск сердечно-сосудистых осложнений. Необходимо назначать максимальные переносимые дозы статинов с целью снижения содержания ЛНП по крайней мере на 50%.
3. У пациентов с заболеваниями, обусловленными атеросклерозом, и очень высоким риском сердечнососудистых осложнений, уровень ЛНП на фоне терапии должен составлять менее 1,8 ммоль/л (70 мг/дл); если достичь этого целевого показателя не удается, целесообразно добавление к статинам иных гиполипидемических препаратов. К категории пациентов с очень высоким риском сердечно-сосудистых осложнений относятся лица с повторными ишемическими событиями в анамнезе или с сочетанием одного события и нескольких дополнительных факторов риска. На первом этапе к статину в максимальной переносимой дозе добавляют эзетемиб. Если уровень ЛНП остается выше 1,8 ммоль/л, следует добавить к терапии ингибиторы PCSK9. Важно отметить, что безопасность долгосрочного приема этих препаратов (более 3 лет) не известна, а экономическая эффективность их применения довольно низкая.
4. Пациентам с высокой первичной гиперхолестеринемией (ЛНП >4,9 ммоль/л [>190 мг/дл]) показано назначение интенсивной терапии статинами без предварительной оценки десятилетнего риска сердечнососудистых осложнений. Если уровень ЛНП не удастся снизить менее 2,6 ммоль/л (100 мг/дл), к терапии следует добавить эзетимиб. Если у пациентов с сопутствующими множественными факторами риска ишемических осложнений не удастся достичь указанных выше целевых значений ЛНП, целесообразно добавить к терапии ингибиторы PCSK9.
5. Пациентам в возрасте 40-75 лет с сахарным диабетом и уровнем ЛНП более 1,8 ммоль/л показано назначение умеренно интенсивной терапии статинами без предварительной оценки десятилетнего риска сердечно-сосудистых осложнений. Пациентам с сахарным диабетом, относящимся к группе высокого риска, особенно в возрасте 50-75 лет с множественными факторами риска, целесообразно назначать интенсивную терапию статинами с целью снижения уровня ЛНП на 50% и более.
6. Для определения показаний к назначению статинов с целью первичной профилактики заболеваний, обусловленных атеросклерозом, показана оценка риска и обсуждение факторов риска с пациентом (курение, артериальная гипертония, уровни ЛНП и гликированного гемоглобина, а также расчетный десятилетний риск сердечно-сосудистых осложнений и факторы, усугубляющие влияние факторов риска). Необходимо обсудить преимущества здорового образа жизни и приема статинов, а также потенциальные побочные эффекты, риск взаимодействия с другими препаратами и стоимость терапии. Решение о назначении статинов следует принимать совместно с подробно информированным пациентом.
7. Взрослым пациентам в возрасте 40-75 лет без сахарного диабета с уровнем ЛНП более 1,8 ммоль/л и расчетным риском сердечно-сосудистых осложнений ≥7,5% в течение 10 лет следует назначить терапию статинам средней интенсивности. Наличие дополнительных факторов, усугубляющих негативное влияние факторов риска, также служит аргументом в пользу терапии статинами. Если риск сердечно-сосудистых осложнений не ясен, для уточнения показаний к терапии статинами целесообразно оценивать индекс кальциноза коронарных артерий по данным компьютерной томографии. Если терапия статинами показана, необходимо снижать уровень ЛНП по крайней мере на 30%, а у пациентов с риском сердечно-сосудистых осложнений за последующие 10 лет >20% – по крайней мере на 50%.
8. К дополнительным факторам, усугубляющим негативное влияние основных факторов риска, относятся семейный анамнез раннего развития заболеваний, обусловленных атеросклерозом, постоянно повышенный уровень ЛНП более 4,1 ммоль/л, метаболический синдром, хроническая болезнь почек, преэклампсия или ранняя менопауза (ранее 40 лет), хронические воспалительные заболевания (например, ревматоидный артрит, псориаз, хроническая ВИЧ-инфекция), принадлежность к некоторым этническим группам (например, Южная Азия), уровни триглицеридов более 1,97 ммоль/л, аполипопротеина В >130 мг/дл, высокочувствительного С-реактивного белка (вч-СРБ) >2 мг/л, лодыжечно-плечевой индекс (ЛПИ) <0,9 и уровень липопротеина (а) ≥50 мг/дл (≥125 нмоль/л). Наличие этих состояний может указывать на целесообразность назначения статинов пациентам с промежуточным значением риска сердечно-сосудистых осложнений за последующие 10 лет (5-7,5%).
9. У пациентов в возрасте 40-75 лет без сахарного диабета с уровнем ЛНП 1,8-4,8 ммоль/л и десятилетним риском сердечно-сосудистых осложнений ≥7,5-19,9% для принятия решения о назначении статинов может быть целесообразным определение индекса кальциноза коронарных артерий. Если кальций в коронарных артериях не определяется, можно не назначать или отложить терапию статинами (за исключением курильщиков и пациентов с отягощенным семейным анамнезом). Если индекс кальциноза составляет 1-99, назначение статинов скорее целесообразно, особенно у лиц старше 55 лет, а при индексе ≥100 следует назначать статины.
10. Через 4-12 недель после назначения статинов или изменения их дозы следует повторно определить уровень ЛНП с целью оценки приверженности к лечению и степени снижения ЛНП. В дальнейшем ЛНП следует определять каждые 3-12 месяцев.
В августе 2019 г. на конгрессе Европейского общества кардиологов в Париже обсуждены и предложены новые клинические рекомендации по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза. Ключевая стратегия этих рекомендаций – чем более низких значений ЛНП удастся добиться, тем лучше [20]. У пациентов с острым коронарным синдромом, у которых несмотря на прием максимальных переносимых доз статина и эзетимиба через 4-6 недель не удается достичь целевых значений ХС ЛНП, следует рассмотреть раннее назначение ингибитора PCSK9 (если возможно, во время госпитализации).
В новом руководстве с целью вторичной профилактики рекомендуется целевой уровень ХС ЛНП <1,4 ммоль/л. Пациентам, перенесшим второе сердечнососудистое событие в течение 2 лет, предлагается еще более жесткий контроль уровня ХС ЛПН – менее 1,0 ммоль/л. Для достижения целевых значений рекомендуется назначать статины в высоких дозах, к которым можно добавить эзетимиб и ингибиторы PCSK9. Важным изменением в руководстве стал отказ от разницы в подходах к проведению первичной и вторичной профилактики. Теперь рекомендации по лечению не зависят от анамнеза пациента, а зависят только от уровня его риска. В случае первичной профилактики пациентам с очень высоким сердечно-сосудистым риском рекомендуется целевой уровень ХС ЛНП <1,4 ммоль/л, высоким – <1,8 ммоль/л, умеренным – <2,6 ммоль/л, низким – <3,0 ммоль/л.
Пациентам в возрасте до 75 лет лечение дислипидемии статинами для первичной профилактики рекомендуется в зависимости от степени риска. Лицам старше 75 лет можно рассмотреть возможность назначения статинов для первичной профилактики при высоком и очень высоком риске.
Лечение статинами должно быть начато в низкой дозе, если имеются значительное нарушение функции почек и/или угроза лекарственного взаимодействия. Затем дозу постепенно увеличивают, пока не будут достигнуты целевые значения ХС ЛНП [20].
Несмотря на наличие нюансов, позволяющих отличать одни национальные подходы от других, во всех рекомендациях по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза имеются и принципиально совпадающие положения. Во-первых, во всех рекомендациях подчеркивается, что в основе профилактики возникновения заболеваний, обусловленных атеросклерозом, лежит соблюдение здорового образа жизни.
Кроме того, при обсуждении медикаментозной терапии в американских, европейских и российских рекомендациях выделяются сходные группы пациентов:- пациенты с клиническими проявлениями атеросклероза, нуждающиеся во вторичной профилактике осложнений, связанных с атеросклерозом;
- пациенты с семейной гиперхолестеринемией;
- пациенты с сахарным диабетом и ЛНП более 1,8 ммоль/л без клинических проявлений атеросклероза;
- пациенты без клинических проявлений атеросклероза, у которых имеются дислипидемия и средний (в американских) или высокий (в европейских и российских рекомендациях) риск сердечно-сосудистых осложнений.
Для медикаментозной коррекции указанных патологических состояний предлагается использование нескольких классов медикаментозных препаратов, замедляющих различными способами прогрессирование атеросклероза. В настоящее время снизить концентрацию ХС ЛНП в крови наиболее эффективно, безопасно и с относительно небольшими финансовыми затратами можно с помощью статинов, подавляющих синтез холестерина в организме. Ингибиторы кишечной абсорбции холестерина, затрудняя всасывание в кишечнике пищевого и билиарного холестерина, поступающего с пищей и из желчи, потенцируют действие статинов. Максимального же снижения уровня ХС ЛНП удается достичь путем добавления к предыдущим двум препаратам еще одного – ингибитора PCSK9, увеличивающего число активных рецепторов к ЛНП на поверхности гепатоцитов, что способствует усилению захвата гепатоцитами ХС ЛНП из кровотока и снижению его содержания в плазме крови.
Принципиально важным и универсальным условием, обозначенным во всех рекомендациях, для всех групп пациентов является требование пожизненного приема гиполипидемических препаратов. В качестве обоснования данного требования используются результаты огромного количества исследований, продемонстрировавших "безопасность" и эффективность основных гиполипидемических средств. В большом числе исследований показано, что прекращение приема статинов неблагоприятно влияет на прогноз. В крупном британском популяционном исследовании прекращение приема статинов в остром периоде инфаркта миокарда (ИМ) ассоциировалось с почти двукратным повышением смертности в течение ближайшего года [21]. В исследовании PRISM у больных с острым коронарным синдромом, у которых по разным причинам статины были отменены во время госпитализации, общая смертность и риск нефатального ИМ оказались почти в 3 раза выше, чем у пациентов, продолжавших прием статинов [22]. В ретроспективном исследовании у больных, прекративших прием статинов по разным причинам в первые сутки госпитализации, суммарный риск смерти, обратимой остановки кровообращения и кардиогенного шока во время госпитализации был почти в 2 раза выше, чем у больных, которые продолжали лечение этими препаратами [23].
Когда алгоритмы гиполипидемической терапии сходным образом формулируются авторитетными экспертами из множества стран и разных континентов, они воспринимаются не как рекомендация, а как указание поступать таким образом, а никак иначе. Однако при более широком знакомстве с литературой возникают вопросы, ответы на которые в рекомендациях формально имеются, однако обоснованность их представляется сомнительной и тенденциозно подобранной. Можно согласиться с точкой зрения, что начинать медикаментозную терапию атеросклероза можно еще на доклинической стадии. Однако, вызывает сомнения утверждение о возможности безопасного, непрерывного приема гиполипидемических препаратов уже с 40 лет. Сомнения вызывают и целевые уровни ЛНП, к достижению которых мы должны стремиться.
Чтобы понять, насколько убедительными выглядят приведенные аргументы, обратимся к некоторым фактам. Средняя продолжительность жизни человека во всем мире различается довольно существенно. В нашей стране она равняется 73 годам, а во многих странах Европы составляет 80 и более лет. Если сопоставить рекомендуемый срок начала профилактической гиполипидемической терапии со средней продолжительностью жизни, становится понятно, что она теоретически должна проводиться в течение 30-40 и более лет. Уместно напомнить, что первая статья о снижении уровня общего ХС у пациентов, страдавших ИБС, на фоне применения первого статина – компактина была опубликована в 1980 г. [24]. К настоящему времени, срок, прошедший с момента публикации первой статьи, меньше рекомендуемой продолжительности приема статинов. С учетом того, что никто и никогда не проводил столь продолжительных исследований, нет оснований утверждать, что неопределенно длительный прием статинов для большинства людей является безопасным.
Возникает вопрос, а насколько обоснованной чисто теоретически выглядит данная рекомендация? Чтобы найти ответ на данный вопрос, следует учитывать, что у гиполипидемической терапии, как и у медали, имеется вторая сторона, которая по недоразумению или сознательно замалчивается. Рекомендация стремиться к достижению как можно более низких значений ЛНП могла бы считаться обоснованной, если бы холестерин в организме играл роль бесполезного или вредного балласта. Однако, в этой роли он начинает выступать преимущественно последние 10-15-20 лет жизни. Бóльшую же часть жизни он выполняет ряд важнейших физиологических функций в организме человека и животных:
Во-первых, ХС является обязательным структурным компонентом любых клеточных мембран, обеспечивая их важнейшие биофизические показатели, в том числе жесткость, стабильность в широком интервале температур, проницаемость, и создает условия для функционирования ассоциированных с мембраной ферментов. В клеточной мембране холестерин образует каркас, занимая свободное пространство между гидрофобными "хвостами" липидов (фосфолипидов и гликолипидов) и не позволяя им изгибаться. Мембраны с малым содержанием холестерина более гибкие, а с большим – более жесткие и хрупкие.
Во-вторых, из ХС в печени синтезируются желчные кислоты, которые необходимы для эмульгации пищевых жиров, активации панкреатической липазы и абсорбции расщепленных жиров в тонкой кишке.
В-третьих, ХС является предшественником стероидных гормонов коры надпочечников (кортизола и альдостерона), половых гормонов (эстрогенов и андрогенов), витамина D3.
Приведенные факты позволяют сделать вывод о том, что при продолжительном, выраженном снижении в организме содержания холестерина человек погибнет точно так же, как без кислорода, воды, еды, витаминов, микроэлементов и множества других незаменимых субстратов.
Возвращаясь к проблеме атеросклероза можно предположить, что на фоне неопределенно продолжительной и агрессивной гиполипидемической терапии у лиц без клинических проявлений атеросклероза, но с высокой степенью риска сердечно-сосудистых осложнений можно выделить период, в течение которого риск смерти от сердечно-сосудистых заболеваний будет снижаться. Однако, поскольку холестерин является незаменимым биологическим субстратом, есть основания ожидать спустя годы после начала лечения наступления второго этапа, во время которого будет регистрироваться увеличение риска смерти от осложнений, связанных уже с самим процессом лечения. Подобной информации нет в официальных рекомендациях, но косвенные данные, свидетельствующие о возможности развитиях подобных событий, в литературе имеются.
К числу наиболее крупных и известных исследований по использованию статинов с целью первичной профилактики возникновения ИБС, цереброваскулярной болезни и смерти от связанных с ними осложнений, можно отнести ASCOT-LLA, в котором пациенты основной группы получали аторвастатин в дозе 10 мг [25], и JUPITER, в котором продемонстрирован профилактический эффект розувастатина в дозе 20 мг по сравнению с приемом плацебо [26]. Следует уточнить, что изучение эффектов аторвастатина и розувастатина в исследованиях ASCOT-LLA и JUPITER вместо запланированных 5 лет наблюдения было прекращено досрочно, спустя менее 3,5 лет, "ввиду явного преимущества исследуемых препаратов". При повторном интракоронарном ультразвуковом исследовании у 64–78% пациентов, получавших розувастатин, действительно было отмечено уменьшение объема бляшек в коронарных артериях и увеличение диаметра пораженного сосуда [27]. Данный процесс сопровождался снижением относительного риска сердечно-сосудистых событий (сердечно-сосудистой смерти, нефатального инфаркта миокарда, нефатального инсульта, острого коронарного синдрома, реваскуляризации артерий) на 44% (рис. 1), что свидетельствует о высокой эффективности розувастатина в профилактике заболеваний и осложнений, обусловленных атеросклерозом [26].
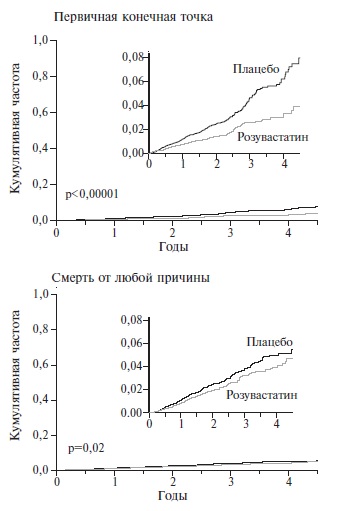
Полученные результаты расценены как основание для более широкого применения максимальных переносимых доз статинов [28]. Данные мета-анализов показывают, что при снижении в крови концентрации ХС ЛНП на 30% с помощью статинов можно ожидать уменьшения объема атеромы на 3%, риска развития ИМ на 33%, мозгового инсульта на 29%, сердечно-сосудистых осложнений на 28%, общей смертности на 22% [29]. В связи с этим нам предлагается без дополнительных доказательств поверить, что если за несколько лет с испытуемыми не произошло ничего плохого, то дальше им тем более не будет хуже, поэтому можно рекомендовать на протяжении десятилетий непрерывно принимать статины с целью первичной профилактики формирования атеросклероза. Нет сомнений, что подобный подход обеспечит процветание и стабильный доход фармацевтическим фирмам, производящим различные гиполипидемические препараты. Однако для населения более важным является вопрос, как данное лечение повлияет на их здоровье и продолжительность жизни?
Несмотря на, казалось бы, успешное и демонстративное достижение первичных конечных точек, окончательные положительные результаты исследования JUPITER могут быть поставлены под сомнение в связи с регистрацией такого важного факта, как наличие тенденции к схождению кривых кумулятивной частоты общей смертности, выявленной незадолго до момента завершения исследования (рис. 1) [26]. При сравнении кривых общей смертности возникает сомнение, действительно ли исследование было прекращено в связи с "явным успехом лечения в основной группе", а не потому, что если бы оно было продолжено, различия между эффектами статина и плацебо могли бы утратить достоверность? Учитывая данные соображения, de Lorgeril и соавт. (2010) заключили, что результаты исследования JUPITER не могут служить доказательством того, что статины, в частности розувастатин, могут использоваться с целью первичной профилактики возникновения сердечно-сосудистых заболеваний. Необходимы новые исследования для оценки воспроизводимости эффектов розувастатина, обнаруженных в рандомизированном клиническом исследовании JUPITER [30].
В литературе встречаются и более категоричные высказывания об отсутствии клинических доказательств пользы применения статинов с целью первичной профилактики возникновения сердечно-сосудистых заболеваний, связанных с атеросклерозом. Более того, высказываются предположения о том, что статины повышая риск кальцификации коронарных артерий и аорты, увеличивают сердечно-сосудистый риск у женщин, пациентов с сахарным диабетом и у людей молодого возраста [31].
Чтобы понять, насколько обоснованы подобные высказывания, попытаемся разобраться в механизме формирования рабдомиолиза и цитолиза гепатоцитов – основных побочных эффектов, которые установлены к настоящему времени при приеме статинов.
При обсуждении вопросов старения и связанного с ним патогенеза атеросклероза в жизни каждого человека можно условно выделить три периода.
Первый – это период внутриутробного развития и максимальной скорости роста в первые 15-20 лет жизни. При этом интенсивность роста, дифференцировки и структурного обновления всех органов и тканей существенно превышает интенсивность апоптоза и катаболических процессов.
Во втором периоде, который продолжается примерно до 40-50 лет, процессы роста и апоптоза находятся в относительном равновесии.
Третий период стартует с наступлением предела Хейфлика, который в разных органах и тканях начинается в разные сроки (условно – в возрасте 40-50-55 лет). При этом процессы апоптоза и катаболизма начинают существенно преобладать над процессами анаболизма и структурного обновления.
Поскольку холестерин является непременным структурным элементом всех клеточных мембран, нужно ли доказывать, что при снижении до определенного предела его содержания на фоне гиполипидемической терапии будет нарушаться стабильность клеточных мембран, в результате чего увеличится количество клеток, погибающих вследствие апоптоза и некроза? Наиболее часто выявляемый на фоне гиполипидемической терапии цитолиз гепатоцитов, поперечнополосатой и гладкой мускулатуры, вероятно, обусловлен тем, что в норме клеточные мембраны этих органов содержат высокое содержание холестерина и, потому, страдают в первую очередь. В то же время, при достаточно продолжительной гиполипидемической терапии, срок которой пока никому не известен, мы сможем наблюдать картину цитолиза в различных органах, что может существенно повлиять на прогноз заболевания.
В литературе часто встречаются высказывания о том, что прекращение приема статинов пациентами ведет к снижению эффективности гиполипидемической терапии. Данное решение пациентов объясняется разными причинами: низкой приверженностью к лечению, некритичной оценкой состояния собственного здоровья, финансовыми трудностями и др. При этом автоматически подразумевается, что если основной причиной смерти в мире являются заболевания, связанные с атеросклерозом, то снижение риска смерти от ассоциированных с ним заболеваний уже может и должно расцениваться как успех и большое достижение. Поэтому выявление редких побочных эффектов не должно служить препятствием к продолжению гиполипидемической терапии. С данной точкой зрения можно согласиться лишь в том случае, если снижение риска смерти от заболеваний, ассоциированных с атеросклерозом, будет сопровождаться снижением общей смертности. Анализ же динамики кривых общей смертности в исследовании JUPITER (рис. 1) показывает, что, несмотря на снижение заболеваемости и смертности, связанных с атеросклерозом, спустя 3,5 года непрерывного приема розувастатина, начинает расти общая смертность, что может отражать смену положительного эффекта от приема статинов на негативный. При этом на фоне снижения риска смерти от ИБС, цереброваскулярной болезни можно ожидать увеличение риска смерти от побочных эффектов, обусловленных самим лечением. Есть основания полагать, что появление симптоматики, которую больной сознательно или интуитивно связывает уже с приемом гиполипидемических препаратов, играет важную роль в прекращении им приема препаратов.
Таким образом, продолжительная гиполипидемическая терапия, существенно замедляя прогрессирование атеросклероза, снижает риск смерти от связанных с ним заболеваний, но при этом может расти риск общей смертности, которая будет обусловлена уже самой гиполипидемической терапией. В конечном же счете можно ожидать снижения средней продолжительности жизни в популяции. Нет необходимости доказывать, что подобный исход не устроит ни врачей, ни пациентов.
Поиск путей медикаментозной терапии с целью первичной профилактики заболеваний, ассоциированных с атеросклерозом, и их лечения
Приведенные данные демонстрируют лишь некоторые проблемы борьбы с атеросклерозом, а также недопустимость использования "простых" и примитивных решений. В обобщенном виде собственное отношение к данному вопросу можно сформулировать следующим образом. Если апоптоз является процессом программируемой гибели клеток, то возрастные инволютивные изменения и связанный ними атеросклероз являются самой распространенной причиной естественной, программируемой смерти человека. Это означает, что точно так же как нельзя отменить закон земного притяжения, невозможно победить и атеросклероз. В то же время можно поставить более скромную, но достижимую цель – замедлить скорость его прогрессирования, увеличив, таким образом, среднюю продолжительность Приведенные данные демонстрируют лишь некоторые проблемы борьбы с атеросклерозом, а также недопустимость использования "простых" и примитивных решений. В обобщенном виде собственное отношение к данному вопросу можно сформулировать следующим образом. Если апоптоз является процессом программируемой гибели клеток, то возрастные инволютивные изменения и связанный ними атеросклероз являются самой распространенной причиной естественной, программируемой смерти человека. Это означает, что точно так же как нельзя отменить закон земного притяжения, невозможно победить и атеросклероз. В то же время можно поставить более скромную, но достижимую цель – замедлить скорость его прогрессирования, увеличив, таким образом, среднюю продолжительность жизни. Считаем данную цель вполне достижимой, при этом полностью согласны с утверждением, что в основе профилактики возникновения заболеваний, обусловленных атеросклерозом, в первую очередь лежит соблюдение здорового образа жизни. Вспомогательную роль в решении главной задачи играют гиполипидемические препараты. С рядом предлагаемых в настоящее время рекомендаций можно согласиться, другие требуют более серьезной проверки и доработки. Третьи же, сформулированные на основе представлений о том, что холестерин – это наш враг, не просто ошибочны, но представляют опасность в глобальном масштабе. К подобным рекомендациям в полной мере относится высказывание Эвклида – "То, что принято без доказательств, может быть отвергнуто без доказательств". Приведенная фраза в первую очередь имеет отношение к рекомендации, предлагающей начинать профилактическую гиполипидемическую терапию лицам без клинических проявлений заболевания, связанного с атеросклерозом, уже в возрасте 40 лет и продолжать ее всю жизнь. Обоснованность данного утверждения не доказана ни теоретически, ни практически.
Наличие стенокардии или транзиторной ишемической атаки свидетельствует о той стадии атеросклероза, когда риск смерти от заболевания, связанного с атеросклерозом, существенно превышает риск смерти от осложнений, связанных с гиполипидемической терапией. В подобной ситуации использование статинов в высоких дозах, предлагаемых действующими рекомендациями [15,32-34], можно считать вполне обоснованным. Объединенной группой исследователей установлено, что использование статинов одинаково полезно как для мужчин, так и для женщин [33]. Логично, что в программу вторичной профилактики сердечно-сосудистых заболеваний также следует рутинно включать гиполипидемическую терапию статинами независимо от пола. Открытым остается вопрос, должна ли эта терапия быть пожизненной?
В исследование ASCOT-LLA, в котором изучалась эффективность первичной профилактики, включали мужчин и женщин в возрасте от 40 до 79 лет (10305 больных с уровнем общего холестерина ≤6,5 ммоль/л), не имевших в анамнезе сердечно-сосудистых заболеваний. Необходимо отметить, что, несмотря на большой диапазон возраста пациентов, большинство (63,6%) из них были старше 60 лет [25]. Соответственно, основные выводы о снижении риска всех коронарных событий на 29% на фоне приема аторвастатина были получены на категории пациентов в возрасте в среднем 63 года. Достигнутый результат в целом можно расценивать как убедительное доказательство преобладания пользы приема аторвастатина в течение 3,5 лет по сравнению с плацебо в данной возрастной группе.
Сходные данные были получены и в исследовании JUPITER, в которое были включены 17802 пациентов (мужчины в возрасте 50 лет и старше и женщины в возрасте 60 лет и старше, средний возраст – 66 лет). Как и в исследовании ASCOT-LLA, пациенты не страдали сердечно-сосудистыми заболеваниями. Уровень ХС ЛНП у них был менее 3,4 ммоль/л, триглицеридов – менее 5,7 ммоль/л, а уровень вч-СРБ – 2,0 мг/л и выше. На фоне приема розувастатина в дозе 20 мг/сут содержание ХС ЛНП снизилось в среднем на 50%, вч-СРБ – на 37% от исходного. При этом риск комбинированной сердечно-сосудистой конечной точки снизился на 47%, ИМ – на 54%, инсульта – на 48%, смерти от любых причин – на 22% [26]. Таким образом, применение розувастатина в течение 3,5 лет по эффективности в профилактике возникновения первичных конечных точек существенно превосходило плацебо в той же возрастной группе.
Снижение риска сердечно-сосудистой и общей смертности на фоне приема статинов в течение 3,5 лет создает иллюзию безопасности их приема в широком возрастном диапазоне. Однако обращаем еще раз внимание на то, что основные выводы сделаны на основании результатов, полученных в выборке пациентов в возрасте в среднем 63-66 лет в течение относительно непродолжительного срока. Обсуждая стратегию лечения любого заболевания, считаем необходимым отметить, что если теоретические предпосылки не подтверждаются практическими результатами, следует автоматически сделать вывод об ошибочности теоретических обоснований. Поскольку исследования продолжительностью 20-30-40 лет еще никогда не проводились, доказательную базу действующих рекомендаций [15-17,19] следует признать недостаточной. Однако это не единственный аргумент.
Дополнительное подтверждение данному выводу можно найти при сопоставлении результатов исследований ASCOT-LLA, JUPITER и WOSCOPS, а также того факта, что после 54 лет содержание общего холестерина начинает быстро увеличиваться. К этому времени у многих людей без клинических проявлений атеросклероза уже имеются признаки поражения органов-мишеней [4]. В последующем в различные сроки возникают характерные клинические проявления атеросклероза, которые зависят от локализации бляшек в конкретных артериях.
Следует уточнить, что в исследовании WOSCOPS средний возраст пациентов составлял 55 лет [35], а в исследованиях ASCOT-LLA и JUPITER, подтвердивших эффективность аторвастатина и розувастатина в первичной профилактике сердечно-сосудистых заболеваний, ассоциированных с атеросклерозом, и смерти от них, – около 65 лет [25,26]. С учетом изложенного, можно предположить, что гиполипидемическую терапию с целью первичной профилактики заболеваний, ассоциированных с атеросклерозом, можно начинать в возрасте 55-65 лет.
В 2016 г. были опубликованы результаты обсервационного исследования, в котором изучались безопасность и эффективность снижения уровня ХС ЛНП на фоне применения статинов в отдаленные сроки (в течение 20 лет) у пациентов, принимавших участие в рандомизированном, двойном слепом, плацебо-контролируемом исследовании WOSCOPS [36]. На фоне 5-летнего (4,9 года) приема правастатина в дозе 40 мг/сут у 6595 мужчин в возрасте от 45 до 64 лет (в среднем 55,2 года) без инфаркта миокарда в анамнезе и со средним уровнем общего холестерина 7,0 ммоль/л было отмечено снижение частоты развития нефатального ИМ и смерти от ИБС на 31% [35]. Частоту применения статинов, к сожалению, оценивали лишь в течение первых 5 лет после завершения исследования WOSCOPS. В течение указанного срока доля пациентов, принимавших статины, в группах правастатина и плацебо составила 38,7% и 35,2% соответственно [37]. Через 15 лет после завершения исследования WOSCOPS у мужчин, которые во время исследования в течение 5 лет принимали правастатин по 40 мг/сут, смертность была на 12% ниже, чем у мужчин, включенных в группу плацебо. С учетом приведенных данных высказывается предположение, что эффект терапии статинами может сохраняться и в отдаленные сроки наблюдения.
В целом, отдаленные результаты исследования WOSCOPS трактуются как очередное доказательство эффективности гиполипидемической терапии статинами. Однако обращает на себя внимание, что алгоритм использования правастатина в данном исследовании существенно отличается от предлагаемых современных схем. На основании анализа отдаленных результатов исследования WOSCOPS высказывается предположение, что эффект терапии статинами может сохраняться и в отдаленные сроки наблюдения. Автоматически это означает, что при непрерывном приеме препаратов данного класса, в конечном счете, разовьется негативный кумулятивный эффект. Чтобы понять, насколько данное предположение является обоснованным, следует попытаться дать ответ на вопрос, почему 2/3 пациентов прекратили прием статинов спустя 5 лет с момента начала исследования?
В рекомендациях АСС/АНА отсутствует требование достижения определенного целевого уровня ХС ЛНП [15]. В рекомендациях же ESC/EAS и российских рекомендациях предполагается достижение определенного целевого уровня ХС ЛНП [16,17]. Однако если достичь целевого уровня ХС ЛНП не удается, предлагается универсальная рекомендация – пациентам с высоким и очень высоким риском сердечно-сосудистых осложнений следует стремиться к снижению уровня ХС ЛНП по крайней мере на 50%. Такого эффекта при монотерапии статинами можно добиться при применении высоких доз аторвастатина и розувастатина. Прием же правастатина в дозе 40 мг/сут относится к недостаточно интенсивным режимам медикаментозного лечения. В исследовании STELLAR было показано, что лечение розувастатином или аторвастатином в дозе 10 мг/сут приводит к снижению уровня ХС ЛНП в среднем на 46,8 и 36,8%, соответственно, симвастатином в дозе 20 мг/сут – на 35,0%, в то время как правастатин в дозе, которая использовалась в исследовании WOSCOPS (40 мг/сут), снижал концентрацию ХС ЛНП всего на 29,7% [38,39].
Таким образом, с одной стороны, имеются исследования, свидетельствующие о том, что прекращение непрерывной и интенсивной терапии статинами при заболевании, обусловленном атеросклерозом, неблагоприятно влияет на прогноз. С другой стороны, статины, принимаемые регулярно с целью первичной профилактики атеросклероза лишь в течение первых 5 лет и в умеренной дозе, в отдаленные сроки вызывают снижение смертности от ИМ даже при нерегулярном приеме препарата.
Возникает вопрос, насколько обоснованным является предложение проводить непрерывную агрессивную гиполипидемическую терапию при высокой и очень высокой степени риска?
В действующих рекомендациях предлагаемый целевой уровень ХС ЛНП для пациентов с очень высоким риском сердечно-сосудистых событий фактически соответствует уровню ЛНП у новорожденного. Известно также, что в современном мире у представителей племен, сохранивших первобытно-общинный образ жизни, не зафиксировано атеросклеротического повреждения артериальной стенки даже в возрасте 70–80 лет [40,41]. На протяжении всей жизни в популяции таких племен отмечается уровень ЛНП 50–75 мг/дл [42]. Пора зи тельно, но уровень ЛНП у здоровых приматов соответствует уровню ЛНП у новорожденных детей и людей, живущих в условиях первобытно-общинных отношений. На основании приведенных данных высказываются предположения, что уровень ХС ЛНП 50–75 мг/дл является допустимым, но сегодня он все же не рассматривается в качестве нормы для здоровых взрослых людей. Важно отметить, что в исследовании REVERSAL прогрессирование атеросклеротической бляшки было остановлено при снижении уровня ХС ЛНП до 79 мг/дл [43]. При уровне ЛНП ≤67 мг/дл рост бляшки останавливается (0% прироста объема). Аналогичные данные получены в исследованиях ASAP и АRBITER [44,45]. Таким образом, был сформирован постулат, получивший очень широкое распространение, – "чем более низкого уровня ХС ЛНП плазмы удается достичь, тем ниже риск возникновения неблагоприятных сердечно-сосудистых событий" [46].
Самый низкий уровень ХС ЛНП был зафиксирован в исследовании ASTEROID: у 12% пациентов, получавших розувастатин в дозе 60 мг/сут – <40 мг/дл (!), а у 41% – 40–60 мг/дл. Такой уровень ХС ЛНП не приводил к ухудшению самочувствия пациентов или иным негативным проявлениям [47]. Самый крупный метаанализ по оценке влияния степени снижения ЛНП на риск развития сердечно-сосудистых событий был выполнен в 2010 году и включал в себя 26 контролируемых клинических исследований, в которых приняли участие 170 000 пациентов [48]. Средняя длительность наблюдения составила 5,1 года. Было установлено, что снижение уровня ХС ЛНП под действием статинов на 1 ммоль/л сопровождается снижением смертности от всех причин на 10%, смертности от сердечно-сосудистых заболеваний на 20%, коронарных осложнений на 23% и инсульта на 17%. Кроме того, было показано, что снижение уровня ХС ЛНП на 2-3 ммоль/л не приведет к пропорциональному 2-3-кратному снижению риска сердечно-сосудистых событий по сравнению с таковым при снижении уровня ХС ЛНП на 1 ммоль/л. При лечении статинами не было отмечено увеличения риска развития онкологических заболеваний, в том числе при снижении уровня ХС ЛНП на 2 ммоль/л и более. В целом, можно сделать вывод, что целевые уровня липопротеинов, указанные в современных рекомендациях, в краткосрочной перспективе могут считаться безопасными, допустимые же значения липопротеинов в отдаленном периоде пока неизвестны.
С учетом сформулированных представлений о роли возраста в патогенезе атеросклероза можно предположить, что низкий уровень ХС ЛНП у новорожденных может быть объяснен высоким темпом роста ребенка и связанным с этим уровнем анаболических процессов. Быстрое увеличение количества новых клеток сопровождается максимальной абсорбцией ими синтезированного холестерина. В таком случае низкий уровень ХС ЛНП в крови ребенка следует расценивать не как вариант нормы, приемлемый для взрослого человека, а как результат временного перераспределения холестерина между клеточным пулом и пулом липопротеинов крови в интенсивно растущем организме. Низкий уровень ХС ЛНП у представителей племен, ведущих первобытно-общинный образ жизни, и здоровых приматов может объясняться более высокой физической активностью, особенностями питания, отсутствием ожирения и гипертриглицеридемии.
Обобщив отдаленные результаты гиполипидемической терапии в исследовании WOSCOPS, считаем возможным сформулировать следующие предположения:- при продолжительной гиполипидемической терапии с целью первичной профилактики заболеваний, связанных с атеросклерозом, прерывистый прием препаратов циклами длительностью до нескольких лет может оказаться более предпочтительным и безопасным;
- назначение статинов с целью первичной профилактики представляется более обоснованным в умеренных дозах, снижающих уровень ХС ЛНП не более чем на 30%.
Предполагаемая продолжительность перерывов между циклами неизвестна.
Если целесообразность назначения гиполипидемических препаратов с целью первичной профилактики заболеваний, ассоциированных с атеросклерозом, представляется дискуссионной и недостаточно обоснованной, то необходимость их непрерывного приема при сформировавшемся заболевании всеми рекомендациями признается не подлежащей сомнению. Наличие заболевания, связанного с атеросклерозом, само по себе служит основанием для назначения агрессивной моноили комбинированной гиполипидемической терапии.
Чтобы понять степень обоснованности данной рекомендации, обратимся к собственным данным. При анализе комбинированной конечной точки у 566 пациентов с инфарктом миокарда, из которых 30 умерли, нами установлено, что содержание общего холестерина в группе выживших и умерших было повышено (соответственно, 5,75±1,22 и 5,67±1,75 ммоль/л) [49]. Обращает внимание, что превышение нормальных параметров общего холестерина в обоих случаях является минимальным. Статистические же различия сравниваемых показателей недостоверны. В целом, ситуация выглядит довольно парадоксальной. Все наши представления о патогенезе атеросклероза и связанных с ним заболеваний базируются на версии, что холестерин является "шлаком", переполняющим наши сосуды. При этом считается, что степень тяжести заболевания пропорциональна степени выраженности гиперхолестеринемии и дислипидемии. С учетом данных представлений формулируются как международные, так и российские рекомендации по гиполипидемической терапии. Дей ствительно, на доклинической стадии атеросклероза и при различных видах стенокардии выраженность гиперхоле стеринемии может существенно превышать выявленные нами показатели. В этом плане, еще более парадоксальным представляется тот факт, что в группе умерших содержание ЛНП и триглицеридов было достоверно более низким, чем в группе выживших (ЛНП 2,70±0,10 и 4,16±1,18 ммоль/л, соответственно, р<0,05, и триглицеридов 0,68±0,11 и 2,62±1,82 ммоль/л, соответственно; р<0,01) [49].
Нет сомнений в том, что снижение содержания ЛНП и триглицеридов в группе умерших является не недоразумением, а прогностическим признаком летального исхода в ближайшие сроки. Чтобы объяснить данный факт, необходимо оценить динамику изменений ЛНП в течение всей жизни. Ранее отмечалось, что у грудного ребенка уровень ЛНП минимальный, затем он растет и, бόльшую часть жизни, остается на стабильном уровне. После 55 лет содержание ЛНП начинает стремительно расти, а перед смертью вновь падает. Объяснить данные факты исходя из представлений о том, что холестерин в организме играет исключительно негативную роль, невозможно. Ситуация перестает казаться неразрешимой, если мы не будем забывать, что холестерин в этой роли выступает лишь во вторую очередь, а в первую – он является незаменимым субстратом в организме человека и животных. При этом главная роль в формировании и прогрессировании атеросклероза принадлежит возрастным инволютивным изменениям [3]. Ранее отмечалось, что низкие уровни ЛНП у грудных детей можно объяснить интенсивной абсорбцией холестерина интенсивно растущим организмом. Стабильный уровень ЛНП в юношеском и среднем возрасте свидетельствует о том, что количество клеток, погибших в результате апоптоза в равной степени восполняется количеством регенерировавших клеток. Падение регенераторного потенциала начинается примерно с 55 лет. На этой доклинической стадии количество клеток, погибающих в различных органах и тканях в результате апоптоза, начинает преобладать над количеством вновьобразованных, чем и может быть объяснен стремительный рост содержания холестерина ЛНП в крови. С определенного момента появляются признаки поражения органов-мишеней, а затем клинические признаки стенокардии, транзиторной ишемической атаки, инфаркта миокарда или инсульта. При этом, в стенках аорты и артерий в результате гибели эндотелиоцитов появляются множественные очаги десквамации эндотелия с обнажением обширных полей субэндотелиального слоя, через которые липопротеины беспрепятственно начинают инфильтрировать стенки аорты и артерий. При десквамации эндотелия с образованием обширных полей изъязвлений интима интенсивно сорбирует не только ЛНП, но и соли кальция, при этом формируется атерокальциноз (IV стадия атеросклероза). При посмертном исследовании в различных отделах аорты и артерий можно обнаружить признаки атеросклероза на разных стадиях развития. Нарушение целости эндотелиального слоя сопровождается активацией процессов свертывания, фибринолиза и кининогенеза в сосудистом русле. В зависимости от соотношения активности систем свертывания и противосвертывания возможен спонтанный лизис тромба. С учетом изложенного есть основание сделать вывод, что низкий уровень общего холестерина, триглицеридов и ЛНП крови при инфаркте миокарда является показателем очень грубых органических изменений в сердечно-сосудистой системе, обусловленных максимальным падением регенераторного потенциала. Одновременно данные изменения являются признаками крайне неблагоприятного прогноза в ближайшие сроки.
В структуре клеточных мембран холестерин играет стабилизирующую и "цементирующую" роль. В связи с этим подавление синтеза холестерина с помощью гиполипидемических препаратов усилит дестабилизацию клеточных мембран. В результате развиваются известные побочные эффекты, такие как цитолиз гепатоцитов и рабдомиолиз.
Следует учитывать, что подавляя синтез холестерина при стабильной стенокардии и достаточно высоком регенераторном потенциале, статины могут замедлить скорость прогрессирования атеросклероза, временно снизив риск сердечно-сосудистой и общей смертности. При тяжелом же инфаркте миокарда, сопровождающися выраженным падением регенераторного потенциала, назначение статинов, усиливая дестабилизацию клеточных мембран, может, наоборот, повысить риск смерти, что делает сомнительной рекомендацию назначения гиполипидемических препаратов при тяжелом инфаркте миокарда.
Обратившись к исследованию JUPITER (рис. 1), мы видим, что на фоне профилактического приема розувастатина риск смерти от заболевания, связанного с атеросклерозом достоверно ниже, чем в группе плацебо на протяжении всего исследования. Именно данная часть исследования легла в основу рекомендации о возможности непрерывного, продолжительного использования статинов при атеросклерозе. В то же время, анализ общей смертности (рис. 1) в том же исследовании свидетельствует о том, что достоверное расхождение кривых общей смертности на фоне приема розувастатина и плацебо мы можем наблюдать лишь в течение первых 3,5-4 лет непрерывного приема розувастатина. Через 4,5 года они почти сливаются, а через 5-6 лет общая смертность на фоне приема статина, возможно, превысит смертность на фоне приема плацебо. Трудно возражать мнению высокоавторитетной армии профессионалов, однако не можем удержаться от вопроса, с учетом приведенных данных, можно ли рекомендацию о целесообразности непрерывного приема гиполипидемических препаратов продолжать считать обоснованной и можно ли при тяжелом ИМ, сопровождающемся снижением ЛНП и триглицеридов, назначать агрессивную гиполипидемическую терапию?
Используемые источники
- Anitschkow N, Chalatow S. Uber experimentelle Cholesterin-steatose und ihre Bedeutung für die Entstehung einiger pathologischer Prozesse. Zentralbl Allg Pathol 1913;24:1-9.
- Ross R, Glomset JA. The pathogenesis of atherosclerosis (first of two parts). N Engl J Med 1976;295:369-77.
- Литовский И.А., Гордиенко А.В. Атеросклероз и гипертоническая болезнь: вопросы патогенеза, диагностики и лечения. СПб., 2013. [Litovskij IA, Gordienko AV. Atherosclerosis and hypertension: issues of pathogenesis, diagnosis and treatment. Saint-Petersburg, 2013 (in Russ.)].
- Сердюков Д.Ю. Оптимизация донозологической диагностики и профилак- тики атеросклероза у военнослужащих-мужчин молодого и среднего возрас- та. СПб., 2018. [Serdyukov DYu. Optimization of prenosological diagnosis and prevention of atherosclerosis in military men of young and middle age. SaintPetersburg, 2018 (in Russ.)].
- Проскуряков С.Я., Габай В.Л., Коноплянников А.Г. Некроз – активная управляемая форма программируемой клеточной гибели. Биохимия 2002;67(4):467-91. [Proskuryakov SYa, Gabai VL, Konoplyannikov AG. Necrosis is an active controlled form of programmed cell death. Biochemistry 2002; 67(4):467-91 (In Russ.)].
- Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res 1961;253:585-621.
- Matsumura T, Zerrudo Z, Hayflick L. Senescent human diploid cells in culture: Sur-vival, DNA synthesis and morphology. J Gerontol 1979;34:328-34.
- Hayfiick L. How and why we age. Exp Gerontol 1998;33:639-53.
- Blackburn EH. Structure and function of telomeres. Nature 1991;350:569-73.
- Blackburn EH. Telomerases. Annu Rev Biochem 1992;61:113-29.
- Zakian VA. Structure and functions of telomeres. Ann Rev Genet 1989;23:579604.
- Counter CM, Avilion AA, LeFeuvre C, et al. Telomere shortening associated with chromosome instability is arrested in immortal cells which express telomerase activity. EMBO J 1992;11:1921-9.
- Allsopp RC, Vaziri H, Patterson C, Goldstein S, et al. Telomere length predicts replicative capacity of human fibroblasts. Proc Natl Acad Sci USA 1992;89(21): 10114-8.
- Коровина Н.А., Захарова И.Н., Обыночная Е.Г. Применение антиоксидан- тов в педиатрической практике. Consilium medicum. Педиатрия 2003;9(5): 47–52. [Korovinа NA, Zakharova IN, Obynochny EG. Тhe use of antioxidants in pediatric practice. Consilium medicum. Pediatrics 2003;9(5):47-52 (In Russ.)].
- Stone NJ, Robinson JG, Lichtenstein AH, et al. American College of Сardiology/ American Heart Association Task Force on Practice Guidelines. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovas-cular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014;129(25 Suppl. 2):1–45.
- Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J 2016;37(39):2999-3058.
- Диагностика и коррекция нарушений липидного обмена с целью профи- лактики и лечения атеросклероза. Российские рекомендации, VI пересмотр. Атеросклероз и дислипидемии 2017;3:5-22. [Diagnosis and correction of lipid metabolism disorders for the prevention and treatment of atherosclerosis. Russian recommendations, VI revision. Atherosclerosis and dyslipidemia 2017;3:5-22 (In Russ.)].
- Jacobson TA, Ito MK, Maki KC, et al. National Lipid Association кecommendations for patient-centered management of dyslipidemia: Part 1 – Full Report. J Clin Lipidol 2015;9:129–69.
- Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ ABC/ACPM/ADA/AGS/APhA/ASPC/ NLA/ PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines [published online ahead of print November 10, 2018]. Circulation. doi: 10.1161/ CIR.0000000000000625.
- Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidemias: lipid modification to reduce cardiovascular risk: The Task Force for the Management of Dyslipidemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J 2019;Aug 31.
- Daskalapoulou SS, Delaney JA, Filion KB, et al. Discontinuation of statin therapy following an acute myocardial infarction: a population-based study. Eur Heart J 2008;29:2083–91.
- Heeschen C, Hamm CW, Laufs U, et al. Withdrawal of statins increases event rates in patients with acute coronary syndromes. Circulation 2002;105:1446-52.
- Spencer FA, Fonarow GC, Frederick PD, et al. Early withdrawal of statin therapy in patients with non-ST-segment elevation myocardial infarction. Arch Intern Med 2004;164(19):2162-68.
- Yamamoto A, Sudo H, Endo A. Therapeutic effects of ML-236B in primary hyper-cholesterolemia. Atherosclerosis 1980;35(3):259–66.
- Sever PS, Dahlof В, Poulter NR, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations in the Anglo-Scandinavian Cardiac Outcomes TrialLipid Lowering Arm (ASCOT-LLA): a multicentre randomized controlled trial. Lancet 2003;361:1149-58.
- Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008; 359:2195-207.
- Nissen SE, Nicholls SJ, Sipahi I, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295(13):1556–65.
- Карпов Ю.А. Статины и профилактика сердечно-сосудистых осложнений: позиции розувастатина. Атмосфера. Новости кардиологии 2013;3:19-24. [Kar-pov YuА. Statins and prevention of cardiovascular complications: positions of ro-suvastatin. Atmosphere. Cardiology news 2013;3:19-24 (In Russ.)].
- Бубнова М., Семенова Е. Розувастатин: гиполипидемический, клинический и антиатеросклеротический эффекты. Врач 2011;4:62-6. [Bubnova M, Semenova E. Rosuvastatin: hypolipidemic, clinical and anti-atherosclerotic effects. Doctor 2011;4:62-6 (In Russ.)].
- de Lorgeril M, Salen P, Abramson J, et al. Cholesterol lowering, cardiovascular diseases, and the rosuvastatin – JUPITER controversy: a critical reappraisal. Arch Intern Med 2010;170 (12):1032–6.
- Sultan S, Hynes N. Cardiovascular disease: primary prevention, disease modulation and regenerative therapy. Vascular 2012;20(5):243-50.
- Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383–9.
- Cholesterol Treatment Trialists’ (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170000 participants in 26 randomised trials. Lancet 2010;376:1670–81.
- Brugts JJ, Yetgin T, Hoeks S, et al. The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials. BMJ 2009;338:b2376.
- Shepherd J, Cobbe SM, Ford I, et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995;333:1301–7.
- Ford I, Murray Н, McCowan С, Packard СJ. Long-term safety and efficacy of low-ering low-density lipoprotein cholesterol with statin therapy: 20-year followup of West of Scotland Coronary Prevention Study. Circulation 2016;133(11): 1073-80.
- Гиляревский C.Р., Кузьмина И.М., Голшмид М.В., Захарова Г.Ю. “Непоте - рянное время” в профилактике развития осложнений сердечно-сосудистых заболеваний: отдаленные результаты применения статинов с целью первич- ной профилактики. Атеротромбоз 2016;2:98-105. [Gilyarevskyi SR, Kuzminа IM, Goldshmid MV., Zakharova GYu. “Not lost time” in the preven-tion of complications of cardiovascular diseases: long-term results with the use of statins in primary prevention. Atherothrombosis 2016;2:98-105 (In Russ.)].
- Jones PH, Davidson MH, Stein EA, et al. for the STELLAR Study Group. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR Trial). Am J Cardiol 2003;92:152–60.
- McKenney JM, Jones PH, Adamczyk MA, et al. Comparison of the efficacy of ro-suvastatin versus atorvastatin, simvastatin, and pravastatin in achieving lipid goals: results from the STELLAR trial. Curr Med Res Opin 2003;19:689-98.
- Akosah KO, Schaper A, Cogbill C, Schoenfeld P. Preventing myocardial infarction in the young adult in the first place: how do the National Cholesterol Education Panel III guidelines perform? J Am Coll Cardiol 2003;41(9):1475–9.
- Cordain L, Eaton SB, Miller JB, et al. The paradoxical nature of hunter-gatherer diets: meat based, yet non-atherogenic. Eur J Clin Nutr 2002;1:42–52.
- Gilyarevsky SR, Golshmid MV. Influence of race on the choice of intervention tac-tics for prevention of cardiovascular diseases. EJIM 2014;1 (3):171–80.
- O'Keefe JH Jr, Cordain L, Harris WH, et al. Optimal low-density lipoprotein is 50 to 70 mg/dl: lower is better and physiologically normal. J Am Coll Cardiol 2004; 43(11):2142–6.
- Smilde TJ, van Wissen S, Wollersheim H, et al. Effect of aggressive versus conven-tional lipid lowering on atherosclerosis progression in familial hypercholesterolemia (ASAP): a prospective, randomized, double-blind trial. Lancet 2001; 357:577–81.
- Taylor AJ, Kent SM, Flaherty PJ, et al. ARBITER: Arterial Biology for the Investi-gation of the Treatment Effects of Reducing Cholesterol: a randomized trial com-paring the effects of atorvastatin and pravastatin on carotid intima medial thickness. Circulation 2002;106:2055–60.
- Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010;376:1670–81.
- Forrester JS. Redefining normal low-density lipoprotein cholesterol: a strategy to unseat coronary disease as the nation's leading killer. J Am Coll Cardiol 2010; 56(8):630–6.
- Boekholdt SM, Hovingh GK, Mora S, et al. Very low levels of atherogenic lipopro-teins and the risk for cardiovascular events: a meta-analysis of statin trials. J Am Coll Cardiol 2014;64(5):485–94.
- Сотников А.В. Метаболические, нефрологические и кардиальные факторы прогноза инфаркта миокарда у мужчин молодого и среднего возраста в раз- личные сезоны года. СПб., 2018. [Sotnikov AV. Metabolic, neurological and cardiac prognostic factors for myocardial infarction in young and middle-aged men in different seasons of the year. Saint-Petersburg, 2018 (in Russ.)].
