Исследование сывороточного уровня резистина у пациентов с морбидным ожирением
Оценить уровень резистина в сыворотке крови у пациентов с различными степенями ожирения и установить его возможные взаимосвязи с метаболическими показателями и проявлениями хронической болезни почек (ХБП).
В исследование включены 69 пациентов с ожирением, готовящихся к бариатрическим операциям в центрах хирургии веса г. Москвы. Степень ожирения определяли на основании индекса массы тела (ИМТ). Перед операцией измеряли уровни глюкозы, инсулина (с оценкой уровня инсулинорезистентности – ИР), липидов и креатинина крови, рассчитывали скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI. Уровень резистина определяли твердофазным иммуноферментным методом в сыворотке крови у больных ожирением и 11 здоровых лиц.
Уровень резистина прямо коррелировал с ИМТ в подгруппе пациентов со сверхожирением (r s =0,629, p=0,002). Связи уровня резистина с параметрами ИР у больных ожирением с нарушением углеводного обмена выявлено не было. Отрицательная корреляционная связь уровня резистина с СКФ (r s =-0,435, p=0,043) выявлена у пациентов со сверхожирением.
Снижение СКФ у больных со сверхожирением ассоциировано с ростом в сыворотке крови резистина, но напрямую оно не коррелирует с показателями ИР, отражая, по-видимому, более сложные механизмы участия резистина в развитии дисфункции почек при ожирении, что нуждается в дальнейшем изучении.
Ожирение – хроническое прогрессирующее заболевание обмена веществ, проявляющееся избыточным развитием жировой ткани. Не вызывает сомнения, что патологическое увеличение объема жировой ткани в организме выходит далеко за рамки сугубо эстетической проблемы и является причиной развития целого ряда тяжелых, часто необратимых и приводящих к смерти заболеваний [1].
Прогрессивное увеличение числа людей с избыточной массой тела и ожирением среди населения экономически развитых стран, выдвинувшее данную проблему в разряд социально значимых, отмечается с 70-80-х годов прошлого столетия. По данным Всемирной организации здравоохранения (ВОЗ), в 2016 г. более 650 миллионов взрослых людей старше 18 лет страдали ожирением [2]. Особую опасность представляют тяжелые формы заболевания, или так называемое морбидное (от лат. morbus – болезнь) ожирение (МО), критериями диагностики которого являются увеличение индекса массы тела (ИМТ) ≥40 кг/м2 или ≥35 кг/м2 в сочетании с серьезными осложнениями, связанными с ожирением.
Среди заболеваний, ассоциированных с ожирением, прогностически значимым является сахарный диабет 2 типа (СД), который сопровождается высокой частотой развития сердечно-сосудистых осложнений и терминальной почечной недостаточности, являющихся основными причинами смертности данной категории больных [3,4]. В этой связи изучение механизмов развития инсулинорезистентности (ИР), лежащей в основе СД типа и метаболического синдрома, представляется особенно актуальным.
Одними из возможных инициаторов метаболических нарушений при ожирении являются синтезируемые жировой тканью медиаторы – адипоцитокины. Участие некоторых из них (в частности, лептина, адипонектина, фактора некроза опухолей-α [ФНО-α] и других) в метаболизме и гомеостазе организма широко освещено в литературе [5], в то время как роль других адипокинов, например, резистина, изучена недостаточна.
Первые данные о строении и функциях резистина – адипокина, ответственного за развитие ИР (за что он и получил свое название), опубликовали зарубежные исследователи в 2001 г. [6]. Результаты эксперимен тальных работ на мышах свидетельствовали о контр инсулярных эффектах резистина: прекращение инсулин-стимулированного входа глюкозы в адипоцит и, как следствие, нарушение толерантности к глюкозе и развитие ИР, улучшение чувствительности к инсулину после иммунонейтрализации антителами эндогенного резистина. М. Rajala и соавт. показали значительное повышение уровня циркулирующего резистина и его положительную корреляцию с сывороточными уровнями инсулина, глюкозы и липидов у мышей с ожирением [7]. Однако полученные в настоящее время противоречивые данные не позволяют однозначно судить о роли резистина в развитии ИР. В исследовании А.Ю. Майорова (2011 г.) показано, что уровни резистина, а также адипонектина у пациентов с ранними формами нарушения углеводного обмена (нарушение толерантности к глюкозе, нарушение гликемии натощак) и с СД 2 типа были достоверно ниже, чем у здоровых людей, а уровни ФНО-α и проинсулина – выше [8].
Целью исследования было оценить уровень резистина в сыворотке крови у пациентов с различными степенями ожирения и установить его возможные взаимосвязи с метаболическими показателями и проявлениями хронической болезни почек (ХБП).
Материал и методы
В исследование включали пациентов с ожирением различной степени, которым по причине безуспешности консервативных методов лечения и наличия сопутствующих заболеваний планировалось проведение бариатрических операций – хирургических вмешательств на органах желудочно-кишечного тракта с целью снижения массы тела (например, продольная резекция желудка, желудочное шунтирование, билиопанкреатическое шунтирование и другие). Пациенты проходили лечение в центрах хирургии веса г. Москвы, в том числе Центре эндохирургии и литотрипсии и Институте пластической хирургии и косметологии.
Для определения степени ожирения использовали индекс массы тела (ИМТ, кг/м2), а для оценки типа рас пределения подкожно-жировой клетчатки определяли окружность талии (ОТ) и бедер (ОБ) и рассчитывали коэффициент ОТ/ОБ. Окружность талии измеряли нерастяжимой стандартной лентой в наиболее узкой части между реберным краем и подвздошным гребнем, окружность бедер – по наиболее широкой части бедер. Показателями наличия абдоминального ожирения считают значения ОТ >88 см у женщин и >102 см у мужчин, ОТ/ОБ >0,85 у женщин и >0,9 у мужчин [9].
Перед операцией измеряли уровни глюкозы, инсулина (с оценкой ИР), общего холестерина, холестерина липопротеидов высокой (ЛВП) и низкой плотности (ЛНП) и креатинина крови и рассчитывали скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI. Уровень ИР оценивали с помощью структурной математической модели на основе определения инсулина и глюкозы плазмы натощак – HOMA (Homeostasis model assessment): HOMAIR = ИРИ (мкЕд/мл) × ГПН (ммоль/л)/22,5, где ИРИ – иммунореактивный инсулин, ГПН – глюкоза плазмы натощак. Критерием ИР было значение HOMA-IR ≥2,7 (2,7 – порог, соответствующий 75-му перцентилю популяционных значений у лиц без диабета). Для оценки функциональной активности β-клеток поджелудочной железы применяли индекс HOMA-β=20 × ИРИ (мкЕд/мл)/(ГПН (ммоль/л) – 3,5). Условно в норме функция β-клеток составляет 100%.
Уровень резистина определяли твердофазным иммуноферментным методом (врач-лаборант А.Г. Серова) с использованием реактива фирмы Human Resistin ELISA "Mediagnost" (Германия) в сыворотке крови, взятой натощак после 14-часового голодания.
Статистическая обработка данных производилась с помощью программы SPSS Statistics Version 23, IBM, США. Анализ соответствия вида распределения признака закону нормального распределения проведен с помощью теста Колмогорова-Смирнова. Так как большинство величин не соответствовало закону нормального распределения, при описании количественных данных использовали медиану (Ме) и интерквартильный размах [25-й; 75-й перцентили]. Качественные показатели представляли в виде абсолютного числа наблюдений и доли (в %) от количества обследованных в соответствующей группе или от общего числа обследованных. Для проверки согласия наблюдаемых и ожидаемых частот вычисляли критерий c2. Для выявления и оценки характера взаимодействия между различными факторами использовали непараметрический тест ранговой корреляции Спирмена, метод логистической регрессии. При сравнении сформированных групп пациентов использовали критерий Манна-Уитни (для двух групп) и критерий Краскала-Уоллиса (для трех и более групп). Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 5% (р=0,05).
Результаты
В исследование включены 69 пациентов с ожирением различных степеней (табл. 1). Медиана ИМТ составила 46,1 кг/м2 [38,4; 52,5]. В зависимости от степени ожирения были выделены 3 подгруппы больных: первую составили 23 пациента с ожирением II степени (ИМТ 35-39,9 кг/м2), вторую – 24 пациента с ожирением III степени (ИМТ 40-49,9 кг/м2), третью – 22 пациента со сверхожирением (ИМТ ≥50 кг/м2). Медианы ИМТ в трех подгруппах равнялись 37,5 кг/м2 [36,3; 38,5], 46,2 кг/м2 [43,5; 46,9] и 56,2 кг/м2 [52,8; 62,4], соответственно. Медианы ОТ и ОТ/ОБ у обследованных пациентов равнялись 133 см [120,0; 144,5] и 1,07 [0,98; 1,17], соответственно, т.е. все пациенты имели висцеральный тип ожирения. Нарушения углеводного обмена (СД 2 типа, нарушение толерантности к глюкозе, нарушение гликемии натощак), диагностированные согласно отечественным клиническим рекомендациям [10], были выявлены у 31 (44,9%) пациента.
| Показатели | Ожирение II степени (n=23) | Ожирение III степени (n=24) | Сверхожирение (n=22) |
|---|---|---|---|
| Возраст, годы | 42 [32;50] | 39[29;47] | 47[39:52] |
| Мужчины, n (%) | 5 (21,7) | 12 (50,0) | 9 (40,9) |
| ИМТ, кг/м2 | 37,5 [36,3;38,5] | 46,2[ 43,5;46,9] | 56,2 [52,8;62,4] |
| ОТ, см | 114 [106;121] | 135 [125;140] | 150 [137;160] |
| ОТ/ОБ | 0,98 [0,92;1,08] | 1,10 [1,00;1,18] | 1,14 [1,04;1,18] |
| Артериальная гипертония, n (%) | 12 (52,2) | 14 (58,3) | 20 (90,9) |
| Нарушение углеводного обмена, n (%) | 4 (17,4) | 15 (62,5) | 12 (54,5) |
| Глюкоза, ммоль/л | 5,34 [4,86;5,81] | 6,30 [5,30;7,30] | 6,26 [5,83;7,27] |
| Общий холестерин, ммоль/л | 6,22 [4,92;7,17] | 5,09 [4,45;6,03] | 4,24 [3,73;5,07] |
| ЛНП, ммоль/л | 3,89 [3,06;4,55] | 3,00 [2,00;3,50] | 2,69 [2,28;3,65] |
| ЛВП, ммоль/л | 1,37 [1,07;1,61] | 1,12 [0,97;1,33] | 1,01 [0,74;1,12] |
| Креатинин, мкмоль/л | 71,9 [62,6;81,2] | 68,5 [60,5;86,8] | 79,2 [67,2;92,0] |
| СКФ, мл/мин/1,73 м2 | 98,9 [76,4;114,6] | 104,9 [90,8;112,5] | 80,8 [67,8;107,3] |
Контрольную группу составили 11 здоровых добровольцев с нормальной массой тела (ИМТ 21,1 кг/м2 [20,1; 22,5]), в том числе 4 мужчины и 7 женщин в возрасте от 24 до 59 лет (медиана 31 год [27; 44]).
Сывороточные концентрации резистина в общей группе больных ожирением и в подгруппах больных с разной степенью ожирения не отличались от соответствующего параметра у здоровых людей (табл. 2).
| Группы | n | Резистин, нг/мл |
|---|---|---|
| Примечание: различия между группами недостоверные | ||
| Все больные с ожирением | 69 | 5,04 [3,99;8,40] |
| Ожирение II cтепени | 23 | 5,04 [3,99;8,19] |
| Ожирение III степени | 24 | 5,67 [3,73;8,19] |
| Сверхожирение | 22 | 6,20 [4,30;9,66] |
| Контрольная группа | 11 | 7,14 [4,83;9,45] |
В общей группе больных ожирением выявлена слабая прямая связь между уровнем резистина сыворотки и ИМТ (r8=0,233, p=0,054). Эта связь была сильной и высокодостоверной в подгруппе пациентов со сверхожирением (r8=0,629, p=0,002). Статистически значимой взаимосвязи уровня резистина с ОТ и ОТ/ОБ в группе больных в целом и в каждой подгруппе не отмечено.
У пациентов с ожирением и нарушением углеводного обмена достоверных корреляций между показателями глюкозы плазмы
натощак и уровнем резистина не выявлено (r
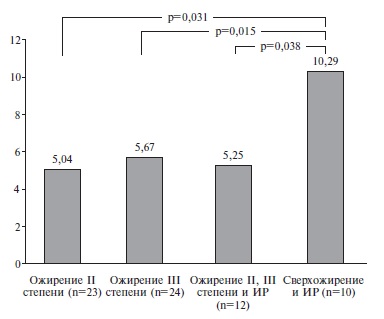
ИР была диагностирована у 22 (91%) из 24 обследованных пациентов с ожирением. У пациентов со сверхожирением и ИР уровень сывороточного резистина был статистически значимо выше, чем у пациентов с ожирением II и III степеней (рис. 1).
| Показатель | Медианы значений/th> | P* |
|---|---|---|
| Примечание: *сила и достоверность взаимосвязи показателей ИР с уровнем резистина | ||
| ИМТ, кг/м2 | 48,9 [39,3;61,7] | r8=0,515, p=0,014 |
| ОТ, см | 138,5 [124,5;150,5] | r8=0,421, p>0,05 |
| Глюкоза, ммоль/л | 6,73 [5,80;7,65] | r8=-0,114, p>0,05 |
| Инсулин, мкЕД/мл | 20,45 [14,73;30,83] | r8=0,090, p>0,05 |
| HOMA-IR | 7,11 [4,16;10,05] | r8=-0,046, p>0,05 |
| HOMA-β | 144,87 [81,32;206,21] | r8=0,129, p>0,05 |
| Резистин, нг/мл | 7,06 [4,36;10,66] | - |
В подгруппе больных с ожирением и ИР выявлена сильная и высокодостоверная связь сывороточного уровня резистина с ИМТ (r8=0,515, p=0,014). Однако достоверная корреляционная связи между сывороточным уровнем резистина и параметрами ИР у больных ожирением и нарушением углеводного обмена отсутствовала (табл. 3), вероятно, по причине длительного приема сахароснижающих препаратов (преимущественно метформина).
Анализ влияния сахароснижающей терапии на содержание в крови резистина показал, что у пациентов, принимавших метформин, который восстанавливает чувствительность к инсулину, медиана уровня резистина была ниже, чем у больных, не получавших этот препарат, однако разница не достигла статистической значимости (4,83 и 4,83 нг/мл, соответственно; p=0,55) (табл. 4).
| Подгруппы пациентов | Резистин, нг/мл |
|---|---|
| Примечание: различия между подгруппами недостоверные | |
| Нарушение углеводного обмена | |
| есть (n=31) | 5,46 [4,20;7,56] |
| нет (n=38) | 5,77 [3,99;8,97] |
| Лечение метформином | |
| да (n=11) | 5,88 [3,99;8,40] |
| нет (n=55) | 4,83 [3,93;8,08] |
Среди других метаболических показателей только у пациентов с ожирением III степени и ИР (n=6) выявлена достоверная корреляционная связь уровня резистина с концентрация ЛНП (r8>=0,9, p=0,037).
У 26 пациентов наблюдалось незначительное или умеренное снижение СКФ (<90 мл/мин/1,73 м2). Пациентов с продвинутой стадией ХБП в исследование не включали. Отрицательная корреляционная связь уровня резистина с СКФ (r8=-0,435, p=0,043) выявлена у пациентов со сверхожирением, у которых уровень резистина был самым высоким. У пациентов со сверхожирением и ИР отмечено некоторое снижение СКФ по сравнению с таковой у пациентов с ожирением III степени (80 [62; 97] и 104 [90; 112] мл/мин/1,73 м2, соответственно) при пограничном уровне достоверности (p=0,05).
У 15 пациентов определялась протеинурия субнефротического уровня. Методом логистического регрессионного анализа было показано, что повышенный уровень резистина ассоциировался с наличием протеинурии (относительный риск 1,214; 95% доверительный интервал 1,014-1,462). Кроме того, у пациентов с ожирением III степени и протеинурией уровень резистина был выше, чем у больных без протеинурии (р=0,006).
Обсуждение
Научный интерес к изучению адипоцитов возрос с начала 1990-х годов, когда было показано, что жировая ткань не только выполняет функции энергетического депо, механической защиты и теплоизоляции, но и представляет собой полноценный эндокринный орган [11]. Был открыт ряд биологически активных молекул, продуцируемых жировыми клетками – адипокинов. Их физиологические эффекты разнообразны и включают в себя контроль объема потребляемой пищи, энергетического баланса и массы тела, репродукции (лептин), гомеостаза глюкозы (адипонектин, резистин, адипонутрин), метаболизма липидов (ретинолсвязывающий протеин, протеин, транспортирующий этерифицированный холестерин), регуляцию ангиогенеза (сосудистый эндотелиальный фактор роста – VEGF), фибринолиза (ингибитор активатора плазминогена-1), а также про- и противовоспалительные эффекты (ФНОα, ИЛ-6, адипонектин) [12].
М. Rayala и соавт. показали, что богатый цистеином протеин резистин секретируется преимущественно преадипоцитами и в меньшей степени зрелыми адипоцитами в основном висцеральной жировой ткани [7]. Абдоминальное, или центральное ожирение (т.е. накопление избытка жировой ткани в висцеральной области) признано индикатором серьезного риска для здоровья, так как оно напрямую коррелирует с ИР, нарушением углеводного и жирового обмена, артериальной гипертонией, протромботической готовностью и провоспалительным состоянием [5]. Перечисленные процессы медиируются рядом адипоцитокинов (ФНО-α, лептин, резистин, адипонектин или висфатин), физиологический баланс которых при ожирении нарушается [13]. Однако значение резистина как предиктора ИР подтверждается не во всех публикациях [14,15], что предполагает, по-видимому, более сложные механизмы его повреждающего действия на ткани.
Недавно М. Jonas и соавт. обнаружили у больных морбидным ожирением экспрессию резистина преимущественно в подкожной жировой, а не висцеральной ткани, где его экспрессия была ниже по сравнению с таковой у лиц с нормальной массой тела [16]. М. De gawa-Yamauchi и соавт. в 2003 г. сообщили о значимом, по сравнению с группой контроля, повышении уровня резистина в сыворотке больных с ожирением, готовящихся к бариатрическим операциям. Однако достоверной связи между содержанием резистина и показателями ИР авторы не выявили [17]. S. Bo и соавт. также показали достоверные различия уровней резистина у пациентов с ожирением и здоровых людей, однако значимую связь резистина с гликемией натощак и другими метаболическими показателями им удалось выявить только у здоровых лиц [18]. Другие авторы также не выявили корреляции уровня резистина ни с ИМТ у больных с избыточной массой тела [19,20], ни с наличием СД 2 типа [21].
В нашем исследовании сывороточные концентрации резистина в общей группе больных ожирением и в подгруппах больных с разной степенью ожирения не отличались от соответствующего параметра у здоровых людей. Вместе с тем при сравнительном анализе содержания резистина у пациентов с различной степенью ожирения выявлена тенденция к повышению уровня этого адипокина по мере увеличения массы тела. Сильная и высокодостоверная взаимосвязь между увеличением сывороточного резистина и ИМТ определялась у пациентов со сверхожирением и больных ожирением, сочетавшимся с ИР. Как и другие авторы, мы не выявили связи содержания резистина с уровнем глюкозы плазмы натощак, а также с показателями ИР у обследованных нами пациентов с ожирением, возможно, по причине того, что большинство из них уже длительно получали сахароснижающие препараты, в том числе восстанавливающие ИР. Среди других показателей метаболического контроля у пациентов с высокой степенью ожирения наблюдалась положительная корреляционная связь между содержанием резистина и проатерогенных липидов.
Значимое увеличение сывороточного уровня резистина у больных со сверхожирением и ИР по сравнению с таковым у пациентов с менее выраженным ожирением можно объяснить большим количеством адипоцитов, продуцирующих резистин в избыточно развитой висцеральной жировой ткани. Большинство таких пациентов имели неудовлетворительный контроль гликемии, артериальную гипертонию высоких степеней и другие традиционные факторы риска ХБП, которые наряду с широко обсуждаемым в литературе повреждающим действием самих адипокинов могут вызывать дисфункцию почек.
В некоторых зарубежных работах показана связь снижения СКФ с повышенным уровнем резистина [22]. Этот факт объясняли инфильтрацией почечной ткани макрофагами, которые в большей степени, чем адипоциты, секретируют резистин. Активация макрофагов сопровождается усилением провоспалительного ответа, эндотелиальной дисфункцией. Прямое повреждающее влияние резистина на структуры почки в настоящее время не подтверждено.
Данные С.А. Бутровой и соавт. о взаимосвязи ИМТ с уровнем резистина согласуются с нашими результатами. Теми же авторами показана положительная корреляционная взаимосвязь между уровнями гликемии натощак и содержанием резистина у больных с ожирением (r=0,51, р=0,051) [23].
В опубликованном ранее исследовании сравнивались сывороточные концентраций резистина, ИЛ-6 и ФНОα у женщин с ожирением и здоровых женщин. Значимой разницы уровней резистина между двумя группами выявлено не было. Концентрации резистина в сыворотке не коррелировали с ИМТ и маркерами ИР, однако отмечена корреляция уровня резистина с массой жировой ткани и ИЛ-6 в группе пациентов с нарушенной толерантностью к глюкозе [24]. В этой и ряде других работ обсуждалась связь уровня резистина с воспалением [25].
Заключение
Механизмы нарушения обмена веществ при ожирении достаточно сложны и до настоящего времени остаются не до конца изученными. В нашем исследовании продемонстрирована прямая корреляционная связь между ИМТ и уровнем резистина в группе больных со сверхожирением. У пациентов со сверхожирением и ИР уровень сывороточного резистина был достоверно выше, чем у пациентов с менее высоким ИМТ. Снижение СКФ у больных со сверхожирением ассоциировано с ростом в сыворотке крови содержания резистина, но напрямую оно не коррелирует с показателями ИР, что, по-видимому, отражает более сложные механизмы участия резистина в развитии дисфункции почек при ожирении. Эти механизмы нуждаются в дальнейшем изучении. Представляют интерес проспективные исследования с целью оценки динамики содержания резистина на фоне стойкого максимального снижения массы тела после бариатрических операций.
Используемые источники
- Центр хирургического лечения ожирения и метаболических нарушений ПСПбГМУ им. акад. И.П. Павлова, 2018, http://bariatric.1spbgmu.ru. World Health Organization, 16 Feb 2018. https://www.who.int/news-room/facsheets/detail/obesity-and-overweight
- Шестакова М.В., Дедов И.И. Сахарный диабет и хроническая болезнь почек, 2009. [Shestakova MV, Dedov II. Diabetes mellitus and chronic kidney disease, 2009 (In Russ.)].
- Европейское общество кардиологов (ESC), Европейская ассоциация по изучению диабета (EASD). Рекомендации по диабету, предиабету и сердено-сосудистым заболеваниям. Российский кардиологический журнал 2014;3:7-61. [European Society of Cardiology, European Association for the Study of Diabetes. Guidelines for diabetes, prediabetes and cardiovascular disease. Rossijskij kardiologicheskij zhurnal 2014;3:7-61 (In Russ.)].
- Дедов И.И., Мельниченко Г.А., Бутрова С.А. Жировая ткань как эндокриный орган. Ожирение и метаболизм 2006;1:6-13. [Dedov II, Melnichenko GA, Butrova SA. Adipose tissue as an endocrine organ. Ozhirenie i metabolizm 2006;1:6-13 (In Russ.)].
- Steppan CM, Bailey ST, Bhat S et al. The hormone resistin links obesity to dibetes. Nature 2001;409(1):307–12.
- Rajala M, Qi Y, Patel Н. et al. Regulation of resistin expression and circulating levels in obesity, diabetes, and fasting. Diabetes 2004;53(7):1671-9.
- Майоров А.Ю. Инсулинорезистентность в патогенезе сахарного диабета 2 типа. Сахарный диабет 2011;1:35-43. [Mayorov AY. Insulin resistance in the pathogenesis of type 2 diabetes mellitus. Saharnyj diabet = Diabetes mellitus 2011;1:35-43 (In Russ.)].
- Шляхто Е.В., Недогода С.В., Конради А.О. и др. Концепция новых нацинальных клинических рекомендаций по ожирению. Российский кардиолгический журнал 2016;4:7-13. [Shlyakhto EV, Nedogoda SV, Konradi AO, et al. Concept for new national clinical guidelines for obesity. Rossijskij kardiologichskij zhurnal 2016;4:7-13 (In Russ.)].
- Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированой медицинской помощи больным сахарным диабетом. Клинические рекомендации 2019; 9. [Dedov II, Shestakova MV, Mayorov AY. Standards of specialized diabetes care, 2019; 9 (In Russ.)].
- Mohamed-Ali V, Pinkney JH, Coppack SW. Adipose tissue as endocrine and paracrine organ. Int J Obes Relat Metab Disord 1998;22(12):1145-58.
- Пальцев М.А, Кветной И.М, Ильницкий А.Н. и др. Ожирение: молекуляные механизмы и оптимизация таргетной терапии. Молекулярная медицна 2013;2:3-12. [Paltsev MA, Kvetnoy IM, Ilnitsky AN, et al. Obesity: molecular mechanisms and optimization of targeted therapy. Molekulyarnaya medicina 2013;2:3-12 (In Russ.)].
- Paquot N, Tappy L. Adipocytokines: link between obesity, type 2 diabetes and atherosclerosis. Rev Med Liege 2005;60(5-6):369-73.
- Monzillo LU, Hamdy O, Horton ES, et al. Effect of lifestyle modification on adpokine levels in obese subjects with insulin resistance. Obesity Res 2003;11:1048- 54.
- Nagaev I, Smith U. Insulin resistance and type 2 diabetes are not related to resstin expression in human fat cells or skeletal muscle. Biochem Biophys Res Comm 2001;285:561-4.
- Jonas MI, Kurylowicz A, Bartoszewicz Z, et al. Adiponectin/resistin interplay in serum and in adipose tissue of obese and normal-weight individuals. Diabetol Metab Syndrome 2017;9(95):1-9.
- Degawa-Yamauchi M, Bovenkerk JE, Juliar BE et al. Serum resistin (FIZZ3) protein is increased in obese humans. J Clin Endocrinol Metab 2003;88(11): 5452–55.
- Bo S, Gambino R, Pagani A, et al. Relationships between human serum resistin, inflammatory markers and insulin resistance. Intern J Obes 2005;29:1315-20.
- Stepie M, Rosniak-Bak K, Paradowski M, et al. Waist circumference, ghrelin and selected adipose tissue-derived adipokines as predictors of insulin resistance in obese patients: Preliminary results. Med Sci Monit 2011;17(11):13-18.
- Sinorita H, Asdie RH, Pramono RB, et al. Leptin, adiponectin and resistin cocentration in obesity class I and II at Sardjito Hospital Yogyakarta. Intern Med 2010;42(2):74-7.
- Kocot J, Dziemidok P, Kie czykowska M, et al. Adipokine profile in patients with type 2 diabetes depends on degree of obesity. Med Science Monitor 2017;23:4995-4.
- Briffa JF, McAinch AJ, Poronnik P, et al. Adipokines as a link between obesity and chronic kidney disease. Am J Physiol Renal Physiol 2013;305:1629–36.
- Бутрова С.А., Ершова Е.В., Ильин А.В. Адипоцитокины: резистин и фактор некроза опухолеу мужчин с абдоминальным ожирением. Ожирение и метаболизм 2007;4:30-3. [Butrova SA, Ershova EV, Ilyin AV. Adipocytokines: resistin and tumor necrosis factor-α in men with abdominal obesity. Ozhirenie i metabolizm 2007;4:30-3 (In Russ.)].
- Janowska J, Zahorska-Markiewicz B, Olszanecka-Glinianowicz M, et al. Relationship between serum resistin concentration and proinflammatory cytokines in obese women with impaired and normal glucose tolerance. Metabolism 2006;55(11):1495-9.
- Mostafazadeh M, Haiaty S, Rastqar A, et al. Correlation between resistin level and metabolic syndrome component: A review. Horm Metab Res 2018;50: 521–36.
