Сарилумаб – новый блокатор рецепторов к интерлейкину-6: фармакологические свойства, клиническая эффективность и безопасность у больных ревматоидным артритом
Сарилумаб – это новый блокатор рецепторов к интерлейкину-6, который применяется в комбинации с метотрексатом или в виде монотерапии для лечения активного ревматоидного артрита (РА). В двойном слепом, рандомизированном исследовании MOBILITY лечение сарилумабом в сочетании с метотрексатом по сравнению с плацебо привело к уменьшению симптомов, улучшению физической функции и замедлению прогрессирования структурных изменений суставов у больных РА, не отвечавших на метотрексат. В исследовании TARGET эффективность сарилумаба в комбинации с метотрексатом была подтверждена у пациентов с РА, у которых были отменены ингибиторы фактора некроза опухоли α в связи с недостаточной эффективностью или плохой переносимостью. В исследовании MONARCH монотерапия сарилумабом по эффективности превосходила лечение адалимумабом у пациентов с РА, у которых не представлялось возможным применение метотрексата. Профиль безопасности сарилумаба соответствовал ожидаемому профилю безопасности ингибитора интерлейкина-6.
Современная стратегия лечения среднетяжелого и тяжелого ревматоидного артрита (РА) у больных, не отвечающих на метотрексат и другие базисные противовоспалительные препараты (БПВП), предполагает применение генно-инженерных биологических препаратов (ГИБП), прежде всего ингибиторов фактора некроза опухоли-α [1]. Однако в течение года примерно каждый пятый больной прекращает лечение этими препаратами из-за плохой переносимости или неэффективности, а через 3 года доля таких пациентов достигает 50% [2]. В связи с этим на протяжении последних двух десятилетий продолжается разработка новых ГИБП, в частности блокаторов эффектов интерлейкина (ИЛ)-6, гиперпродукция которого играет важную роль в патогенезе РА и многих других иммуновоспалительных заболеваний [3]. ИЛ-6 – это плеотропный провоспалительный цитокин, который вызывает секрецию белков острой фазы гепатоцитами, образование иммуноглобулинов, миграцию и активацию Т- и В-клеток, моноцитов и остеокластов и дает другие эффекты, поддерживающие воспаление и усиливающие деструкцию суставов [4].
Сарилумаб представляет собой человеческое IgG1 моноклональное антитело, которое взаимодействует с растворимыми и мембранными рецепторами ИЛ-6 и блокирует сигнальные системы цитокина [5]. В настоящее время сарилумаб зарегистрирован во многих странах, включая Российскую Федерацию, под торговым наименованием Кевзара® для лечения РА умеренной или высокой степени активности у взрослых пациентов при недостаточной эффективности или непереносимости одного или нескольких БПВП. Выпускается в виде раствора для подкожного введения и применяется в дозе 200 мг каждые 2 недели, которая может быть снижена до 150 мг каждые 2 недели в случае развития нежелательных эффектов. Сарилумаб можно назначать в виде как комбинированной терапии с метотрексатом, так и монотерапии в случае плохой переносимости последнего.
Комбинированная терапия. Эффективность комбинированной терапии сарилумабом и метотрексатом была установлена в многоцентровом, рандомизированном, двойном слепом, плацебо-контролируемом исследовании MOBILITY (часть В), в которое были включены 1197 больных активным РА (счет опухших и болезненных суставов ≥6 и ≥8, соответственно, наличие по крайней мере одной эрозии на рентгенограммах, концентрация С-реактивного белка [СРБ]≥6 мг/л), не отвечавших на метотрексат в стабильной дозе (10-25 мг/нед) в течение по крайней мере 12 недель [6]. Пациенты были рандомизированы на три группы и получали сарилумаб в дозах 150 или 200 мг подкожно каждые 2 недели или плацебо в сочетании с метотрексатом в течение 52 недель. Эффективность лечения оценивали на основании анализа трех первичных конечных точек, включавших частоту ответа по критериям Американской коллегии ревматологов (АКР20) через 24 недели, изменение индекса нетрудоспособности HAQDI через 16 недель и модифицированного счета Шарпа, отражающего выраженность рентгенологических изменений, через 52 недели.
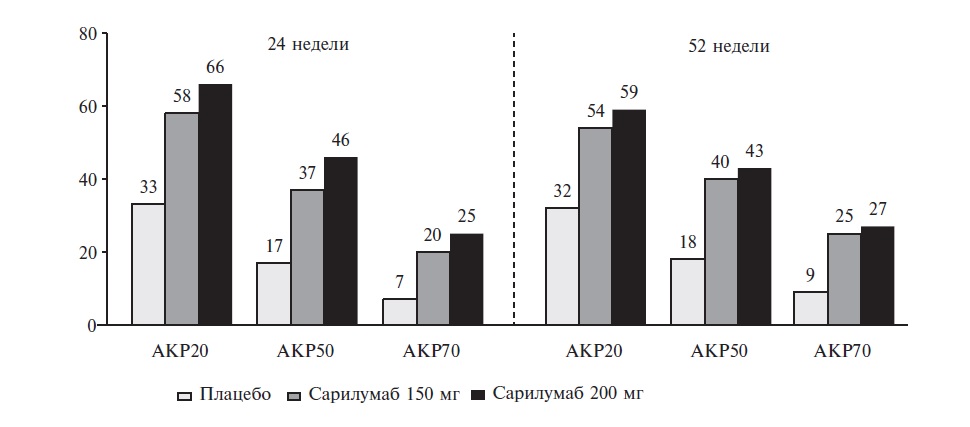
По всем первичным и вторичным показателям эффективности сарилумаб в обеих дозах достоверно превосходил плацебо и вызывал уменьшение симптомов РА, улучшал физическую функцию и задерживал прогрессирование структурных изменений суставов. Эффект препарата проявлялся уже через 2 недели после начала лечения и сохранялся через 52 недели. Например, частота ответа по критериям АКР20 через 24 недели в группах сарилумаба 150 и 200 мг составила 58% и 66%, соответственно, через 52 недели – 54% и 59%, в то время как в группе плацебо в те же сроки на лечение ответили 33% и 32% больных, соответственно (p<0,0001). Частота более выраженного улучшения (АКР50 и АКР70) при лечении сарилумабом также достоверно превышала таковую в группе плацебо (p<0,0001; рис. 1). Ремиссия по критерию DAS28-СРБ (<2,6) через 24 недели была достигнута примерно у трети больных, получавших сарилумаб (27,8-34,1% против 10,1% в группе плацебо; p<0,0001). Около 20% больных, включенных в исследование MOBILITY, имели опыт применения ГИБП в анамнезе. Эффектив ность сарилумаба была сопоставимой у пациентов, получавших и не получавших ГИБП до начала исследования.
Лечение сарилумабом в дозах 150 и 200 мг по сравнению с плацебо привело к значительному (p<0,0001) улучшению физической функции: через 24 недели счет HAQ-DI в трех группах снизился в среднем на 0,53, 0,55 и 0,29, соответственно. Достигнутый эффект сохранялся через 52 недели. Доля пациентов, ответивших на лечение по этому критерию (снижение счета HAQ-DI по крайней мере на 0,3) в группах сарилумаба была достоверно выше, чем в группе плацебо, как через 24 недели (51,0, 57,4 и 33,4%, соответственно), так и 52 недели (47,0, 47,6 и 26,1%).
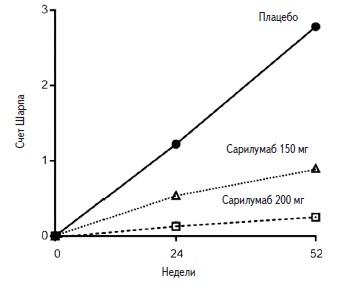
Сарилумаб в дозах 150 и 200 мг замедял увеличение модифицированного счета Шарпа (рис. 2), которое отражает прогрессирование рентгенологических изменений в суставах. Причем через 52 недели в группах сарилумаба было выявлено достоверное снижение как счета эрозий, так и счета сужения суставной щели по сравнению с плацебо.
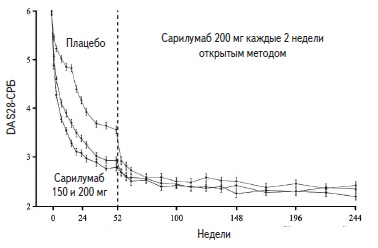
После завершения исследования MOBILITY около 900 пациентов продолжили лечение сарилумабом в дозе 200 мг подкожно каждые 2 недели и метотрексатом открытым методом (исследование EXTEND). Недавно были опубликованы результаты 5-летнего наблюдения этих пациентов, которые показали, что эффект препарата сохраняется при длительном лечении [7]. Например, средний счет DAS28-СРБ в трех пер во начально выделенных группах пациентов был сопо ставимым через 5 лет, причем у больных, рандомизированных в группу сарилумаба 200 мг в двойном слепом исследовании, он снизился на 62% (рис. 3). В выборке ITT частота ремиссии, которую оценивали на основании счета DAS28-СРБ, к концу 5-летнего наблюдения (31-37%) соответствовала таковой в группах сарилумаба в конце исследования MOBILITY. Сходные результаты были получены и при анализе динамики счета CDAI и HAQ. После перевода пациентов с плацебо на сарилумаб было отмечено замедление нарастания счета Шарпа. Тем не менее, через 5 лет показатель прогрессирования структурных изменений суставов в наименьшей степени увеличился в группе больных, которые первоначально получали сарилумаб в дозе 200 мг, а частота отсутствия прогрессирования рентгенологических изменений в группах сарилумаба 150 и 200 мг и плацебо к концу 5-летнего наблюдения составила 42,2, 47,1 и 37,2%, соответственно.
Эффективность сарилумаба в комбинации с метотрексатом у пациентов с РА, прекративших лечение ингибиторами ФНО-α из-за утраты ответа или нежелательных явлений, изучалась в рандомизированном, двойном слепом, плацебо-контролируемом исследовании TARGET [8]. В него были включены 546 больных активным РА, которых рандомизировали на группы сарилумаба 150 и 200 мг и плацебо.
По эффективности, которую оценивали на основании частоты ответа по критериям АКР20 через 24 недели и динамики счета HAQ, сарилумаб в обеих дозах достоверно превосходил плацебо. Частота ответа по АКР20 соответствовала таковой в исследовании MOBILITY и составила 55,8% и 60,9% в группах сарилумаба 150 и 200 мг, соответственно, и 33,7% в группе плацебо (p<0,0001). Частота более выраженного ответа (АКР50 и АКР70) в группах сарилумаба также достоверно превышала таковую в группе плацебо. Ремиссии РА по критерию DAS28-СРБ через 24 недели удалось достичь у 24,9-28,8% больных групп сарилумаба и только у 7,2% пациентов, получавших плацебо. Пре имущества сарилумаба перед плацебо были подтверждены и при анализе динамики счета опухших и болезненных суставов, интенсивности боли в суставах по визуальной аналоговой шкале (ВАШ), общего мнения врачей и пациентов об активности заболевания, концентрации СРБ. Лечение сарилумабом по сравнению с плацебо вызывало также значительное улучшение физической функции (снижение счета HAQ-DI в группах сарилумаба 150 и 200 мг и плацебо составило 0,46, 0,47 и 0,26, соответственно; р<0,001 в обоих случаях).
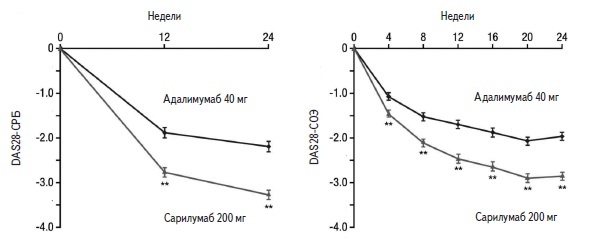
Монотерапия. Хотя ГИБП пациентам с активным РА рекомендуют назначать в комбинации с метотрексатом, тем не менее, на практике многие пациенты получают монотерапию ГИБП, что может быть связано с плохой переносимостью метотрексата, наличием противопоказаний к его назначению или предпочтениями врачей и пациентов [9,10]. Целью двойного слепого, рандомизированного, контролируемого исследования MONARCH было сравнение эффективности и безопасности монотерапии сарилумабом 200 мг каждые 2 недели или адалимумабом 40 мг каждые 2 недели у 369 больных активным РА, у которых по мнению исследователей было нецелесообразным продолжение приема метотрексата в связи с побочными эффектами или недостаточной эффективностью [11]. Первичным показателем эффективности было снижение счета DAS28-СОЭ через 24 недели. Лечение сарилумабом привело к более значительному снижению этого показателя по сравнению с адалимумабом, причем достоверная разница между группами была достигнута через 12 недель и сохранялась через 24 недели (p<0,0001). Вероятность достижения ремиссии по критерию DAS28-СОЭ при применении сарилумаба по сравнению с адалимумабом была примерно в 3 раза выше через 12 недель (отношение шансов 2,61, 95% доверительный интервал [ДИ] 1,31-5,20; р=0,0051) и в 5 раз выше через 24 недели (4,88, 95% ДИ 2,54-9,39; p<0,0001). Сходные результаты были получены при анализе динамики счета DAS28СРБ. Уже через 4 недели после начала лечения средний счет DAS28-СРБ в группе сарилумаба снизился в большей степени, чем в группе адалимумаба (р=0,0005), а при продолжении терапии ГИБП разница между двумя группами продолжала увеличиваться (рис. 4).
Сарилумаб превосходил также адалимумаб по влиянию на счет CDAI. Величина этого показателя клинического ответа не зависит от концентрации белков острой фазы, динамика которых может быть более выраженной при применении ингибиторов ИЛ-6. У пациентов, получавших сарилумаб, средний счет CDAI через 12 и 24 недели был достоверно ниже, чем у больных группы адалимумаба. Кроме того, через 24 недели в группе сарилумаба доля пациентов, достигших ремиссии или низкой активности РА по критерию CDAI (7,1% и 41,8%, соответственно), была значительно выше, чем в группе адалимумаба (2,7% и 24,9%). В обоих случаях разница была статистически значимой (р=0,0468 и р=0,0005, соответственно).
Через 24 недели в группе сарилумаба было отмечено значительное увеличение частоты ответа по критериям АКР20, АКР50 и АКР70 по сравнению с группой адалимумаба. Разница между группами была достигнута через 8 недель и во всех случаях превышала 10%. Лечение сарилумабом привело также к более выраженному снижению числа опухших и болезненных суставов и улучшению физической функции и показателей качества жизни.
Безопасность
Хотя частота нежелательных явлений при лечении сарилумабом в комбинации с метотрексатом превышала таковую при введении плацебо, тем не менее, переносимость ингибитора ИЛ-6 была в целом хорошей. Например, в двойных слепых, плацебо-контролируемых исследованиях частота серьезных нежелательных явлений у больных, получавших сарилумаб в дозах 150 мг и 200 мг, составила 6,4% и 8,9%, соответственно, а у пациентов группы плацебо – 4,7% [12]. Из-за нежелательных явлений лечение было прекращено у 10,9, 12,6 и 4,7% больных трех групп, соответственно. Наиболее частыми нежелательными эффектами при применении сарилумаба в двух дозах были нейтропения (9,8 и 12,4 против 0,5% в группе плацебо), инфекции верхних дыхательных путей (6,4 и 7,1 против 4,8%), повышение активности АЛТ (6,7 и 6,8 против 2,6%) и эритема в месте введения (5,3 и 5,3 против 0,9%) [12]. При монотерапии сарилумабом чаще всего встречались нейтропения (15,6%), назофарингит (6,0%) и эритема в месте инъекций (6,2%).
Инфекции являются одним из основных нежелательных эффектов любых ГИБП, включая ингибиторы ИЛ-6. Сопутствующая терапия БПВП и/или глюкокортикостероидами может способствовать увеличению риска инфекционных осложнений. В клинических исследованиях частота серьезных инфекций при применении сарилумаба в дозах 150 и 200 мг была сопоставимой с таковой при введении плацебо (3,0, 4,3 и 3,1 на 100 пациенто-лет, соответственно) [13]. Среди серьезных инфекций чаще всего встречались пневмония и целлюлит. В редких случаях отмечалось развитие оппортунистических инфекций, прежде всего опоясывающего герпеса.
Сарилумаб может вызвать снижение числа нейтрофилов и тромбоцитов в крови. В клинических исследованиях в первые 12 недель после начала лечения частота снижения числа нейтрофилов <1 ×109/л при применении сарилумаба в дозах 150 и 200 мг достигала 3,6% и 6,4%, соответственно (против 0% в группе плацебо). Более выраженная нейтропения (<0,5 ×109/л) встречалась значительно реже – у 0,6 и 0,8% пациентов, соответственно [12]. Сниженное число нейтрофилов не сопровождалось увеличением риска развития инфекций и увеличивалось после снижения дозы препарата или перерыва в лечении. Частота тромбоцитопении (<100 × 109/л) при применении сарилумаба в дозах 150 и 200 мг была низкой (0,6 и 1,2%, соответственно). Кроме того, лечение сарилумабом может осложниться увеличением активности аминотрансфераз, которая обычно нормализуется после снижения дозы или временной отмены препарата. В исследовании EXTEND, в которое включали пациентов, завершивших участие в исследовании MOBILITY, снижение дозы сарилумаба с 200 до 150 мг каждые 2 недели было отмечено у 20% из 899 пациентов, продолжавших лечение ингибитором ИЛ-6
Как и при применении другого ингибитора ИЛ-6 – тоцилизумаба, при лечении сарилумабом описаны редкие случаи перфорации желудочно-кишечного тракта, которые в основном были осложнением дивертикулита и чаще наблюдались на фоне сопутствующей терапии нестероидными противовоспалительными препаратами, глюкокортикостероидами или метотрексатом [12].
R. Fleischmann и соавт. недавно обобщили многолетний опыт изучения безопасности сарилумаба у 2887 пациентов, получавших комбинированную терапию, и 471 пациентов, которым проводилась монотерапия этим препаратом [14]. Средняя длительность лечения составила 2,8 и 1,7 года, соответственно, а максимальная – 7,3 и 3,5 года. Самыми частыми нежелательными явлениями при комбинированной терапии были нейтропения, эритема в месте введения и инфекции верхних отделов дыхательных путей, а при монотерапии – нейтропения, эритема в месте введения и назофарингит. Частота серьезных нежелательных явлений при лечении сарилумабом в сочетании с метотрексатом или в виде монотерапии (на 100 пациенто-лет) составила 9,4 и 6,7, соответственно, серьезных инфекций – 3,7 и 1,0, опоясывающего герпеса – 0,6 и 0,5, перфорации желудочно-кишечного тракта – 0,1 и 0, сердечно-сосудистых событий – 0,5 и 0,2, злокачественных опухолей – 0,7 и 0,6. Следует отметить, что частота сердечно-сосудистых исходов и злокачественных опухолей при применении сарилумаба не отличалась от таковой в общей популяции пациентов с РА, а частота серьезных инфекций была несколько ниже, чем при применении тоцилизумаба в сходном анализе [15].
Снижение числа нейтрофилов <1 ×109/л, которое является основанием для перерыва в лечении/снижения дозы сарилумаба, наблюдалось у 13% и 15% больных, получавших комбинированную и монотерапию, соответственно [14]. Частота нейтропении была самой высокой в течение первых 6 мес после начала лечения, а затем снижалась. Нормализация числа нейтрофилов при продолжении комбинированной или монотерапии сарилумабом была отмечена у 70% и 80% пациентов, соответственно. Нейтропения при лечении сарилумабом не сопровождалась развитием серьезных инфекций. Возможно, это связано с тем, что ингибирование ИЛ-6 вызывает миграцию нейтрофилов во внесосудистые депо без ухудшения их функции [16]. В исследованиях in vitro и in vivo блокада ИЛ-6 не оказывала влияния на апоптоз нейтрофильных лейкоцитов, экспрессию молекул адгезии или хемотаксис [17].
Частота увеличения активности АЛТ более чем в 3 раза по сравнению с верхней границей нормы составила 10% и 6% у пациентов, получавших комбинированную и монотерапию сарилумабом, соответственно. Как и частота нейтропении, она была выше в первые 6 мес после начала лечения, а затем снижалась. У большинства больных активность АЛТ нормализовалась при продолжении терапии сарилумабом в сниженной дозе.
В целом исследователи пришли к выводу о том, что профиль безопасности сарилумаба при длительном лечении (до 7 лет) оставался стабильным и соответствовал ожидаемому профилю безопасности ингибитора ИЛ-6 [14].
В исследовании ASCERTAIN были сопоставлены безопасность и переносимость сарилумаба в дозах 150 мг (n=49) и 200 мг (n=51) каждые 2 недели и тоцилизумаба в дозе 4 мг/кг каждые 4 недели, которую при необходимости увеличивали до 8 мг (n=102), у пациентов с РА [18]. Частота нежелательных явлений была сопоставимой в группах сарилумаба и тоцилизумаба. При применении сарилумаба чаще всего встречались нейтропения (12,2-15,7%), назофарингит (5,9-12,2%) и эритема в месте введения (7,8-8,2%), тоцилизумаба – непреднамеренная передозировка (8,8%), инфекции верхних дыхательных путей (6,9%) и тошнота (6,9%). Следует отметить, что средние изменения числа нейтрофилов через 24 недели были сопоставимыми у пациентов, получавших сарилумаб в дозе 200 мг каждые 2 недели, и больных, у которых доза тоцилизумаба была увеличена до 8 мг/кг. По мнению авторов, профиль безопасности двух препаратов существенно не отличался.
Заключение
В двойных слепых, плацебо-контролируемых исследованиях комбинированная терапия сарилумабом и метотрексатом вызывала значительное уменьшение симптомов, улучшала физическую функцию и замедляла прогрессирование структурных изменений суставов у больных активным РА, не отвечавших на метотрексат в адекватной дозе, а также у пациентов, у которых пришлось прекратить терапию ингибиторами ФНО-α в связи с недостаточной эффективностью или плохой переносимостью. Действие сарилумаба проявлялось в течение первых 2 недель, а клинический эффект препарата сохранялся при длительном лечении.
Сарилумаб у пациентов с активным РА может быть использован в виде монотерапии, если применение метотрексата по тем или иным причинам невозможно. В исследовании MONARCH вероятность достижения ремиссии РА при монотерапии сарилумабом была в несколько раз выше, чем при лечении адалимумабом. Это подтверждает тот факт, что при необходимости монотерапии ингибиторы ИЛ-6 могут иметь преимущества по эффективности перед другими ГИБП [1].
В клинических исследованиях профиль безопасности сарилумаба был в целом благоприятным, в частности частота серьезных инфекций оказалась низкой. Лечение сарилумабом, особенно в первые 6 мес, может привести к снижению числа нейтрофилов в крови или повышению активности аминотрансфераз, однако эти лабора торные показатели обычно нормализуются после перерыва в лечении и возобновления терапии сарилумабом в более низкой дозе (150 мг каждые 2 недели).
Судить о сравнительной эффективности сарилумаба и тоцилизумаба не представляется возможным в связи с отсутствием соответствующих исследований. В исследовании ASCERTAIN два ингибитора ИЛ-6 существенно не отличались по профилю безопасности. Сарилумаб при подкожном введении обладает более длительным периодом полувыведения, что позволяет назначать его один раз в 2 недели.
Используемые источники
- Smolen JS, Landewe R, Bijlsma J, et al. EULAR recommendations for the man- agement of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017;76(6):960–77.
- Marchesoni A, Zaccara E, Gorla R, et al. TNF-α antagonist survival rate in a cohort of rheumatoid arthritis patients observed under conditions of standard clin- ical practice. Ann N Y Acad Sci 2009;1173(1):837–46.
- Насонов ЕЛ, Лила АМ. Ингибиция интерлейкина 6 при иммуновоспали- тельных ревматических заболеваниях: достижения, перспективы и надежды. Научно-практическая ревматология 2017;55(6):590-9 [Nasonov EL, Lila AM. Inhibition of interleukin 6 in immune inflammatory rheumatic diseases: achieve- ments, prospects, and hopes. Nauchno-Prakticheskaya Revmatologiya = Rheu - ma tology Science and Practice 2017;55(6):590-9 (In Russ.)].
- Srirangan S, Choy CH. The role of interleukin 6 in the pathophysiology of rheumatoid arthritis. Ther Adv Musculoskel Dis 2010;2(5):247–56.
- Lamb YN, Deeks ED. Sarilumab: A review in moderate to severe rheumatoid arthritis. Drugs 2018;78(9):929-40.
- Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to methotrexate: Results of a phase III study. Arthritis Rheumatol 2015;67(6):1424-37.
- Genovese MC, van der Heijde D, Lin Y, et al. Long-term safety and efficacy of sarilumab plus methotrexate on disease activity, physical function and radiograph- ic progression: 5 years of sarilumab plus methotrexate treatment. RMD Open 2019;5(2):e000887.
- Fleischmann R, van Adelsberg J, Lin Y, et al. Sarilumab and nonbiologic disease- modifying antirheumatic drugs in patients with active rheumatoid arthritis and inadequate response or intolerance to tumor necrosis factor inhibitors. Arthritis Rheumatol 2017;69(2):277–90.
- Emery P, Sebba A, Huizinga TW. Biologic and oral disease-modifying anti - rheumatic drug monotherapy in rheumatoid arthritis. Ann Rheum Dis 2013;72: 1897–904.
- Detert J, Klaus P. Biologic monotherapy in the treatment of rheumatoid arthritis. Biologics 2015;9:35–43.
- Burmester GR, Lin Y, Patel R, et al. Efficacy and safety of sarilumab monother- apy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double-blind, parallel-group phase III trial. Ann Rheum Dis 2017;76(5):840–7.
- European Medicines Agency. Kevzara: CHMP assessment report. 2017. http://www.ema.europa.eu.
- European Medicines Agency. Kevzara: summary of product characteristics 2017. http://www.ema.europa.eu/.
- Fleischmann R, Genovese MC, Lin Y, et al. Long-term safety of sarilumab in rheumatoid arthritis: an integrated analysis with up to 7 years' follow-up. Rheumatology (Oxford) 2019 Jul 15. pii: kez265. [Epub ahead of print].
- Genovese MC, Rubbert-Roth A, Smolen JS et al. Longterm safety and efficacy of tocilizumab in patients with rheumatoid arthritis: a cumulative analysis of up to 4.6 years of exposure. J Rheumatol 2013;40:768-80.
- Lok LSC, Farahi N, Juss JK et al. Effects of tocilizumab on neutrophil function and kinetics. Eur J Clin Invest 2017;47:736-45.
- Wright HL, Cross AL, Edwards SW, Moots RJ. Effects of IL-6 and IL-6 blockade on neutrophil function in vitro and in vivo. Rheumatology 2014;53:1321-31.
- Emery P, Rondon J, Parrino J, et al. Safety and tolerability of subcutaneous sar- ilumab and intravenous tocilizumab in patients with rheumatoid arthritis. Rheumatology (Oxford) 2019;58(5):849-58.
