Меполизумаб в лечении эозинофильного гранулематоза с полиангиитом
Эозинофильный гранулематоз с полиангиитом (ЭГПА; старое название – синдром ЧергаСтраусс) – это АНЦА-ассоциированный васкулит, характеризующийся сочетанием бронхиальной астмы/риносинусита и эозинофилии крови с поражением периферической нервной системы, почек, кожи, сердца и других органов. У трети больных определяются АНЦА к миелопероксидазе. Лечение ЭГПА начинают с глюкокортикостероидов ± иммуносупрессивных препаратов. При рефрактерном к стандартной терапии или рецидивирующем течении ЭГПА может быть использован генно-инженерный биологический препарат меполизумаб (300 мг подкожно каждые 4 недели), блокирующий взаимодействие интерлейкина (ИЛ)-5 с рецепторами на поверхности эозинофилов. ИЛ-5 – это основной цитокин, регулирующий дифференцировку, рост, активацию, выживаемость и миграцию эозинофилов. Эффективность и безопасность меполизумаба установлены в двойном слепом, плацебо-контролируемом клиническом исследовании у 136 больных ЭГПА. Применение ингибитора ИЛ-5 на фоне стандартной иммуносупрессивной терапии по сравнению с плацебо позволяло чаще достичь ремиссии заболевания, оказывало стероидосберегающее действие и снижало частоту обострений ЭГПА.
Эозинофильный гранулематоз с полиангиитом (ЭГПА) относится к группе системных васкулитов, ассоциированных с антителами к цитоплазме нейтрофилов (АНЦА), и характеризуется сочетанием бронхиальной астмы/риносинусита и эозинофилии крови с поражением периферической нервной системы, почек, кожи, сердца и других органов [1]. ЭГПА был описан в 1951 году J. Churg и L. Strauss, которые наблюдали 13 пациентов с эозинофильной бронхиальной астмой и некротизирующим васкулитом сосудов мелкого калибра в сочетании с периваскулярной эозинофильной инфильтрацией и гранулематозом [2]. Долгое время заболевание именовали синдромом Черга-Страусс, однако на конференции в Чапел-Хилл (2012 г.) было предложено новое название, соответствующее номенклатуре других АНЦА-ассоциированных васкулитов (гранулематоза с полиангиитом и микроскопического полиангиита) и отражающее характер гистологических изменений при ЭГПА [3,4].
Основой лечения ЭГПА являются глюкокортикостероиды, которые для индукции ремиссии назначают в дозе 0,5-1 мг/кг в пересчете на преднизолон (не более 60 мг), в то время как иммунодепрессанты, в частности циклофосфамид, применяют только при наличии неблагоприятных прогностических факторов (поражение сердца или желу дочно-кишечного тракта, тяжелая пери ферическая полиневропатия, альвеолярное кровотечение и/или гломерулонефрит) или отсутствии ответа на монотерапию глюкокортикостероидами [5]. Несмотря на поддерживающую иммуносупрессивную терапию у значительной части больных ЭГПА развиваются рецидивы заболевания. Например, в крупном французском исследовании (n=383) рецидивы васкулита были отмечены у 35,2% и 22,5% АНЦА-пози тивных и АНЦА-негативных больных, соответственно, а 5-летняя безрецидивная выживаемость составила 58,1% и 67,8% [6]. Сходные данные были получены в нашем исследовании у 93 больных ЭГПА: 5-лет няя выживаемость без рецидивов, требовавших усиления иммуносупрессивной те рапии, составила 68,1% и 77,9% у пациентов с АНЦА-позитивным и АНЦА-негативным вариантами заболевания, соответственно [7]. Даже если иммуносупрессивная терапия приводит к стойкой ремиссии системного васкулита, больные обычно не могут отказаться от пероральных глюкокортикостероидов из-за обострений бронхиальной астмы и риносинусита, которые развиваются несмотря на лечение ингаляционными глюкокортикостероидами и бронходилататорами. Например, в нашей когорте только 8% больных смогли полностью прекратить прием пероральных глюкокортикостероидов [7]. Длительная терапия глюкокортикостероидами даже в небольших дозах неизбежно приводит к развитию многочисленных побочных эффектов, в том числе остеопороза, сахарного диабета, артериальной гипертонии, вторичной надпочечниковой недостаточности и др.
Приведенные данные диктуют необходимость разработки новых эффективных и безопасных препаратов для лечения ЭГПА. Меполизумаб – это гуманизированное моноклональное антитело, которое блокирует взаимодействие интерлейкина (ИЛ)-5 с рецепторами на поверхности эозинофилов и вызывает снижение продукции и выживаемости этих клеток. Эффективность и безопасность меполизумаба в дозе 100 мг подкожно каждые 4 недели установлены у пациентов с тяжелой эозинофильной бронхиальной астмой [8], а в 2020 г. препарат (в дозе 300 мг каждые 4 недели) был одобрен для применения у больных ЭГПА на основании результатов двойного слепого, плацебо-контролируемого исследования MIRRA [9], которое обсуждается в данной статье.
Критерии классификации ЭГПА
Практически у всех больных ЭГПА начинается с бронхиальной астмы и/или риносинусита. Особенностью бронхиальной астмы у таких больных являются позднее развитие (после 40 лет), эозинофилия крови и среднетяжелое или тяжелое течение. Спустя несколько лет после начала бронхиальной астмы у пациентов появляются различные системные проявления, которые, как правило, сочетаются с увеличением эозинофилии крови (доля эозинофилов в общем анализе крови может достигать 50-70%) и могут быть связаны с эозинофильной инфильтрацией тканей (эозинофильные инфильтраты в легких, кардиомиопатия, гастроэнтерит) и/или васкулитом (гломерулонефрит, периферическая полиневропатия, кожная пурпура, альвеолярное кровотечение) [1]. Симптомы, позволяющие заподозрить развитие ЭГПА у пациентов с бронхиальной астмой/ риносинуситом, перечислены в табл. 1.
| Показатели | Меполизумаб (n=68) | Плацебо (n=68) |
|---|---|---|
| Возраст, лет | 49±12 | 48±14 |
| Мужчины, n (%) | 26 (38) | 30 (44) |
| АНЦА, n (%) | 7 (10) | 6 (9) |
| Преднизолон, мг/сут (меиана и диапазон) | 12,0 | 11,0 |
| (7,5-40,0) | (7,5-50,0) | |
| Иммуносупрессивная терапия, n (%) | 41 (60) | 31 (46) |
| Клинические проявления ЭГПА, n (%) | ||
| Эозинофильная астма | 68 (100) | 68 (100) |
| Гистологические признаки | 25 (37) | 31 (46) |
| Нейропатия | 32 (47) | 24 (35) |
| Инфильтраты в легких | 50 (74) | 48 (71) |
| Синусит | 64 (94) | 64 (94) |
| Кардиомиопатия | 13 (19) | 7 (10) |
| Гломерулонефрит | 1 (1) | 0 |
| Альвеолярное кровотечение | 3 (4) | 1 (1) |
| Пальпируемая пурпура | 9 (13) | 8 (12) |
| АНЦА в любое время | 13 (19) | 13 (19) |
| Рецидивирующее течение, n (%) | 51 (75) | 49 (72) |
| Рефрактерное течение, n (%) | 34 (50) | 40 (59) |
| Срок после установления диагноза, лет | 5,2±4,4 | 5,9±4,9 |
Характерный признак ЭГПА – наличие АНЦА к миелопероксидазе (МПО), хотя, в отличие от других АНЦА-ассоциированных васкулитов, АНЦА определяются значительно реже – в 30-35% случаев. На основании результатов серологического исследования многие авторы предлагают выделять МПО-АНЦА позитивный и негативный варианты ЭГПА, которые характеризуются преобладанием признаков васкулита (поражение почек, нейропатия, кожный васкулит) или эозинофильного гранулематозного воспаления (ин фильтраты в легких, поражение сердца), соответственно (рис. 1) [6,10]. В некоторых исследованиях наличие МПО-АНЦА ассоциировалось с более высоким риском рецидивов ЭГПА, но более низким риском смерти. Выделение двух вариантов ЭГПА представляется достаточно условным, так как они в значительной степени перекрещиваются между собой. Например, типичные проявления васкулита, такие как гломерулонефрит или периферическая невропатия, могут наблюдаться как при АНЦА-позитивном, так и АНЦА-негативном ЭГПА, т.е. отрицательный результат серологического исследования не позволяет сделать вывод об отсутствии васкулита. С другой стороны, некоторые проявления болезни, например, поражение нервной системы или сердца, могут быть следствием как васкулита, так и эозинофильной инфильтрации тканей [11].
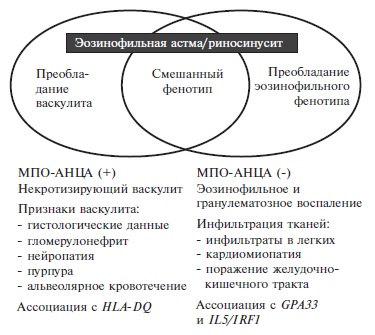
Первые классификационные критерии ЭГПА были предложены J. Lanham и соавт. в 1984 г. и включали в себя бронхиальную астму, эозинофилию крови и признаки васкулита с поражением по крайней мере двух органов [12]. Однако в клинической практике чаще всего используются классификационные критерии Американской коллегии ревматологов, разработанные в 1990 г.: бронхиальная астма, эозинофилия крови более 10%, невропатия, преходящие инфильтраты в легких, поражение синусов и наличие эозинофилов в биоптатах ткани [13]. Наличие по крайней мере 4 из 6 критериев позволяет классифицировать системный васкулит как ЭГПА с чувствительностью 85% и специфичностью 99,7%. Следует отметить, что наличие гистологического подтверждения не считают обязательным для установления диагноза ЭГПА. В то же время важное диагностическое значение имеет определение АНЦА, наличие которых не предусматривается в классификационных критериях Американской коллегии ревматологов. В 2015 г. в рекомендациях рабочей группы по ЭГПА было указано, что у пациентов с эозинофильной астмой наличие МПО-АНЦА с высокой вероятностью указывает на ЭГПА, хотя отсутствие этих антител не исключает данный диагноз [14]. Сходной точки зрения придерживаются и другие авторы, рассматривающие МПО-АНЦА как "суррогатный" маркер васкулита наряду с некоторыми клиническими проявлениями, такими как множественный мононеврит [15].
Для выявления АНЦА могут быть использованы метод непрямой иммунофлюоресценции и иммуноферментный анализ. При применении первого метода выделяют два типа антител – с диффузным цитоплазматическим (цАНЦА) или перинуклеарным (пАНЦА) окрашиванием, в то время как антигенспецифические твердофазные методы дают возможность определить антитела к протеиназе-3 (ПР3) и МПО. В настоящее время именно последние методы рекомендуют использовать для определения АНЦА [16]. Необходимо обратить внимание на то, что, в отличие от гранулематоза с полиангиитом, при ЭГПА практически во всех случаях определяются МПО-АНЦА, а не ПР3-АНЦА.
Таким образом, диагноз ЭГПА следует подозревать у пациентов с бронхиальной астмой/риносинуситом, сочетающимися с высокой эозинофилией крови, при появлении различных системных проявлений, особенно характерных для васкулита, таких как гломерулонефрит, кожная пурпура, периферическая полиневропатия, альвеолярное кровотечение. В таких случаях необходимо определять АНЦА с помощью антигенспецифических методов. Наличие МПО-АНЦА имеет важное значение для подтверждения диагноза ЭГПА, хотя у 2/3 больных они отсутствуют.
Исследование MIRRA
ИЛ-5 – это основной цитокин, регулирующий дифференцировку, рост, активацию, выживаемость и миграцию эозинофилов [17]. Глюкокортикостероиды вызывают апоптоз эозинофилов, что частично объясняет их эффективность при эозинофильной бронхиальной астме и других заболеваниях, ассоциирующихся с эозинофилией крови и тканей [18]. Однако пациенты с тяжелой эозинофильной бронхиальной астмой, гиперэозинофильным синдромом или ЭГПА могут быть рефрактерными к ингаляционным или системным глюкокортикостероидам, что объясняется высокими уровнями ИЛ-5 в бронхах и других тканях [19]. Этиданные обосновывают включение ингибиторов ИЛ-5 в схемы терапии указанных состояний.
В клинических исследованиях у больных тяжелой эозинофильной бронхиальной астмой лечение меполизумабом вызывало снижение числа обострений и улучшение качества жизни и показателей функции внешнего дыхания, а также оказывало стероидосбе регающее действие [20,21]. Профиль безопасности препарата оказался благоприятным. Основными нежелательными явлениями были головная боль и боли в горле, реже встречались реакции в месте инъекции [22]. Положительные результаты применения меполизумаба у пациентов с эозинофильной бронхиальной астмой и роль эозинофилов и ИЛ-5 в патогенезе ЭГПА послужили основанием для изучения эффективности и безопасности препарата при этом заболевании.
Первый случай успешного применения меполизумаба у молодой пацентки с ЭГПА был описан в 2010 г. [23]. В том же году были опубликованы результаты небольшого неконтролируемого исследования, в котором применение меполизумаба позволило достичь ремиссии у 8 из 10 больных ЭГПА, не ответивших на лечение иммуносупрессивными средствами и глюкокортикостероидами в дозе более 12,5 мг/сут [24]. После прекращения введения меполизумаба у 7 пациентов развился рецидив, что указывало на целесообразность поддерживающей терапии препаратом.
В 2017 году были опубликованы результаты регистрационного двойного слепого, плацебо-контролируемого 52-недельного исследования MIRRA, в котором эффективность и безопасность меполизумаба изучались у 136 больных рецидивирующим или рефрактерным ЭГПА, установленным по крайней мере 6 мес назад [9]. ЭГПА диагностировали на основании наличия бронхиальной астмы в сочетании с эозинофилией крови (>10% или >1000 клеток в мм3) и по крайней мере двумя из следующих признаков:- характерные гистологические изменения: эозинофильный васкулит, периваскулярная эозинофильная инфильтрация или гранулематозное воспаление с большим числом эозинофилов;
- нейропатия;
- легочные инфильтраты;
- синусит;
- кардиомиопатия;
- гломерулонефрит;
- альвеолярное кровотечение;
- пальпируемая пурпура;
- АНЦА.
После скрининга пациентов рандомизировали на две группы (1:1) и в течение 52 недель проводили терапию меполизумабом в дозе 300 мг подкожно каждые 4 недели или плацебо. Во время исследования допускалась стандартная терапия глюкокортикостероидами ± иммуносупрессивными препаратами. Доза, выбранная для изучения у больных ЭГПА, превышала зарегистрированную дозу меполизумаба у пациентов с эозинофильной бронхиальной астмой (300 и 100 мг подкожно каждые 4 недели, соответственно), так как ожидалось, что для подавления активности системного васкулита потребуется более высокая доза ингибитора ИЛ-5. Эффективность лечения оценивали на основании анализа двух первичных конечных точек – общей длительности ремиссии в неделях (Бирмингемский индекс активности васкулита [BVAS], равный 0, и доза преднизолона ≤4,0 мг/сут) и доли пациентов, у которых отмечалась ремиссия через 36 и 48 недель. Кроме того, анализировали различные вторичные конечные точки, в частности предполагавшие менее "строгое" опре деление ремиссии (доза преднизолона ≤7,5 мг) в соответствии с рекомендациями Европейской антиревматической лиги (EULAR) [25].
Пациенты, включенные в исследование, были репрезентативными по отношению к общей популяции больных ЭГПА (табл. 2). У всех больных имелась эозинофильная бронхиальная астма, а у большинства – риносинусит. У 41% больных наблюдалась активная полиневропатия, у 15% – кардиомиопатия, у 13% – пальпируемая пурпура, у 19% – определялись АНЦА в любые сроки после начала болезни. В то же время альвеолярное кровотечение и гломерулонефрит отмечались в единичных случаях. Очевидно, что исследователи старались не включать таких пациентов в клиническое исследование, так как они нуждаются в лечении иммуносупрессивными препаратами, такими как циклофосфамид или ритуксимаб.
По обоим первичным показателям эффективности меполизумаб достоверно превосходил плацебо. Доля пациентов, у которых ремиссия ЭГПА во время исследования сохранялась в течение по крайней мере 24 недель, составила 28% и 3% в двух группах, соответственно (отношение шансов 5,91; 95% доверительный интервал [ДИ] 2,68-13,03; p<0,001) (рис. 2), а частота ремиссии в конце лечения (через 36 и 48 недель) – 32% и 3% (отношение шансов 16,75; 95% ДИ 3,61-77,56; p<0,001). Лечение меполизумабом было более эффективным у пациентов с числом эозинофилов ≥150 в мм3. В этой выборке при приеме плацебо ни в одном случае не удалось достичь ремиссии, сохранявшейся ≥24 недель, в то время как в группе меполизумаба доля таких больных составила 33% (отношение шансов 26,10; 95% ДИ 7,02-97,02)
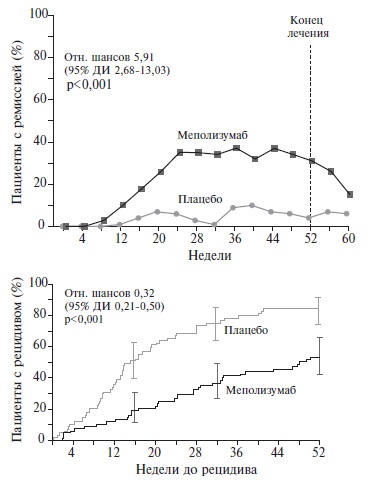
Доля пациентов, у которых развилось обострение ЭГПА в течение 52 недель, в группе меполизумаба была значительно ниже, чем в группе плацебо (56% и 82%, соответственно; отношение шансов 0,32; 95% ДИ 0,210,50; p<0,001). Ежегодная частота обострений также была на 50% ниже в группе меполизумаба (1,14 и 2,27, соответственно; р<0,001). Обострения васкулита в группах меполизумаба и плацебо отмечались у 43% и 65% больных, соответственно, бронхиальной астмы – у 37% и 60%, риносинусита – у 35% и 51%.
Меполизумаб оказывал также стероидосберегающее действие. К концу исследования (недели 48-52) доза преднизолона была снижена по крайней мере до 4,0 мг у 44% и 7% больных групп меполизумаба и плацебо, соответственно, а полностью прекратили прием глюкокортикостероидов 18% и 3% пациентов.
Переносимость меполизумаба была хорошей, в частности из-за нежелательных явлений лечение было прекращено у 3% больных основной группы и 1% больных группы плацебо. Основными нежелательными явлениями в обеих группах были головная боль (32% и 18%, соответственно), назофарингит (18% и 24%), артралгии (22% и 18%), синусит (21% и 16%) и инфекции верхних отделов дыхательных путей (21% и 16%).
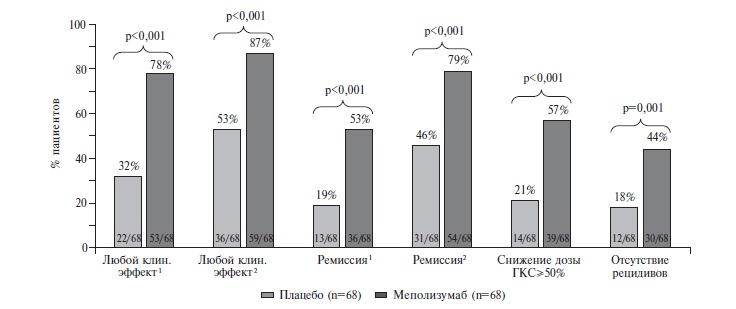
Недавно J. Steinfeld и соавт. провели повторный анализ результатов исследования MIRRA с целью дополнительной оценки эффективности меполизумаба с учетом трех основных целей лечения – достижение ремиссии, снижение дозы глюкокортикостероида и профилактика рецидивов [26]. Терапию меполизумабом считали эффективной, если была достигнута по крайней мере одна из трех клинических конечных точек, выделенных в протоколе исследования: (1) ремиссия в любые сроки исследования (недели 1-52); (2) снижение дозы глюкокортикостероида по крайней мере на 50% в конце исследования (недели 48-52); (3) отсутствие обострений ЭГПА во время исследования (недели 152). Как и в первичной публикации, авторы выделяли два определения ремиссии ЭГПА: первое – BVAS, равный 0, и доза преднизолона ≤4 мг/сут, второе – BVAS, равный 0, и доза преднизолона <7,5 мг/сут. Критериями обострения ЭГПА считали значение BVAS>0 или ухудшение бронхиальной астмы или симптомов риносинусита, требовавшие увеличения дозы преднизолона более 4 мг/сут, назначения иммуносупрессивных препаратов или увеличения их доз или госпитализации.
По обоим "комбинированным" показателям эффективности меполизумаб достоверно превосходил плацебо (рис. 3). В целом эффективность лечения в группе меполизумаба составила 78-87% (в зависимости от определения ремиссии), а в группе плацебо – 32-53%. Преимущество меполизумаба перед плацебо было выявлено и при анализе отдельных компонентов клинического ответа, в том числе частоты достижения ремиссии, снижения дозы пероральных глюкокортикостероидов по крайней мере на 50% и отсутствия обострений заболевания во время исследования. Доля пациентов, у которых были достигнуты все три перечисленные конечные точки, составила 29% в группе меполизумаба и только 7% в группе плацебо.
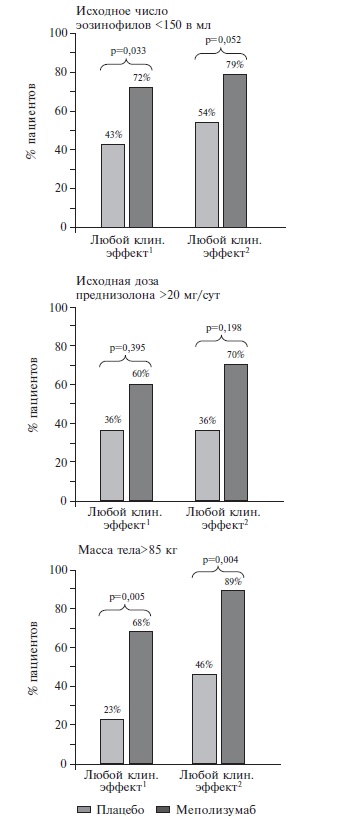
Кроме того, авторы оценили результаты лечения в трех когортах пациентов, в том числе с исходным числом эозинофилов менее 150 в мл (n=57), исходной дозой преднизолона более 20 мг/сут (n=21) и массой тела более 85 кг (n=45). Во всех этих выборках исследуемый препарат по эффективности превосходил плацебо, хотя у пациентов, получавших преднизолон в исходной дозе более 20 мг/сут, разница между группами не достигла статистической значимости (рис. 4). Результаты этого анализа имеют важное практическое значение, так как количество эозинофилов в крови обычно быстро снижается после назначения глюкокортикостероидов и не всегда увеличивается при обострении заболевания. При ве денные выше данные показали, что лечение меполизумабом эффективно у пациентов как с более высокой, так и низкой эозинофилией крови.
Заключение
ЭГПА – это редко встречающийся АНЦА-ассоциированный васкулит, который следует подозревать у пациентов с бронхиальной астмой/риносинуситом и эозинофилией крови при появлении системных проявлений, в том числе лихорадки, артралгий, нейропатии, поражения сердца, почек и желудочно-кишечного тракта. Важное значение в диагностике ЭГПА имеют МПО-АНЦА, хотя они определяются только у трети больных. Основой лечения ЭГПА остаются глюкокортикостероиды, которые при наличии неблагоприятных прогностических факторов, таких как поражение сердца или почек, тяжелая периферическая полиневропатия и др., или неэффективности монотерапии применяют в комбинации с иммуносупрессивными препаратами. Однако даже комбинированная иммуносупрессивная терапия не всегда позволяет достичь необходимого ответа, а примерно у трети пациентов наблюдается рецидивирующее течение заболевания. Результаты двойного слепого плацебо-контролируемого исследования MIRRA показали, что меполизумаб, ингибирующий взаимодействие ИЛ-5 с рецепторами, может быть использован в качестве дополнения к стандартной иммуносупрессивной терапии при рефрактерном или рецидивирующем ЭГПА. В этом исследовании применение меполизумаба по сравнению с плацебо позволяло чаще достичь ремиссии заболевания, оказывало стероидосберегающее действие и снижало частоту обострений ЭГПА. Теоретически более высокой эффективности меполизумаба можно ожидать у пациентов с преобладающим эозинофильным фенотипом ЭГПА, однако на практике оценить вклад васкулита и эозинофильной инфильтрации тканей в развитие клинических проявлений заболевания сложно. Степень эозинофилии крови не имеет особого значения при выделении фенотипов ЭГПА, так как она не всегда отражает выраженность эозинофильной инфильтрации тканей. В исследовании MIRRA, подтвердившем эффективность меполизумаба при ЭГПА, у значительной части пациентов помимо эозинофильной бронхиальной астмы отмечались периферическая полиневропатия и кожная пурпура, которые традиционно считают проявлениями васкулита. Наличие МПО-АНЦА, которые рассматривают как "суррогатный" маркер васкулита, также не является основанием для отказа от терапии меполизумаба. Хотя перед началом исследования АНЦА были выявлены только у 10% больных, однако на протяжении всей болезни частота их обнаружения составила 19%. В то же время в исследовании MIRRA фактически не было пациентов с альвеолярным кровотечением и быстропрогрессирующим гломерулонефритом. Для лечения пациентов с указанными проявлениями ЭГПА целесообразно применять иммуносупрессивные препараты, в том числе циклофосфамид или ритуксимаб. Около половины пациентов, включенных в исследование MIRRA, получали не только глюкокортикостероиды, но и иммуносупрессивные препараты. В исследовании не изучалась возможность снижения доз или отмены последних на фоне терапии меполизумабом. Соответственно, оценивать целесообразность модификации иммуносупрессивной терапии после достижения стойкой ремиссии ЭГПА и снижения дозы/отмены преднизолона следует индивидуально. Необходимо также учитывать, что обострения ЭГПА могут отражать не только рецидив васкулита, но и ухудшение течения бронхиальной астмы и/или риносинусита. В последнем случае альтернативой пероральным глюкокортикостероидам могут служить ингаляционные глюкокортикостероиды и современные бронходилататоры.
Используемые источники
- Жабина Е.С., Моисеев С.В., Новиков П.И., Федоров К.Е. Эозинофильный гранулематоз с полиангиитом (Черга-Страусс): клинические варианты, диагностика и лечение. Клин фармакол тер 2013;22(5):85-92 [Zhabina ES, Moiseev SV, Novikov PI, Fedorov KE. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome): clinical forms, diagnosis and treatment. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2013;22(5):85-92 (In Russ.)].
- Churg J., Strauss L. Allergic granulomatosis, allergic angiitis and periarteritis nodosa. Am J Pathol 1951;27:277–301.
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 Revised international Chapel Hill consensus conference nomenclature of vasculitides. Arthritis Rheum 2013; 65:1–11.
- Моисеев С.В., Семенкова Е.Н., Новиков П.И. Актуальная номенклатура сис темных васкулитов – рекомендации международной консенсусной конференции (Чапел-Хилл, 2012). Клин фармакол тер 2014;23(1):32-7 [Moiseev SV, Semenkova EN, Novikov PI. New nomenclature of systemic vasculitides recommended at the International Consensus Conference (Chapel-Hill, 2012). Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2014;23(1):32-7 (In Russ.)].
- Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with poly angiitis (Churg–Strauss) (EGPA) Consensus Task Force recommendations for evaluation andmanagement. Europ J Intern Med 2015;26:545–53
- Comarmond C, Pagnoux C, Khellaf M, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Arthritis Rheum 2013;65(1):270-81.
- Загвоздкина Е.С., Новиков П.И., Моисеев С.В. Особенности клинических проявлений и течения эозинофильного гранулематоза с полиангиитом в зависимости от наличия антител к цитоплазме нейтрофилов. Клин фармакол тер 2017;26(1):24-30 [Zagvozdkina ES, Novikov PI, Moiseev SV. Clinical features of eosinophilic granulomatosis with polyangiitis in ANCA-positive and ANCA-negative patients. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2017;26(1):24-30 (In Russ.)].
- Deeks ED. Mepolizumab: A review in eosinophilic asthma. BioDrugs 2016; 30(4):361-70.
- Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or placebo for eosino philic granulomatosis with polyangiitis. N Engl J Med 2017;376(20):1921-32
- Lyons PA, Peters JE, Alberici F, et al. Genome-wide association study of eosinophilic granulomatosis with polyangiitis reveals genomic loci stratified by ANCA status. Nat Commun 2019;10:5120.
- Berti A, Boukhlal S, Groh M, Cornec D. Eosinophilic granulomatosis with polyangiitis: the multifaceted spectrum of clinical manifestations at different stages of the disease. Expert Rev Clin Immunol 2020;16: 51-61.
- Lanham JG, Elkon KB, Pusey CD, Hughes GR. Systemic vasculitis with asthma and eosinophilia: a clinical approach to the Churg-Strauss syndrome. Medicine (Baltimore) 1984;63:65–81.
- Masi AT, Hunder GG, Lie JT, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990; 33: 1094–100.
- Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Intern Med 2015;26:545-53.
- Cottin V, Bel E, Bottero P, et al.; Groupe d’Etudes et de Recherche sur les Maladies Orphelines Pulmonaires (GERM“O”P). Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis (Churg-Strauss): A study of 157 patients by the Groupe d'Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce on eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Autoimmun Rev 2017;16:1-9.
- Bossuyt X, Cohen Tervaert JW, Arimura Y, et al. Position paper: Revised 2017 international consensus on testing of ANCAs in granulomatosis with polyangiitis and microscopic polyangiitis. Nat Rev Rheumatol 2017;13(11):683-92.
- Varricchi G, Canonica GW. The role of interleukin 5 in asthma. Expert Rev Clin Immunol 2016;12(9):903-5.
- Zhang X, Moilanen E, Kankaanranta H. Enhancement of human eosinophil apoptosis by fluticasone propionate, budesonide, and beclomethasone. Eur J Pharmacol 2000;406(3):325-32.
- Dunican EM, Fahy JV. Asthma and corticosteroids: time for a more precise approach to treatment. Eur Respir J 2017;49(6):1701167.
- Nair P, Pizzichini MM, Kjarsgaard M, et al. Mepolizumab for prednisone-dependent asthma with sputum eosinophilia. N Engl J Med 2009;360(10):985–93.
- Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet 2012;380(9842):651–9.
- Kallur L, Gonzalez-Estrada A, Eidelman F, Dimov V. Pharmacokinetic drug evaluation of mepolizumab for the treatment of severe asthma associated with persistent eosinophilic inflammation in adults. Expert Opin Drug Metab Toxicol 2017;13(12):1275–80.
- Kahn J-E, Grandpeix-Guyodo C, Marroun I, et al. Sustained response to mepolizumab in refractory Churg-Strauss syndrome. J Allergy Clin Immunol 2010;125(1):267–270.
- Moosig F, Gross WL, Herrmann K, et al. Targeting interleukin-5 in refractory and relapsing Churg-Strauss syndrome. Ann Intern Med 2011;155(5):341–3.
- Hellmich B, Flossmann O, Gross WL, et al. EULAR recommendations for conducting clinical studies and/or clinical trials in systemic vasculitis: focus on antineutrophil cytoplasm antibody-associated vasculitis. Ann Rheum Dis 2007;66: 605-17.
- Steinfeld J, Bradford ES, Brown J, et al. Evaluation of clinical benefit from treatment with mepolizumab for patients with eosinophilic granulomatosis with polyangiitis. J Allergy Clin Immunol 2019;143:2170-7.
