Применение алгоритма HFA-PEFF для диагностики сердечной недостаточности с сохраненной фракцией выброса левого желудочка
Выявление сердечной недостаточности с сохраненной фракцией выброса левого желудочка (СНсФВ) у пациентов с артериальной гипертонией (АГ) высокого риска и симптомами СН по новому модифицированному алгоритму HFA-PEFF с применением пробы с пассивным подъемом ног и неинвазивной оценкой давления заклинивания легочной артерии (ДЗЛА).
В исследование включено 90 пациентов с АГ высокого риска, симптомами СН и фракцией выброса левого желудочка (ФВ ЛЖ) ≥ 50%. Для выявления СНсФВ использован алгоритм HFA-PEFF. Стресс-эхокардиографию проводили с применением пробы с пассивным подъемом ног, неинвазивную оценка ДЗЛА – с использованием уравнения Nagueh (1997) [ДЗЛА = 1,91+(1,24×E/e’)].
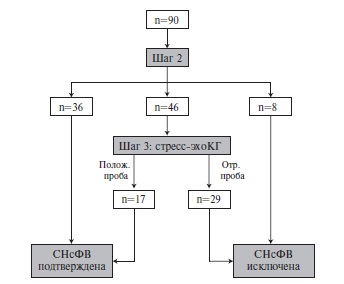
Согласно алгоритму HFA-PEFF пациенты были распределены на 3 группы: низкая вероятность/исключена СНсФВ (<2 баллов) – 8 (9%), высокая вероятность/ подтверждена СНсФВ (≥5 баллов) – 36 (40%), промежуточная вероятность (2-4 балла) – 46 (51%). При стресс-эхокардиографии у 17 из 46 последних пациентов была подтверждена СН.
Алгоритм HFA-PEFF позволил подтвердить наличие СНсФВ у 58,9% пациентов с АГ, симптомами СН и ФВ ЛЖ ≥50%. Полученные данные демонстрируют целесообразность проведения стресс-эхокардиографии с пассивным подъемом ног для диагностики СНсФВ.
Несмотря на значительную заболеваемость и смертность, сердечная недостаточность с сохраненной фракцией выброса (СНсФВ) остается "загадкой" современной кардиологии. Прогноз пациентов с СНсФВ практически не изменился и по-прежнему считается неблагоприятным [1,2]. Отсутствие единого алгоритма диагностики и оценки прогноза СНсФВ, а также наличие "недочетов" в существующих рекомендациях являются одной из очевидных и важных проблем современной кардиологии.
В 2019 г. был опубликован документ, выпущенный под эгидой Европейского общества специалистов по сердечной недостаточности (HFA) и Европейского общества кардиологов (ESC) и предлагающий новый алгоритм диагностики СНсФВ – HFA-PEFF [3], который включает в себя клиническую оценку, ультразвуковое исследование сердца в покое и при нагрузке, определение уровня натрийуретического пептида (НУП), а также инвазивную оценку гемодинамики и определение этиологии сердечной недостаточности. Инвазивное изучение гемодинамики предполагает катетеризацию сердца, которая сопряжена с определенными сложностями и осложнениями, что ограничивает ее использование в рутинной клинической практике. В нашем исследовании мы использовали модифицированный алгоритм HFA-PEFF с неинвазивной оценкой давления заклинивания легочной артерии (ДЗЛА) с помощью эхокардиографии [4].
Целью исследования было выявление СНсФВ у пациентов с артериальной гипертонией (АГ) высокого риска и симптомами сердечной недостаточности (СН) по новому модифицированному алгоритму HFA-PEFF с применением пробы с пассивным подъемом ног и неинвазивной оценкой ДЗЛА.
Материал и методы
В проспективное исследование включали пациентов старше 65 лет или ≥55 лет при наличии ожирения и/или фибрилляции предсердий (ФП) и сахарного диабета (СД), у которых имелись артериальная гипертония и симптомы СН с ФВ ЛЖ ≥50%. Критерии исключения: индекс массы тела (ИМТ) ≥40 кг/м2, острый коронарный синдром или острое нарушение мозгового кровообращения в течение последних трех месяцев, онкологические заболевания, тяжелый порок клапанов сердца, заболевания, которые сопровождаются симптомами, сходными с таковыми СН (хроническая обструктивная болезнь легких, бронхиальная астма, анемия – концентрация гемоглобина менее 90 г/л).
Шаг 1 алгоритма HFA-PEFF аналогичен критериям диагностики СНсФВ в соответствии с действующими рекомендациями Европейского общества кардиологов 2016 г. [5]: оценка симптомов и признаков СН, выявление факторов риска и сопутствующих заболеваний, определение функционального класса (ФК) СН по NYHA с помощью теста с 6-минутной ходьбой, ЭКГ и стандартная эхокардиография (как минимум, измерение ФВ ЛЖ и конечного диастолического размера ЛЖ).
Шаг 2 включает оценку структурно-функциональных параметров миокарда и измерение уровня NT-proBNP. На этом этапе используется расширенный протокол эхокардиографии с тканевой допплерографией с выделением больших и малых критериев, которым присваиваются баллы (табл. 1). При сочетании большого и малого критериев в пределах одной области (структурная, функциональная, натрийуретические пептиды) баллы не суммируются. При наличии <2 баллов диагноз СНсФВ считается маловероятным, ≥5 баллов – подтвержденным.
| Критерии | Критерии | Структурные параметры | Натрийуретические пептиды (синусовый ритм) | Натрийуретические пептиды (ФП) |
|---|---|---|---|---|
| Примечание: иОЛП – индекс объема левого предсердия, иММЛЖ – индекс массы миокарда левого желудочка, ОТС – относительная толщина стенок, СР – синусовый ритм, ФП – фибрилляция предсердий, ТСЛЖд – толщина стенок левого желудочка в диастолу, TР – трикуспидальная регургитация, СДЛА – систолическое давление в легочной артерии, GLS – global longitudinal strain (глобальная продольная деформация ЛЖ [3]. | ||||
| Большие (2 балла) | e’ септальный <7 см/с или e’ латеральный <10 см/с у пациентов <75 лет, e’ септальный <5 см/с или e’ латеральный <7 см/с у пациентов ≥ 75 лет ИЛИ E/e’ср ≥15, ИЛИ TР >2,8 м/с (СДЛА >35 мм рт. ст.) |
иОЛП >34 мл/м2 (СР), иОЛП >40 мл/м2 (ФП) ИЛИ иММЛЖ ≥149 г/м2 у мужчин или ≥122 г/м2 у женщин и ОТС >0,42 |
NT-proBNP >220 пг/мл ИЛИ BNP >80 пг/мл |
NT-proBNP >660 пг/мл ИЛИ BNP >240 пг/мл |
| Малые (1 балл) | E/e’ср 9-14 или GLS <16% |
иОЛП - 29-34 мл/м2 (СР), иОЛП - 34-30 мл/м2 (ФП) ИЛИ иММЛЖ ≥115 г/м2 у мужчин и ≥95 г/м2 у женщин ИЛИ ОТС >0,42 ИЛИ ТСЛЖд ≥12 мм |
NT-proBNP 125-220 пг/мл ИЛИ BNP 35-80 пг/мл |
NT-proBNP 375-660 пг/мл ИЛИ BNP 105-240 пг/мл |
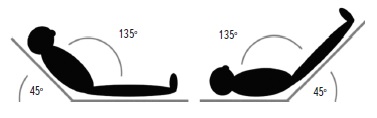
Пациентам с промежуточной вероятностью СН (2-4 балла) проводится диастолическая стресс-эхокардиография с пассивным подъемом ног (Шаг 3) (рис. 1) [6]. Применение диастолической стресс-эхокардиографии позволяет выявить диастолическую дисфункцию на ранних стадиях, когда давление наполнения в ЛЖ остается нормальным в покое, но достигает патологических значений при нагрузке. При проведении пробы с пассивным подъемом ног происходит отток крови от нижних конечностей, увеличение притока венозной крови к сердцу и давления наполнения ЛЖ. Косвенными показателями давления наполнения ЛЖ при эхокардиографии являются параметры E/e’ и максимальная скорость трикуспидальной регургитации (ТРmax). Проба считается положительной при E/e’≥15 (2 балла) или при E/e’≥15 и увеличении скорости ТРmax >3,4 м/с (3 балла). Если у пациента определяется только увеличение ТРmax, проба считается отрицательной, так как нарастание этого показателя отражает физиологический ответ на физическую нагрузку и связано с увеличением легочного кровотока. ДЗЛА рассчитывали по уравнению Nagueh: ДЗЛА = 1,91+(1,24×E/e’), где Е – максимальная скорость раннего диастолического наполнения ЛЖ, измеренная при импульсно-волновой допплерографии, e’ – усредненная максимальная скорость раннего диастолического смещения септальной и латеральной частей кольца митрального клапана. Была выявлена тесная корреляция измерения ДЗЛА инвазивным методом и при эхокардиографии с применением тканевого допплера [4]. Косвенным показателем повышения давления в левых отделах сердца является увеличение ДЗЛА ≥15 мм рт. ст. в покое и ≥25 мм рт. ст. при нагрузке [6].
Результаты
Клинико-демографическая характеристика пациентов приведена в табл. 2. При поступлении наиболее распространенными симптомами были одышка при нагрузке (100%), слабость (57,4%) и отеки (35,0%).
| Показатель | Значение |
|---|---|
| Женщины, n (%) | 63(70,0) |
| Возраст, годы | 69,3±10,6 |
| Длительность АГ, годы | 15,8±7,8 |
| Индекс массы тела, г/м2 | 28,3±4,9 |
| Ожирение, n (%) | 39 (33;43) |
| Функциональный класс СН, NYHA, n (%) | |
| II | 24 (26,7) |
| III | 47 (52,2) |
| IV | 19 (21,1) |
| Одышка, n (%) | |
| Легкая | 41 (45,6) |
| Умеренная | 41 (45,6) |
| Тяжелая | 8 (8,8) |
| Отеки нижних конечностей, n (%) | 45 (50,0) |
| NT-proBNP, пг/мл | 142 (50;220) |
| рCКФ, мл/мин/1,73 м2 | 58,6 (48,6;72,9) |
| Фибрилляция предсердий, n (%) | 29 (32,2) |
| Пароксизмальная форма | 26 (28,9) |
| 3 (3,3)Постоянная форма | 3 (3,3) |
| Сахарный диабет 2 типа, n (%) | 40 (44,4) |
| Хроническая болезнь почек, n (%) | 41 (45,6) |
| Легочная гипертензия, n (%) | 67 (74,4) |
| 1 степень | 58 (64,4) |
| 2 степень | 6 (6,7) |
| 3 степень | 3 (3,3) |
| Фракция выброса левого желудочка, % | 58,1±5,3 |
| Диастолическая дисфункция, n (%) | |
| 1 тип | 41 (45,6) |
| 2 тип | 46 (51,1) |
| 3 тип | 0 (0) |
| Фибрилляция предсердий | 3 (3,3) |
| Гипертрофия левого желудочка, n (%) | 65 (72,2) |
| Среднее давление в легочной артерии, мм рт. ст. | 33,2±12,0 |
| Индекс объема левого предсердия, мл/м2 | 27,4±10,7 |
| Индекс массы миокарда ЛЖ, г/м2 | 113,6±21,2 |
| GLS | 17 (14,20) |
| E/e’ | 8,0±2,2 |
Результаты оценки наличия СНсФВ по алгоритму HFA-PEFF представлены на рис. 2. На втором этапе СНсФВ была выявлена у 36 (40,0%) из 90 пациентов и исключена у 8 (9,0%), в то время как 46 (51,0%) больным для установления диагноза потребовалась стрессэхокардиография (шаг 3). При проведении этого исследования у 17 (18,9%) пациентов отмечено увеличение E/e’ ≥15, а наличие СНcФВ подтверждалась увеличением ДЗЛА при проведении пробы с пассивным подъемом ног ≥25 мм рт. ст. Следует отметить, что у 4 (4,4%) из 90 пациентов имелись только малые критерии диагностики СНсФВ. Таким образом, при применении алгоритма HFA-PEFF у 53 (58,9%) из 90 пациентов была диагностирована СНсФВ.
Обсуждение
В нашем исследовании показана возможность использования модифицированного алгоритма HFA-PEFF, применение которого позволило выявить СНсФВ у 58,9% пациентов с АГ высокого риска с сохраненной ФВ и симптомами СН.
За последние десятилетия доля СНсФВ в структуре СН увеличилась с 41% до 56% [7]. Согласно данным крупного обсервационного исследования ЭПОХА-О-ХС среди всех больных с СН пациенты с ФВ ЛЖ более 50% составляют 56,8% [8]. В будущем можно ожидать дальнейшего роста числа таких пациентов в связи со старением населения. Однако в настоящее время нет единых критериев диагностики СНсФВ, которые отличаются как в рекомендациях кардиологических обществ, так и в рандомизированных клинических исследованиях. Хо и соавт. провели инвазивное исследование гемодинамики у 461 пациента с одышкой при нагрузке и ФВ ЛЖ≥50% и сопоставили частоту СНсФВ, установленной с использованием различных критериев [9]. Увеличение ДЗЛА было выявлено у 243 (52,7%) больных, в то время как по критериям Американской коллегии кардиологов/Американской ассоциации сердца 2013 г. СНсФВ была диагностирована у 416 (90,2%) пациентов, по критериям Евро пей ского общества кардиологов 2016 г. – у 205 (44,5%), а по критериям Американского общества сердечной недостаточности – у 55 (11,9%). Полученные данные демонстрируют ограниченные возможности современных рекомендаций. Авторы предложили фенотипировать пациентов с СНсФВ по клиническим и гемодинамическим параметрам, что, безусловно, имеет большое значение для их лечения. Таким образом, в действующих рекомендациях не учитываются неоднородность и коморбидность больных с СНсФВ, что обусловливает низкую специфичность и чувствительность предложенных критериев диагностики.
Новый алгоритм HFA-PEFF учитывает все современные аспекты диагностики СНсФВ, предполагает комплексное обследование пациентов и может стать альтернативой существующим рекомендациям. Наибо лее значимым преимуществом данного алгоритма явля ется тот факт, что авторы принимают во внимание особенности изменений уровней натрийуретических пептидов и индекса объема левого предсердия у пациентов с ФП.
Однако данный алгоритм имеет и ограничения. Заболевания опорно-двигательного аппарата, неврологические нарушения и ожирение могут препятствовать выполнению нагрузочной пробы. В свою очередь, инвазивная оценка гемодинамики, как было указано ранее, сопряжена с определенными сложностями выполнения и осложнениями. Например, в японском исследовании при проведении 576 процедур катетеризации правых отделов сердца было зарегистрировано 65 (11,3%) осложнений, 13 из которых были серьезными, включая 1 (2,3%) случай смерти [10]. В другом исследовании, проведенном специалистами из Уэльского кардиологического научно-исследовательского института, общая частота осложнений катетеризации правых отделов сердца составила 7,4%, а смертность – 0,7% [11].
В 2018 г. специалисты из Швеции провели исследование у 29 пациентов с симптомами СН, которым проводили эхокардиографию и катетеризацию правых камер сердца в покое и при нагрузке с пассивным подъемом ног. Было установлено, что у 41% пациентов с нормальным ДЗЛА в покое наблюдалось значительное его повышение при проведении пробы с пассивным подъемом ног [12]. Учитывая простоту выполнения пробы с пассивным подъемом ног, ее доступность, а также независимость от состояний, которые препятствуют проведению нагрузочных проб, представляется целесообразным проведение дальнейших исследований для оценки эффективности предложенного нами модифицированного алгоритма HFA-PEFF у большей популяции пациентов с симптомами СН.
Заключение
Частота выявления СНсФВ по модифицированному алгоритму диагностики HFA-PEFF у пациентов с АГ высокого риска и симптомами СН составила 58,9%. Применение нового алгоритма диагностики HFA-PEFF позволяет верифицировать СНсФВ с оценкой давления наполнения ЛЖ с помощью диастолической стрессэхокардиографии и неинвазивной оценки ДЗЛА.
Используемые источники
- Dunlay SM, Roger VL, Redfield MM. et.al. Epidemiology of heart failure with preserved ejection fraction. Nat Rev Cardiol 2017;14:591–602.
- Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006;355:251–9.
- Pieske B, Tschope C, de Boer R, et al. How to diagnose heart failure with preserved ejection fraction: the HFA–PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur J Heart Fail. 2020;22(3):391-412.
- Nagueh SF, Middleton K, Kopelen H, et al. Doppler tissue imaging: a noninvasive technique for evaluation of LV relaxation and estimation of filling pressures. J Am Coll Cardiol 1997;30:1527–33.
- Ponikowski P, Voors AA, Anker SD, et al; ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur Heart J 2016;37: 2129–200.
- Lancellotti P, Pellikka PA, Budts W, et. Al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocar diography. doi: 10.1016/j.echo.2016.10.016
- Oktay AA, Rich JD, Shah SJ et al. The emerging epidemic of heart failure with preserved ejection fraction. Curr Heart Fail Rep. 2013;10:401–10.
- Мареев Ю.В., Даниелян М.О., Беленков Ю.Н. Сравнительная характеристика больных с ХСН в зависимости от величины ФВ по результатам Российского многоцентрового исследования ЭПОХА-О-ХСН. Журнал Сердечная Недостаточность 2006;7(4):164-71 [Mareev VYu, Danielyan MO, Belenkov YuN. Comparative characteristics of patients with CHF in relation to the value of injection fraction by data from the Russian multicenter study EPOCH-A-CHF. Russian Heart Failure Journal 2006;7(4):164–71 (In Russ.)].
- Ho JE, Zern E, Wooster L, et al. Differential clinical profiles, exercise responses, and outcomes associated with existing HFpEF definitions. Circulation 2019;140:353–65.
- West R, Ellis G, Brooks N. Complications of diagnostic cardiac catheterisation: results from a confidential inquiry into cardiac catheter complications. Heart 2006;92:810-4.
- Mori Y, Takahashi K, Nakanishi T. Complications of cardiac catheterization in adults and children with congenital heart disease in the current era. Heart Vessels 2013:28:352–59.
- Henein M, Tossavainen E, Aroch R, et al. Can Doppler echocardiography estimate raised pulmonary capillary wedge pressure provoked by passive leg lifting in suspected heart failure? Clin Physiol Funct Imaging 2019;39(2):128-34
