Применение прямых оральных антикоагулянтов у пациентов с фибрилляцией предсердий и ухудшающейся функцией почек
Результаты клинических исследований свидетельствуют о том, что примерно у четверти больных с ФП в динамике наблюдается ухудшение функции почек, хотя частота развития и прогрессирования хронической болезни почек (ХБП) варьируется в зависимости от выбранных критериев оценки. Риск ухудшения функции почек у пациентов с ФП выше, чем у больных без аритмии, что, вероятно, связано с пожилым и старческим возрастом больных, частым сочетанием ФП с сердечно-сосудистыми заболеваниями и сахарным диабетом, активацией нейрогуморальных систем, гемодинамическими нарушениями, неблагоприятными эффектами лекарственных средств. По данным мета-анализов рандомизированных контролируемых исследований, у пациентов с ФП и ХБП прямые оральные антикоагулянты (ПОАК) имели преимущества перед варфарином по эффективности и по крайней мере не уступали по безопасности. В исследовании ROCKET AF лечение ривароксабаном у пациентов с ухудшающейся функции почек ассоциировалось со снижением частоты инсульта и системных эмболий по сравнению с таковой при приеме варфарина, в то время как частота кровотечений достоверно не отличалась между двумя группами. Дозы ПОАК зависят от функции почек, поэтому при лечении этими препаратами необходимо регулярно контролировать расчетный клиренс креатинина (по крайней мере ежегодно) и своевременно корректировать дозы в случае его снижения.
Фибрилляция предсердий (ФП) часто встречается в клинической практике, особенно у людей пожилого и старческого возраста, и примерно в трети случаев сочетается с хронической болезнью почек (ХБП) III-V стадии, т.е. снижением расчетной скорости клубочковой фильтрации (рСКФ) <60 мл/мин/1,73 м2 [1]. Сочетание ФП и ХБП ассоциируется с дополнительным увеличением риска инсульта, а также других неблагоприятных исходов. Наруше ние функции почек учитывается также при расчете индекса HAS-BLED, который ис поль зуют для оценки риска геморрагических осложнений у пациентов с ФП [2]. Значение индекса HAS-BLED ≥3 указывает на высокий риск кровотечений, но не исключает возможность антикоагулянтной терапии. В большинстве случаев риск тромбоэмболических осложнений выше риска кровотечений, поэтому, в первую очередь, больного ФП необходимо защищать от тромбоэмболий.
Нарушение функции почек приводит к изменению фармакокинетики прямых ораль ных антикоагуляентов (ПОАК), кото рые сегодня все чаще применяют для профилактики инсульта и других тромбоэмболических осложнений у пациентов с ФП, в том числе сочетающейся с ХБП. Допол нительные проблемы при планировании антикоагулянтной терапии создает тот факт, что у больных с ХБП функция почек со временем может ухудшиться, в том числе под влиянием сопутствующих заболеваний, таких как артериальная гипертония и сахарный диабет 2 типа, что может потребовать изменения дозы ПОАК или его замены.
Естественное снижение функции почек наблюдается и у пациентов старческого возраста. В статье обсуждается тактика антикоагулянтной терапии у пациентов с ФП и ухудшающейся функцией почек.
Частота и клиническое значение сочетания фибрилляции предсердий и ХБП
Результаты многочисленных исследований свидетельствуют о том, что нарушение функции почек ассоциируется с увеличением риска развития ФП [1]. В исследовании REGARDS была проанализирована частота ФП в зависимости от функции почек примерно у 27000 взрослых американцев [3]. У людей с нормальной функцией почек частота ФП составила 1,0%, т.е. соответствовала таковой в общей популяции, в то время как у пациентов с ХБП различных стадей она увеличилась до 2,7-4,2%. Наиболее значительное увеличение риска развития ФП выявили у пациентов с ХБП 4-5 стадии (отношение шансов 3,52). Сходные данные были получены в другом крупном исследовании ARIC (n=10328), в котором снижение рСКФ до 30-50 и 15-29 мл/мин/1,73 м2 сопровождалось увеличением риска развития ФП в 1,6 и 3,2 раза по сравнению с таковым у пациентов с нормальной функцией почек [4]. Увели чение риска развития ФП наблюдалось и у пациентов с протеинурией и микроальбуминурией (в 2,0-3,2 раза).
По данным эпидемиологического исследования ЭССЕ-РФ, среди почти 17000 жителей различных городов Российской Федерации (возраст 25-64 года) частота ХБП 3-5 стадии составила 1,1% [5], в то время как у больных с ФП снижение рСКФ <60 мл/мин/1,72 м2 отмечается по крайней мере в трети случаев. Например, в исследовании ATRIA, в которое были включены более 13000 пациентов с ФП (средний возраст около 72 лет), ХБП 3-5 стадии была выявлена у 29,1% мужчин и 38,8% женщин [6].
Причиной частого сочетания ФП и ХБП являются общие факторы риска двух состояний, такие как пожилой возраст, артериальная гипертония, сахарный диабет и др. Важную роль в патогенезе ФП играет гипертрофия левого желудочка, которая часто встречается у пациентов с ХБП, а на стадии диализа определяется фактически у всех больных [7]. Определенный вклад в развитие ФП у пациентов с заболеваниями почек может вносить и активация ренин-ангиотензиновой и симпатической систем [8].
Наличие ХБП не учитывается при расчете индекса CHA2DS2-VASc, который используется для оценки риска инсульта у пациентов с ФП и, соответственно, определения необходимости в антикоагулянтной терапии. Тем не менее, результаты проспективных исследований свидетельствуют о том, что снижение рСКФ ассоциируется с увеличением риска инсульта [9], поэтому нарушение функции почек может способствовать дополнительному его повышению у больных с ФП [6]. По данным мета-анализа 18 исследований, у пациентов с ФП и рСКФ <60 мл/мин/1,73 м2 риск тромбоэмболических осложнений был в 1,62 раза выше, чем у пациентов с ФП и более высокой рСКФ (p<0,001) [10].
Таким образом, нарушение функции почек может служить дополнительным доводом в пользу антикоагулянтной терапии у пациентов с ФП, хотя при оценке ее целесообразности следует в первую очередь ориентировать на значение индекса CHA2DS2-VASc.
Частота и механизмы прогрессирования ХБП у пациентов с ФП
В большинстве исследований роль ХБП как предиктора неблагоприятных исходов у пациентов с ФП изучали только с учетом исходной рСКФ. Однако последняя не является статичным параметром, а у части пациентов с ХБП функция почек постепенно ухудшается. В 2-летнем исследовании прогрессирование ХБП, характеризовавшееся снижением рСКФ по крайней мере на 25% через 6 и 12 мес, наблюдалось у 10% и 13% из 617 пациентов с ФП, соответственно [11]. При этом ухудшение функции почек ассоциировалось с достоверным увеличением риска неблагоприятных исходов, включая инсульт.
L. Hu и соавт. изучали изменения функции почек у 631 пациента с ФП в течение в среднем около 30 мес [12]. В течение указанного срока значительное ухудшение функции почек (снижение рСКФ по крайней мере на 30% по сравнению с исходной) было выявлено у 24,6% пациентов. Кроме того, у 28,7% из 478 пациентов с исходной рСКФ ≥60 мл/мин/1,73 м2 было отмечено развитие ХБП 3 стадии. Факторами, ассоциировавшимися с ухудшением функции почек, были возраст ≥75 лет, застойная сердечная недостаточность, более низкая исходная рСКФ и дилатация левого предсердия.
ФП и сама по себе, по-видимому, способствует прогрессированию ХБП. В крупном когортном исследовании развитие ФП наблюдалось у 8% из 206229 взрослых пациентов с рСКФ<60 мл/мин/1,73 м2 [13]. В течение в среднем 5 лет частота прогрессирования ХБП с развитием терминальной почечной недостаточности составила 74 на 1000 пациенто-лет у больных с ФП и 64 на 1000 пациенто-лет у пациентов без ФП (p<0,001; скорректированное отношение шансов 1,67).
В рамках регистра ORBIT-AF II динамику функции почек анализировали у 6682 пациентов с ФП (медиана возраста 72 года), получавших ПОАК или варфарин. Исходная медиана клиренса креатинина составляла 80,1 мл/мин (57,4,108,5). Критерием ухудшения функции почек служило снижение клиренса креатинина более чем на 20% и 30% по сравнению с исходным. В течение примерно одного года указанные конечные точки были достигнуты у 23,1% и 10,6% пациентов, соответственно [14].
Таким образом, примерно у каждого четвертого пожилого пациента с ФП в течение года можно ожидать прогрессирования ХБП. Следует отметить, что у пациентов с исходно нарушенной функцией почек даже относительно небольшое дальнейшее снижение рСКФ может быть основанием для пересмотра антикоагулянтной терапии. Основные причины ухудшения функции почек у пациентов с ФП, вероятно, соответствуют общим механизмам развития и прогрессирования ХБП [15] и включают в себя возрастное снижение числа функционирующих нефронов, воздействие плохо контролируемых артериальной гипертонии и сахарного диабета, гиперурикемию, нефротоксичные эффекты лекарственных средств и т.п. Важное значение для развития и прогрессирования ХБП при ФП имеют нарушения гемодинамики. Как указано выше, застойная сердечная недостаточность и дилатация левого предсердия ассоциировались с ухудшением функции почек в крупном исследовании у пациентов с ФП [12].
В последние годы обсуждается и неблагоприятное влияние антикоагулянтов на функцию почек. В 2009 г. S. Brodsky и соавт. описали 9 случаев острого повреждения почек (ОПП), развившегося на фоне лечения варфарином [16]. У всех пациентов нарушение функции почек по времени совпало с увеличением международного нормализованного отношения (МНО) >3, а при биопсии определялись кровоизлияния в клубочках и обструкция почечных канальцев эритроцитарными цилиндрами. Полученные данные свидетельствовали о том, что причиной ОПП была чрезмерная антикоагуляция, которая сопровождалась кровоизлиянием в клубочки почек. Нефропатия, ассоциированная с варфарином, по-видимому, встречается нередко и может развиться у пациентов как с нарушенной, так и нормальной функцией почек. S. Brodsky и соавт. ретроспективно проанализировали результаты измерения сывороточного уровня креатинина при эпизодах увеличения МНО более 3,0 у 4006 больных, получавших варфарин [17]. Частота ОПП, предположительно ассоциированного с варфарином, составила 33,0% у больных с ХБП и 16,5% у пациентов без ХБП. Риск острого ухудшения почек был выше у пожилых людей и пациентов с артериальной гипертонией и сердечно-сосудистыми заболеваниями. Еще в одном крупном ретроспективном исследовании нефропатия, ассоциированная с варфарином, была диагностирована у 19,3% из 1297 пациентов, у которых измеряли сывороточный креатинин в течение 1 недели после и в течение 6 мес до эпизода повышения МНО более 3,0. Частота нефропатии также была выше у пациентов с ХБП [18]. По данным мета-анализа 4 исследований, развитие нефропатии, ассоциированной с антикоагулянтами, сопровождалось почти двукратным увеличением риска смерти в течение 5 лет по сравнению с таковым у больных, у которых антикоагулянтная терапия не вызывала острое ухудшение функции почек (относительный риск 1,91; 95% доверительный интервал 1,22-3,00) [19].
Таким образом, ОПП является нередким осложнением терапии варфарином, особенно у пациентов с ХБП, пожилых людей, больных с сердечно-сосудистыми заболеваниями. Соответственно, риск нефропатии может быть выше у пациентов с ФП, которая, как правило, развивается в пожилом и старческом возрасте, сочетается с другими сердечно-сосудистыми заболеваниями и может вызывать нарушения гемодинамики.
Чрезмерная антикоагуляция, сопровождающаяся кровоизлияниями в почечные клубочки, может наблюдаться при лечении любыми антикоагулянтами [20]. Однако ПОАК оказывают более предсказуемое антикоагулянтное действие по сравнению с варфарином, что может снизить риск развития ОПП при лечении этими препаратами.
Антагонисты викамина К ингибируют внепеченочный витамин К зависимый матриксный Gla белок, который принимает участие в регуляции кальциноза, и могут способствовать развитию кальциноза сосудов, в том числе почечных артерий [21]. J. Andrews и соавт. обобщили результаты 8 проспективных рандомизированных исследований, в которых больным с коронарной болезнью сердца проводили внутрисосудистую эхографию коронарных артерий [22]. По данным многофакторного анализа, лечение варфарином ассоциировалось с достоверным увеличением кальциевого индекса коронарных артерий. В другом исследовании у 1155 пациентов с ФП лечение антагонистами витамина К сопровождалось достоверным увеличением риска развития кальциноза клапанов, которое оставалось статистически значимым после внесения поправки на другие факторы риска [23].
В отличие от варфарина, ПОАК не оказывают ингибирующее действие на витамин К и, соответственно, Gla белок, что может снизить риск прогрессирования кальциноза сосудов. J. Lee и соавт. в рандомизированном исследовании у 97 больных с ФП, получавших ривароксабан или варфарин, оценивали результаты КТкоронароангиографии, которую проводили исходно и через 1 год после начала лечения [24]. В группе варфарина выявили достоверное увеличение объема фиброзных бляшек в коронарных артериях по сравнению с таковым в группе ривароксабана (p=0,035). По данным многофакторного анализа, лечение варфарином ассоциировалось с увеличением общего объема бляшек (p=0,015) и кальцифицированных бляшек (p=0,026). Сходные результаты были получены в другом рандомизированном клиническом исследовании, в котором сравнивали влияние варфарина и апиксабана на прогрессирование атеросклероза у 66 больных с неклапанной ФП [25].
Теоретически более медленное прогрессирование атеросклероза при лечении ПОАК может способствовать снижению риска сердечно-сосудистых осложнений по сравнению с таковым при применении антагонистов витамина К. Однако клиническое значение выявленных различий между эффектами ПОАК и варфарина на течение атеросклероза не определено.
Эффективность ПОАК у пациентов с нарушенной и ухудшающейся функцией почек
Эффективность ПОАК в профилактике инсульта и системных тромбоэмболий у пациентов с ФП, сочетавшейся с ХБП, была установлена на основании оценки результатов лечения больных с нарушенной функцией почек, принимавших участие в регистрационных клинических исследованиях препаратов этой группы. Z. Gu и соавт. проанализировали сравнительную эффективность и безопасность ПОАК и варфарина в зависимости от функции почек на основании мета-анализа исследований ROCKET-AF, RE-LY, ARISTOTLE, ENGAGE AF-TIMI 48, в которых изучались ривароксабан, дабигатран, апиксабан и эдоксабан, соответственно [26]. У 64% из 70952 больных, включенных в мета-анализ, была диагностирована ХБП на основании снижения клиренса креатинина≤80 мл/мин. При лечении ПОАК у пациентов с ФП и нарушенной функцией почек выявили достоверное снижение относительного риска развития инсульта и системных эмболий на 20% (p<0,01), больших кровотечений на 21% (р=0,017) и смерти от любых причин на 9% (р=0,031) по сравнению с таковым при применении варфарином. "Чистая" польза ПОАК, которую оценивали с учетом риска не только инсульта/системных эмболий, но и кровотечений, возрастала по мере ухудшения функции почек и была выше всего у пациентов со среднетяжелой ХБП (клиренс креатинина 30-50 мл/мин). Наибольшее количество больных со сниженным клиренсом креатинина (30-49 мл/мин) было включено в исследование ROCKET AF, в котором была специально изучена возможность применения "почечной" дозы ривароксабана (15 мг/сут). Выбор дозы основывался на одном объективном показателе – величине клиренса креатинина. В то же время в исследовании RE-LY доза дабигатрана определялась случайным образом при рандомизации, а в исследовании ARISTOTLE доза зависела от нескольких критериев (возраст старше 80 лет, масса тела менее 60 кг или уровень креатинина сыворотки 1,5 мг/дл или более), что могло затруднить ее подбор.
В последние годы эффективность ПОАК изучалась также в ретроспективных исследованиях на основании данных, полученных в обычной клинической практике. Подобные исследования дополняют результаты рандомизированных клинических исследований. Например, H. Bonnemeier и соавт. в исследовании RELOAD сравнивали эффективность и безопасность ривароксабана и фенпрокумона у пациентов с неклапанной ФП и нарушенной функцией почек на основании базы данных Health Risk Institute (Германия). В анализ были включены 4164 больных, получавших ривароксабан в дозах 15 или 20 мг один раз в день, и 7002 пациентов, которым был назначен антагонист витамина К. При применении ривароксабана было выявлено достоверное снижение риска развития ишемического инсульта (2,40 и 3,51 на 100 пациентов-лет, соответственно; отношение рисков = 0,72, 95% доверительный интервал [ДИ] 0,55–0,94, p=0,015), а также тенденция к снижению риска внутричерепного кровотечения (0,57 и 0,89 на 100 пациенто-лет; отношение рисков 0,66; 95% ДИ 0,38– 1,14, p=0,14). Хотя это исследование не было рандомизированным, тем не менее, авторы провели регрессионный анализ с учетом более 40 исходных показателей, чтобы внести поправку на возможные различия между двумя группами. Результаты лечения у пациентов с нарушенной функцией почек соответствовали данным, полученным во всей выборке исследования RELOAD, в которое включали пациентов как с почечной дисфункцией, так и нормальной функцией почек. При лечении ривароксабаном было отмечено снижение риска развития ишемического инсульта на 23% по сравнению с таковым в группе сравнения (p=0,01)
Дизайн рандомизированных контролируемых исследований не предполагал изучение влияния ПОАК на почечные исходы. Тем не менее, накапливаются данные, свидетельствующие о том, что эти препараты могут иметь преимущества перед варфарином по влиянию на функцию почек. По данным регистра ORBIT AF II, степень снижения клиренса креатинина в течение 2 лет достоверно не отличалась у больных с неклапанной ФП, получавших ПОАК или варфарин, однако в группе ПОАК было выявлено достоверное уменьшение частоты снижения клиренса креатинина более чем на 20% (22,1% против 28,0% в группе варфарина; p<0,0001) и 30% (9,8% против 14,3%; p<0,0001) и абсолютного увеличения сывороточного содержания креатинина более чем на 0,3 мг/дл (12,9% против 18,0%; p<0,0001) [14].
| Показатели | Ривароксабан | Фенпрокумон | ОШ (95% ДИ) | p | ||||
|---|---|---|---|---|---|---|---|---|
| n | Средняя длительность набл. (мес) | Число событий на 100 пациенто-лет | n | Средняя длительность набл. (мес) | Число событий на 100 пациенто-лет | |||
| Ишемический инсульт | 104 | 381 | 2,40 | 149 | 221 | 3,51 | 0,72 (0,55-0,94) | 0,015 |
| Внутричерепное кровотечение | 25 | 387 | 0,57 | 38 | 222 | 0,89 | 0,66 (0,38-1,14) | 0,14 |
| Комб. конечная точка | 125 | 380 | 2,88 | 184 | 221 | 4,35 | 0,69 (0,54-0,88) | <0,01 |
X. Yao и соавт. ретроспективно сравнивали риск развития почечных исходов у 9769 пациентов с неклапанной ФП, получавших различные ПОАК или варфарин, на основании административной базы данных [28]. Лечение ПОАК в течение 2 лет ассоциировалось с достоверным снижением риска развития или прогрессирования ХБП. В частности, при применении препаратов этой группы было отмечено уменьшение вероятности снижения рСКФ по крайней мере на 30% (отношение шансов 0,77; 95% ДИ 0,66-0,89; p<0,001) и удвоения сывороточного креатинина (0,62; 0,40-0,95; p=0,03) по сравнению с таковой при лечении варфарином. Улучшение почечного прогноза было выявлено при применении ривароксабана и дабигатрана, но не апиксабана. Так, при лечении ривароксабаном по сравнению с варфарином риск снижения рСКФ по крайней мере на 30% уменьшился на 27% (отношение рисков 0,74; 95% ДИ 0,62-0,87), а удвоения сывороточного креатинина – на 54% (0,46; 95% ДИ 0,28-0,75) (рис. 1). Необходимо отметить, что риск развития ОПП при применении ривароксабана также достоверно снизился на 31% по сравнению с таковым в группе варфарина (0:69; 95% ДИ 0,57-0,84). Полученные данные позволили констатировать отчетливые преимущества ривароксабана перед варфарином в плане негативного влияния на функцию почек.
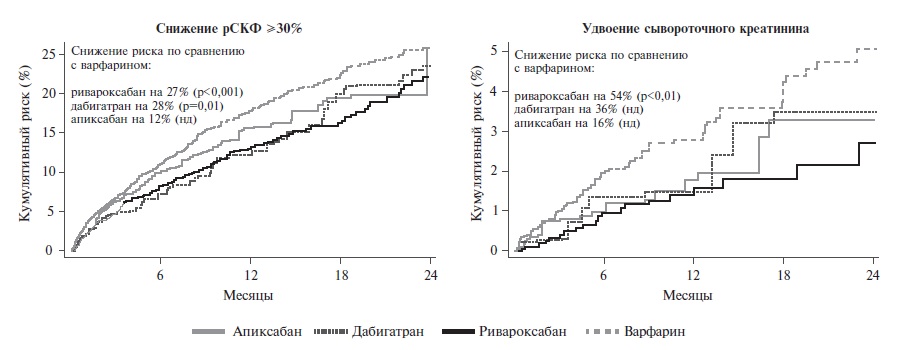
Сходные данные были получены в другом ретроспективном американском исследовании [29]. Авторы анализировали почечные исходы более чем у 72000 пациентов с ФП, начавших лечение ривароксабаном или варфарином в течение по крайней мере 12 мес назад. Частота ХБП 3 и 4 стадии в этой выборке составила 5% и 1%, соответственно. Терапия ривароксабаном ассоциировалась со снижением риска развития ОПП на 19% и ХБП 5 стадии на 18% по сравнению с варфарином.
В крупном тайваньском исследовании частоту ОПП анализировали более чем у 75000 больных с неклапанной ФП, которые получали терапию ривароксабаном, дабигатраном, апиксабаном или варфарином [30]. Ле че ние ПОАК по сравнению с варфарином ассоциировалось с достоверным снижением риска развития ОПП как у больных с нормальной функцией почек (на 2735%), так и у пациентов с ХБП (на 46-50%).
Таким образом, результаты ретроспективных исследований показали, что лечение ПОАК у пациентов с неклапанной ФП может сопровождаться улучшением почечных исходов по сравнению с варфарином, в том числе снижением частоты ОПП, которое может отражать развитие нефропатии на фоне чрезмерной антикоагуляции. Основным ограничением перечисленных исследований был ретроспективный дизайн, который не позволял в полной мере учесть влияние других факторов на функцию почек. В настоящее время проводится проспективное наблюдательное исследование XARENO, в которое планируется включить более 2500 пациентов с неклапанной ФП и рСКФ/клиренсом креатитина 15-49 мл/мин. Цель исследования – сравнить частоту прогрессирования ХБП и клинических исходов при применении ривароксабана, антагонистов витамина К или без антикоагулянтной терапии в течение ≥3 мес [31]. Первые результаты этого многоцентрового исследования ожидаются в конце 2020 г.
В исследовании ROCKET AF, которое подтвердило благоприятный профиль эффективности ривароксабана в профилактике инсульта и системных эмболий у пациентов с неклапанной ФП, были изучены результаты профилактического применения антикоагулянтов у больных с ухудшающейся функцией почек [32]. В анализ post hoc были включены 12612 пациентов, у которых в динамике по крайней мере однократно измеряли сывороточный уровень креатинина на фоне лечения ривароксабаном или варфарином. Прогрес сирование ХБП, критерием которого служило снижение клиренса креатинина более чем на 20% по сравнению с исходным, наблюдалось у 3320 (26,3%) больных. Выборки пациентов со стабильной и ухудшающейся функцией почек были сопоставимы по исходным показателям. Частота прогрессирования ХБП была сходной в группах ривароксабана и варфарина. У пациентов с ухудшающейся функцией почек было отмечено увеличение риска смерти от сосудистых причин (отношение шансов 1,47, 95% ДИ 1,05–2,06; р=0,026), комбинированной конечной точки, включавшей в себя инсульт, системные эмболии, сердечно-сосудистую смерть и инфаркт миокарда (1,40, 1,13–1,73; р=0,0023), и смерти от любых причин (1,49, 1,12–1,98; р=0,0067) по сравнению с таковым у пациентов со стабильной функцией почек, в то время как риск инсульта, инфаркта миокарда и кровотечений достоверно не отличался между этими выборками. Лечение ривароксабаном по сравнению с варфарином у больных с ухудшающейся функцией почек привело к достоверному снижению частоты инсульта и системных эмболий (1,54 и 3,25 на 100 пациенто-лет, соответственно). При этом частота больших и клинически значимых небольших кровотечений достоверно не отличалась между группами. При нарастании степени снижения клиренса креатинина вероятность развития инсульта или системных эмболий в группе варфарина увеличивалась, а в группе ривароксабана существенно не менялась (рис. 2). Частота кровотечений была сходной в двух группах независимо от степени ухудшения функции почек.
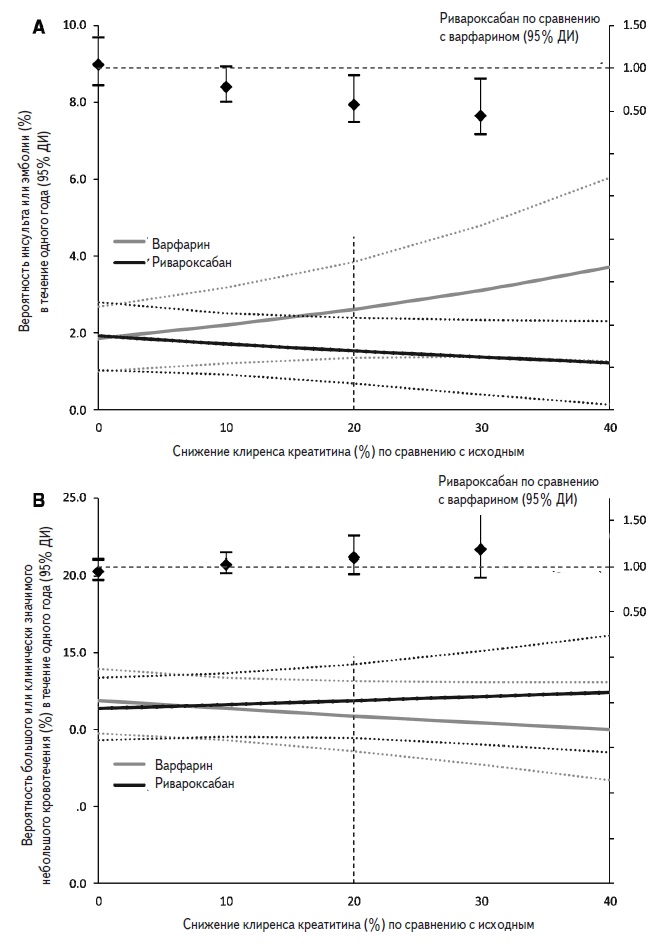
Таким образом, результаты анализа показали, что лечение ривароксабаном у пациентов с неклапанной ФП и ухудшающейся функцией почек, доля которых составляла около 26% в исследовании ROCKET AF, снижает риск развития инсульта и системных эмболий и не вызывает увеличения риска больших и клинически значимых небольших кровотечений по сравнению варфарином. Приведенные данные обосновывают приме нение ривароксабана в этой группе пациентов, у которых имеется более высокий риск развития неблагоприятных сердечно-сосудистых исходов.
Выбор антикоагулянта и его дозы у пациентов с ухудшающейся функцией почек
Все ПОАК частично выводятся почками – в большей степени дабигатран и в меньшей степени ривароксабан и апиксабан [33]. Соответственно, при выборе ПОАК и его дозы следует учитывать функцию почек. Дабигатран не рекомендуется применять у пациентов с клиренсом креатинина <30 мл/мин, в то время как дозу ривароксабана снижают с 20 до 15 мг один раз в сутки у больных с клиренсом креатинина 15-49 мл/мин, а дозу апиксабана – с 5 мг до 2,5 мг два раза в сутки при увеличении сывороточного уровня креатинина ≥133 мкмоль/л у пациентов в возрасте ≥80 лет или с массой тела ≤60 кг, а также у пациентов с клиренсом креатинина 15-29 мл/мин. Чтобы обеспечить безопасность антикоагулянтной терапии у больных с ФП, необходимо регулярно контролировать функцию почек (по крайней мере один раз в год или чаще у пациентов, относящихся к группе риска, например, при наличии исходного снижения функции почек).
К сожалению, результаты исследований, проводившихся в обычной клинической практике, свидетельствуют о том, что врачи далеко не всегда учитывают функцию почек при выборе дозы ПОАК и часто не корректируют ее при ухудшении функции почек, что может сопровождаться увеличением риска кровотечений. По данным американского ретроспективного исследования, необходимость в снижении дозы ПОАК в связи с нарушением функции почек имелась у 1474 из 14865 больных с ФП, начавших лечение апиксабаном, дабигатраном или ривароксабаном [34]. Однако доза антикоагулянта не была снижена у 43,0% из 1474 пациентов, что ассоциировалось с двукратным увеличением риска больших кровотечений при отсутствии существенных изменений риска инсульта. С другой стороны, у 13,3% из 13392 пациентов без нарушения функции почек, требовавшего снижения дозы ПОАК, эти препараты применяли в сниженных дозах, что привело почти к 5-кратному увеличению риска развития инсульта при применении апиксабана.
Как указано выше, в регистре ORBIT AF II снижение клиренса креатинина более чем на 20% в динамике наблюдалось у 23% из 6682 больных с ФП, примерно у трети из которых исходно диагностировали ХБП [12]. У 154 (3,7%) из 4120 больных, получавших ПОАК, имелись основания к снижению доз препаратов в соответствии с зарегистрированными инструкциями по применению. Тем не менее, дозы были снижены только у 20,1% из 154 пациентов. У пациентов, которые продолжили прием ПОАК в прежних дозах несмотря на ухудшение функции почек, частота геморрагических кровотечений в течение 1 года была выше, чем у пациентов, у которых доза ПОАК была снижена (большие кровотечения: 1,7% и 0%, соответственно, госпитализация по поводу кровотечения: 2,6% и 0%).
Следует отметить, что в клинических исследованиях функцию почек оценивали на основании расчетного клиренса креатинина, в то время как в клинической практике сегодня чаще рассчитывают СКФ по формуле CKD-EPI. Этот же показатель используют для определения стадии ХБП. Д.Н. Федорова и П.В. Лазарев сопоставили различные расчетные показатели функции почек у 47 пациентов с ФП, у 28 из которых имелась ХБП [35]. При сравнении рСКФ, рассчитанной по формулам MDRD и CKD-EPI, с клиренсом креатинина несоответствие категорий снижения функции почек наблюдалось в 23,4% и 27,6% случаев, соответственно, что могло привести как к необоснованному снижению дозы ПОАК, так и применению избыточной дозы. Сходные данные приводят и зарубежные авторы [36].
Таким образом, при лечении ПОАК необходимо регулярно контролировать функцию почек (по крайней мере один раз в год) на основании клиренса креатинина, так как именно этот показатель использовался в рандомизированных клинических исследованиях. При снижении клиренса креатинина необходимо корректировать дозу ПОАК, например, дозу ривароксабана снижают с 20 до 15 мг один раз в сутки, если клиренс креатинина составляет <50 мл/мин. У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно применять ПОАК, которые в меньшей степени выводятся почками (ривароксабан или апиксабан).
Заключение
У значительной части пациентов с ФП в динамике наблюдается ухудшение функции почек, хотя частота развития и прогрессирования ХБП в клинических исследованиях отличалась в зависимости от выбранных критериев оценки. Причины прогрессирования ХБП включают в себя возрастное снижение числа функционирующих клубочков, плохо контролируемые артериальную гипертонию и сахарный диабет, нарушения гемодинамики и т.п. Определенный вклад в прогрессирующее ухудшение функции почек могут вносить и эпизоды ОПП на фоне чрезмерной антикоагуляции. В ретроспективных исследованиях риск ОПП при применении ПОАК был ниже, чем при лечении варфарином. При назначении ПОАК пациентам с ФП необходимо регулярно контролировать функцию почек и своевременно снижать дозы этих препаратов в случае ее ухудшения. Результаты мета-анализов рандомизированных контролируемых исследований показали, что у больных с ФП и ХБП новые антикоагулянты имеют преимущества перед антагонистами витамина К по эффективности в профилактике неблагоприятных исходов и по крайней мере не уступают им по безопасности. В исследовании ROCKET AF лечение ривароксабаном у пациентов с ухудшающейся функции почек ассоциировалось со снижением частоты инсульта и системных эмболий по сравнению с таковой при приеме варфарина, в то время как частота больших и клинически значимых небольших кровотечений достоверно не отличалась между двумя группами. Способность ривароксабана уменьшать риск ухудшения функции почек показана также в наблюдательных исследованиях, что может свидетельствовать о целесообразности его использования у пациентов с ФП и сопутствующими заболеваниями. Приведенные данные обосновывают применение ривароксабана также у больных с ФП и ухудшающейся функцией почек.
Используемые источники
- Моисеев С.В., Киякбаев Г.Г., Фомин В.В. Новые пероральные антикоагулянты в профилактике инсульта у больных с фибрилляцией предсердий и хронической болезнью почек. Клин фармакол тер 2015;3:5-11. [Moiseev S, Kiyakbaev GG, Fomin VV. Novel oral anticoagulants in prevention of stroke in patients with atrial fibrillationa and chronic kidney disease. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2015;3:5-11 (In Russ.)].
- Lip GY, Andreotti F, Fauchier L, Huber K, Hylek E, Knight E, et al. European Heart Rhythm Association. Bleeding risk assessment and management in atrial fibrillation patients. Thromb Haemost 2011;106:997–1011.
- Baber U, Howard VJ, Halperin JL, et al. Association of chronic kidney disease with atrial fibrillation among adults in the United States: REasons for Geographic and Racial Differences in Stroke (REGARDS) Study. Circ Arrhythm Electro physiol 2011;4(1):26-32.
- Alonso A, Lopez FL, Matsushita K, et al. Chronic kidney disease is associated with the incidence of atrial fibrillation: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2011;123(25):2946-53
- Ощепкова Е.В., Долгушева Ю.А., Жернакова Ю.В. и др. Распространенность нарушения функции почек при артериальнои гипертонии (по данным эпидемиологического исследования ЭССЕ-РФ). Системные гипертензии. 2015;12(3):19–24 [Oshchepkova EV, Dolgusheva IuA, Zhernakova IuV, et al. The prevalence of renal dysfunction in arterial hypertension (in the framework of the ESSE-RF study). Systemic Hypertension 2015;12(3):19–24.
- Go AS, Fang MC, Udaltsova N, et al. Impact of proteinuria and glomerular filtration rate on risk of thromboembolism in atrial fibrillation. The Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. Circulation 2009;199: 1363-9.
- Atar I, Konas D, Acikel S, et al. Frequency of atrial fibrillation and factors related to its development in dialysis patients. Int J Cardiol 2006;106:47–51 Schmieder RE, Hilgers KF, Schlaich MP, Schmidt BM. Renin-angiotensin system and cardiovascular risk. Lancet 2007;369:1208–19.
- Lee M, Saver JL, Chang KH, et al. Low glomerular filtration rate and risk of stroke: meta-analysis. BMJ 2010;341:c4249.
- Zeng WT, Sun XT, Tang K, et al. Risk of thromboembolic events in atrial fibrillation with chronic kidney disease. Stroke 2015;46:157-63.
- Guo Y, Wang H, Zhao X, et al. Sequential changes in renal function and the risk of stroke and death in patients with atrial fibrillation. Intern J Cardiol 2013; 168(5):4678–84.
- Hu L, Xiong Q, Chen Z, et al. Factors associated with a large decline in renal function or progression to renal insufficiency in hospitalized atrial fibrillation patients with early-stage CKD. Int Heart J 2020 Mar 14. doi: 10.1536/ihj.19-205. [Epub ahead of print].
- Bansal N, Fan D, Hsu C, et al. Incident atrial fibrillation and risk of end-stage renal disease in adults with chronic kidney disease. Circulation 2013;127: 569-74.
- Inohara T, Holmes DN, Pieper K, et al. Decline in renal function and oral anticoagulation dose reduction among patients with atrial fibrillation. Heart 2020;106(5):358-64
- Romagnani P, Remuzzi G, Glassock R, et al. Chronic kidney disease. Nat Rev Dis Primers 2017;3:17088.
- Brodsky SV, Satoskar A, Chen J et al. Acute kidney injury during warfarin therapy associated with obstructive tubular red blood cell casts: a reportof 9 cases. Am J Kidney Dis 2009;54:1121–6.
- Brodsky SV, Nadasdy T, Rovin BH, et al. Warfarin-related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney Int 2011;80(2):181-9.
- An JN, Ahn SY, Yoon CH, et al. The occurrence of warfarin-related nephropathy and effects on renal and patient outcomes in korean patients. PLoS One 2013;8(4):e57661.
- de Aquino Moura KB, Behrens PMP, et al. Anticoagulant-related nephropathy: systematic review and meta-analysis. Clin Kidney J 2019;12(3):400-407.
- Brodsky S, Eikelboom J, Hebert LA. Anticoagulant-related nephropathy. J Am Soc Nephrol 2018;29(12):2787-93.
- Luo G, Ducy P, McKee M, et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature 1997;385:78–81.
- Andrews J, Psaltis PJ, Bayturan O, et al. Warfarin use is associated with progressive coronary arterial calcification: insights from serial intravascular ultrasound. JACC Cardiovasc Imaging 2018;11(9):1315-23.
- Lerner RG, Aronow WS, Sekhri A, et al. Warfarin use and the risk of valvular calcification. J Thromb Haemost 2009;7(12):2023-7.
- Lee J, Nakanishi R, Li D, et al. Randomized trial of rivaroxaban versus warfarin in the evaluation of progression of coronary atherosclerosis. Am Heart J 2018; 206:127-30.
- Win TT, Nakanishi R, Osawa K, et al. Apixaban versus warfarin in evaluation of progression of atherosclerotic and calcified plaques (prospective randomized trial). Am Heart J 2019;212:129-33.
- Gu ZC, Kong LC, Yang SF, et al. Net clinical benefit of non-vitamin K antagonist oral anticoagulants in atrial fibrillation and chronic kidney disease: a trade-off analysis from four phase III clinical trials. Cardiovasc Diagn Ther 2019;9(5):410-419.
- Bonnemeier H, Huelsebeck M, Kloss S. Comparative effectiveness of rivaroxaban versus a vitamin K antagonist in patients with renal impairment treated for nonvalvular atrial fibrillation in Germany - A retrospective cohort study.Int J Cardiol Heart Vasc 2019;23:100367.
- Yao X, Tangri N, Gersh BJ, et al. Renal outcomes in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol 2017;70(21):2621-32
- Coleman CI, Kreutz R, Sood N, et al. Rivaroxaban's impact on renal decline in patients with nonvalvular atrial fibrillation: A US MarketScan claims database analysis. Clin Appl Thromb Hemost 2019;25:1076029619868535.
- Chan YH, Yeh YH, Hsieh MY, et al. The risk of acute kidney injury in Asians treated with apixaban, rivaroxaban, dabigatran, or warfarin for non-valvular atrial fibrillation: A nationwide cohort study in Taiwan. Int J Cardiol 2018;265:83-9.
- GWT-TUD GmbH. Factor XA - Inhibition in RENal Patients With Non-valvular Atrial Fibrillation - Observational registry XARENO. NCT02663076. https://clinicaltrials.gov/ct2/show/NCT02663076#wrapper.
- Fordyce CB, Hellkamp AS, Lokhnygina Y, et al. On-treatment outcomes in patients with worsening renal function with rivaroxaban comparedwith warfarin: insights from ROCKET AF. Circulation 2016;134:37–47.
- Shroff GR, Stoecker R, Hart A. Non-vitamin K-dependent oral anticoagulants for nonvalvular atrial fibrillation in patients with CKD: Pragmatic considerations for the clinician.Am J Kidney Dis 2018;72(5):717-27.
- Yao X, Shah ND, Sangaralingham LR, et al. Non-vitamin K antagonist oral antcoagulant dosing in patients with atrial fibrillation and renal dysfunction.J Am Coll Cardiol 2017;69(23):2779-2790.
- Федорова Д.Н., Лазарев П.В. Значение методов оценки функции почек у пациентов с фибрилляцией предсердий для принятии решения о коррекции дозы прямых оральных антикоагулянтов. Клин фармакол тер 2019;28(3):21-24. [Fedorova DN, Lazarev PV. The role of various methods of kidney function assessment in dosing of oral anticoagulants in atrial fibrillation patients. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2019;28(3):21-4 (Im Russ.)].
- Hawkins NM, Jhund PS, Pozzi A, et al. Severity of renal impairment in patients with heart failure and atrial fibrillation: implications for non-vitamin K antagonist oral anticoagulant dose adjustment. Eur J Heart Fail 2016;18(9):1162–71.
