Роль полиморфных маркеров генов CYP2С19 (rs4244285 и rs4986893), CYP2D6 (rs3892097) и ABCB1 (rs1045642) в развитии седации при лечении блокатором Н1-гистаминовых рецепторов
Изучение роли полиморфных маркеров генов CYP2С19 (rs4244285 и rs4986893), CYP2D6 (rs3892097) и ABCB1 (rs1045642) в развитии седации при хроническом приеме блокаторов Н 1 -гистаминовых рецепторов у больных с аллергодерматозами.
В исследование были включены 50 пациентов с аллергодерматозами, которые получали терапию лоратадином в дозе 10-20 мг/сут в течение более 5 дней. Генотипирование CYP2С19*2 и *3 (rs4244285 и rs4986893), CYP2D6*4 (rs3892097), ABCB1*6 (rs1045642) осуществлялось методом полимеразной цепной реакции в режиме реального времени. Наличие и выраженность побочных реакций оценивали с помощью адресной методики В.М. Цветова и визуальной аналоговой шкалы (ВАШ).
Выраженность седации по ВАШ достоверно отличалась (р<0,05) между группами носителей генотипов GG и GA+AA по полиморфному маркеру rs4244285 гена CYP2С19 через 30 минут, 2, 4, 6, 8, 10 и 12 ч после приема очередной дозы препарата. В остальных группах статистических различий выраженности седации не выявлено (р>0,05). Величина эффекта седации, понимаемая как интегральная величина кривой седации, статистически значимо увеличивалась у носителей генотипов GA+AA по полиморфному маркеру rs4244285 гена CYP2С19 по сравнению с носителями генотипа GG за 2, 4, 6, 8, 10 и 12 ч (р<0,05). Статистически значимых различий в остальных группах выявлено не было (р>0,05).
Носительство аллельного варианта A по полиморфному маркеру rs4244285 гена CYP2С19 ассоциируется с увеличением выраженности седации по шкале ВАШ и величины эффекта седации.
Блокаторы Н1-гистаминовых рецепторов применяются для лечения многих аллергических заболеваний, в том числе кожи [1,2]. По классификации Европейской академии аллергии и клинической иммунологии (EAACI) от 2003 года все препараты данной группы можно разделить на 2 поколения: "седативные" (I поколение) и "неседативные" (II поколение) [2]. Бло ка торы Н1-гистаминовых рецепторов II поколения значительно превосходят предшественников по безопасности и эффективности. Одним из часто применяемых блокаторов Н1-гистаминовых рецепторов II поколения является лоратадин. Общая частота нежелательных побочных реакций (НПР) при лечении данным препаратом не превышает 14% [3]. Чаще всего встречаются головная боль, седация, сухость во рту и повышенная утомляемость [3-6]. Однако наличие и выраженность НПР, в частности седации, варьируются в широких пределах. Данные фармакогенетических исследований свидетельствуют о том, что изменчивость фармакологического ответа организма и развитие НПР при применении лекарственных средств на 20-96% [7,8] зависят от генетических особенностей системы биотрансформации ксенобиотиков, определяющей индивидуальную фармакокинетику препарата [9-14]. В метаболизме лоратадина участвуют изоферменты цитохрома Р450 CYP3A4, CYP2D6, CYP2C19, СYP1A1 и в меньшей степени CYP2C9, CYP1A2, CYP2B6, CYP2C8 и CYP3A5 [15] и Р-гликопротеин [16-20]. Фено ти пи ческие характеристики соответствующих генов определяют высокую изменчивость фармакологического ответа пациентов [4,15,21,22]. Изучение персонализированных подходов к повышению безопасности применения блокаторов Н1-гистаминовых рецепторов у пациентов с аллергическими заболеваниями кожи является одной из актуальных проблем современной дерматологии. Риск развития НПР при применении блокаторов Н1-гистаминовых рецепторов изучался в немногочисленных фармакогенетических исследованиях [1,17,22-34]. В частности, было установлено, что фактором риска развития седации при применении блокаторов Н1-гистаминовых рецепторов является носительство мутантных аллелей генов CYP2D6 [32] и АВСВ1 [17,23,24].
Целью исследования было изучение роли полиморфных маркеров генов CYP2С19 (rs4244285 и rs4986893), CYP2D6 (rs3892097) и ABCB1 (rs1045642) системы детоксикации ксенобиотиков в развитии седации при применении блокатором Н1-гистаминовых рецепторов в терапии аллергодерматозов.
Материал и методы
Критериями включения в открытое проспективное неконтролируемое нерандомизированное исследование, проводившееся на базе ООО КДЦ "Медиклиник" г. Пензы, были диагноз аллергодерматоза легкого или среднетяжелого течения, возраст от 18 до 60 лет, терапия блокатором Н1-гистаминовых рецепторов лоратадином в таблетированной форме в дозе 10-20 мг/сут более 5 дней, наличие подписанного информированного согласия на участие в исследовании и обработку персональных данных. Критериями невключения служили аллергический контактный дерматит и токсикодермия, аллергодерматозы тяжелого течения, противопоказания к назначению лоратадина, использование в качестве терапии иных блокаторов Н1-гистаминовых рецепторов, применение препаратов, влияющих на возникновение и выраженность НПР при применении лоратадина, тяжелая сопутствующая патология, депрессия (14 и более баллов по шкале депрессии Бека).
Исследование было одобрено Локальным этическим комитетом ГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России (Протокол №10 от 14.05.2018).
Исследование проводилось с мая 2018 года по апрель 2019 года в течение двух последовательных амбулаторных приемов с разницей в 5-7 дней. На первом приеме после установления диагноза и соответствия испытуемых критериям включения и невключения проводили анкетирование для оценки приверженности к лечению, выдавали анкеты для регистрации возникновения и выраженности НПР для самостоятельного заполнения на протяжении курса приема лоратадина, проводили забор венозной крови. На повторном приеме оценивали безопасность терапии. Для оценки безопасности лоратадина применяли анкетирование по авторской адресной методике В.М. Цветова [35] и оценку седации по визуальной аналоговой шкале (ВАШ).
Генотипирование проводили с использованием венозной крови, собранной в первый день исследования в вакуумные пробирки с ЭДТА-К3 IMPROVACUTER (Guangzhou Improve Medical Instruments Co., Ltd, Китай). Для изучения генетических полиморфизмов CYP2С19*2 и *3 (rs4244285 и rs4986893), CYP2D6*4 (rs3892097) и ABCB1*6 (rs1045642) применяли метод полимеразной цепной реакции в режиме реального времени. Пациентов распределяли на подгруппы с учетом наличия генотипов GG, GA и AA по полиморфному маркеру rs4244285 гена CYP2С19; генотипа GG по полиморфному маркеру rs4986893 гена CYP2С19; генотипов GG и GA по полиморфному маркеру rs3892097 гена CYP2D6; генотипов CC, CT и TT по полиморфному маркеру rs1045642 гена ABCB1.
Статистический анализ результатов проводился с помощью программ Statistica 13 и RStudio 1.0.136. При выборе метода учитывали нормальность распределения данных в выборках, оценку которой осуществляли с помощью теста Шапиро–Уилка. Различия считали статистически значимыми при р<0,05. Выбор метода статистической обработки определялся видом изучаемых признаков и характером решаемой задачи. Данные представлены в виде медианы и интерквартильного интервала (Me [Q1;Q3]). Сравнение частоты генотипов осуществляли с помощью теста χ2 Пирсона.
Результаты
В исследование были включены 50 пациентов, в том числе 15 мужчин и 35 женщин в возрасте от 18 до 60 лет (средний возраст 33,0±10,3 года).
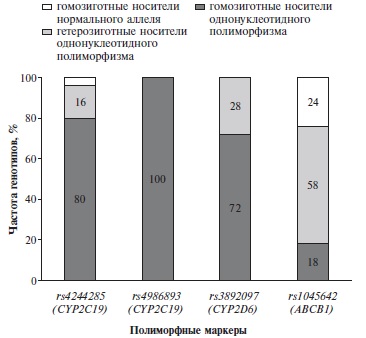
Распределение генотипов по изучаемым полиморфным маркерам представлено на рис. 1. По полиморфному маркеру rs4244285 гена CYP2С19 генотип GG выявили у 40 (80%) пациентов, GA – у 8 (16%), AA – у 2 (4%); распределение подчинялось закону Харди− Вайнберга (χ2=2,94, p=0,88). По полиморфному маркеру rs4986893 гена CYP2С19 все пациенты (100%) оказались носителями генотипа GG. По полиморфному маркеру rs3892097 гена CYP2D6 генотип GG имелся у 36 (72%) пациентов, GA – у 14 (28%); распределение подчинялось закону Харди−Вайнберга (χ2=1,33, p=0,86). По полиморфному маркеру rs1045642 гена ABCB1 генотип СС определялся у 9 (18%) пациентов, TC – у 29 (58%), TT – у 12 (24%); распределение подчинялось закону Харди−Вайнберга (χ2 =1,35, p=0,47).
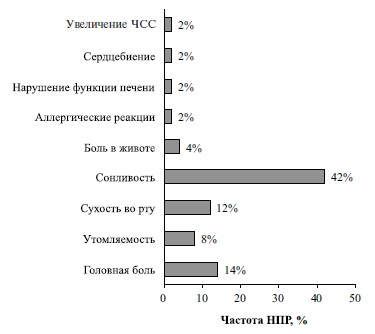
При анализе 50 анкет (по методике В.М. Цветова) были зарегистрированы 44 случая НПР (рис. 2). Чаще всего пациенты жаловались на сонливость (42%), реже – на головную боль (14%), сухость во рту (12%), утомляемость (8%), боль в животе (4%), аллергические реакции (2%), нарушение функции печени (2%), сердцебиение (2%), увеличение частоты сердечных сокращений (2%).
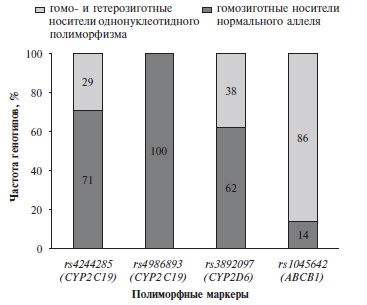
Среди пациентов, жаловавшихся на сонливость, генотип GG по полиморфному маркеру rs4244285 гена CYP2С19 выявили в 71% случаев и AA+GA – в 29%. По полиморфному маркеру rs4986893 у всех пациентов определялся генотип GG. По полиморфному маркеру rs3892097 гена CYP2D6 генотип GG имелся у 62% пациентов и GA – у 38%. По полиморфному маркеру rs1045642 гена ABCB1 генотип CC обнаружили у 14% пациентов и AA+GA – у 86%. Ассоциации между носительством генотипов по изучаемым полиморфным маркерам и развитием седации не выявлено (р>0,05). Распределение генотипов пациентов с седацией по изучаемым полиморфным маркерам представлено на рис. 3.
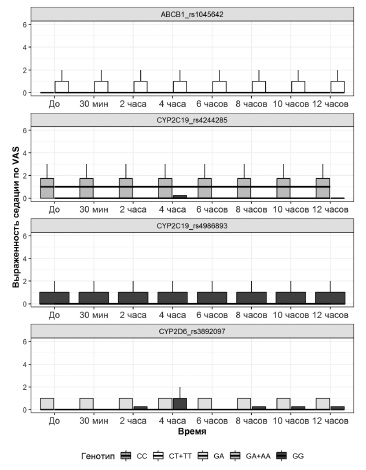
Выраженность седации (рис. 4), которую оценивали с помощью ВАШ у всех пациентов, отметивших данную НПР, до приема очередной дозы лоратадина была минимальной во всех группах, выделенных с учетом генотипа: rs4244285 гена CYP2С19 – 0 [0;0] (GG) и 1 [0;2] (GA+AA); rs4986893 гена CYP2С19 0 [0;1] (GG); rs3892097 гена CYP2D6 0 [0;0] (GG) и 0 [0;1] (GA); rs1045642 гена ABCB1 0 [0;0] (CC) и 0 [0;1] (CT+TT) и оставалась постоянной на протяжении всего периода наблюдения. Выраженность седации достоверно отли чалась (р<0,05) между группами носителей генотипов GG и GA+AA по полиморфному маркеру rs4244285 гена CYP2С19. В остальных группах статистических различий выраженности седации не выявлено (р>0,05).
Величина эффекта седации (интегральная величина кривой седации) при хроническом приеме препарата была рассчитана для различных временных промежутков (2, 4, 6, 8, 12 ч) и соотнесена с носительством генотипов по изучаемым полиморфным маркерам (табл. 1). Выявлено статистически значимое увеличение величины эффекта седации у носителей генотипов GA+AA по полиморфному маркеру rs4244285 гена CYP2С19 по сравнению с носителями генотипа GG во всех выбранных временных интервалах (р<0,05). Статистически значимых различий в остальных группах выявлено не было (р>0,05).
| Полиморфный маркер | Генотип | Срок после приема препарата | |||||
|---|---|---|---|---|---|---|---|
| 0-2 ч | 0-4 ч | 0-6 ч | 0-8 ч | 0-10 ч | 0-12 ч | ||
| rs4244285 | GG | 0 [0;0] | 0 [0;0,5] | 0 [0;1] | 0 [0;2] | 0 [0;3] | 0 [0;6] |
| (CYP2С19) | GA+AA | 2 [0;4] | 4 [0;8] | 6 [0;12] | 8 [0;16] | 10 [0;20] | 12 [0;12] |
| р | 0,017 | 0,024 | 0,024 | 0,028 | 0,028 | 0,042 | |
| rs4986893 | GG | 0 [0;2] | 0 [0;4] | 0 [0;6] | 0 [0;8] | 0 [0;10] | 0 [0;12] |
| (CYP2С19) | р | 1,000 | 1,000 | 1,000 | 1,000 | 1,000 | 1,000 |
| rs3892097 | GG | 0 [0;0,4] | 0 [0;2] | 0 [0;3] | 0 [0;4] | 0 [0;6] | 0 [0;10] |
| (CYP2D6) | GA | 0 [0;2] | 0 [0;4] | 0 [0;6] | 0 [0;8] | 0 [0;10] | 0 [0;12] |
| р | 0,24 | 0,296 | 0,296 | 0,288 | 0,288 | 0,276 | |
| rs1045642 | CC | 0 [0;0] | 0 [0;0] | 0 [0;0] | 0 [0;0] | 0 [0;0] | 0 [0;0] |
| (ABCB1) | CT+TT | 0 [0;2] | 0 [0;4] | 0 [0;6] | 0 [0;8] | 0 [0;10] | 0 [0;12] |
| р | 0,275 | 0,233 | 0,233 | 0,436 | 0,454 | 0,436 | |
Обсуждение
Результаты показали, что выраженность седации при постоянном приеме лоратадина отличается у пациентов с разными генотипами по полиморфному маркеру rs4244285 гена CYP2С19. У носителей генотипов GA и AA отмечалось статистически значимое увеличение выраженности седации по шкале ВАШ и величины эффекта седации по сравнению с таковой у носителей генотипа GG (р<0,05), что может указывать на более высокий риск развития НПР при терапия лоратадином у носителей аллельного варианта A. Ранее фармакогенетическое тестирование полиморфного маркера rs4244285 гена CYP2С19 с целью оценки риска развития сонливости и других НПР при применении блокаторов H1-гистаминовых рецепторов не проводилось.
Влияние генов, кодирующих систему детоксикации ксенобиотиков, на безопасность применения блокаторов H1-гистаминовых рецепторов изучалось и другими авторами. В исследовании П.В. Колхира и соавт. [23]
Cонливость при приеме блокаторов H1-гистаминовых рецепторов (исследуемый препарат фексофенадин) чаще наблюдалась у добровольцев с генотипом ТТ по полиморфному маркеру rs1045642 гена ABCB1 по сравнению с лицами с генотипом СС и СТ. В работах Y. Xiong и соавт. (исследуемый препарат рупатадин) [36] и K. Alzoubi (исследуемый препарат фексофенадин) [37] обнаружено влияние полиморфного маркера rs1045642 гена ABCB1 на снижение экспрессии Р-гликопротеина и изменение фармакодинамических и фармакокинетических характеристик блокаторов H1гистаминовых рецепторов. Влияние полиморфного маркера rs1065852 гена CYP2D6 на безопасность блокаторов H1-гистаминовых рецепторов определяли J. Saruwatari (исследуемый препарат хлорфенирамин) [32] и О. Yin (исследуемый препарат лоратадин) [38]. Наличие полиморфизма rs1065852 гена CYP2D6 приводило к изменению фармакокинетических характеристик блокаторов H1-гистаминовых рецепторов и повышению риска развития НПР. В нашем исследовании таких закономерностей не выявлено.
Основным ограничением исследования является небольшой объем выборки.
Заключение
Результаты показали, что носительство аллельного варианта A по полиморфному маркеру rs4244285 гена CYP2С19 сопряжено с увеличением выраженности седации по ВАШ и величины эффекта седации у пациентов с аллергодерматозами при длительном приеме лоратадина. Можно предположить, что носительство аллеля A по полиморфному маркеру rs4244285 гена CYP2С19 может приводить к замедлению скорости элиминации лоратадина и повышению риска развития НПР. Полученные результаты свидетельствуют о том, что генотипирование по полиморфному маркеру rs4244285 гена CYP2С19 является перспективным в изучении персонализированного подхода при терапии блокаторами Н1-гистаминовых рецепторов. Продемонстрировано также отсутствие влияния полиморфных маркеров CYP2D6*4 (rs3892097), ABCB1*6 (rs1045642) на профиль безопасности терапии лоратадином.
Используемые источники
- Застрожина А.К., Сычёв Д.А. Фармакогенетические аспекты профиля эффективности и безопасности блокаторов Н1-гистаминовых рецепторов в терапии аллергических заболеваний. Фармакогенетика и фармакогеномика. 2018;1:15–20 [Zastrozhina AK, Suchev DA. Pharmacogenetic aspects of efficacy and safety profile of Hl-histamine receptor blockers in the treatment of allergic diseases. Farmakogenetika i farmakogenomika. 2018;1:15-20 (In Russ)].
- Карева Е.Н. Выбор антигистаминного препарата: взгляд фармаколога. РМЖ 2016;12:811-16. [Kareva EN. Choosing an antihistamine: A pharmacologist's perspective. RMZh = Russian Medical Journal 2016;12:811-16 (In Russ.)].
- Physicians' Desk Reference. 50th Ed. Montvale, NJ: Medical Economics Co. 1996:2350.
- Абатуров А.Е. Лоратадин – антигистаминное средство II поколения. Здоровье ребенка. 2008;3(12):51-55. [Abaturov AE. Loratadine – an antihistamine of the II generation. Zdorove rebenka 2008;3(12):51-5 (In Russ.)].
- Регистр лекарственных средств России. РЛС. [Электронный ресурс]. URL: https://www.rlsnet.ru (дата обращения: 12.05.2018). [Registr lekarstvennykh sredstv Rossii RLS. [Internet]. Russia. [cited 2018 May 12]. Available from: https://www.rlsnet.ru (In Russ.)].
- Pacor ML, Biasi D, Girelli D, et al. Effectiveness of loratadine vs. placebo in the treatment of urticaria-angioedema syndrome in patients with food allergy. Clin Ter 1993;142(6):529-32.
- Сычев Д.А. Клиническая фармакогенетика как путь к персонализированной медицине: оправданы ли надежды? Клин фармакол тер 2005;14(5):7783 [Sychev DA. Clinical pharmacogenetics as a way to personalized medicine: are the expectations justified? Klinicheskaya farmakologiya i terapiya = Clin. Pharmacol. Ther. 2005;14(5):77-83 (In Russ.)].
- Ingelmen-Sundberg M. The human genome project and novel aspects of Cytochrome P450 research. Tox Appl Pharmacol 2005;207:52-6.
- Абдрашитов Р.Х., Гильдеева Г.Н., Раменская Г.В. и др. Обзор существующих методик оценки активности CYP2D6 с применением экзогенных и эндогенных маркеров. Фармакокинетика и фармакодинамика 2015;1:4-11
- [Abdrashitov RKh, Gildeeva GN, Ramenskaya GV, et al. A review of existing methods for assessing the activity of CYP2D6 using exogenous and endogenous markers. Farmakokinetika i farmakodinamika = Pharmacokinetics and Pharmacodynamics 2015;1:4-11 (In Russ.)].
- Иващенко Д.В. Безопасность применения транквилизаторов из группы бензодиазепинов при синдроме отмены алкоголя. Москва, 2017; 24 с. [Ivashchenko DV. The safety of the use of tranquilizers from the benzodiazepine group for alcohol withdrawal syndrome. Moscow, 2017;24 p. (In Russ.)].
- Каркищенко Н.Н., Хоронько В.В., Сергеева Л.А. и др. Фармакокинетика. Ростов-на-Дону: Феникс, 2001, 383. [Karkishchenko NN, Khoronko VV, Sergeeva LA., et al. Pharmacokinetics. 2001, 383 p. (In Russ.)].
- Сычев Д.А., Раменская Г.В., Игнатьев И.В. и др. Клиническая фармакогенетика. Под ред. В.Г. Кукеса, Н.П. Бочкова. ГЭОТАР-Медиа; 2007; 118-130.
- Середенин С.Б. Лекции по фармакогенетике. Москва, МИА, 2004, 303 [Seredenin SB. Lectures on pharmacogenetics. Moscow, 2004;303 (In Russ.)].
- Levy RH, Thummel КE, Trager WF, et al. Metabolic Drug Interactions. Philadelphia: Lippincott Williams & Wilkins;2000:793.
- Ghosal A, Gupta S. Ramanathan R, et al. Metabolism of loratadine and further characterization of its in vitro metabolites. Drug Metab Lett 2009;3:162-70.
- Клиническая фармакология: учебник для вузов. Под ред. В. Г. Кукеса. 4-е издание. М., 2009; 1056 с.
- Колхир П.В. Клиническое значение изучения активности транспортера лекарственных средств гликопротеина-Р для оптимизации фармакотерапии. Москва, 2007;105 c. [Kolkhir PV. The clinical significance of the study of the activity of the transporter of glycoprotein-R drugs to optimize pharmacotherapy. Moscow; 2007; 105 p. (In Russ.)].
- Ташенова А.И. Транспортная система гликопротеина-Р и фармакокинетика лекарственных средств. Биомедицина. 2010;4:24–32. [Tashenova AI. Transport system glycoprotein-P and pharmacokinetics of generic drugs. Biomedicine 2010;4:24–32. (In Russ.)].
- Li C, Choi BC, Kim DK, et al. Effects of curcumin on the pharmacokinetics of loratadine in rats: possible role of CYP3A4 and P-glycoprotein inhibition by curcumin. J Appl Pharmacol 2011;19(3):364-70.
- Yumibe N, Huie K, Chen KJ, et al. Identification of human liver cytochrome P450 enzymes that metabolize the nonsedating antihistamine loratadine. Formation of descarboethoxyloratadine by CYP3A4 and CYP2D6. Biochem Pharmacol 1996;51:165–72.
- Фомина Д.С., Горячкина Л.А. Выбор антигистаминного препарата с позиции доказательной медицины. Эффективная фармакотерапия 2012;6:18-24
- [Fomina DS, Goryachkina LA. The choice of an antihistamine in terms of evidence-based medicine. Effektivnaya farmakoterapiya 2012;6:18-24 (In Russ)].
- Yin OQ, Shi XJ, Tomlinson B, et al. Effect of СYP2D6*10 allele on the pharmacokinetics of loratadine in chinese subjects. Drug Metab Dispos 2005;33(9): 1283–87.
- Колхир П.В., Игнатьев И.В., Сычев Д.А. и др. Влияние носительства генотипов по полиморфному маркеру С3435Т гена MDR1, кодирующего гликопротеид-P, на фармакокинетику блокатора Н1-гистаминовых рецепторов III поколения фексофенадина. Аллергология и иммунология 2006; 7(3):279a–279. [Kolkhir PV, Ignatev IV, Sychev DA, et al. The effect of genotype carriage on the polymorphic marker C3435T of the MDR1 gene encoding glycoprotein-P on the pharmacokinetics of the blocker of H1-histamine receptors of the third generation of fexofenadine. Allergologiya i immunologiya = Allergology and Immunology. 2006;7(3):279a–279. (In Russ.)].
- Сычёв Д.А., Игнатьев И.В., Раменская Г.В., и др. Значение полиморфизма гена MDR1, кодирующего гликопротеин-Р, для индивидуализации фармакотерапии. Клин фармакол тер 2005;14(1):1–5 [Sychev DA, Ignatiev IV, Ramenskaya GV, et al. The importance of the polymorphism of the MDR1 gene encoding glycoprotein-P for individualization of pharmacotherapy. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2005;14(1):1–5 (In Russ.)].
- Alzoubi KH, Khabour OF, Al-Azzam SI, et al. The role of multidrug resistance-1 (MDR1) variants in response to fexofenadine among Jordanians. Int J Clin Pharmacol Ther 2013;51(11):880–87.
- Ambudkar SV, Kimchi-Sarfaty C, Sauna ZE, et al. P-glycoprotein: from geno mics to mechanism. Oncogene 2003;22(47):7468–85.
- Daly AK. Pharmacogenetics of the cytochromes P450. Curr Topics Med Chem 2004;4:21.
- Drescher S, Schaeffeler E, Hitzl M, et al. MDR1 gene polymorphisms and disposition of the P-glycoprotein substrate fexofenadine. Br J Clin Pharmacol 2002;53(5):526–34.
- Kim RB, Leake BF, Choo EF, et al. Identification of functionally variant MDR1 alleles among European Americans and African Americans. Clin Pharmacol Ther 2001;70:189–99.
- Lessard E, Yessine MA, Hamelin BA, et al. Diphenhydramine alters the disposition of venlafaxine through inhibition of CYP2D6 activity in humans. J Clin Psychopharmacol 2001;21:175-84.
- Li P, Wei MJ, Zhang ZY, et al. Effects of UGT1A1, CYP3A5 and ABCB1 genetic variants on pharmacokinetics of antihistamine drug mizolastine in Chinese healthy volunteers. Basic Clin Pharmacol Toxicol 2018;123:464–73.
- Saruwatari J, Matsunaga M, Ikeda K, et al. Impact of CYP2D6*10 on H1-antihistamine-induced hypersomnia. Eur J Clin Pharmacol 2006;62(12):995–1001.
- Yasuda SU, Zannikos P, Young AE. The roles of CYP2D6 and stereoselectivity in the clinicalpharmacokinetics of chlorpheniramine maleate. Br J Clin Pharmacol 2002;53:519–25.
- Yi SY, Hong KS, Lim HS, et al. A variant 2677A allele of the MDR1 gene affects fexofenadine disposition. Clin Pharmacol Ther 2004;76(5):418-27.
- Цветов В.М. Мониторинг неблагоприятных побочных реакций лекарственных препаратов в амбулаторно-поликлиническом учреждении на современном этапе. Челябинск, 2007:73-87. [Tsvetov VM. Monitoring adverse drug reactions in an outpatient facility at the present stage. Chelyabinsk. 2007:73-87 (In Russ.)]
- Xiong Y, Yuan Z, Yang J, et al. CYP3A5*3 and MDR1 C3435T are influencing factors of inter-subject variability in rupatadine pharmacokinetics in healthy Chinese volunteers. Eur J Drug Metab Pharmacokinet 2016 ;41(2):117–24.
- Alzoubi KH, Khabour OF, Al-Azzam SI, et al. The role of multidrug resistance-1 (MDR1) variants in response to fexofenadine among Jordanians. Int J Clin Pharmacol Ther 2013;51(11):880–7.
- Yin OQ, Shi XJ, Tomlinson B, et al. Effect of cyp2d6*10 allele on the pharmacokinetics of loratadine in chinese subjects. Drug Metab Dispos 2005;33(9):1283–7.
