Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии
Изучение летальности и факторов риска смерти больных с COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии (ОРИТ) лечебных учреждений Российской Федерации.
Ретроспективное исследование было выполнено в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых пациентов с COVID-19 на базе Первого МГМУ им. И.М. Сеченова. В исследование включали всех пациентов с известными исходами (смерть от любых причин или выздоровление) SARS-CoV-2 пневмонии, осложнившейся острым респираторным дистресс синдромом (ОРДС), которые были проконсультированы с 16 марта по 3 мая 2020 г. Факторы риска смерти анализировали с помощью многофакторной регрессионной модели Кокса.
В исследование были включены 1522 пациента, 864 (56,8%) мужчины и 658 (43,2%) женщин. Медиана возраста – 62 года. 922 (60,6%) больных находились в ОРИТ стационаров Москвы и Московской области, 600 (39,4%) – лечебных учреждений в 70 регионах Российской Федерации. У 995 (65,4%) больных диагноз SARS-CoV-2 инфекции был подтвержден с помощью ПЦР. Умерли 995 (65,4%) пациентов, выжили 527 (34,6%). Основными причинами смерти были ОРДС (93,2%), серКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (3) дечно-сосудистые осложнения (3,7%) и тромбоэмболия легочной артерии (1,0%). Летальность была низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно повышалась у больных, которых приходилось переводить на неинвазивную (36,8%) или инвазивную (76,5%) вентиляцию легких. Риск смерти увеличивался с возрастом и в возрастных группах старше 50 лет у мужчин был достоверно выше, чем у женщин. В однофакторных моделях заболеваниями, ассоциировавшимися с развитием летального исхода, были артериальная гипертония, ИБС, инсульт, фибрилляция предсердий, сахарный диабет 2 типа, ожирение и солидные опухоли, однако в многофакторной модели, построенной по всем признакам с коррекцией по полу и возрасту, статистическое значение сохранили только ИБС (отношение рисков [ОР] 1,257, 95% доверительный интервал [ДИ] 1,064-1,485, p=0,007), сахарный диабет 2 типа (ОР 1,300, 95% ДИ 1,131-1,494, p<0,0001) и ожирение (ОР 1,347, 95% ДИ 1,166-1,556, p<0,0001).
Основными факторами риска смерти больных с COVID-19, переведенных в ОРИТ для респираторной поддержки, были тяжесть ОРДС, прежде всего необходимость в ИВЛ, пожилой возраст, мужской пол, а также ИБС, ожирение и сахарный диабет 2 типа.
Вдекабре 2019 г. в Китае началась вспышка инфекции, вызванной SARS-CoV-2 (severe acute respiratory syndrome coronavirus-2) и получившей название COVID-19 (Coronavirus disease 2019) [1]. В течение последующих 6 мес общее число подтвержденных случаев новой коронавирусной инфекции в мире превысило 18 млн и продолжает быстро увеличиваться, особенно в США, странах Южной Америки и Индии. Только в июле 2020 г. в мире было зарегистрировано более 7 млн новых случаев SARS-CoV-2 инфекции. Хотя санитарно-эпидемиологические меры, которые в том или ином объеме предпринимаются во всех странах, охваченных пандемией COVID-19, позволяют ограничить распространение инфекции, их неизбежное ослабление сопровождается новым ростом заболеваемости (“второй волной"). В связи с этим основные надежды в борьбе с пандемией связывают с вакцинацией. В настоящее время в различных странах, включая Россию, разрабатываются почти 200 вакцин-кандидатов против SARS-CoV-2 [2]. Недавно были опубликованы обнадеживающие результаты клинических исследований 1-2 фазы вакцин, разработанных в России, Великобри тании, США или Китае [3-6]. В рандомизированном контролируемом исследовании у 1077 здоровых добровольцев в возрасте 18-55 лет однократное введение рекомбинантной векторной вакцины ChAdOx1, содержащей ген белка S( spike) SARS-CoV-2 (университет Оксфорда, Великобритания), вызывало образование нейтрализующих антител в достаточном титре в 91% случаев и Т-клеточный ответ в 100% [4]. Достигнутый эффект сохранялся через 56 дней. Вакцинация часто вызывала развитие местных и общих нежелательных реакций, однако они не были тяжелыми и обычно контролировались парацетамолом. В августе 2020 г. в Российской Федерации была зарегистрирована первая отечественная вакцина против SARS-CoV-2, которая состоит из двух рекомбинантных аденовирусных векторов, несущих ген белка S вируса SARS-CoV-2. В двух открытых неконтролируемых исследованиях 1/2 фазы у 76 здоровых добровольцев введение вакцины вызывало мощный гуморальный и клеточный ответ и хорошо переносилось [6]. Основными нежелательными явлениями были боль в месте инъекции (58%), повышение температуры тела (50%), головная боль (42%), астения (28%) и боль в мышцах и суставах (24%). Серьезных нежелательных явлений не зарегистрировали.
У большинства больных COVID-19 характеризуется легким или бессимптомным течением, однако у части пациентов наблюдается развитие вирусной пневмонии, которая может осложниться острым респираторным дистресс синдромом (ОРДС) и полиорганной недостаточностью [7]. В Китае доля пациентов, которым потребовался перевод в отделение реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки, среди госпитализированных больных с COVID19 варьировалась от 5% до 32% [8,9], в Ломбардии (Италия) в ОРИТ были госпитализированы 9% из 17713 пациентов с подтвержденной SARS-CoV-2 инфекцией [10], а в Чикаго (США) – 6,1% из 8673 больных [11] По данным исследований, проводившихся в Китае и других странах, риск более тяжелого течения COVID-19 выше у людей старшего возраста, страдающих различными сопутствующими заболеваниями, прежде всего сердечно-сосудистыми, сахарным диабетом и ожирением [12-16]. Сходные результаты были получены в нашем ретроспективном исследовании, в которое были включены более 1000 пациентов с тяжелой и крайней тяжелой SARS-CoV-2 пневмонией, госпитализированных в ОРИТ лечебных учреждений Российской Федерации для респираторной поддержки [17]. Около половины из них были в возрасте старше 60 лет, а более чем у 2/3 пациентов имелись различные сопутствующие заболевания, в том числе артериальная гипертония и другие сердечно-сосудистые болезни, сахарный диабет, ожирение и др. У каждого пятого больного с тяжелым течением COVID-19 наблюдалось раннее развитие септического шока, факторами риска которого были возраст старше 50 лет и наличие трех сопутствующих заболеваний [18]. Мы не анализировали летальность больных в российских ОРИТ, так как исследование проводилось вскоре после начала вспышки SARS-CoV2 инфекции в Российской Федерации, а исходы заболевания у большинства пациентов еще не были известны вследствие непродолжительного срока наблюдения. Необходимо отметить, что в регулярно публикуемые статистические показатели включают данные о летальности больных только с подтвержденной SARS-CoV-2 инфекцией, в то время как у значительной части госпитализированных пациентов со средне-тяжелым или тяжелым течением COVID-19 результаты полимеразной цепной реакции (ПЦР) оказываются отрицательными, а диагноз устанавливают на основании клинической картины, эпидемиологического анамнеза и данных компьютерной томографии (КТ) органов грудной клетки. В нашей когорте доля таких пациентов составила около 40% [17]. Соответственно, исследования, которые проводятся в обычной клинической практике, позволяют получить более точное представление об исходах COVID-19.
Целью настоящего ретроспективного исследования было изучение летальности и факторов риска смерти больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ лечебных учреждений Российской Федерации.
Материал и методы
Ретроспективное исследование было выполнено в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых на базе Первого МГМУ им. И.М. Сеченова. Анализировали заявки на консультацию больных с тяжелым течением COVID-19, поступавшие в центр по интернет из ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В исследование включали всех пациентов с COVID-19, которым потребовалась респираторная поддержка, независимо от результата ПЦР. Если результаты вирусологического исследования были отрицательными, сомнительными или отсутствовали, то диагноз устанавливали на основании клинических признаков острой респираторной инфекции, осложнившейся острой дыхательной недостаточностью, в сочетании с характерными данными компьютерной томографии (КТ) органов грудной клетки при отсутствии других этиологических факторов [19].
На основании полученных заявок оценивали демографические показатели, сопутствующие заболевания (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция), данные КТ легких, уровень респираторной поддержки (оксигенотерапия, неинвазивная вентиляция легких [НИВЛ], искусственная вентиляция легких [ИВЛ] без признаков септического шока, ИВЛ в сочетании с септическим шоком [полиорганная недостаточность и необходимость в вазопрессорной поддержке]). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аорто-коронарное шунтирование) в анамнезе. Хроническую сердечную недостаточность не учитывали в связи с высокой вероятностью гипердиагностики этого состояния. Ожирение диагностировали на основании индекса массы тела: <25,0 кг/м2 – нормальная масса тела, 25,0-29,9 кг/м2 – избыточная масса тела, 30,0-34,9 кг/м2 – ожирение 1 степени, 35,039,9 кг/м2 – 2 степени и ≥40,0 кг/м2 – 3 степени. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты. Степень выраженности изменений на КТ легких оценивали с учетом распространенности и характера поражения [17].
Исходы (смерть или выздоровление) определяли с помощью базы данных COVID-19, которая создана в Российской Федерации по решению Министерства здравоохранения. В эту базу данных включается информация о всех пациентах, у которых установлен диагноз COVID-19, в том числе вероятный. Если исход заболевания в базе данных не был зафиксирован, то запрашивали соответствующее лечебное учреждение. Пациентов, у которых продолжалась респираторная поддержка на момент анализа, в исследование не включали.
Статистический анализ. Описательный статистический анализ проводился с использованием программы IBM SPSS Statistics 22 (IBM Corporation, США). Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Данные для количественных показателей представлены в виде среднего арифметического и стандартного отклонения (при нормальном распределении) или в виде медианы и межквартильного размаха (при отклонении распределения от нормального). Данные для качественных переменных представлены в виде абсолютных значений и доли в процентах. Медианы количественных показателей сравнивали с помощью U-критерия Манна-Уитни (при сравнении двух групп). Сравнение групп по качественным признакам проводилось с помощью критерия χ2-Пирсона (при количестве наблюдений в группе ≥10) и точного критерия Фишера (при количестве наблюдений в группе <10). Расчет отношения рисков (ОР) для факторов, ассоциированных с развитием летального исхода, проводили с помощью регрессионной модели Кокса. Исходную однофакторную модель корректировали по полу и возрасту (Модель 1), а также проводили многофакторный анализ по всем признакам с коррекцией по полу и возрасту (Модель 2). В основной модели пациентов с ожирением сравнивали с больными с нормальной и избыточной массой тела. При анализе зависимости риска смерти от степени увеличения массы тела с помощью модели Кокса пациентов с избыточной массой тела или ожирением разной степени сравнивали с больными с нормальной массой тела. Различия считали достоверными при величине p<0,05. Все результаты приведены с двусторонним уровнем значимости.
Результаты
Демографические показатели. Федеральный дистанционный консультативный центр анестезиологии и реаниматологии для взрослых на базе Первого МГМУ им. И.М. Сеченова был создан по приказу Минздрава РФ 16 марта 2020 г. С этого времени в центр ежедневно поступает по 100-180 заявок на консультацию больных с диагнозом COVID-19, госпитализированных в ОРИТ. В целом на 16 августа 2020 г. в центре проконсультированы 11829 больных, в том числе 3100 из Москвы, 909 из Московской области и 7820 из других регионов Рос сийской Федерации. Из этой когорты были отобраны первые 1522 пациента с известными исходами, которые были проконсультированы до 3 мая 2020 г. Наблюдение за пациентами с момента госпитализации в инфекционный стационар до развития конечной точки (летальный исход или выписка из стационара) проводили до 7 июля 2020 г. Медиана длительности наблюдения составила 16 (9; 27) дней.
Доля мужчин среди обследованных больных несколько превышала долю женщин (табл. 1). Женщины были достоверно старше мужчин (средний возраст 64,4±13,4 и 59,1±13,8 лет, соответственно; р<0,0001). Около 60% больных находились в стационарах Москвы и Московской области, остальные – в лечебных учреждениях в 70 регионах Российской Федерации. У 65,4% больных диагноз SARS-CoV-2 инфекции был подтвержден с помощью ПЦР, а в остальных случаях установлен на основании клинической картины и результатов КТ органов грудной клетки.
| Параметры | Значения |
|---|---|
| Возраст, лет; Me (IQR) | 62 (53;7) |
| Мужчины, n (%) | 864 (56,8) |
| Регион, n (%) | |
| Москва | 740 (48,6) |
| Московская область | 182 (12,0) |
| Другие регионы | 600 (39,4) |
| Положительная ПЦР на SARS-CoV-2, n (%) | 995 (65,4) |
| Респираторная поддержка, n (%) | |
| Оксигенотерапия | 199 (13,1) |
| НИВЛ | 95 (6,2) |
| ИВЛ без шока | 944 (62,0) |
| ИВЛ и признаки септического шока | 284 (18,7) |
| ЭКМО | 7 (0,5) |
| Сердечно-сосудистые заболевания, n (%) | 976 (64,1) |
| Артериальная гипертония | 905 (59,5) |
| ИБС | 234 (15,4) |
| Инсульт в анамнезе | 113 (7,4) |
| Фибрилляция предсердий | 161 (10,6) |
| Сахарный диабет 2 типа, n (%) | 406 (26,7) |
| Ожирение, n (%) | 396 (26,0) |
| Бронхиальная астма, n (%) | 35 (2,3) |
| ХОБЛ, n (%) | 78 (5,1) |
| Солидные опухоли, n (%) | 63 (4,1) |
| Гемобластозы, n (%) | 27 (1,8) |
| Ревматические заболевания, n (%) | 17 (1,1) |
| ВИЧ-инфекция, n (%) | 6 (0,4) |
Клиническая характеристика пациентов. У всех больных наблюдалась картина ОРДС в виде двусторонней полисегментарной пневмонии 3-4 стадии и острой дыхательной недостаточности, требовавшей респираторной поддержки. Примерно 80% больных были переведены на ИВЛ в связи с нарастающей острой дыхательной недостаточностью, которую не удавалось контролировать оксигенотерапией или НИВЛ. Почти у каждого пятого пациента отмечено развитие септического шока, характеризовавшегося полиорганной недостаточностью и необходимостью в вазопрессорной поддержке. Доля пациентов, находившихся на ИВЛ, в Москве и Московской области была выше (86,5% и 88,5%), чем в других регионах Российской Федерации (66,3%), а доля больных, которым потребовалась только оксигенотерапии, в московском регионе была, наоборот, в несколько раз ниже (4,9%, 8,2% и 24,7%, соответственно).
У большинства больных имелись различные сопутствующие заболевания. Чаще всего встречались артериальная гипертония (59,5%), сахарный диабет 2 типа (26,7%) и ожирение (26,0%), несколько реже – ИБС (15,4%), инсульт в анамнезе (7,4%), фибрилляция предсердий (10,6%) и ХОБЛ (5,1%). Частота других заболеваний, в том числе бронхиальной астмы, злокачественных новообразований, ревматических аутоиммунных заболеваний и ВИЧ-инфекций была низкой и не превышала 5%.
У 363 (23,9%) пациентов не были выявлены сопутствующие заболевания, у 395 (26,0%) – имелось по крайней мере одно заболевание, у 383 (25,3%) – два, у 379 (24,9%) – три и более.
Выживаемость пациентов. За период наблюдения умерли 995 (65,4%) пациентов, выжили 527 (34,6%). Медиана выживаемости пациентов, рассчитанная методом Каплана-Майера, составила 17 (15,7; 18,2) дней (рис. 1). С момента госпитализации в стационар 14- и 28-дневная выживаемость пациентов равнялась 56,0% и 36,4%, соответственно. В Москве за период наблюдения умерли 551 (74,5%) из 740 человек, в Московской области – 143 (78,6%) из 182, в других регионах – 301 (50,2%) из 600.
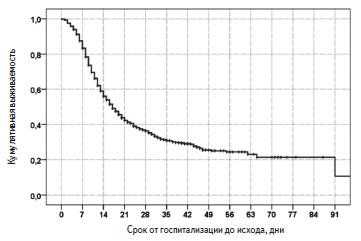
Причины летального исхода включали в себя ОРДС (93,2%), сердечно-сосудистые осложнения (3,7%), тромбоэмболию легочной артерии (1,0%), осложнения онкологических заболеваний (0,9%), “септические" осложнения (0,7%), осложнения цирроза печени (0,3%), осложнения ВИЧ-инфекции (0,1%) и туберкулез (0,1%).
Летальность пациентов, находившихся на оксигенотерапии, составила 10,1% (20/199), НИВЛ – 36,8% (35/95), ИВЛ – 76,5% (940/1228). Самой высокой летальность была среди пациентов, у которых имелись признаки септического шока – 86,6% (246/284). Медиана длительности ИВЛ у умерших пациентов равнялась 6 (3; 12) дней, а медиана длительности ИВЛ до экстубации у выживших пациентов – 13 (7; 21) дней. Среди пациентов, у которых диагноз SARS-CoV-2 инфекции, был подтвержден и не был подтвержден с помощью ПЦР, летальность не отличалась – 63,5% и 68,9%, соответственно.
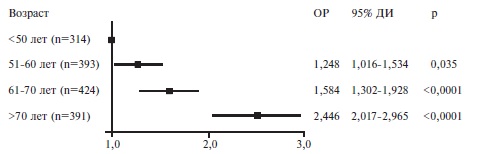
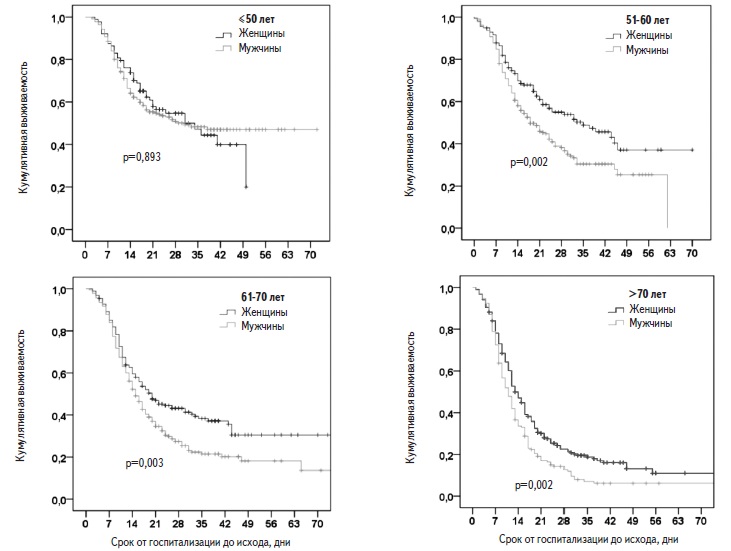
Факторы риска смерти. Пациенты, у которых наступил летальный исход, были старше выживших больных (табл. 2). В регрессионной модели Кокса риск смерти у пациентов старше 50 лет был достоверно выше, чем у больных более молодого возраста, и достигал максимума у пациентов старше 70 лет (рис. 2). Выживаемость в значительной степени зависела как от возраста, так и от пола. Среди пациентов старше 50 лет выживаемость у мужчин была достоверно ниже, чем у женщин, однако среди пациентов в возрасте ≤50 лет выживаемость не различалась у мужчин и женщин (рис. 3).
| Параметры | Выжившие (n=527) | Умершие (n=995) | p |
|---|---|---|---|
| Возраст, лет; Me (IQR) | 56 (48; 64) | 65 (56; 74) | <0,0001 |
| Мужчины, n (%) | 282 (53,5) | 582 (58,5) | 0,065 |
| Респ. поддержка, n (%) | |||
| Оксигенотерапия | 179 (34,0) | 20 (2,0) | <0,0001 |
| НИВЛ | 60 (11,4) | 35 (3,5 | <0,0001 |
| ИВЛ без признаков шока | 250 (47,4) | 694 (69,7) | <0,0001 |
| ИВЛ с признаками шок | 38 (7,2 | 246 (24,8) | <0,0001 |
| ЭКМО | 0 | 7 (0,7) | 0,103 |
| Сердечно-сосудистые заболевания, n (%) |
269 (51,0) | 707 (71,1) | <0,0001 |
| Артериальная гипертония | 260 (49,3) | 645 (64,8) | <0,0001 |
| ИБС | 41 (7,8) | 193 (19,4) | <0,0001 |
| Инсульт | 27 (5,1) | 86 (8,6) | 0,013 |
| Фибрилляция предсердий | 21 (4,0) | 140 (14,1) | <0,0001 |
| Сахарный диабет 2 типа, n (%) | 97 (18,4) | 309 (31,1) | <0,0001 |
| Ожирение, n (%) | 120 (22,8) | 276 (27,7) | 0,037 |
| Бронхиальная астма, n (%) | 12 (2,3) | 23 (2,3) | 1,000 |
| ХОБЛ, n (%) | 17 (3,2) | 61 (6,1) | 0,014 |
| Солидные опухоли, n (%) | 10 (1,9) | 53 (5,3) | 0,001 |
| Гемобластозы, n (%) | 8 (1,5) | 19 (1,9) | 0,686 |
| Ревм. заболевания, n (%) | 4 (0,8) | 13 (1,3) | 0,445 |
| ВИЧ-инфекция, n (%) | 2 (0,4) | 4 (0,4) | 1,000 |
Умершие пациенты достоверно чаще нуждались в ИВЛ, чем выжившие больные (94,5% и 54,4%, соответственно), в то время как доля пациентов, находившихся на оксигенотерапии или НИВЛ, в первой группе была значительно ниже, чем во второй (5,6% и 45,4%). Кроме того, в группе умерших пациентов была примерно в 3 раза выше частота развития септического шока. В группе больных, у которых наступил летальный исход, частота сердечно-сосудистых заболеваний, сахарного диабета 2 типа, ожирения, ХОБЛ и солидных опухолей превышала таковую в группе выздоровевших пациентов, в то время как частота бронхиальной астмы, гемобластозов, ревматических аутоиммунных заболеваний и ВИЧ-инфекции была сопоставимой в двух группах.
В однофакторных регрессионных моделях Кокса заболеваниями, ассоциировавшимися с развитием летального исхода, были артериальная гипертония, ИБС, инсульт, фибрилляция предсердий, сахарный диабет 2 типа, ожирение и солидные опухоли, однако после внесения поправки на пол и возраст в исходную модель (Модель 1) статистическую значимость сохранили только ИБС, фибрилляция предсердий, сахарный диабет и ожирение (табл. 3). При построении многофакторной модели по всем признакам с коррекцией по полу и возрасту (Модель 2) значимыми факторами, ассоциирующимися с летальным исходом, были ИБС, сахарный диабет и ожирение (табл. 3). В многофакторной модели Кокса риск развития летального исхода после внесения поправки на пол и возраст был повышен у пациентов со 2 (n=114) и 3 (n=126) степенью ожирения (ОР; 1,448; 95% ДИ 1,145-1,831; р=0,002 и 1,666; 1,341-2,069; р<0,0001, соответственно) по сравнению с таковым у пациентов без ожирения. В то же время риск смерти с поправкой на пол и возраст не различался у пациентов с избыточной массой тела (n=58) и 1 степенью (n=113) ожирения (ОР; 1,222; 95% ДИ 0,891-1,675; р=0,213 и 1,067; 0,826-1,377; р=0,620, соответственно) и больных без ожирения.
| Фактор | Исходная модель | Модель 1 | Модель 2 | |||
|---|---|---|---|---|---|---|
| ОР; 95% ДИ | p | ОР; 95% ДИ | p | ОР; 95% ДИ | p | |
| Примечание: Исходная модель: однофакторный анализ; *анализ двух признаков совместно – пол и возраст; Модель 1: многофакторный анализ каждого признака по отдельности с коррекцией по полу и возрасту; Модель 2: многофакторный анализ по всем признакам с коррекцией по полу и возрасту | ||||||
| Пол (мужской) | 1,167; 1,029-1,324 | 0,016 | 1,358*; 1,194-1,545 | <0,0001 | 1,403; 1,229-1,601 | |
| Возраст, лет | 1,011; 1,007-1,015 | <0,0001 | 1,027*; 1,022-1,031 | <0,0001 | 1,024; 1,019-1,030 | <0,0001 |
| Артериальная гипертония (n=905) | 1,382; 1,213-1,574 | <0,0001 | 1,077; 0,933-1,243 | 0,309 | - | - |
| ИБС (n=234) | 1,680; 1,435-1,967 | <0,0001 | 1,302; 1,104-1,535 | 0,002 | 1,257; 1,064-1,485 | 0,007 |
| Инсульт (n=113) | 1,299; 1,039-1,622 | 0,021 | 1,050; 0,838-1,316 | 0,672 | - | - |
| Фибрилляций предсердий (n=161) | 1,680; 1,404-2,009 | <0,0001 | 1,240; 1,027-1,497 | 0,025 | 1,164; 0,962-1,408 | 0,119 |
| Сахарный диабет 2 типа (n=406) | 1,472; 1,287-1,685 | <0,0001 | 1,390; 1,213-1,592 | <0,0001 | 1,300; 1,131-1,494 | <0,0001 |
| Ожирение (n=396) | 1,238; 1,077-1,422 | 0,003 | 1,418; 1,231-1,634 | <0,0001 | 1,347; 1,166-1,556 | <0,0001 |
| Бронхиальная астма (n=35) | 0,863; 0,571-1,305 | 0,863 | - | - | - | - |
| ХОБЛ (n=78) | 1,241; 0,958-1,609 | 0,102 | - | - | - | - |
| Солидные опухоли (n=63) | 1,487; 1,127-1,961 | 0,005 | 1,226; 0,927-1,621 | 0,152 | - | - |
| Гемобластозы (n=27) | 0,957; 0,607-1,506 | 0,848 | - | - | - | - |
| Ревматические заболевания (n=17) | 1,506; 0,871-2,604 | 0,143 | - | - | - | - |
| ВИЧ-инфекция (n=6) | 1,066; 0,399-2,847 | 0,898 | - | - | - | - |
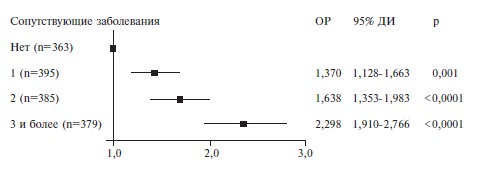
Увеличение числа сопутствующих заболеваний ассоциировалось с повышением риска смерти. Так, у больных с тремя сопутствующими заболеваниями отношение рисков смерти было примерно в 2 раза выше, чем у пациентов без сопутствующих заболеваний (ОР 2,298, 95% ДИ 1,910-2,766, р<0,0001; (рис. 4).
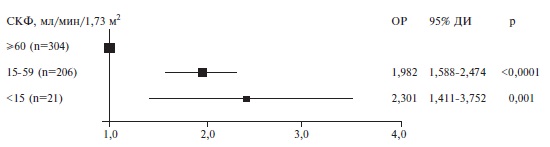
Лабораторные показатели. У умерших пациентов количество лейкоцитов, нейтрофилов и содержание глюкозы в крови были выше, чем у выживших больных, а количество тромбоцитов и сывороточное содержание альбумина оказалось ниже (табл. 4). В то же время концентрации С-реактивного белка (СРБ), фибриногена и D-димера достоверно не отличались между двумя группами. Частота острого повреждения почек (ОПП) была достоверно выше в группе умерших пациентов (26,7% и 8,5%, соответственно; p<0,0001), в то время как разница частоты повреждения печени между двумя группами не достигла статистической значимости. В регрессионной модели Кокса риск развития летального исхода возрастал по мере снижения исходного уровня СКФ, рассчитанной по формуле CKD-EPI, при поступлении в стационар (рис. 5). ОПП, зарегистрированное во время госпитализации, также ассоциировалось с развитием летального исхода (ОР 1,411; 95% ДИ 1,250-1,594; р<0,0001), в том числе после внесения поправки по полу и возрасту (ОР 1,364; 95% ДИ 1,211-1,537; р<0,0001).
| Параметры | Все пациенты | Выжившие | Умершие | p |
|---|---|---|---|---|
| Гемоглобин, г/л | 126 (110; 136), n=449 | 132 (119; 145), n=158 | 125 (110; 135), n=219 | 0,859 |
| Лейкоциты, ×109/л | 8,1 (5,6; 11,8), n=595 | 7,2 (5,0; 9,9), n=227 | 9,0 (6,3; 12,6), n=368 | <0,0001 |
| Лимфоциты, ×109/л | 0,9 (0,6; 1,3), n=519 | 1,0 (0,6; 1,3), n=190 | 0,9 (0,6; 1,3), n=329 | 0,167 |
| Нейтрофилы, ×109/л | 6,2 (3,9; 8,8), n=351 | 5,3 (3,6; 7,6), n=139 | 6,9 (4,3; 9,3), n=212 | 0,001 |
| Тромбоциты, ×109/л | 235 (170; 293), n=371 | 191 (144; 268), n=198 | 180 (132; 244), n=304 | 0,050 |
| Альбумин, г/л | 32,0 (27,9; 36,9), n=278 | 33,1 (28,8; 37,1), n=97 | 31,0 (27,0; 35,7), n=181 | 0,010 |
| Глюкоза, ммоль/л | 7,3 (5,8; 9,9), n=436 | 6,9 (5,6; 8,5), n=164 | 7,7 (5,9; 10,8), n=272 | 0,001 |
| СРБ max, мг/л | 131,0 (72,8; 209,0), n=218 | 117,5 (42,0; 207,0), n=86 | 133,5 (96,0; 212,0), n=132 | 0,231 |
| Фибриноген, г/л | 5,1 (3,9; 7,2), n=234 | 5,1 (4,0; 7,3), n=100 | 5,3 (3,9; 7,1), n=134 | 0,866 |
| Д-димер, нг/мл | 820 (384; 2348), n=95 | 727 (381; 1957), n=36 | 930 (426; 2682), n=59 | 0,485 |
| Поражение почек, n (%) | 335/587 (57,1) | 83/210 (39,5) | 252/377 (66,8) | <0,0001 |
| Креатинин при поступлении, мкмоль/л | 97,0 (78,6; 128,0), n=527 | 91,0 (74,4; 108,9), n=193 | 105,3 (82,0; 152,0), n=331 | <0,0001 |
| СКФ при поступлении, мл/мин/1,73 м2 | 64,6 (43,7; 84,0), n=531 | 76,7 (61,0; 92,4), n=197 | 57,0 (36,5; 77,4), n=334 | <0,0001 |
| Креатинин max, мкмоль/л | 104,1 (82,0; 153,0), n=509 | 91,0 (74,4; 108,8), n=193 | 122,0 (88,0; 190,3), n=316 | <0,0001 |
| СКФ min, мл/мин/1,73 м2 | 59,0 (36,0; 80,8), n=510 | 75,3 (56,0; 89,4), n=193 | 46,9 (27,5; 72,2), n=317 | <0,0001 |
| ОПП во время госпитализации, n (%) | 242/1197 (20,2) | 36/425 (8,5) | 206/772 (26,7) | <0,0001 |
| Гематурия, n (%) | 65/438 (14,8) | 18/158 (11,4) | 47/280 (16,8) | 0,001 |
| Протеинурия, n (%) | 130/436 (29,8) | 50/158 (31,6) | 80/278 (28,8 | 0,079 |
| Бактериурия/лейкоцитурия, n (%) | 37/446 (8,3) | 15/165 (9,1) | 22/281 (7,8) | 0,145 |
| Поражение печени, n (%) | 283/1201 (23,6) | 85/433 (19,6) | 198/768 (25,8) | 0,090 |
| АЛТ max, ед/л | 41,1 (28,1; 73,0), n=515 | 43,0 (29,2; 76,0), n=194 | 40,0 (27,3; 69,0), n=321 | 0,320 |
| АСТ max, ед/л | 56,0 (39,0; 93,0), n=500 | 53 (36,0; 83,5), n=189 | 58,0 (40,0; 101,7), n=311 | 0,040 |
| Общий билирубин, мкмоль/л | 13 (9; 20), n=88 | 12 (8; 15), n=33 | 14 (9; 27), n=55 | 0,072 |
| ЛДГ max, ед/л | 619 (418; 875), n=179 | 511,6 (375; 694), n=56 | 675 (495;994), n=123 | 0,003 |
Обсуждение
В нашем исследовании летальность у 1522 больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ лечебных учреждений Российской Федерации, составила 65,4%. В течение первых 14 дней после госпитализации в инфек ционный стационар умерли 44,0% больных, а в течение 28 дней – 63,6%. В качестве причины смерти у 93% больных был указан ОРДС. Летальность была низкой (10,1%) у пациентов, находившихся на оксигенотерапии, однако она значительно увеличивалась при прогрессирующем течении заболевании и достигала 76,8% у больных, которых приходилось переводить на ИВЛ. Самой высокой летальность (86,6%) была у пациентов с септическим шоком, характеризовавшися полиорганной недостаточностью и необходимостью в вазопрессорной поддержке. Следует отметить, что у больных с тяжелым течением COVID-19 именно вирус, а не вторичные бактериальные инфекции является ведущей причиной развития сепсиса и септического шока [20]. В пользу этого свидетельствуют раннее развитие септического шока у значительной части пациентов [18] и отрицательные результаты бактериологического исследования крови и выделений из нижних дыхательных путей более чем у 75% больных сепсисом, развившимся на фоне COVID-19 [21].
В исследованной когорте летальность больных, госпитализированных в ОРИТ, была практически одинаковой в Москве и Московской области (74,5% и 78,6%, соответственно) и существенно ниже (50,2%) в других регионах России. Вероятно, это объяснялось тем, что в Московском регионе, где было зарегистрировано максимальное число случаев SARS-CoV-2 инфекции, в ОРИТ переводили пациентов с наиболее тяжелым течением пневмонии, прежде всего нуждавшихся в ИВЛ. Так, частота ИВЛ у больных, поступивших в ОРИТ лечебных учреждений Москвы и Московской области, превышала 85%, в то время как в других регионах России только около 66% больных, переведенных в ОРИТ, нуждались в ИВЛ, а примерно 25% пациентов получали оксигенотерапию.
Для достоверного диагноза SARS-CoV-2 инфекции необходим положительный результат ПЦР, однако в исследованной когорте примерно у трети пациентов диагноз не удалось подтвердить с помощью вирусологического исследования. Тем не менее, во всех этих случаях наличие COVID-19 не вызывало сомнения и подтверждалось как клиническими данными (острая респираторная инфекция, осложнившаяся острой дыхательной недостаточностью, при отсутствии других возможных этиологических факторов), так и типичными результатами КТ органов грудной клетки (двусторонние зоны “матового стекла" ± зоны консолидации и ретикулярные изменения легких). Высокие чувствитель
ность и специфичность КТ органов грудной клетки в диагностике SARS-CoV-2 инфекции подтверждаются результатами исследований, проводившихся в других странах [22-24]. Летальность больных с подтвержденным и неподтвержденным диагнозом SARS-CoV-2 инфекции в нашем исследовании была практически одинаковой.
Хотя пандемия COVID-19 продолжается уже более полугода, данные о летальности больных, которым потребовалась госпитализация в ОРИТ, остаются ограниченными. P. Quah и соавт. провели мета-анализ 15 исследований, в которых оценивали летальность у 3798 больных с COVID-19, поступивших в ОРИТ [25]. Эти исследования проводились в разных странах, в том числе в Китае, США, Италии, Испании, Германии, Дании и Великобритании. Большинство из них были небольшими и включали в себя не более 100 пациентов. В целом летальность составила всего 25,7%, однако более половины больных оставались в ОРИТ на момент публикации, поэтому очевидно, что приведенный показатель является заниженным и его не следует сравнивать с таковым в нашем исследовании, в которое включали только пациентов с известными исходами SARS-CoV-2 пневмонии. Например, в самом крупном итальянском исследовании, в которое были включены более 1500 больных с COVID-19, госпитализированных в ОРИТ, на момент анализа летальность равнялась 26%, однако 58% больных продолжали лечение в ОРИТ, и только 16% пациентов были выписаны [10]. В исследованной нами когорте летальность увеличилась с 44% через 14 дней до 63% через 28 дней. Необходимо также учитывать и различную частоту ИВЛ, которая варьировалась от 35,4% в китайских исследованиях до 89,3% в исследованиях, проведенных в США. В целом частота ИВЛ в исследованиях, включенных в мета-анализ, была ниже (70%), чем в российской когорте (около 80%). В другом мета-анализе были обобщены результаты 24 наблюдательных исследований в целом у 10150 пациентов с COVID-19, госпитализированных в ОРИТ в лечебных учреждениях Азии, Европы и Северной Америки [26]. Летальность варьировалась от 0 до 84,6% и в среднем составила 41,6%. Следует отметить, что только в 7 исследованиях исходы были известны у всех больных, причем только в одно из них было включено достаточно количество больных (n=371), в то время как в остальных оно варьировалось от 1 до 50 (в целом 80). В более крупном исследовании, проводившемся в НьюЙорке, летальность в ОРИТ достигла 78% [27]. Кроме того, авторы мета-анализа не оценивали тяжесть пациентов, поступивших в ОРИТ, в частности частоту ИВЛ.
Одним из основным неблагоприятных прогностических факторов у больных с COVID-19 является пожилой возраст. В нашем исследовании более 90% пациентов, госпитализированных в ОРИТ, была старше 40 лет, а медиана возраста составила 62 года. Ранее мы показали, что возраст старше 50 лет ассоциируется более чем с двукратным увеличением риска развития септического шока, который в большинстве случаев заканчивается летальным исходом [18]. В настоящем исследовании риск смерти у пациентов старше 50 лет был достоверно выше, чем у больных более молодого возраста, и достигал максимума у пациентов старше 70 лет (отношение рисков 2,446, 95% ДИ 2,017-2,965, р<0,0001). Сходные данные были получены и в других исследованиях [9,10,21]. В международном исследовании, проводившемся в различных странах Европы, медиана возраста 639 больных с тяжелым течением COVID-19, поступивших в ОРИТ (63 года), соответствовала таковой в нашем исследовании, а 88% пациентов были старше 40 лет [28].
Еще одним фактором, оказывающим неблагоприятное влияние на течение COVID-19, является мужской пол. В 38 странах средняя летальность (case fatality rate – отношение числа летальных исходов к общему числу зарегистрированных случаев SARS-CoV-2 инфекции) у мужчин с COVID-19 была в 1,7 раза выше, чем у женщин [29]. Возможными причинами, объясняющими зависимость исходов COVID-19 от пола, считают эффекты половых гормонов, различия активности иммунной системы, показателей коагуляции, частоты сердечно-сосудистых заболеваний у мужчин и женщин [30]. Дефицит тестостерона, уровень которого с возрастом снижается у мужчин, ассоциировался с развитием аутоиммунных заболеваний и увеличением содержания маркеров воспаления, в то время как эстрогены обладают противовоспалительными свойствами и могут препятствовать прогрессированию пневмонии у женщин с COVID-19 [31]. В нашем исследовании летальность больных с тяжелым течением COVID-19 в значительной степени зависела не только от возраста, но и от пола. Среди пациентов старше 50 лет летальность у мужчин была достоверно выше, чем у женщин, однако среди пациентов в возрасте ≤50 лет она существенно не различалась у мужчин и женщин. По данным нашего предыдущего анализа [17], у женщин частота основных сопутствующих заболеваний, в том числе артериальной гипертонии, сахарного диабета 2 типа и ожирения, была достоверно выше, чем у мужчин. Соответственно, сопутствующие заболевания не позволяют объяснить выявленные различия выживаемости больных разного пола.
К факторам риска смерти больных COVID-19 относят также различные сопутствующие заболевания, прежде всего сердечно-сосудистой системы, которые наблюдаются у большинства пациентов с тяжелым течением SARS-CoV-2 пневмонии. В исследованной нами когорте основными сопутствующими заболеваниями, которые в целом были выявлены более чем у 75% больных, оказались артериальная гипертония, сахарный диабет 2 типа, ожирение, ИБС, инсульт в анамнезе, фибрилляция предсердий и ХОБЛ. В однофакторных регрессионных моделях Кокса сердечно-сосудистые заболевания, сахарный диабет 2 типа, ожирение и солидные опухоли ассоциировались с летальным исходом, однако только ИБС, сахарный диабет и ожирение сохранили статистическое значение в многофакторной модели, построенной по всем признакам с поправкой по полу и возрасту. При этом отношение рисков смерти прогрессивно увеличивалось при нарастании числа сопутствующих заболеваний и достигало максимума при наличии трех и более болезней.
В нашем исследовании артериальная гипертония была самым распространенным сопутствующим заболеванием, однако ее частота соответствовала таковой в российской популяции у людей сходного возраста и пола [32]. У умерших пациентов артериальная гипертония встречалась значительно чаще, чем у выживших. Тем не менее, в отличие от других авторов [33,34], мы не подтвердили роль артериальной гипертонии как независимого фактора, ассоциирующегося с риском смерти у больных с тяжелым течением COVID-19. В то же время ИБС ассоциировалась с достоверным увеличением риска смерти больных, госпитализированных в ОРИТ. Следует отметить, что при анализе частоты ИБС мы учитывали только больных с достоверным диагнозом коронарной болезни сердца, установленным на основании инфаркта миокарда и/или вмешательств на коронарных артериях в анамнезе. Связь между сердечно-сосудистыми заболеваниями и риском развития или более тяжелого течения COVID-19 может опосредоваться ренин-ангиотензиновой системой, так как ангиотензинпревращающий фермент 2 (АПФ2) является рецептором SARS-CoV-2 на поверхности альвеолоцитов и клеток других тканей [35]. Мы сравнивали клинические исходы только у больных, находившихся в ОРИТ. Соответственно, полученные нами данные не позволяют исключить неблагоприятное прогностическое значение артериальной гипертонии в общей популяции пациентов с SARS-CoV-2 пневмонией, которое было продемонстрировано в других когортных исследованиях [33].
Определенное влияние на течение COVID-19 могут оказывать блокаторы ренин-ангиотензиновой системы (РАС), которые широко применяют для лечения артериальной гипертонии и ИБС. Высказывались предположения, что ингибиторы АПФ или антагонисты рецепторов ангиотензина II могут ухудшить течение SARS-CoV-2 инфекции или, наоборот, дают протективный эффект [36]. По данным недавно опубликованного мета-анализа 18 исследований у 17311 больных COVID19, применение блокаторов РАС ассоциировалось с достоверным снижением риска комбинированной конечной точки (смерть, госпитализация в ОРИТ, необходимость в ИВЛ или развитие тяжелой пневмонии) на 16% [37]. В другое исследование, проведенное в Великобритании, были включены 19486 пациентов с COVID-19, 1286 из которых были переведены в ОРИТ [38]. По сравнению с контролем (более 8 млн пациентов, находящихся под наблюдением врачей общей практики) лечение как ингибиторами АПФ, так и антагонистами рецепторов ангиотензина II ассоциировалось с достоверным снижением риска развития COVID-19 (на 29% и 37%, соответственно), но не оказывало влияния на риск госпитализации в ОРИТ. Таким образом, вопрос о возможном влиянии блокаторов РАС на прогрессирование поражения легких при COVID-19 остается спорным. Мы не анализировали частоту применения препаратов этой группы в нашем исследовании, так как достоверная информация о проводимом ранее лечении в заявках на консультацию часто отсутствовала.
Результаты нашего исследования показали, что ожирение и сахарный диабет 2 типа не только часто встречаются у больных с тяжелым течением COVID-19, которым требуется госпитализация в ОРИТ, но и являются независимыми факторами, ассоциирующимися с повышенным риском смерти (ОР 1,347; 95% ДИ 1,166-1,556, р<0,0001 и ОР 1,300; 95% ДИ 1,131-1,494, р<0,0001, соответственно), что согласуется с данными других авторов [14,39]. Необходимо отметить, что увеличение риска смерти было отмечено нами только у больных с ожирением 2 и 3 степени, т.е. с ИМТ≥35 кг/м2, в то время как у пациентов с избыточной массой тела и ожирением 1 степени клинические исходы не отличались от таковых у пациентов с нормальной массой тела. В исследовании, проведенном в Нью-Йорке у 3615 пациентов с SARS-CoV-2 инфекцией, ожирение (ИМТ 30-34 кг/м2) и тяжелое ожирение (ИМТ≥35 кг/м2) у больных в возрасте до 60 лет ассоциировались с увеличением риска госпитализации в ОРИТ в 1,8 и 3,6 раза, соответственно (р=0,006 и p<0,001), по сравнению с таковым у пациентов с ИМТ <30 кг/м2 [16]. В то же время у пациентов в возрасте 60 лет и старше риск госпитализации в ОРИТ не зависел от ИМТ. В ретроспективном французском исследовании доля пациентов, которым потребовалась ИВЛ, возрастала по мере увеличения категории ИМТ и была самой высокой (85,7%) у больных с ИМТ>35 кг/м2 [40]. Ассоциация между риском летального исхода и тяжелым ожирением (ИМТ>40 кг/м2 ) была выявлена выявлена в Вели ко британии при анализе около 11000 случаев смерти больных COVID-19 [41]. Неблагоприятное влияние ожирения на течение COVID-19 может объясняться тем, что увеличение массы тела сопровождается снижением функции легких и эффективности ИВЛ. В пользу этого свидетельствует увеличение риска смерти только у пациентов с ИМТ>35 кг/м2 . Кроме того, ожирение способствует повышению АД, развитию почечной дисфункции и нарушения функции сердечно-сосудистой системы, которые могут ухудшить клинические исходы у больных тяжелой SARS-CoV-2 пневмонией. Нельзя исключить эффект и других факторов, таких как хроническое воспаление, окислительный стресс и нарушение иммунитета, которые наблюдаются у пациентов с ожирением [39].
В опубликованных ранее исследованиях также была выявлена ассоциация между сахарным диабетом и более тяжелым течением COVID-19. Например, в крупном американском исследовании (n=7162) частота сахарного диабета у пациентов, поступивших в ОРИТ, была в несколько раз выше, чем у больных, которым не потребовалась госпитализация [42]. Сходные данные были получены в другом американском исследовании [15]. В итальянском исследовании у 373 госпитализированных больных с COVID-19 сахарный диабет ассоциировался с достоверным увеличением риска летального исхода (относительный риск 1,56; 95% ДИ 1,05-2,02) [43].
ХОБЛ и бронхиальная астма в исследованной нами когорте больных с тяжелым течением COVID-19 встречались реже (5,1% и 2,3%, соответственно), чем в общей российской популяции [44]. Результаты метаанализа 6 исследований у 1558 больных COVID-19 показали, что ХОБЛ является независимым фактором риска прогрессирования SARS-CoV-2 инфекции [45]. В нашем исследовании частота ХОБЛ у умерших пациентов примерно в два раза превышала таковую у выживших. Тем не менее, роль этого заболевания как фактора риска смерти у пациентов, госпитализированных в ОРИТ, не была подтверждена при многофакторном анализе.
Низкая частота бронхиальной астмой у пациентов с COVID-19 была отмечена и в других исследованиях [46]. S. Lovinsky-Desir и соавт. показали, что наличие бронхиальной астмы у больных с COVID-19 не сопровождалось ухудшением прогноза независимо от возраста, наличия ожирения или других сопутствующих заболеваний [47]. В нашем исследовании частота бронхиальной астмы у умерших и выживших пациентов была одинаковой. Высказано предположение, что особенности иммунного ответа у пациентов с бронхиальной астмой или терапия ингаляционными глю ко кор ти костероидами могут препятствовать более тяжелому течению SARS-CoV-2 пневмонии [46,48], хотя благоприятный эффект последних вызывает сомнение. Бронхиальная астма часто асоциируется с увеличением количества эозинофилов, которые обладают как провоспалительными эффектами, так и иммунорегулирующей противовирусной активностью. Однако в настоящее время нет данных о том, что эозинофилы оказывают защитное действие или, наоборот, способствуют поражению легких при SARS-CoV-2 инфекции, хотя эозинопения позволяет предсказать более тяжелое течение заболевания [49]. В нашей когорте абсолютное число эозинофилов в крови было ниже 0,02 × 109/л у большинства больных, госпитализированных в ОРИТ, а случаев эозинофилии крови мы не зарегистрировали [50].
Частота других сопутствующих заболеваний, которые теоретически могут повысить риск смерти больных с тяжелым течением COVID-19, в том числе злокачественных опухолей, гемобластозов, ревматических аутоиммунных заболеваний (таких как ревматоидный артрит, системная красная волчанка и др.) и ВИЧинфекции, в исследованной когорте была низкой. У умерших пациентов частота солидных опухолей, диагностированных в течение последних 5 лет, в несколько раз превышала таковую у выживших больных (5,3% и 1,9%, соответственно), однако роль злокачественных новообразований как фактора риска смерти не была подтверждена при многофакторном регрессионном анализе Кокса. Частота аутоиммунных заболеваний, гемобластозов и ВИЧ-инфекции соответствовала таковой в общей популяции и была практически одинаковой у умерших и выживших пациентов.
Мы не анализировали прогностическое значение лабораторных показателей, так как подробные результаты анализов крови и мочи имелись далеко не во всех случаях. Следует отметить, что концентрации СРБ и Dдимера достоверно не отличались между группами выживших и умерших пациентов. Как и следовало ожидать, частота ОПП, которое служит одним из проявлений сепсиса и септического шока, была достоверно выше у умерших больных. В то же время разница частоты повреждения печени между двумя группами не достигла статистической значимости.
Наша работа является одним из первых многоцентровых исследований, в которых была проанализирована летальность у большого числа пациентов с тяжелой SARS-CoV-2 пневмонией, госпитализированных в ОРИТ. В отличие от многих других опубликованных исследований, мы оценивали летальность только у больных, которые умерли или были выписаны из стационара, и исключали пациентов, остававшихся в ОРИТ на момент анализа. Соответственно, наши данные позволяют оценить истинные показатели летальности у пациентов с тяжелым течением COVID-19. Однако наше исследование имеет и ограничения. Частота некоторых сопутствующих заболеваний, например, ХОБЛ, могла быть заниженной, так как заявки на консультацию готовились врачами ОРИТ, которые могли указать неполный диагноз. Чтобы избежать гипердиагностики ИБС, мы фиксировали только случаи инфаркта миокарда и/или вмешательств на коронарных артериях в анамнезе и не учитывали диагнозы “атеросклероз коронарных артерий" или “стенокардия". Мы не оценивали влияние проводимой терапии на исходы SARS-CoV-2 пневмонии, так как во многих заявках на консультацию отсутствовала полная и достоверная информация о назначенных лекарственных средствах, их дозах и сроках применения. В российских стационарах большинство пациентов с SARS-CoV-2 пневмонией в первые месяцы пандемии получали аминохинолоновые производные (прежде всего гидроксихлорохин) и различные антибиотики, в частности азитромицин, реже – лопинавир/ритонавир и интерферон-b, а также глюкортикостероиды в небольших дозах и ингибиторы интерлейкина (ИЛ)-6 (тоцилизумаб, сарилумаб). Эффективность “противовирусных" препаратов в лечении COVID-19 остается недоказанной и вызывает большие сомнения, особенно на стадии ОРДС. Большие надежды в лечении SARS-CoV-2 пневмонии возлагаются на ингибиторы ИЛ-6, однако опубликованные результаты их изучения противоречивые [51]. Хотя препараты этой группы вызывают быстрое улучшение состояния больных, в частности нормализацию температуры тела, и снижение концентрации СРБ, их эффективность в профилактике неблагоприятных исходов, таких как перевод на ИВЛ или смерть, не доказана в рандомизированных исследованиях. В рандомизированном контролируемом исследовании RECOVERY введение дексаметазона внутрь или внутривенно в дозе 6 мг/сут в течение 10 дней привело к снижению 28-дневной летельности по сравнению с таковой на фоне стандартной терапии, хотя разница между двумя группами оказалась не очень большой (21,6% и 24,6%, соответственно) [52]. Более выраженного эффекта введение глюкокортикостероида позволяло достичь у пациентов, находившихся на ИВЛ на момент рандомизации (летальность 29,7% и 40,7% в двух группах, соответственно). Следует отметить, что при более раннем введении препарата больным, которым не требовалась оксигенотерапия, была отмечена тенденция к повышению летальности с 13% до 17%. Соответственно, нельзя исключить, что применение глюкокортикостероидов и/или ингибиторов ИЛ-6 могло оказать влияние на полученные нами данные.
Заключение
В российских ОРИТ летальность больных SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержки, составила в среднем 65,4%. Летальность в значительной степени зависела от тяжести ОРДС и показаний к госпитализации в ОРИТ. Так, она была значительно выше у пациентов, которых переводили на ИВЛ, особенно при наличии признаков септического шока, и оказалась ниже в регионах Российской Федерации, где, в отличие от Москвы и Московской области, около четверти больных, поступивших в ОРИТ, не нуждались в НИВЛ или ИВЛ. Летальность у пациентов старше 50 лет, особенно мужчин, была выше, чем у больных более молодого возраста. По данным многофакторного анализа Кокса, факторами, ассоциировавшимися с более высоким риском смерти больных тяжелой SARS-CoV-2 пневмонией, осложнившейся ОРДС, были ИБС (инфаркт миокарда и/или вмешательства на коронарных артериях в анамнезе), ожирение (ИМТ≥35 кг/м2) и сахарный диабет 2 типа.
Используемые источники
- Phelan AL, Katz R, Gostin LO. The novel coronavirus originating in Wuhan, China: challenges for global health governance. JAMA 2020; published online Jan 30. DOI:10.1001/jama.2020.1097.
- Lurie N, Sharfstein JM, Goodman JL. The development of COVID-19 vaccines: safeguards needed. JAMA 2020; published online July 6. https://doi.org.10.1001/jama.2020.12461.
- Jackson LA, Anderson EJ, Rouphael NG, et al. An mRNA Vaccine against SARS-CoV-2 Preliminary Report. N Engl J Med 2020; published online July 14. 10.1056/NEJMoa2022483. doi:10.1056/NEJMoa2022483
- Folegatti PM, Ewer KJ, Aley PK, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 2020; published online July 20. https://doi.org/10.1016/S0140-6736(20)31604-4.
- Zhu F-C, Guan X-H, Li Y-H, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebocontrolled, phase 2 trial. Lancet 2020; published online July 20. https://doi.org/10.1016/S0140-6736(20)31605-6.
- Logunov DY, Dolzhikova IV, Zubkova OV, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. 2020; Published Online September 4. https://doi.org/10.1016/S0140-6736(20)31866-3.
- Wu Z, McGoogan JM. Characteristics of and important lessons from the Coronavirus Disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020 published online Feb 24. doi: 10.1001/jama.2020.2648.
- Guan WJ, Ni ZY, Hu Y, et al; China Medical Treatment Expert Group for Covid-19. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708-20.Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395(10223):497-506.
- Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA 2020, published online April 6. doi:10.1001/jama.2020.5394 .
- Gottlieb M, Sansom S, Frankenberger C, et al. Clinical course and factors associated with hospitalization and critical illness among COVID-19 patients in Chicago, Illinois. Acad Emerg Med 2020, published online Aug 6. 2020;10.1111/ acem.14104
- Wang D, Hu B, Hu C, et al. Clinical сharacteristics of 138 hospitalized patients with 2019 novel Coronavirus–infected pneumonia in Wuhan, China. JAMA 2020;323(11):1061-9.
- Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with Coronavirus Disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020;180(7):1-11.
- Drucker DJ. Coronavirus infections and type 2 diabetes shared pathways with therapeutic implications. Endocr Rev 2020;41(3):bnaa011.
- Petrilli CM, Jones SA, Yang J, et al. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: prospective cohort study. BMJ 2020;369:m1966.
- Lighter J, Phillips M, Hochman S, et al. Obesity in patients younger than 60 years is a risk factor for Covid-19 hospital admission. Clin Infect Dis 2020;71:896-97.
- Глыбочко П.В., Фомин В.В., Авдеев С.Н. и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке. Клин фармакол тер 2020;29(2):21-9 [Glybochko P, Fomin V, Avdeev S, et al. Clinical characteristics of 1007 intensive care unit patients with SARS-CoV-2 pneumonia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):21-29 (In Russ.)].
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Факторы риска раннего развития септического шока у больных с тяжелым COVID-19. Терапев тический архив 2020, в печати. [Glybochko PV, Fomin VV, Moiseev SV, et al. Rist factors for early development of septic shock in patients with severe COVID19. Terapevticheskiy arkhiv 2020, in press (In Russ.)].
- Salehi S, Abedi A, Balakrishnan S, Gholamrezanezhad A. Coronavirus disease 2019 (COVID-19): a systematic review of imaging findings in 919 Patients. AJR Am J Roentgenol 2020;215(1):87-93.
- Li H, Liu L, Zhang D, et al. SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet 2020;395(10235):1517-20.
- Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020;395:1054–62.
- Schulze-Hagen M, Hübel C, Meier-Schroers M, et al. Low-dose chest CT for the diagnosis of COVID-19. Dtsch Arztebl Int 2020;117(22-23):389-95.
- Falaschi Z, Danna PSC, Arioli R, et al. Chest CT accuracy in diagnosing COVID-19 during the peak of the Italian epidemic: A retrospective correlation with RT-PCR testing and analysis of discordant cases. Eur J Radiol 2020;130: 109192.
- Hermans JJR, Groen J, Zwets E, et al. Chest CT for triage during COVID-19 on the emergency department: myth or truth? Emerg Radiol 2020, published online Jul 20.
- Quah P, Li A, Phua J. Mortality rates of patients with COVID-19 in the intensive care unit: a systematic review of the emerging literature. Critical Care 2020;24: 285.
- Armstrong RA, Kane AD, Cook TM. Outcomes from intensive care in patients with COVID-19: a systematic review and meta-analysis of observational studies. Anaesthesia 2020, published online June 30.
- Richardson S, Hirsch JS, Narasimhan M, et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA 2020;323:2052-9.
- Wendel Garcia PD, Fumeaux T, Guerci P, et al. Prognostic factors associated with mortality risk and disease progression in 639 critically ill patients with COVID-19 in Europe: Initial report of the international RISC-19-ICU prospective observational cohort. EClinicalMedicine 2020;4:26.
- Scully EP, Haverfield J, Ursin RL, et al. Considering how biological sex impacts immune responses and COVID-19 outcomes. Nat Rev Immunol 2020;20:442–7.
- Capuano A, Rossi F, Paolisso G. Covid-19 kills more men than women: an overview of possible reasons. Front Cardiovasc Med 2020;7:131.
- Al-Lami RA, Urban RJ, Volpi E, et al. Sex hormones and novel corona virus infectious disease (COVID-19). Mayo Clin Proc 2020;95(8):1710-4.
- Муромцева Г.А., Концевая А.В., Константинов В.В. и др. Распро стра нен ность факторов риска неинфекционных заболеваний в российской популяции в 2012-2013 гг. Результаты исследования ЭССЕ-РФ. Кардиоваскулярная терапия и профилактика 2014;13(6):4–11 [Muromtseva GA, Kontsevaya AV, Konstantinov VV, et al. The prevalence of non-infectious diseases risk factors in Russian population in 2012-2013 years. Cardiovascular Therapy and Prevention 2014;13(6):4–11 (In Russ.)].
- Xiong T-Y, Huang F-Y, Liu Q, et al. Hypertension is a risk factor for adverse outcomes in patients with coronavirus disease 2019: a cohort study. Ann Med 2020 published online Jul 27. doi: 10.1080/07853890.2020.1802059.
- Liang X, Shi L, Wang Y, et al. The association of hypertension with the severity and mortality of COVID-19 patients: Evidence based on adjusted effect estimates. J Infect 2020;81(3):e44–7.
- Pillay TS. Gene of the month: the 2019-nCoV/SARS-CoV-2 novel coronavirus spike protein. J Clin Pathol 2020;73(7):366-9.
- Vaduganathan M, Vardeny O, Michel T, et al. Renin-angiotensin-aldosterone system inhibitors in patients with Covid-19. N Engl J Med 2020;82:1653-9.
- Barochiner J, Martínez R. Use of inhibitors of the renin-angiotensin system in hypertensive patients and COVID-19 severity: A systematic review and metaanalysis J Clin Pharm Ther 2020, published online Aug 7.
- Hippisley-Cox J, Young D, Coupland C, et al. Risk of severe COVID-19 disease with ACE inhibitors and angiotensin receptor blockers: cohort study including 8.3 35 million people. Heart 2020, published online Jul 31.
- Caci G, Albini A, Malerba M, et al. COVID-19 and obesity: dangerous liaisons. J Clin Med 2020;9(8):E2511.
- Simonnet A, Chetboun M, Poissy J, et al. High prevalence of obesity in severe acute respiratory syndrome Coronavirus-2 (SARS-CoV-2) requiring invasive mechanical ventilation. Obesity 2020;28:1195–9.
- Williamson EJ, Walker AJ, Bhaskaran K, et al. OpenSAFELY: Factors associated with COVID-19 death in 17 million patients. Nature 2020, published online Jul 8.
- Team CC-R. Preliminary estimates of the prevalence of selected underlying health conditions among patients with Coronavirus Disease 2019 United States, February 12-March 28, 2020. MMWR Morb Mortal Wkly Rep 69:382-6.
- Ciardullo S, Zerbini F, Perra S, et al. Impact of diabetes on COVID-19-related in-hospital mortality: a retrospective study from Northern Italy [published online ahead of print, 2020 Aug 10]. J Endocrinol Invest 2020, published online Aug 10.
- Chuchalin AG, Khaltaev N, Antonov NS, et al. Chronic respiratory diseases and risk factors in 12 regions of the Russian Federation. Intern J COPD 2014:9: 963–74.
- Wang B, Li R, Lu Z, Huang Y. Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis. Aging 2020;12:6049-57.
- Li X, Xu S, Yu M, et al. Risk factors for severity and mortality in adult COVID19 inpatients in Wuhan. J Allerg Clin Immunol 2020;146(1):110-8.
- Lovinsky-Desir S, Deshpande DR, De A, et al. Asthma among hospitalized patients with COVID-19 and related outcomes. J Allergy Clin Immunol 2020, published online Aug 6.
- Halpin DMG, Faner R, Sibila O, et al. Do chronic respiratory diseases or their treatment affect the risk of SARS-CoV-2 infection? Lancet Respir Med 2020;8(5): 436-8.
- Lindsley AW, Schwartz JT, Rothenberg ME. Eosinophil responses during COVID-19 infections and coronavirus vaccination. J Allergy Clin Immunol 2020 2020;146(1):1-7.
- Avdeev S, Moiseev S, Brovko M, et al. Low prevalence of bronchial asthma and chronic obstructive lung disease among intensive care unit patients with COVID19. Allergy 2020, published online May 2.
- Winthrop KL, Mariette X To immunosuppress: whom, when and how? That is the question with COVID-19 Ann Rheum Dis 2020;79:1129-31.
- RECOVERY Collaborative Group, Horby P, Lim WS, et al. Dexamethasone in hospitalized patients with Covid-19 preliminary report. N Engl J Med 2020, published online Jul 17.
