Профиль пристеночного и полостного микробиома кишечника пациентов с язвенным колитом
Дисбаланс бактерий, приводящий к нарушению кишечного гомеостаза наблюдаются при различных патологических состояниях, в том числе при воспалительных заболеваниях кишечника. Однако остается неясным, является ли дисбиоз одним из этиологических факторов воспаления кишечной стенки или его следствием.
Определить состав пристеночной и полостной микробиоты толстой кишки у пациентов с язвенным колитом в российской популяции методом полимеразной цепной реакции (ПЦР) с детекцией результатов в режиме реального времени.
В исследование были включены 70 пациентов с верифицированным диагнозом язвенного колита, 43 женщины и 27 мужчин. Средний возраст составил 40,0±14,4 лет, средняя длительность анамнеза язвенного колита – 7,2±7,0 лет. Тотальное поражение диагностировано у 55 (78,6%) больных, левостороннее – у 15 (21,4%). Хроническое реци- дивирующее течение язвенного колита отмечено у 29 (41,4%) пациентов, хроническое непрерывное – у 38 (54,3%), острое – у 3 (4,3%). Эндоскопическую активность заболевания оценивали на основании классификации Schroeder: ремиссия – 18 (25,7%), минимальная активность – 31 (44,3%), умеренная – 18 (25,7%), выраженная – 3 (4,3%). У всех пациентов с язвенным колитом и 50 пациентов с синдромом раздраженного кишечника и бессимптомными дивертикулами ободочной кишки, составивших контрольную группу, про- изводили забор биоптатов слизистой оболочки толстой кишки и образцов фекалий. В полученных материалах определяли состав просветного и пристеночного микробиома методом полимеразной цепной реакции (ПЦР) в режиме реального времени .
В составе пристеночной и просветной микробиоты при язвенном колите преобладали три типа бактерий: Firmicutes, Bacteroidetes и Proteobacteria. Состав фекального и пристеночного микробиома отличался незначительно. В составе микробиоты при язвенном колите по сравнению с груп- пой сравнения достоверно чаще определялись микроорганизмы рода Bacteroides. При левостороннем язвенном колите не выявлено достоверной разницы в составе микробиоты пораженного и непораженного отделов тол- стой кишки (p>0,05). При хроническом рецидивирующем и непрерывном течении заболевания состав микробиоты толстой кишки достоверно не отличался (p>0,05). Количество бактерий рода Bacteroides spp. увеличивалось при нарастании эндоскопической активности язвенного колита (p<0,05), а содержание бактерий семейства Erysipelotrichaceae уменьшалось (p<0,05).
Полученные данные свидетельствуют о том, что представители рода Bacteroides spp. как в биоптатах слизистой оболочки кишки, так и в образцах фекалий могут рассматриваться в качестве биомаркера язвенного колита.
Язвенный колит развивается в результате сочетания нескольких этиологических факторов. Достигнут значительный прогресс в понимании роли иммунитета, генетических факторов и окружающей среды в формировании хронического воспалительного процесса [1,2]. В настоящее время активно обсуждается взаимосвязь микробиоты кишки и иммунного ответа хозяина в патогенезе воспалительных заболеваний кишечника (ВЗК), а также потенциальные терапевтические стратегии, связанные с влиянием на кишечную экосистему [3]. Эволюция методов диагностики микробного состава от посева кала на обогащенные питательные среды до современных молекулярно-генетических методов, позволяющих выделить генетический материал бактерий, безусловно, играет ключевую роль в нашем понимании роли микроорганизмов в развитии заболеваний различных органов и систем человека.
Имеющиеся данные об изменениях микробиоты кишки у пациентов с язвенным колитом немногочисленны. Большинство научных исследований, посвященных этой тематике, проведены с использованием образцов фекалий, что позволяет определить лишь состав просветной микробиоты. Более ценной считают информацию о микробной колонизации кишечной стенки, полученную путем забора биоптатов слизистой оболочки толстой кишки. Таких работ значительно меньше, и они проведены на небольших выборках.
Целью нашего исследования была оценка просветного и пристеночного микробиома толстой кишки у пациентов с язвенным колитом в российской популяции методом ПЦР с детекцией результатов в режиме реального времени.
Материал и методы
Научная работа проводилась в гастроэнтерологическом отделении на базе отдела по изучению воспалительных и функциональных заболеваний кишечника ФГБУ “НМИЦ колопроктологии имени А.Н. Рыжих" Минздрава России с 2017 по 2018 г. Протокол исследования был одобрен на заседании Комитета по этике научных исследований ФГБОУ ДПО РМАНПО Минздрава России от 14.11.2017 года.
В исследование включали пациентов старше 18 лет с язвенным колитом, установленным на основании действующих клинических рекомендаций (2017 г.) [4]. В исследовании принимали участие пациенты с различными клиническими формами и течением заболевания, получавшие терапию препаратами 5-аминосалициловой кислоты, глюкокортикостероидами, иммуносупрессивными средствами и/или генно-инженерными биологическими пре паратами.
Критерии невключения: 1) тяжелая или сверхтяжелая атака язвенного колита; 2) прием антибактериальных или пробиотических препаратов на догоспитальном этапе; 3) наличие кишечной инфекции; 4) наличие тяжелой сопутствующей патологии. Группу сравнения составили 50 пациентов с диагнозами синдрома раздраженного кишечника или бессимптомных дивертикулов ободочной кишки.
Для количественной оценки состава пристеночной микробиоты у больных язвенным колитом при колоноскопии брали биоптаты слизистой оболочки левых отделов толстой кишки, а также дополнительно биоптаты из правых отделов толстой кишки при левостороннем поражении. Для изучения просветной микробиоты использовали образцы фекалий. У пациентов группы сравнения для определения состава мукозного микробиома были взяты биоптаты слизистой оболочки неизмененных левых отделов толстой кишки.
Биологический материал помещали в пробирку типа “Эппендорф" объемом 1,5 мл, содержащую транспортную среду для ПЦР исследований, и маркировали. Био ло гические образцы замораживали, хранили при -20°С и доставляли в лабораторию с соблюдением правил транспортировки.
ПЦР диагностика исследуемых образцов проводилась на базе ФГБУ “ГНЦ Институт иммунологии" ФМБА России с использованием детектирующего амплификатора ДТпрайм (производитель ООО “ДНК-Технология", Россия), обеспечивающего проведение ПЦР с автоматической регистрацией результатов в режиме реального времени. Изучали состав и проводили количественную оценку пристеночной и просветной микробиоты.
В образцах определяли следующие параметры: 1) общая бактериальная масса (ОБМ) – показатель, по которому можно судить об общем количестве бактерий, присутствующих в данной пробе; 2) абсолютные значения показателей, которые зависят от техники взятия биоматериала и способа выделения ДНК и представлены в виде десятичного логарифма (lоg); 3) относительные значения показателей микробного состава, которые отражают количество конкретных микроорганизмов по отношению к ОБМ и применяются для более точного анализа. Например, ОБМ составляет 6,0 lоg, абсолютный показатель микроорганизма – 5,7 lоg; относительный показатель (5,7 lоg – 6,0 lоg) = -0,3 lоg. Количество ДНК искомого микроорганизма в образце принято выражать в геном-эквивалентах (ГЭ/обр.), которое пропорционально количеству микроорганизма.
Статистическая обработка результатов выполнена с использованием пакета прикладной программы Statistica 12.0. Качественные признаки представлены в виде абсо лютных и относительных показателей. Нормальность распределения проверяли с помощью критерия Колмого рова-Смирнова. Для распределения, отличающегося от нормального, вычисляли среднее значение, стандартное отклонение, медиану (Me) и интерквартильный размах (25-й и 75-й процентиль). Данные представлены в виде Me (25%;75%). Для оценки достоверности различий непараметрических показателей использовали U-критерий МаннаУитни. Для исследования взаимосвязи двух переменных применяли коэффициент корреляции Пирсона (r). Ста ти стически достоверными считали значения при p<0,05.
Результаты
В исследование были включены 70 пациентов с язвенным колитом (43 женщины и 27 мужчин; средний возраст – 40,0±14,4 лет) (табл. 1). Средняя длительность анамнеза язвенного колита – 7,2±7,0 лет. Тотальное поражение диагностировано у 55 (78,6%) больных, левостороннее – у 15 (21,4%). Хроническое рецидивирующее течение язвенного колита наблюдалось у 29 (41,4%) пациентов, хроническое непрерывное – у 38 (54,3%), острое – у 3 (4,3%). Эндоскопическую активность заболевания оценивали на основании классификации Schroeder. Ремиссия язвенного колита выявлена у 18 (25,7%) больных, минимальная активность – у 31 (44,3%), умеренная – у 18 (25,7%), выраженная – у 3 (4,3%).
| Показатели | Значение |
|---|---|
| Примечание: 5-АСК – 5-аминосалициловая кислота, ГКС – глюкокортикостероиды, АЗА – азатиоприн, ГИБП – генно-инженерные биологические препараты | |
| Женщины, n (%) | 43 (61,4) |
| Средний возраст, годы | 40,0±14,4 |
| Длительность анамнеза, годы | 7,2±7,0 |
| Протяженность поражения, n (%) | |
| тотальное | 55 (78,6) |
| левостороннее | 15 (21,4) |
| Течение заболевания, n (%) | |
| острое | 3 (4,3) |
| хроническое рецидивирующее | 29 (41,4) |
| хроническое непрерывное | 38 (54,3) |
| Эндоскопическая активность, n (%) | |
| ремиссия | 18 (25,7) |
| минимальная | 31 (44,3) |
| умеренная | 18 (25,7) |
| выраженная | 3 (4,3) |
| Лечение, n (%) | |
| 5-АСК | 33 (47,1) |
| 5-АСК + ГКС | 10 (14,3) |
| 5-АСК + АЗА | 15 (21,4) |
| ГИБП + АЗА | 12 (17,1) |
Группу сравнения составили 50 пациентов (30 женщин и 20 мужчин, средний возраст 54,5±13,6 лет). У 26 (52,0%) из них при эндоскопии диагностировали бессимптомные дивертикулы ободочной кишки, а у 24 (48,0%) – синдром раздраженного кишечника.
Методом ПЦР в режиме реального времени в полученных материалах выделены микроорганизмы, относящиеся к домену Bacteria, четырем основным (Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria) и двум редко встречающимся (Fusobacteria и Verrucomicrobia) типам, а также к домену Archaea (филотип Euryarchaeota). Систематика и распределение микроорганизмов в иерархическом порядке согласно таксономическим группам выполнены с использованием базы данных Национального центра биотехнологической информации США (табл. 2) [5].
| Домен | Тип | Класс | Порядок | Семейство | Род | Вид |
|---|---|---|---|---|---|---|
| Bacteria | Actinobacteria | Actinobacteria | Bifidobacteriales | Bifidobacteriaceae | Bifidobacterium | |
| Coriobacteriia | Coriobacteriales | Coriobacteriaceae | ||||
| Bacteroidetes | Bacteroidia | Bacteroidales | Bacteroidaceae | Bacteroides | ||
| Odoribacteraceae | Butyricimonas | |||||
| Prevotellaceae | Prevotella | |||||
| Rikenellaceae | Alistipes | |||||
| Tannerellaceae | Parabacteroides | |||||
| Firmicutes | Bacilli | Bacillales | Staphylococcaceae | Staphylococcus spp. | ||
| Lactobacillales | Enterococcacaea | Enterococcus spp. | ||||
| Clostridia | Clostridiales | Hungateiclostridiaceae | Mageeibacillus | M. indolicus | ||
| Lachnospiraceae | Blautia | C. (Blautia) coccoides gr | ||||
| Peptostreptococcaceae | Clostridioides unclassified | C. difficile gr | ||||
| Ruminococcaceae | Ruminococcaceae | C. leptum gr+ | ||||
| Erysipelotrichia | Erysipelotrichales | Erysipelotrichaceae | C. leptum gr- | |||
| Negativicutes | Veillonellales | Veillonellaceae | Dialister | |||
| Megasphaera | ||||||
| Allisonella | ||||||
| Veillonella | ||||||
| Tissierellia | Tissierellales | Peptoniphilaceae | Anaerococcus spp. | |||
| Fusobacteria | Fusobacteriia | Fusobacteriales | Fusobacteriaceae | |||
| Proteobacteria | Betaproteobacteria | Burkholderiales | Sutterellaceae | Sutterella wadsworthensis | ||
| Gammaproteobacteria | Pseudomonadales | Pseudomonadaceae | Pseudomonas spp. | |||
| Enterobacterales | Enterobacteriaceae | Escherichia | E. coli | |||
| Deltaproteobacteria | Desulfovibrionales | Desulfovibrionaceae | Desulfovibrio | |||
| Epsilonproteobacteria | Campylobacterales | Helicobacteraceae | Helicobacter spp. | |||
| Campylobacteriaceae | Campylobacter spp. | |||||
| Oligoflexia | Bdellovibrionales | Bdellovibrionaceae | Bdellovibrio | |||
| Verrucomicrobia | Verrucomicrobiae | Verrucomicrobiales | Akkermansiaceae | Akkermansia | A. muciniphila | |
| Archaea | Euryarcheota | Methanobacteria | Methanobacteriales | Methanobacteriaceae | Methanobrevibacter |
Общая бактериальная масса в образцах фекалий пациентов с язвенным колитом составила 6,55 log (ГЭ/обр.). Основу просветной микробиоты в основной группе составили представители типа Firmicutes (46,7%), доля которых в 2 раза превышала таковую Bacteroidetes (21,7%) (рис. 1). Главными бактериями фекального микробного сообщества были Bacteroides spp., Clostridium leptum group+ и Clostridium coccoides group, а также Streptococcus spp, Clostridium leptum group-, Erysi pe lotrichaceae, Veillonellaceae (Dialister + Alisonella + Mega spherae + Veillonella), Parabacteroides spp. и Alistipes spp. (рис. 2). Далее по численности расположились представители типа Proteobacteria (19,5%) с основной бактерией E. coli и типа Actinobacteria (10,1%), включающие Bifido bacterium spp. и Coriobacteriia. Филотипы Verrucomicrobia (1,4%), Fusobacteria (0,5%) и Eury arc haeota (0,1%) имели наименьшее представительство (рис. 1).
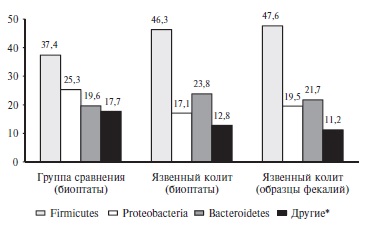
Согласно филотипической принадлежности бактерии в образцах слизистой оболочки толстой кишки при язвенном колите расположились следующим образом в порядке убывания: Firmicutes (46,3%), Bacteroidetes (23,8%), Proteobacteria (17,1%), Actinobacteria (9,9%), Fusobacteria (1,8%) и Verrucomicrobia (1,1%) (рис. 1). Общая бактериальная масса составила 4,47 log (ГЭ/обр.).
Относительное количество микроорганизмов, нормированное на ОБМ, в составе фекальной и пристеночной микробиоты пациентов с язвенным колитом приведено на рис. 2 и 3. В составе пристеночного микробиома пациентов основной группы преобладали Bacteroides spp., Clostridium coccoides group, Clostridium leptum group+, Streptococcus spp, Clostridium leptum group(рис. 3).
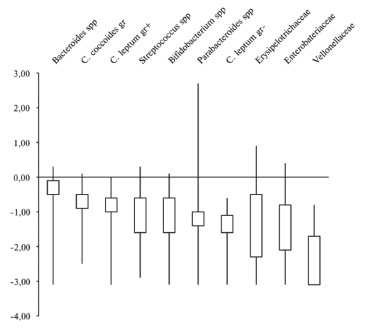
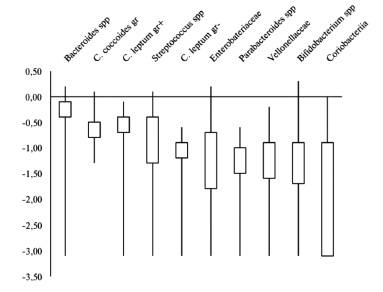
При сравнении бактериального состава пристеночной (биоптаты толстой кишки) и просветной (образцы фекалий) микробиоты пациентов с язвенным колитом существенных различий по основным представителям не выявили (p>0,05).
На предыдущем этапе исследования у пациентов с язвенным колитом не выявлено статистически достоверной разницы состава пристеночной микробиоты в зависимости от течения заболевания, протяженности поражения толстой кишки, а также между пораженным и непораженным участком толстой кишки при левосторонней локализации воспалительного процесса (p>0,05) [6].
Эндоскопическая активность воспалительных заболеваний кишечника играет важную роль в оценке тяжести атаки заболевания, определении дальнейшей тактики ведения и лечения пациента. Микробный состав у пациентов с ремиссией воспалительного процесса был более разнообразным по сравнению с таковым у больных с минимальной и умеренной активностью (p<0,05) и не отличался от состава микробиоты у пациентов с выраженной активностью. Количество Clostridium leptum group+, Streptococcus spp. и Clostridium coccoides group было достоверно снижено в ремиссии заболевании по сравнению с таковым при минимальной активности язвенного колита (p<0,05). Количество Bacteroides spp. возрастало при увеличении активности заболевания (p<0,05), в то время как количество бактерий семейства Erysipelotrichaceae достоверно уменьшалось (p<0,05) (табл. 3). При анализе количества остальных бактерий значимых различий не выявлено.
| Эндоскопическая ремиссия (1) |
Минимальная активность (2) |
Умеренная активность (3) |
Выраженная активность (4) | р1-2 | р1-3 | р1-4 | р2-3 | р2-4 | р3-4 | |
|---|---|---|---|---|---|---|---|---|---|---|
| ОБМ | 4,83 | 4,27 | 4,42 | 4,63 | 0,02 | 0,05 | 0,62 | 0,88 | 0,49 | 0,51 |
| Clostridium leptum gr+ | -0,77 (-0,90;-0,70) | -0,61 (-0,70;-0,40) | -0,56 (-0,60;-0,40) | -0,63 (-0,70;-0,60) | 0,00 | 0,01 | 0,19 | 0,98 | 0,40 | 0,34 |
| Streptococcus spp. | -1,16 (-1,50;-0,60) | -0,86 (-1,30;-0,30) | -0,86 (-1,10;-0,60) | -1,00 (-1,40;-0,60) | 0,04 | 0,10 | 0,73 | 0,66 | 0,45 | 0,69 |
| Clostridium coccoides gr | -0,76 (-0,80;-0,60) | -0,55 (-0,70;-0,40) | -0,64 (-0,90;-0,40) | -0,57 (-0,70;-0,50) | 0,01 | 0,16 | 0,12 | 0,51 | 1,00 | 0,88 |
| Bacteroides spp. | -0,61 (-0,90;-0,20) | -0,22 (-0,10; 0,00) | -0,17 (-0,30; 0,00) | -0,40 (-0,70;-0,10) | 0,01 | 0,01 | 0,15 | 0,03 | 1,00 | 0,19 |
| Erysipelotrichaceae | -1,59 (-1,90;-1,20) | -1,74 (-2,10;-1,30) | -3,01 (-3,10;-3,10) | -2,90 (-3,10;-2,70) | 0,63 | 0,00 | 0,01 | 0,00 | 0,06 | 0,23 |
С-реактивный белок является основным лабораторным маркером воспалительного процесса при язвенном колите. С содержанием С-реактивного белка отрицательно коррелировало только количество представителей семейства Erysipelotrichaceae (r= -0,313, р=0,008).
| Язвенный колит | Группа сравнения | p | |
|---|---|---|---|
| ОБМ | 4,47 | 5,01 | 0,0000 |
| Clostridium leptum gr+ | -0,64 (-0,70;-0,40) | -0,99 (-0,80;-1,10) | 0,0000 |
| Streptococcus spp. | -0,94 (-1,30;-0,40) | -1,80 (-1,50;-2,10) | 0,0000 |
| Clostridium coccoides gr | -0,63 (-0,80;-0,50 | 0,02 (0,20; -0,10) | 0,0000 |
| Clostridium difficile gr | -2,29 (-2,70;-1,90) | -2,12 (-1,60;-2,50) | 0,0804 |
| Bacteroides spp. | -0,39 (-0,40;-0,10) | -0,72 (-0,40;-1,00) | 0,0000 |
| Bifidobacterium spp. | -1,40 (-1,70;-0,90) | -3,12 (-2,20;-4,30) | 0,0000 |
| Methanobrevibacter spp. | -3,09 (-3,10;-3,10) | -4,34 (-3,90;-5,20) | 0,0000 |
| Parabacteroides spp. | -1,33 (-1,50;-1,00) | -1,53 (-1,30;-1,70) | 0,0001 |
| Alistipes spp. | -1,90 (-2,70;-1,30) | -2,23 (-1,40;-2,70) | 0,1033 |
| Fusobacteriaceae | -2,56 (-3,10;-1,70) | -3,40 (-1,80;-5,10) | 0,0207 |
| Akkermansia muciniphila | -2,80 (-3,10;-3,10) | -2,87 (-1,80;-4,20) | 0,0781 |
| Butyricimonas | -2,50 (-3,10;-2,00) | -2,36 (-2,00;-2,50) | 0,0307 |
| Desulfovibrio spp. | -2,68 (-3,10;-2,20) | -2,05 (-1,60;-2,30) | 0,0000 |
| Coriobacteriia | -1,70 (-3,10;-0,90) | -1,79 (-1,50;-2,10) | 0,1705 |
| Enterococcus spp. | -2,96 (-3,10;-3,10) | -4,36 (-3,50;-5,20) | 0,0000 |
| Staphylococcus spp. | -2,43 (-3,10;-1,90) | -4,55 (-4,30;-5,20) | 0,0000 |
| Anaerococcus spp. | -2,90 (-3,10;-3,00) | -4,97 (-4,70;-5,20) | 0,0000 |
| Helicobacter | -3,09 (-3,10;-3,10) | -4,97 (-4,70;-5,20) | 0,0000 |
| Bdelovibrio | -3,03 (-3,10;-3,10) | -5,00 (-4,80;-5,20) | 0,0000 |
| Sutterella wadsworthensis | -2,68 (-3,10;-2,40) | -3,10 (-1,90;-4,50) | 0,5708 |
| Dialister+Alisonella+ | -1,36 (-1,60;-0,90) | -1,80 (-1,50;-1,90) | 0,0000 |
| Megaspherae+Veillonella | |||
| Pseudomonas spp. | -1,84 (-2,30;-1,20) | -3,08 (-2,40;-3,40) | 0,0000 |
| Enterobacteriaceae | -1,25 (-1,80;-0,70) | -0,90 (-0,40;-1,40) | 0,0100 |
| Campylobacter spp. | -3,08 (-3,10;-3,10) | -4,90 (-4,70;-5,20) | 0,0000 |
| Mageebacillus indolicus | -3,09 (-3,10;-3,10) | -5,01 (-4,80;-5,20) | 0,0000 |
| Prevotella spp. | -1,71 (-3,10;-0,70) | -1,67 (-0,60;-2,10) | 0,5690 |
| Clostridium leptum gr | -1,08 (-1,20;-0,90) | -0,78 (-0,70;-0,90) | 0,0000 |
| Erysipelotrichaceae | -1,78 (-2,00;-1,30) | -1,63 (-1,30;-2,00) | 0,5161 |
| Escherichia coli | -2,38 (-3,10;-1,50) | -2,49 (-1,60;-3,00) | 0,4063 |
| Lactobacillaceae | -2,87 (-3,10;-2,80) | -4,39 (-3,20;-5,20) | 0,0000 |
У пациентов как основной группы, так и группы сравнения в пристеночной микробиоте преобладали представители типа Firmicute. При язвенном колите в наибольшем количестве в образцах слизистой оболочки толстой кишки были выявлены бактерии типа Bacteroidetes рода Bacteroides и в меньшем количестве – Clostridium leptum group+, Streptococcus spp. и Clostridium coccoides group. Количество Clostridium coccoides group было снижено при наличии воспаления (р=0,0000). Представители семейства Veillonellaceae (Dialister + Alisonella + Megaspherae + Veillonella) преобладали в образцах слизистой оболочки толстой кишки при язвенном колите (р=0,0000). Количество Clostridium difficile group, Escherichia coli и Akkermansia muciniphila достоверно не отличалось в двух группах (табл. 4). Вероятно, данные микроорганизмы не принимают активного участия в воспалительном ответе при язвенном колите.
Обсуждение
Данные об изменении соотношения филотипов бактерий при ВЗК в целом и при язвенном колите в частности несколько противоречивы. В достаточно крупном исследовании D. Frank и соавт. [7], опубликованном в 2007 г., было проведено 16S секвенирование рРНК в образцах биоптатов толстой кишки у 68 пациентов с болезнью Крона, 61 пациента с язвенным колитом и 61 пациента контрольной группы. У пациентов с ВЗК выявлено увеличение количества представителей типа Proteobacteria и снижение количества Firmicutes и Bacteroidetes. В нашем исследовании в составе пристеночной и просветной микробиоты при язвенном колите преобладали три типа бактерий: Firmicutes, Bacteroidetes и Proteobacteria. При этом состав фекальной и пристеночной биоты отличался незначительно.
Неоднозначны данные об участии бактерий рода Bacteroides в развитии воспаления. Представители этого рода, вероятно, связаны с деградацией муцина и усиленным воспалительным ответом слизистой оболочки. В предыдущих исследованиях было выявлено увеличение количества представителей рода Bacteroides в биоптатах толстой кишки при язвенном колите по сравнению с контрольной группой [8,9]. Согласно последним данным, роду Bacteroides отводится значительная роль в формировании воспалительного ответа. А. Altomare и соавт. [10] предложили использовать увеличение количества Bacteroides в биоптатах толстой кишки в качестве биомаркера ВЗК. В нашем исследовании количество представителей рода Bacteroides в биоптатах толстой кишки пациентов основной группы превышало таковое в группе сравнения (p<0,05). Полученные данные подтверждают, что увеличение количества бактерий этого рода в биоптатах толстой кишки и образцах фекалий может быть биомаркером язвенного колита.
О роли представителей класса Bacilli (тип Firmicutes) в развитии воспаления информации несколько меньше. F. Imhann и соавт. [9] показали, что при язвенном колите повышено содержание представителей семейств Enterococcaceae и Lactobacillaceae. В исследовании Lo Presti и соавт. [11] выявлено изменение количества Streptococcus в составе микробиоты толстой кишки при ВЗК. О возможном участии Streptococcus в развитии воспаления свидетельствуют также результаты других исследований, в которых выявлено взаимодействие стрептококковых факторов вирулентности с иммунными клетками, вызывающими воспалительный ответ в различных органах. Мы показали, что в составе пристеночной биоты при язвенном колите содержание Staphylococcus spp., Enterococcus spp., Lactobacillus и Streptococcus достоверно превышает таковое в группе сравнения.
Информации о представителях семейства Veillone llaceae в литературе немного. Altomare и соавт. [10] выявили статистически значимое увеличение содержание Veillonella dispar в пристеночной микробиоте у пациентов с ВЗК независимо от локализации и активности заболевания. В нашем исследовании содержание представителей семейства Veillonellaceae (Dialister + Alisonella + Megaspherae + Veillonella) в слизистой оболочке толстой кишки также было достоверно повышено при язвенном колите.
Многие авторы говорят о важной роли типа Proteo bacteria и увеличении его содержания при ВЗК, причем
как в пристеночной, так и фекальной микробиоте. Прежде всего речь идет о семействе Еnterobacteriaceae и E. coli. Этот факт безусловно имеет место быть в первую очередь при болезни Крона. Altomare и соавт. даже рассматривают Еnterobacteriaceae в образцах стула как биомаркер ВЗК [10]. Однако во все эти исследования включали пациентов как с язвенным колитом, так и болезнью Крона. Вероятно, поэтому в нашем исследовании, в котором принимали участие только пациенты с язвенным колитом, были получены иные результаты. Тип Proteobacteria в составе пристеночной биоты занимал лишь третье место после Firmicutes и Bacteroidetes. Содержание представителей семейства Еnterobacteriaceae и рода Desulfovibrio было достоверно снижено при язвенном колите, в то время как количество E. coli и Sutterella wadsworthensis достоверно не отличалось от контроля.
Таким образом, полученные нами результаты не противоречат опубликованным ранее общемировым данным и позволяют дополнить и уточнить имеющуюся информацию, так как наше исследование было выполнено на выборке пациентов с язвенным колитом.
Заключение
В данной работе проведена комплексная оценка микробного состава как полостной, так и пристеночной биоты с помощью ПЦР в режиме реального времени при различных протяженности поражения толстой кишки, течении, эндоскопической активности и схемах лечения язвенного колита в российской популяции. Новая информация об изменениях микробиоты толстой кишки необходима для лучшего понимания патогенеза язвенного колита и в будущем может стать основой для разработки оптимальных схем обследования и консервативного лечения пациентов.
Используемые источники
- Халиф И.Л., Шелыгин Ю.А. (ред.). Атлас. Воспалительные заболевания кишечника: диагностика и лечение. СПб: Гиппократ; 2017, 116 с. [Atlas. Inflammatory Bowel Disease: Diagnosis and Treatment. Khalif IL, Shelygina JA (ed). SPb: 2017. 116 s. (In Russ.)].
- Лоранская И.Д., Халиф И.Л., Болдырева М.Н. и др. Характеристика микро- биома при воспалительных заболеваниях кишечника. Экспериментальная и клиническая гастроэнтерология 2018;153(5):104–11 [Loranskaya ID, Khalif IL, Boldyreva MN, et al. Characteristic of microbiome in inflammatory bowel disease. Experimental and Clinical Gastroenterology 2018;153(5):104–11 (In Russ.)].
- Clemente JC, Ursell LK, Parfrey LW, et al. The impact of the gut microbiota on human health: an integrative view. Cell 2012;148:1258-70.
- Ивашкин В.Т., Шелыгин Ю.А., Халиф И.Л. и др. Клинические рекоменда- ции российской гастроэнтерологической ассоциации и ассоциации коло- проктологов России по диагностике и лечению язвенного колита. Колопроктология 2017;1:6-30 [Ivashkin VT, Shelygin JA, Halif IL, et al. Clinical guide of Russian association of gastroenterology and Russian association of coloproctology on diagnostics and treatment of ulcerative colitis. Koloproktologia 2017;1:6-30 (In Russ.)].
- National Center for Biotechnological Information, NCBI [Internet]. Available from: https://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi.
- Купаева В.А., Лоранская И.Д., Болдырева М.Н. и др. Особенности микро- биоты кишечника при язвенном колите. Экспериментальная и клиническая гастроэнтерология 2020;179(7). [Kupaeva VA, Loranskaya ID, Boldyreva MN, et al. Features of intestinal microbiota in ulcerative colitis. Experimental and Clinical Gastroenterology 2020;179(7). (In Russ.)].
- Frank DN, Amand AL, Feldman RA, et al. Molecular-phylogenetic characteriza- tion of microbial community imbalances in human inflammatory bowel diseases. Proc Natl Acad Sci USA 2007;104(34):13780-85.
- Kabeerdoss J, Sankaran V, Pugazhendhi S, et al. Clostridium leptum group bacte- ria abundance and diversity in the fecal microbiota of patients with inflammatory bowel disease: a case-control study in India. BMC Gastroenterol 2013;13:20.
- Imhann F, Vich Vila A, Bonder MJ, et al. Interplay of host genetics and gut microbiota underlaying the onset and clinical presentation of inflammatory bowel disease. Gut 2018;67(1):108–19.
- Altomare A, Putignani L, Del Chierico F, et al. Gut mucosal-associated micro- biota better discloses inflammatory bowel disease differential patterns than fecal microbiota. Dig Liver Dis 2019;51(5):648–656.
- Lo Presti A, Zorzi F, Del Chierico F, et al. Fecal and mucosa microbiota profil- ing in irritable bowel syndrome and inflammatory bowel disease. Front Microbiol 2019;10:1655.
