Триггеры декомпенсации различных фенотипов хронической сердечной недостаточности
Изучение клинико-демографических и лабораторно-инструментальных триггеров, ассоциированных с декомпенсацией различных фенотипов хронической сердечной недостаточности (ХСН).
В открытое исследование включены 350 пациентов (средний возраст 72,1±12,3 года, 47,4% женщин), госпитализированных с декомпенсацией сердечной недостаточности (СН). У 43,2% пациентов диагностирована ХСН с низкой фракцией выброса (ФВ; <40%), у 23,4% – с промежуточной ФВ (40-49%), у 34,4 – с сохраненной ФВ (≥50%).
Во всей выборке триггерами декомпенсации ХСН были низкая приверженность к лечению (25,7%), тахисистолическая форма фибрилляции предсердий (24,0%), неэффективный контроль АД (14,9%), бронхолегочная инфекция (7,7%), избыточное потребление соли (6,3%). У 21,1% пациентов не удалось установить явную причину декомпенсации ХСН. У пациентов с низкой ФВ основными триггерами декомпенсации были низкая приверженность к лечению (33,8%) и фибрилляция предсердий (23,8%), у больных с промежуточной ФВ – фибрилляция предсердий (30,5%) и низкая приверженность к лечению (23,2%), у пациентов с сохраненной ФВ – неэффективный контроль АД (25,6%), нарушения сердечного ритма (19,7%), низкая приверженность к терапии (17,1%) и инфекция (14,5%).
Основными причинами декомпенсации ХСН являются низкая приверженность к лечению, фибрилляция предсердий и неэффективный контроль АД. У пациентов с низкой ФВ ведущую роль играет низкая приверженность к лечению, у пациентов с промежуточной ФВ – фибрилляция предсердий, у пациентов с сохраненной ФВ – неэффективный контроль АД.
Хроническая сердечная недостаточность (ХCН) является глобальной проблемой общественного здравоохранения и затрагивает до 26 миллионов человек в мире. В России количество пациентов с ХСН за последние 20 лет увеличилось почти вдвое – с 7,18 до 12,35 млн человек, а количесто больных с ХСН III–IV функционального класса достигло 4,5 млн [1]. ХСН характеризуется повторными госпитализациями на фоне декомпенсаций, что приводит не только к существенному увеличению затрат на лечение, но и значительному ухудшению прогноза жизни больных [2-5].
Одним из ведущих показателей тяжести нарушения функции миокарда у пациентов с ХСН является фракция выброса левого желудочка (ФВ ЛЖ), отражающая его сократительную способность [6]. В зависимости от величины этого показателя пациентов с ХСН разделяют на три группы – с низкой, промежуточной и сохраненной ФВ. Фенотипы ХСН, выделенные в зависимости от ФВ, значительно отличаются по ожи даемой 5-летней выживаемости и риску повторных госпитализаций по поводу декомпенсацией ХСН. Риск смерти у больных с низкой ФВ значительно выше, чем у пациентов с сохраненной ФВ [7,8].
ХСН с промежуточной ФВ диагностируют у 10-20% пациентов с ХСН. Эта форма ХСН занимает особое положение по клиническим, гемодинамическим, эхокардиографическим параметрам и показателям биомаркеров [9]. Механизмы и причины развития данного фенотипа ХСН и подходы к его лечению остаются недостаточно изученными.
Целью исследования было изучение причин декомпенсации фенотипов ХСН, выделенных на основании ФВ, и клинико-демографических показателей пациентов с разными формами ХСН.
Материал и методы
В наблюдательное исследование включали пациентов с декомпенсацией ХСН и любым значением ФВ ЛЖ, госпитализированных в ГКБ им. В.В. Виноградова. Критериями исключения были острый коронарный синдром, тромбоэмболии легочной артерии, выраженные когнитивные нарушения, отказ от предоставления информации о состоянии здоровья и проводимом лечении. ФВ ЛЖ оценивали следующим образом: низкая – <40%, промежуточная – 40-49% и сохраненная – ≥50%. Степень тяжести ХСН определяли на основании функционального класса (ФК) по классификации NYHA (New York Heart Association).
Анализ данных проводился с помощью пакета статистических программ IBM SPSS Statistic 22 с использованием статистических критериев значимости Стьюдента в случае параметрического распределения данных. Непрерывные переменные в зависимости от типа распределения представлены в виде средних значений и стандартных отклонений (M±SD) или медиан и интерквартильного размаха (Med [IQR]). Оценку достоверности различий между группами проводили при помощи непараметрического критерия Манна-Уитни. Частоту непараметрического признака оценивали по методу χ2. При p<0,05 различия считали статистически достоверными.
Результаты
Клиническая характеристика всех больных. В исследование были включены 350 пациентов в возрасте в среднем 72,1±12,3 лет, в том числе 184 (52,6%) мужчины (табл. 1). Медиана ФВ ЛЖ составила 42,0%. Около трети больных курили. У 182 (52,0%) из 350 больных диагностирована ХСН III ФК, у 138 (39,4%) – IV ФК. Две трети госпитализированных больных (69,7%) длительно страдали ХСН. У большинства больных в анамнезе отмечались артериальная гипертония, ИБС, в том числе перенесенный инфаркт миокарда, фибрилляция/трепетание предсердий и/или сахарный диабет, реже анемия, хроническая болезнь почек (ХБП), хроническая обструктивная болезнь легких (ХОБЛ) и острое нарушение мозгового кровообращения. Около четверти больных перенесли различные инвазивные вмешательства, включая имплантацию электрокардиостимулятора или кардиовертера-дефибриллятора, сердечную ресинхронизирующую терапию, аортокоронарное шунтирование или чрескожное коронарное вмешательство. Медиана индекса коморбидности Чарлсона составила 7,0 баллов. У 151 (43,1%) пациента диагностирована ХСН с низкой ФВ, у 82 (23,4%) – с промежуточной ФВ, у 117 (33,5%) – с сохраненной ФВ.
| Показатель | Значение |
|---|---|
| Возраст, лет | 72,1±12,3 |
| Мужчины, n (%) | 184 (52,6) |
| Индекс массы тела, кг/м2 | 30,5 [27,8;35,3] |
| Курение, n (%) | 92 (26,3) |
| Алкоголь, n (%) | 18 (5,1) |
| ИБС, n (%) | 254 (72,6) |
| Инфаркт миокарда в анамнезе, n (%) | 178 (50,9) |
| ХСН в анамнезе, n (%) | 244 (69,7) |
| ХСН de novo, n (%) | 106 (30,3) |
| Артериальная гипертония, n (%) | 329 (94,0) |
| Сахарный диабет, n (%) | 151 (43,1) |
| Фибрилляция/трепетание предсердий, n (%) | 235 (67,1) |
| Инсульт в анамнезе, n (%) | 68 (19,4) |
| Хроническая болезнь почек, n (%) | 74 (21,1) |
| Анемия, n (%) | 88 (25,1) |
| ХОБЛ/астма, n (%) | 73 (20,9) |
| Электрокардиостимулятор, кардиовертер-дефибриллятор, ресинхронизирующая терапия, n (%) |
32 (9,2) |
| Аорто-коронарное шунтирование, n (%) | 23 (6,6) |
| Чрескожное коронарное вмешательство, n (%) | 43 (12,3) |
| Шкала Чарлсона, баллы | 7,0 [6,0;8,0] |
Триггеры декомпенсации ХСН. Во всей выборке причинами декомпенсации ХСН были низкая приверженность к лечению (25,7%), тахисистолическая форма фибрилляции предсердий (24,0%), неэффективный контроль АД (14,9%), бронхолегочная инфекция (7,7%), избыточное потребление соли (6,3%). У 21,1% больных не удалось установить явную причину ухудшения состояния. У пациентов с низкой ФВ на первом месте среди причин декомпенсации ХСН была низкая приверженность к лечению, на втором – фибрилляция предсердий, в то время как у пациентов с промежуточной ФВ, наоборот, чаще отмечалась фибрилляция предсердий и реже – низкая приверженность к лечению (табл. 2). У пациентов с сохраненной ФВ основными причинами декомпенсации ХСН были увеличение АД и фибрилляция предсердий, а низкая приверженность к терапии имела меньшее значение. В этой группе нередкой причиной декомпенсации ХСН были также бронхолегочные инфекции.
| Причины | Низкая ФВ (n=151) (1) |
Промежуточная (ФВ (n=82) (2) |
Сохраненная (ФВ (n=117) (3) |
р (1-2 | р (1-3) | р (2-3) |
|---|---|---|---|---|---|---|
| Артериальная гипертония, n (%) | 10 (6,6) | 12 (7,9) | 30 (25,6) | <0,05 | <0,001 | нд |
| Фибрилляция предсердий, n (%) | 36 (23,8) | 25 (30,5) | 23 (19,7) | нд | нд | нд |
| Инфекция, n (%) | 4 (2,6) | 6 (7,3) | 17 (14,5) | нд | <0,001 | нд |
| Избыточное потребление соли, n (%) | 12 (7,9) | 6 (7,3) | 4 (3,4) | нд | нд | нд |
| Низкая приверженность к лечению, n (%) | 51 (33,8) | 19 (23,2) | 20 (17,1) | нд | <0,05 | нд |
| Не известна, n (%) | 38 (25,1) | 14 (17,0) | 23 (19,6) | <0,05 | <0,05 | нд |
Клиническая характеристика пациентов с разными фенотипами ХСН. Пациенты с низкой ФВ были моложе (68,8±13,3 лет) больных с промежуточной и сохраненной ФВ (табл. 3). Среди них была достоверно выше доля мужчин (72,8%) и курильщиков (23,8%), а также частота ранее диагностированной ХСН, инфаркта миокарда в анамнезе, имплантации электрокардиостимулятора или кардиовертера-дефибриллятора, аортокоронарного шунтирования и чрескожных коронарных вмешательств. Частота ХБП в этой группе была выше, чем в группе больных с сохраненной ФВ.
| Показатели | Низкая ФВ (n=151) (1) |
Промежуточная ФВ (n=82) (2) |
Сохраненная ФВ (n=117) (3) |
р (1-2 | р (1-3) | р (2-3) |
|---|---|---|---|---|---|---|
| Возраст, лет | 68,8±13,3 | 72,3±12,70 | 76,3±9,0 | <0,05 | <0,05 | нд |
| Мужчины, n (%) | 110 (72,8) | 40 (48,8) | 34 (29,1) | <0,05 | <0,001 | <0,05 |
| Индекс массы тела, кг/м2 | 31,3 [27,6;37,9] | 30,4 [27,6;31,8] | 31,2 [28,0;35,6] | нд | нд | нд |
| Курение, n (%) | 36 (23,8) | 6 (7,3) | 12 (10,3) | <0,001 | <0,05 | нд |
| Алкоголь, n (%) | 8 (5,3) | 7 (8,5) | 3 (2,6) | <0,05 | <0,001 | нд |
| ИБС, n (%) | 121 (80,1) | 61 (74,4) | 72 (61,5) | нд | <0,001 | нд |
| Инфаркт миокарда, n (%) | 102 (67,5) | 41 (50,0) | 35 (29,9) | <0,001 | <0,001 | <0,05 |
| ХСН в анамнезе, n (%) | 127 (84,1) | 49 (59,8) | 68 (58,1) | <0,001 | <0,001 | нд |
| Артериальная гипертония, n (%) | 141 (93,4) | 77 (93,9) | 111 (94,9) | нд | нд | нд |
| Сахарный диабет, n (%) | 69 (45,7) | 32 (39,0) | 50 (42,7) | нд | нд | нд |
| Фибрилляция/трепетание предсердий, n (%) | 99 (65,6) | 59 (72,0) | 77 (65,8) | нд | нд | нд |
| Инсульт в анамнезе, n (%) | 24 (15,9) | 11 (13,4) | 33 (28,2) | нд | <0,05 | <0,05 |
| Хроническая болезнь почек, n (%) | 49 (32,4) | 24 (29,3) | 28 (23,9) | <0,05 | нд | нд |
| Анемия, n (%) | 40 (26,5) | 12 (14,6) | 24 (20,5) | нд | нд | нд |
| Имплантируемые устройства, n (%) | 23 (15,3) | 2 (2,4) | 7 (6,0) | <0,05 | <0,05 | нд |
| Аортокоронарное шунтирование, n (%) | 14 (9,3) | 7 (8,5) | 2 (1,7) | <0,05 | <0,05 | нд |
| Чрескожное коронарное вмешательство, n (%) | 22 (14,6) | 8 (9,8) | 13 (11,1) | <0,05 | <0,05 | нд |
| Шкала Чарлсона, баллы | 7,0 [5,0;8,0] | 7,0 [6,0;8,0] | 7,0 [6,0;8,0] | нд | нд | нд |
Группу пациентов с сохраненной ФВ составили в основном люди пожилого и старческого возраста (средний возраст 76,3±9,0 лет). В отличие от двух других групп, среди них преобладали женщины (70,9%). Хотя артериальная гипертония наблюдалась более чем у 90% пациентов всех трех групп, частота острого нарушения мозгового кровообращения у больных с сохраненной ФВ была примерно в два раза выше, чем в двух других группах. Почти у трети пациентов с сохраненной ФВ имелась анемия в анамнезе.
Пациенты с промежуточной ФВ занимали среднее положение между больными с низкой и сохраненной ФВ по возрасту (72,3±12,7 лет), а соотношение мужчин и женщин в этой группе было примерно одинаковым. Доля курильщиков среди пациентов с промежуточной ФВ была самой низкой. Около половины больных перенесли инфаркт миокарда. Частота анемии в анамнезе в этой группе была ниже, чем у больных с низкой и сохраненной ФВ.
Медианы индекса коморбидности Чарлсона и индекса массы тела, частота сахарного диабета 2 типа и ХОБЛ были сопоставимыми в трех группах.
При поступлении у пациентов отмечались одышка при нагрузке (93,4%), ортопноэ (40,9%), отеки нижних конечностей (88,0%) и слабость (73,5%), а при обследовании определялись гепатомегалия (46,9%) и влажные мелкопузырчатые хрипы (61,6%), а также признаки застоя в малом круге кровообращения при рентгенографии органов групдной клетки (53,7%) (табл. 4). Паци ентов с низкой ФВ чаще всего беспокоили слабость (77,1%) и одышка в покое (59,6%) и при нагрузке (95,4%). У пациентов сохраненной ФВ, в отличие от больных с низкой и промежуточной ФВ, чаще встречался отечный синдром как по малому (74,4%), так и по большому кругу кровообращения (93,2%).
| Показатели | Все больные (n=350) | Низкая ФВ (n=151) (1) |
Промежуточная ФВ (n=82) (2) |
Сохраненная ФВ (n=117) (3) |
р (1-2 | р (1-3) | р (2-3) |
|---|---|---|---|---|---|---|---|
| Слабость, n (%) | 257 (73,5) | 116 (77,1) | 52 (63,1) | 78 (66,9) | <0,05 | <0,05 | нд |
| Одышка в покое, n (%) | 189 (54,0) | 96 (59,6) | 38 (46,3) | 55 (47,0) | <0,05 | <0,05 | нд |
| Одышка при нагрузке, n (%) | 327 (93,4) | 144 (95,4) | 76 (92,7) | 107 (91,5) | нд | нд | нд |
| Ортопноэ, n (%) | 143 (40,9) | 66 (43,7) | 31 (37,8) | 46 (39,3) | нд | нд | нд |
| Отеки, n (%) | 308 (88,0) | 130 (86,1) | 69 (84,1) | 109 (93,2) | нд | нд | <0,05 |
| Хрипы в легких, n (%) | 235 (67,1) | 101 (66,9) | 47 (57,3) | 87 (74,4) | нд | нд | <0,05 |
| Гепатомегалия, n (%) | 164 (46,9) | 82 (54,3) | 37 (45,1) | 45 (38,5) | нд | <0,05 | нд |
| Класс по NYHA, n (%) | |||||||
| II | 30 (8,6) | 7 (4,6) | 8 (9,7) | 15 (12,8) | нд | <0,05 | нд |
| III | 182 (52,0) | 84 (55,6) | 40 (48,8) | 58 (49,5) | нд | нд | нд |
| IV | 138 (39,4) | 60 (39,8) | 34 (41,4) | 44 (37,6) | нд | нд | нд |
У 91,4% больных при поступлении отмечалась тяжелая ХСН, в том числе III ФК по NYHA у 52,0% и IV ФК у 39,4%. Во всех группах преобладали пациенты с ХСН III ФК (48,8-55,6%) или IV ФК (37,6-41,4%) (табл. 4). Среди пациентов с III-IV ФК была выше доля пациентов с низкой ФВ (43,5% и 46,2%, соответственно), а среди пациентов со II ФК преобладали больные с сохраненной ФВ (50,0%).
| Показатели | Низкая ФВ (n=151) (1) |
Промежуточная ФВ (n=82) (2) |
Сохраненная ФВ (n=117) (3) |
р (1-2 | р (1-3) | р (2-3) |
|---|---|---|---|---|---|---|
| Систолическое АД, мм рт.ст. | 130,7±24,9 | 131,7±22,5 | 139,7±27,7 | нд | <0,05 | нд |
| Диастолическое АД, мм рт.ст. | 77,8±12,2 | 78,2±13,1 | 80,9±13,7 | нд | <0,05 | нд |
| Частота сердечных сокращений в минуту | 92,4±21,6 | 89,9±23,7 | 88,9±19,9 | нд | нд | нд |
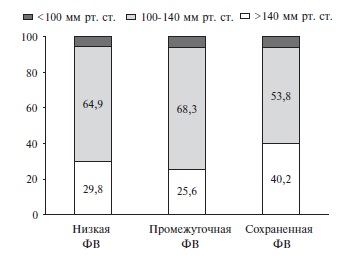
Частота сердечных сокращений (ЧСС) повышалась по мере снижения ФВ (табл. 5). Пациенты с низкой ФВ характеризовались более низкими значениями АД при высокой ЧСС. В группах больных с низкой и промежуточной ФВ преобладали пациенты с САД при поступлении от 100 до 140 мм рт. ст. (64,9-68,3%). Доля пациентов с более высоким систолическим АД в этих группах составляла 25,6-29,8%, а в группе больных с сохраненной ФВ – 40,2%. В то же время доля пациентов с систолическим АД<100 мм рт. ст. достоверно не отличалась между тремя группами (рис. 1).
Лабораторные показатели. Медиана уровня NTproBNP нарастала по мере снижения сократительной функции миокарда и в группе пациентов с низкой ФВ достигла 4856 нг/мл (табл. 6). Активность креатинфосфокиназы (КФК) и МВ-фракции КФК и уровни тропонина при всех фенотипах ХСН оставались в пределах нормы и достоверно не отличались между тремя группами. Уровень глюкозы крови у пациентов с сохраненной ФВ был недостоверно выше, чем у больных двух других групп, хотя доля пациентов с сахарным диабетом была несколько выше среди больных с низкой ФВ. Показатели липидного обмена не различались в зависимости от фенотипа ХСН (табл. 6).
Сывороточный уровень креатинина у пациентов с низкой и промежуточной ФВ был выше, чем у больных с сохраненной ФВ, однако скорость клубочковой фильтрации (СКФ), рассчитанная по формуле CKDEPI, достоверно не отличалась между группами, вероятно, за счет большей доли мужчин в первых двух группах (табл. 6). Уровни билирубина и активность АСТ и АЛТ у пациентов с низкой и промежуточной ФВ были выше, чем у больных с сохраненной ФВ, однако все эти показатели оставались в пределах нормы (табл. 6). Признаки анемии на момент госпитализации в трех группах выявлены не были. У пациентов с сохраненной ФВ отмечены более низкие содержание гемоглобина и количество эритроцитов и более высокое количество тромбоцитов, хотя эти показатели были в пределах референтных значений. Наиболее высокий уровень Среактивного белка (СРБ) при поступлении выявлен в группе пациентов с промежуточной ФВ (32,85 мг/л) (табл. 6).
| Показатели | Низкая ФВ (n=151) (1) |
Промежуточная ФВ (n=82) (2) |
Сохраненная ФВ (n=117) (3) |
р (1-2 | р (1-3) | р (2-3) |
|---|---|---|---|---|---|---|
| NT-proBNP, нг/мл, | 4856,6 [1821,8;5832,4] | 3761,0 [2852,5;4569,0] | 2750,5 [1463,0;4962,0] | нд | <0,05 | <0,05 |
| КФК, Ед/л, | 125,0 [67,8;235,3] | 99,5 [60,5;184,3] | 126,0 [78,3;202,3] | нд | нд | нд |
| МВ-КФК, Ед/л, | 20,0 [14,8;32,8] | 13,1 [10,2;14,6] | 21,4 [12,9;29,5] | нд | нд | нд |
| Тропонин, нг/мл | 0,03±0,005 | 0,03±0,006 | 0,5±0,01 | нд | нд | нд |
| Глюкоза, ммоль/л | 6,2 [5,3;9,0] | 6,2 [5,2;8,3] | 7,1 [5,7;9,6] | нд | нд | нд |
| Общий холестерин, ммоль/л | 3,8 [3,1;4,6] | 4,1 [3,5;4,5] | 3,7 [2,9;4,9] | нд | нд | нд |
| ХС ЛНП, ммоль/л | 2,5 [1,8;3,0] | 2,5 [2,0;2,8] | 2,4 [2,0;3,4] | нд | нд | нд |
| ХС ЛВП, ммоль/л | 0,9 [0,7;1,1] | 1,0 [0,9;1,2] | 1,0 [0,7;1,3] | нд | нд | нд |
| Триглицериды, ммоль/л | 1,2 [0,7;1,8] | 0,9 [0,8;1,4 | 1,0 [0,7;1,2] | нд | нд | нд |
| Мочевая кислота, мкмоль/л | 537,9 [429,0;635,9] | 547,7 [434,9;718,8 | 546,5 [454,7;673,7] | нд | нд | нд |
| Креатинин мкмоль/л | 117,0 [96,5;151,5] | 113,0 [95,0;137,0] | 96,0 [82,0;122,0] | нд | <0,01 | <0,01 |
| СКФ, мл/мин/1,73 м2 | 50,0 [39,0;61,0] | 47,0 [39,0;60,0] | 52,0 [39,5;64,0] | нд | нд | нд |
| АЛТ, Ед/л | 24,0 [14,0;40,0] | 21,9 [16,1;37,4] | 17,0 [12,3; 22,1] | нд | <0,001 | <0,001 |
| АСТ, Ед/л | 31,4 [21,7;48,2] | 28,6 [23,6;42,5] | 19,0 [16,5;30,4] | нд | <0,001 | <0,001 |
| γ-Глютамилтранспептидаза, Ед/л | 55,0 [40,3;116,5] | 59,0 [45,0;220,5] | 58,0 [39,3;524,0] | нд | нд | нд |
| Билирубин общ., мкмоль/л | 20,0 [12,9;33,4] | 16,3 [11,0;27,6] | 14,8 [10,3;20,1] | нд | <0,001 | нд |
| Билирубин пр., мкмоль/л | 6,0 [3,6;14,0] | 4,6 [3,9;6,9] | 3,0 [2,0; 5,7] | нд | <0,001 | <0,05 |
| Гемоглобин, г/л | 136,0 [119,0;151,0] | 134,0 [122,0;147,0] | 127,0 [109,0;135,0] | нд | <0,05 | <0,05 |
| Эритроциты, ×1012/л | 4,6 [4,1;5,4] | 4,8 [4,1;5,3] | 4,1 [3,8;4,8] | нд | <0,001 | <0,05 |
| Тромбоциты, ×109/л | 208,0 [169,0;259,0] | 201,0 [174,0;225,0] | 264,0 [182,5;326,3] | нд | <0,05 | <0,05 |
| СРБ, мг/л | 17,0 [6,2;64,3] | 32,9 [13,9;84,0] | 31,8 [23,8;70,9] | <0,05 | <0,05 | нд |
Лекарственная терапия. Более половины госпитализированных пациентов на догоспитальном этапе получали b-адреноблокаторы (53,1%) и чуть менее половины – блокаторы ренин-ангиотензиновой системы (РАС), в том числе ингибиторы АПФ и антагонисты рецепторов ангиотензина II (30,9 и 17,1%; соответственно). Из мочегонных препаратов всего применяли петлевые диуретики (42,8%) и антагонисты минералокортикоидных рецепторов (33,4%) и реже – тиазидные диуретики (7,7%). Доли пациентов, получавших сердечные гликозиды (18,0%) и статины (18,9%), были сопоставимыми. Лечение нитратами проводилось лишь у 7,1% больных.
Больные с низкой ФВ чаще принимали b-адреноблокаторы, блокаторы РАС и петлевые диуретики с антагонистами минералокортикоидных рецепторов. У четверти пациентов данной группы имелась необходимость в лечении сердечными гликозидами. У пациентов с промежуточной ФВ частота применения ингибиторов АПФ была сходной с таковой у больных с сохраненной ФВ, в то время как частота лечения антагонистами рецепторов ангиотензина II была значительно ниже и соответствовала таковой в группе больных с низкой ФВ. По сравнению с группой пациентов с сохраненной ФВ больные с промежуточной ФВ чаще получали дигоксин и петлевые диуретики. Ни один пациент с промежуточной ФВ не принимал тиазидные диуретики, а лечение антагонистами кальция проводилось менее чем в 10% случаев. В группе пациентов с сохраненной ФВ по сравнению с двумя другими группами была выше частота применения антагонистов кальция и тиазидных диуретиков, что, вероятно, отражало более высокие значения АД. Статины чаще получали больные с низкой ФВ, что объясняется большей частотой ИБС, однако в нитратах нуждались пациенты всех групп. Отмечена тенденция к увеличению частоты применения нитратов по мере снижения сократительной функции миокарда (табл. 7).
Обсуждение
Пациенты с ХСН представляют собой весьма неоднородную группу и отличаются по этиологии поражения сердца, клиническим фенотипам, параметрам гемодинамики, лабораторным данным и, соответственно, клиническим исходам. Все это, в свою очередь, диктует необходимость дальнейшего изучения данного вопроса и разработки максимально персонифицированного подхода к обследованию и лечению конкретного больного не только во время госпитализации, но и при последующем амбулаторном наблюдении.
В данном исследовании при анализе фенотипов ХСН выявлено, что доля пациентов с низкой ФВ составила 43,1%, с промежуточной ФВ – 23,4% и с сохраненной ФВ – 33,5%. Это согласуется с данными как российских, так и зарубежных исследований. В крупнейшем американском регистре OPTIMIZED-HF доля пациентов с ХСН с низкой ФВ составляла 48,8%, а в международном рандомизированном клиническом исследовании CHARM, в котором принимали участие российские центры, – даже 57%, т.е. была существенно выше [10,11]. В 2016 году в московском исследовании анализировались пациенты, поступившие в стационары с ухудшением ХСН: низкая ФВ зарегистрирована у 46% из них, а сохраненная – у 39% [12]. Таким образом, в целом доля больных c ФВ ЛЖ <40% среди больных с ХСН варьируется от 40 до 50% по данным как российских, так и зарубежных исследований [13,14].
Пациенты c низкой ФВ были моложе (средний возраст 68,8±13,3 лет) больных с промежуточной и сохраненной ФВ. Среди них преобладали мужчины: 72,8% против 27,2% среди пациентов с сохраненной ФВ. В этой группе отмечена более высокая частота курения, а у большинства больных наблюдались артериальная гипертония и ИБС, в том числе инфаркт миокарда в анамнезе. Пациенты с низкой ФВ, по сравнению с больными с промежуточной и сохраненной ФВ, чаще подвергались инвазивным вмешательствам, включая имплантацию электрокардиостимулятора или кардиовертера-дефибриллятора, сердечную ресинхронизирующую терапию, аорто-коронарное шунтирование или чрескожное коронарное вмешательство. Кроме этого, в этой группе была значительной доля пациентов с ХБП.
Сопоставимыми клинико-демографические характеристики пациентов с ХСН с сохраненной ФВ были в многоцентровом плацебо-контролируемом исследование I-PRESERVE, в которое включали больных старше 60 лет. В этом исследовании треть пациентов были старше 75 лет, доля женщин составила 60%. У 80% пациентов диагностирована ХСН III–IV ФК по NYHA, а 88% больных длительно страдали АГ [15].
Пациенты с промежуточной ФВ в нашем исследование по клинико-демографическим характеристикам занимали среднее положение между двумя другими фенотипическими группами ХСН. Средний возраст пациентов составил 72,3±12,7 лет. Доли мужчин и женщин были сопоставимыми. Частота ИБС и фибрилляции предсердий была сходной с таковой в группе пациентов с низкой ФВ, а частота ХСН в анамнезе была значительно ниже. Аналогичное преобладание ИБС в структуре причин развития ХСН у больных с низкой и промежуточной ФВ ЛЖ было отмечено при субанализе результатов исследования CHARM и в ряде других исследований [11,16]. Так, в крупном обсервационном исследовании GWTGHF, в которое было включено более 99 тысяч больных с ХСН, госпитализированных в 305 стационаров в США, более половины пациентов как с низкой, так и с промежуточной ФВ ЛЖ имели в анамнезе коронарную болезнь сердца или ишемию миокарда [17,18]. Эти данные свидетельствуют о том, что пациенты с низкой и промежуточной ФВ имеют один и тот же механизм развития ХСН, но находятся на разных стадиях ишемического повреждения миокарда и снижения сократительной функции ЛЖ.
В многочисленных исследованиях продемонстрирована высокая частота сопутствующих заболеваний у больных c ХСН. У пациентов старших возрастных групп с сохраненной ФВ наблюдаются многочисленные причины для госпитализации в стационар, не связанные с декомпенсацией ХСН. В регистре пациентов старше 75 лет с диагнозом ХСН, проводившемся в Санкт-Петербурге, в 68% случаев выявлены по крайней мере два сопутствующих заболевания, а в 38% – 5 и более [19]. Аналогичные данные получены в США. До 65% больных в когортных исследованиях имеют экстракардиальные причины декомпенсации ХСН, особенно при сохраненной ФВ. Это затрудняет правильную диагностику и трактовку причин заболеваемости и смертности пациентов [20].
В нашем исследовании среди причин декомпенсации ХСН во всей выборке ведущую роль играли низкая приверженность к лечению (25,7%) и нарушения ритма сердца (24,0%), в частности тахисистолическая форма фибрилляции предсердий, а также увеличение АД (14,9%) и бронхолегочные инфекции (7,7%). Почти у трети пациентов установить триггер декомпенсации ХСН не удалось. У пациентов с низкой ФВ основной причиной декомпенсации ХСН была низкая приверженность к лечению (33,8%), а фибрилляция предсердий отмечалась реже (23,8%), в то время как у пациентов с промежуточной ФВ ЛЖ, наоборот, фибрилляция предсердий встречалась чаще (30,5%) низкой приверженности к лечению (23,2%). У пациентов с сохраненной ФВ основными причиной декомпенсации ХСН были артериальная гипертония (25,6%) и фибрилляция предсердий (19,7%), а низкая приверженность к терапии (17,1%) и инфекции (14,5%) ушли на второй план. В другом клиническом исследовании основными причинами 30-дневной повторной госпитализации пациентов с ХСН были острая сердечная недостаточность (28,01%), инфекции (9,54%), острое повреждение почек (5,35%), дыхательная недостаточность (4,86%) и пневмония (3,92%), а предикторами увеличения риска повторной госпитализации – возраст, сахарный диабет, ХОБЛ, хроническая почечная недостаточность, заболевание периферических сосудов, анемия и индекс коморбидности Чарлсона ≥3 [21].
В нашем исследовании индекс Чарлсона был высоким (медиана 7,0 [5,0;8,0]) у больных со всеми фенотипами ХСН, что согласуется с данными зарубежных авторов, которые продемонстрировали прямую зависимость повторных госпитализаций от частоты сопутствующих заболеваний [22,23].
Анализ проводимой терапии у пациентов с ХСН позволяет сделать вывод, что она была недостаточной и зачастую неэффективной. Среди пациентов с низкой ФВ 62,3% принимали b-адреноблокаторы, 50,4% – петлевые диуретики, 47,7% – антагонисты минералокортикоидных рецепторов и только 54,3% – блокаторы РАС (39,7% – ингибиторы АПФ и 14,6% – антагонисты ангиотензиновых рецепторов). По данным исследования ЭПОХА–Д–ХСН, дозы основных препаратов для лечения ХСН в амбулаторной практике были далеки от рекомендованных [24]. Недостаточными дозы назначенных препаратов при ХСН были и в регистре CHECK-HF [25,26]. В группах пациентов с промежуточной и сохраненной ФВ лекарственная терапия еще в большей степени не соответствовала рекомендациям по лечению ХСН.
Заключение
ХСН является значимой медико-социальной проблемой и требует персонифицированного подхода к диагностике и лечению. Фенотипы ХСН различаются по этиологическим, клиническим и гемодинамическим факторам. Соответственно, и течение заболевания, методы лечения и прогноз у пациентов могут зависеть от способности врача учитывать эти особенности.
Используемые источники
- Фомин И.В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал 2016;8:7–13 [Fomin IV. Chronic heart failure in the Russian Federation: what do we know and what to do. Russian Journal of Cardiology 2016;8:7–13 (In Russ.)].
- Stewart S. Financial aspects of heart failure programs of care. Eur J Heart Fail 2005;12(7): 423-8.
- Klersy C, Silvestri AD, Gabutti G, et al. Economic impact of remote patient monitoring: an integrated economic model derived from a meta-analysis of randomized controlled trials in heart failure. Eur J Heart Fail 2011;13(12), 450-9.
- Stewart S, Jenkins A, Buchan S, et al. The current cost of heart failure to the National Health Service in the UK. Eur J Heart Fail 2002;4(3):361–71.
- Setoguchi S, Stevenson LW, Schneeweiss S. Repeated hospitalizations predict mortality in the community population with heart failure. Am Heart J 2007;154(2):260–6.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM, et al. Echocardiography in heart failure: applications, utility, and new horizons. J Am Coll Cardiol 2007; 50:381–96.
- Snyder ML, Love SA, Sorlie PD, et al. Redistribution of heart failure as the cause of death: the Atherosclerosis Risk in Communities Study. Popul Health Metr 2014;12(1):10.
- Rich JD, Burns J, Freed BH, et al. Meta-analysis global group in chronic (MAGGIC) heart failure risk score: Validation of a simple tool for the prediction of morbidity and mortality in heart failure with preserved ejection fraction. J Amer Heart Ass 2018;20(7):e009594.
- Lam CS, Solomon SD. The middle child in heart failure: heart failure with midrange ejection fraction (40-50%). Eur J Heart Fail 2014;16:1049–55.
- Abraham WT, Fonarow GC, Albert NM, et al. Predictors of in-hospital mortality in patients hospitalized for heart failure: insights from the Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure (OPTIMIZE-HF). J Am Coll Cardiol 2008;52(5):347–56.
- Lund LH, Claggett B, Liu J, et al. Heart failure with mid-range ejection fraction in CHARM: characteristics, outcomes and effect of candesartan across the entire ejection fraction spectrum. Europ J Heart Fail 2018;20(8):1230-9.
- Шаварова Е.К., Падарьян С.С., Лукина О.И. и др. Хроническая сердечная недостаточность: рекомендации и реальная клиническая практика. Рациональная фармакотерапия в кардиологии 2016;12(6):631–7 [Shavarova EK, Babaeva LA, Padaryan SS, et al. Chronic heart failure: clinical guidelines and real clinical practice. Rational Pharmacotherapy in Cardiology 2016;12(6):631-7 (In Russ.)].
- Sato N, Kajimoto K, Asai K, et al. Acute decompensated heart failure syndromes (ATTEND) registry. A prospective observational multicenter cohort study: rationale, design, and preliminary data. Am Heart J 2010;159 (6):949-55.
- Maggioni AP, Dahlstrom U, Filippatos G, et al. EURObservational Research Programme: regional differences and 1-year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). Eur J Heart Fail 2013;15(7):808–17.
- McMurray J, Carson P, Komajda M, et al. Heart failure with preserved ejection fraction: Clinical characteristics of 4133 patients enrolled in the I-PRESERVE trial. Eur J Heart Fail 2008;10:149–56.
- Kapoor JR, Kapoor R, Ju C, et al. Precipitating clinical factors, heart failure characterization, and outcomes in patients hospitalized with heart failure with reduced, borderline, and preserved ejection fraction. JACC: Heart Failure 2016;4(6): 464–72.
- Lam CSP, Teng T-HK. Understanding heart failure with mid-range ejection fraction. JACC: Heart Failure 2016;4(6):473–6.
- Braunstein JB, Anderson GF, Gerstenblith G, et al. Noncardiac comorbidity increases preventable hospitalizations and mortality among Medicare beneficiaries with chronic heart failure. J Am Coll Cardiol 2003;42(7):1226–33.
- Ситникова М.Ю., Лелявина Т.А., Шляхто Е.В., Вологдина И.В. Особен ности клиники, диагностики и прогноза хронической сердечной недостаточности у госпитализированных пациентов старческого возраста. Журнал Сердечная Недостаточность 2006;7(2):85–7 [Sitnikova MYu, Lelyavina TA, Shlyakhto EV, Vologdina IV. Features of the clinic, diagnosis and prognosis of chronic heart failure in hospitalized senile patients. ZHurnal Serdechnaya Nedostatochnost'. 2006;7(2):85–7 (In Russ.)].
- Ather S, Chan W, Bozkurt B, et al. Impact of noncardiac comorbidities on morbidity and mortality in a predominantly male population with heart failure and preserved versus reduced ejection fraction. J Am Coll Cardiol 2012;59(11): 998–1005.
- Arora S, Lahewala S, Hassan Virk HU, et al. Etiologies, trends, and predictors of 30-day readmissions in patients with diastolic heart failure. Amer J Cardiol 2017;120(4):616-24.
- Cordier T, Slabaugh L, Haugh G, et al. Achy breaky heart – quality of life changes with progressing congestive heart failure. J Cardiac Fail 2015;21(8):s56. Visaria A, Balkan L, Pinheiro L, et al. Relation of a simple cardiac co-morbidity count and cardiovascular readmission after a heart failure hospitalization. Amer J Cardiol 2020;125(10):1529-35.
- Поляков Д.С., Фомин И.В., Валикулова Ф.Ю. и др. Эпидемиологическая программа ЭПОХА–ХСН: декомпенсация хронической сердечной недостаточности в реальной клинической практике (ЭПОХА–Д– ХСН). Журнал Сердечная Недостаточность 2016;17(6):299–305 [Polyakov DS, Fomin IV, Valikylova FU, et al. Epidemiological program EPOHA – CHF: decompensation of chronic heart failure in real clinical practice (EPOCHA – D – CHF). ZHurnal Serdechnaya Nedostatochnost' 2016;17(6):299–305 (In Russ.)].
- Brunner-La Rocca HP, Linssen GC, et al., Contemporary drug treatment of chronic heart failure with reduced ejection fraction: The CHECK-HF Registry. JACC Heart Fail 2019;7(1)13-21.
- Greene SJ, Fonarow GC, DeVore AD, et al. Titration of medical therapy for heart failure with reduced ejection fraction. J Am Coll Cardiol 2019;73:2365-83.
