Частота, клиническая характеристика и эхокардиографические фенотипы сердечной недостаточности у пациентов с сахарным диабетом 2-го типа
Изучение частоты, клинической характеристики и эхокардиографических фенотипов сердечной недостаточности (СН) у пациентов с сахарным диабетом 2-го типа (СД2) по данным госпитального регистра.
В одноцентровое проспективное исследование были включены 1008 госпитализированных пациентов c СД2. Диагноз СН устанавливали в соответствии с Европейскими рекомендациями по диагностике и лечению СН (ESC, 2016 г.). На основании эхокардиографии выделяли СН с сохраненной, промежуточной и низкой фракцией выброса (ФВ) левого желудочка.
СН, преимущественно с со х - раненной ФВ, была выявлена у 68,1% госпитализированных пациентов с СД2 и, независимо от фенотипа, часто сочеталась со снижением СКФ менее 60 мл/ мин/1,73 м 2 и анемией.
Сахарный диабет 2-го типа (СД2) является самостоятельным фактором риска сердечной недостаточности (СН), не зависимым от других сердечнососудистых заболеваний, в частности артериальной гипертонии (АГ) и ишемической болезни сердца (ИБС) [1-4]. СД2 служит одной из основных причин развития СН в России [5,6], а среди пациентов, госпитализированных с декомпенсацией СН, частота СД2 может достигать 40% [3]. Развитие СН с низкой и промежуточной фракцией выброса левого желудочка ассоциировано с ИБС и перенесенным инфарктом миокарда (ИМ), а СН с сохраненной ФВ – с АГ, нефропатией и возрастом [1]. Данные о фенотипах СН при СД2 в российской госпитальной практике немногочислены.
Трудности ведения пациентов с СД2 и СН связаны как с неоднородностью попу ляции, так и с отсутствием оптимальных скрининговых алгоритмов [1]. Следует подчеркнуть, что исследования, в которых оценивали частоту СН у пациентов с СД2 и их клиническую характеристику, проводились или в амбулаторной когорте пациентов, или с использованием критериев, зачастую не соответствующих применяемым в клинической практике. В ряде случаев СН у пациентов с СД2 остается недиагностированной [7,8].
Данные об истинной частоте СН у пациентов с СД2 и их клинико-лабораторных характеристиках в условиях реальной клинической практики остаются ограниченными. Целью исследования было изучение частоты СН, ее фенотипов и клинико-лабораторной характеристики у пациентов с СД2 по данным госпитального регистра.
Материал и методы
В одноцентровое проспективное исследование включали пациентов старше 40 лет, госпитализированных в ГБУЗ ГКБ им В.В. Виноградова с диагнозом СД2 в качестве основного или сопутствующего заболевания, страдавших или не страдавших сердечно-сосудистыми заболеваниями. Критериями исключения были СД 1-го типа, другие нарушения углеводного обмена и острый коронарный синдром. Регистрировали возраст и пол пациентов, причины госпитализации и сопутствующие заболевания, результаты объективного осмотра, лабораторные и инструментальные данные.
Уровни NT-proBNP определяли в сыворотке венозной крови с помощью набора для иммуноферментного анализа "NTproBNP-ИФА-БЕСТ" (Россия, ЗАО "Вектор-Бест").
Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI. СКФ <60 мл/мин/1,73 м2 считали признаком хронической болезни почек (ХБП) в соответствии с рекомендациями KDIGO [9]. Анемию устанавливали на основании уровня гемоглобина в общем анализе крови в соответствии с рекомендациями Всемирной организации здравоохранения [10].
Стандартная эхокардиография на аппаратах Vivid Е90 (General Electric, США) проводилась на 1-3-й день госпитализации для оценки ФВ левого желудочка и выявления сопутствующих заболеваний и зон нарушения локальной сократимости. Во время исследования использовали стандартные проекции, позволяющие обеспечить регистрацию необходимых параметров при оптимальном уровне визуализации.
Диагноз СН и ее эхокардиографические фенотипы (СН с сохраненной, промежуточной и низкой ФВ) устанавливали в соответствии с рекомендациями ESC 2016 года [11]. Алгоритм диагностики СН, использованный в проспективном исследовании в рамках регистра, представлен на рис. 1.
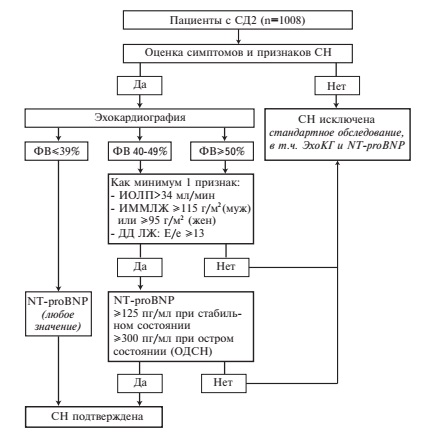
Статистический анализ. Ведение базы данных исследования проводили с помощью программного обеспечения Microsoft Excel 2019, а статистический анализ – с помощью Statsoft Statistica 8.0. Характер распределения признаков определяли с помощью критериев Шапиро-Уилка, Колмогорова-Смирнова и Лиллиефорса. Параметрические методы статистики применяли при нормальном характере распределения. Для количественных показателей рассчитывали среднюю арифметическую величину (М) и стандартное отклонение (SD). При сравнении количественных показателей у пациентов с СН и без СН в большинстве случаев использовали t-критерия Стьюдента. Различия показателей в нескольких группах оценивали с помощью критерия Краскел-Уоллиса. При ненормальной распределении признаков вычисляли медиану (Mе) и межквартильный интервал (IQR). Приемлемым считали уровень значимости p<0,05.
Результаты
В проспективное исследование были включены 1008 пациентов в возрасте в среднем 70,1±10,9 лет с СД2, в том числе 55,8% женщин. Подавляющее большинство пациентов имели в анамнезе АГ (табл. 1). Зареги стрирована достаточно высокая распространенность фибрилляции или трепетания предсердий (42,9%), а более чем у половины пациентов наблюдалось снижение СКФ <60 мл/мин/1,73 м2. Средний уровень HbA1c превышал целевые значения. 560 (55,6%) пациентов были госпитализированы в связи с сердечно-сосудистыми заболеваниями, причем 316 (31,3%) – с декомпенсацией хронической СН.
| Показатель | Значение |
|---|---|
| Возраст, лет (М±SD) | 70,1±10,9 |
| Мужчины, n (%) | 446 (44,2) |
| Причины госпитализации, n (%) | |
| Сердечно-сосудистые заболевания | 560 (55,6) |
| Другие | |
| Количество сердечно-сосудистых заболеваний на пациента | 2 (1; 2,5) |
| Сопутствующие заболевания, n (%) | |
| Артериальная гипертония | 975 (96,7) |
| Атеросклеротические сердечно-сосудистые заболевания | 632 (62,7) |
| Фибрилляция или трепетание предсердий | 432 (42,9) |
| Снижение СКФ<60 мл/мин/1,73 м2 | 668 (66,3) |
| Средний HbA1c, % | 8,9±2,6 |
Характеристика пациентов в зависимости от наличия СН. СН была диагностирована у 686 (68,1%) из 1008 пациентов с СД2, включенных в исследование. Пациенты с СН были старше пациентов без СН (72,0±10,3 и 66,1±11,0 лет, соответственно, р<0,05) (табл. 2). В обеих группах преобладали женщины (53,9% и 59,6%, соответственно; p<0,05), доля которых была
| Показатели | Пациенты с СН (n=686) | Пациенты без СН (n=322) |
|---|---|---|
| Примечание: *p<0,05 | ||
| Средний возраст, лет | 72,0±10,3 | 66,1±11,0 |
| Женщины, n (%) | 370 (53,9 | 192 (59,6)* |
| Сопутствующие заболевания, n (%) | ||
| Артериальная гипертония | 671 (97,8) | 304 (94,4)* |
| ИБС | 352 (51,3) | 115 (35,7)* |
| Инфаркт миокарда в анамнезе | 269 (39,2) | 51 (15,8)* |
| Фибрилляция/трепетание предсердий | 343 (50,0) | 89 (27,6)* |
| Кардиомиопатия | 22 (3,2) | 0* |
| Инсульт в анамнезе | 160 (23,3) | 63 (19,6) |
| Заболевание периферических артерий | 122 (17,8) | 52 (16,1) |
| Снижение СКФ <60 мл/мин/1,73 м2 | 510 (74,3) | 158 (49,1)* |
| Анемия | 285 (41,5) | 86 (26,7)* |
выше среди больных без СН. Частота АГ, ИБС, инфаркта миокарда в анамнезе, фибрилляции/трепетания предсердий и кардиомиопатии в группе пациентов с СН была достоверно выше, чем в группе больных без СН, в то время как частота острого нарушения мозгового кровообращения и заболеваний периферических артерий достоверно не отличалась между двумя группами. Кроме того, у пациентов с СН значительно чаще наблюдали снижение СКФ <60 мл/мин/1,73 м2 (74,3% и 49,1%, соответственно; p<0,05) и анемию (41,5% и 26,7%; p<0,05).
| Показатели | Пациенты без СН (n=322) |
Пациенты с СН | ||
|---|---|---|---|---|
| Сохраненная ФВ (n=324) |
Промежуточная ФВ (n=182) |
Низкая ФВ (n=180) |
||
| Средний возраст, лет | 66,1±11,0 | 73,8±10,2 | 72,2±10,0 | 68,4±10,2 |
| Мужчины, n (%) | 130 (40,4) | 105 (32,4) | 73 (40,1) | 138 (76,7) |
| Причины госпитализации, n (%) | ||||
| Декомпенсация хронической СН | 51 (15,8) | 104 (32,1) | 71 (39,0) | 90 (50,0) |
| Декомпенсация СД | 78 (24,2) | 40 (12,3) | 20 (11,0) | 8 (4,4) |
| Гипертонический криз | 31 (9,6) | 24 (7,4) | 5 (2,7) | 5 (2,8) |
| Фибрилляция/трепетание предсердий | 19 (5,9) | 19 (5,9) | 5 (2,7) | 6 (3,3) |
| Прочие | 54 (16,8) | 83 (25,6) | 52 (28,3) | 59 (32,9) |
| Сопутствующие заболевания, n (%) | ||||
| Артериальная гипертония | 304 (94,4) | 314 (96,9) | 179 (98,4) | 178 (98,9) |
| ИБС | 115 (35,7) | 120 (37,0) | 97 (53,3) | 135 (75,0) |
| Инфаркт миокарда в анамнезе | 51 (15,8) | 77 (23,8) | 70 (38,5) | 122 (67,8) |
| Фибрилляция/трепетание предсердий | 89 (27,6) | 148 (45,7) | 101 (55,5) | 94 (52,2) |
| Инсульт в анамнезе | 63 (19,6) | 84 (25,9) | 42 (23,1) | 34 (18,9) |
| Заболевание периферических артерий | 52 (16,1) | 52 (16,0) | 35 (19,2) | 35 (19,4) |
| Дилатационная кардиомиопатия | 0 (0,0) | 0 (0,0) | 3 (1,6) | 19 (10,6) |
| Анемия | 86 (26,7) | 142 (43,8) | 75 (41,2) | 68 (37,8) |
| СКФ<60 мл/мин/1,73 м2 | 158 (49,1) | 244 (75,3) | 139 (76,4) | 127 (70,6) |
| HbA1c, % (M±SD) | 9,2±2,4 | 9,0±3,0 | 7,5±1,8 | 9,1±3,2 |
| NT-proBNP, нг/мл (Me, IQR) | 194 (20; 480) | 2630 (150; 6938) | 4410 (130; 10019) | 5420 (240; 11942 |
| Гемоглобин, г/л (M±SD) | 134,0±20,4 | 123,6±23,5 | 126,7±22,3 | 131,2±22,7 |
| СКФ, мл/мин/1,73 м2 (M±SD) | 59,6±19,2 | 48,1±19,1 | 47,8±18,7 | 51,2±19,2 |
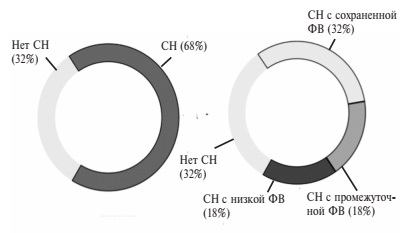
Эхокардиографические фенотипы СН. В соответствии с классификацией ESC 2016 г. у 324 (47,2%) пациентов наблюдалась СН с сохраненной ФВ, у 182 (26,5%) – с промежуточной ФВ и у 180 (26,2%) – с низкой ФВ (рис. 2). Пациенты с сохраненной ФВ были старше больных с другими фенотипами СН и пациентов без СН (табл. 3). Среди больных с сохраненной ФВ преобладали женщины (67,6%), в то время как большинство пациентов с низкой ФВ составляли мужчины (76,7%). В то же время пациенты с промежуточной ФВ не отличались от пациентов без СН по полу (доля мужчин в двух группах составляла 40,1 и 40,4%, соответственно). У пациентов с низкой ФВ декомпенсация хронической СН была причиной госпитализации достоверно чаще (50,0%; p<0,05), чем в других группах Частота сопутствующих сердечно-сосудистых заболеваний приведена в табл. 3. Частота ИБС не отличалась между группами пациентов без СН и больных СН с сохраненной ФВ, однако частота инфаркта миокарда в анамнезе была достоверно выше у пациентов второй группы (p<0,05). Статистически достоверных различий частоты заболеваний периферических артерий между группами не выявлено.
Уровень NT-proBNP у пациентов с СН, особенно с низкой ФВ, был достоверно выше, чем у больных без СН (табл. 3). Частота анемии и снижения СКФ не зависела от ФВ.
Обсуждение
С помощью использованного в регистре алгоритма СН была диагностирована у 68,1% и 1008 пациентов с СД2, включенных в исследование. Необходимо учитывать, что исследование проводилось у пациентов, поступающих в стационар скорой помощи, поэтому частота СН значительно превышала таковую в когортном исследовании у амбулаторных больных СД2 (32%) [12]. Кроме того, частота СН значительно увеличивается с возрастом пациентов с СД2 [13], а в нашем исследовании средний возраст больных составлял 70,1±10,9 лет.
Почти у половины пациентов с СН, развившейся на фоне СД2, наблюдалась сохраненная ФВ, в то время доли пациентов с низкой и промежуточной ФВ были сопоставимыми. Данные литературы о частоте эхокардиографических фенотипов СН у пациентов с СД2 немногочисленные. К примеру, СД2 имелся у 36,4% из 2896 пациентов, включенных в исследование Health ABC Study. В течение 11,4 лет СН развилась у 484 (16,7%) пациентов, в том числе у 214 (44,2%) больных СД2. У 45,2% из них ФВ была низкой, а у 54,8% – сохраненной [14].
Среди пациентов с СН, в том числе с низкой и сохраненной ФВ, распространенность СД2 варьируется в пределах 10-47% [2]. В крупном проспективном регистре ASIAN-HF, в который были включены 5028 больных СН с низкой ФВ и 1139 пациентов с СН с сохраненной ФВ, частота СД2 составила 40,2% и 45,0%, соответственно [15].
В настоящем исследовании частота артериальной гипертонии, ИБС, инфаркта миокарда в анамнезе и фибрилляции/трепетания предсердий у пациентов с различными фенотипами СН была достоверно выше, чем у больных без СН. Хотя частота ИБС не различалась между группами пациентов без СН и больных СН с сохраненной ФВ, инфаркт миокарда в анамнезе достоверно чаще встречался у пациентов второй группы. Это свидетельствует о том, что именно перенесенный инфаркт миокарда является значимым фактором риска развития СН с сохраненной ФВ у пациентов с СД2. В регистре SWEDEHEART было показано, что СД2 ассоциирован с развитием СН, в том числе с сохраненной ФВ, у пациентов с первым инфарктом миокарда (скорректированное отношение рисков 1,56, 95% доверительный интервал 1,39-1,76) [16]. Необходимо также обратить внимание на достаточно высокую распространенность фибрилляции/трепетания предсердий в этой группе пациентов.
У двух третей пациентов, включенных в регистр, при поступлении было отмечено снижение СКФ менее 60 мл/мин/1,73 м2. Частота ХБП у больных с СН была достоверно выше, чем у пациентов без СН. В настоящее время подтверждена гипотеза о центральной роли почек в генезе СН с сохраненной ФВ [17,18]. Подтвер ждением участия почек в патофизиологии СН, как минимум с низкой ФВ, являются результаты клинических исследований, в которых изучалось влияние ингибиторов натрий-глюкозного котранспортера 2-го типа на риск сердечно-сосудистых и почечных исходов (CREDENCE, DAPA-CKD) [19,20].
Известно, что прогрессирование диабетической нефропатии способствует развитию анемии [21]. Кроме того, наличие СН, применение сахароснижающих препаратов, к примеру метформина, и ингибиторов ренинангиотензиновой системы дополнительно могут увеличивать риск развития анемии [22,23]. В настоящем исследовании у пациентов с СД2 и СН анемия встречалась в два раза чаще чем у пациентов без СН. Аналогичная тенденция наблюдалась у пациентов со всеми фенотипами СН.
Заключение
В госпитальной когорте пациентов с СД2 отмечена высокая частота СН (68,1%). Ожидаемо, что среди пациентов с СН и СД2 по сравнению с пациентами без СН чаще встречались сердечно-сосудистые заболевания, в частности АГ, ИБС, перенесенный ИМ и фибрилляция/трепетание предсердий. У большей части пациентов была диагностирована СН с сохраненной ФВ (47,2%), а пациенты с СН с промежуточной и низкой ФВ были представлены в равном соотношении (26,5% и 26,2%, соответственно). Снижение СКФ менее 60 мл/мин/1,73 м2 и анемия статистически значимо чаще встречались в группе пациентов с СН вне зависимости от фенотипа СН по сравнении с группой пациентов без СН, а у больных СН с сохраненной ФВ чаще встречался перенесенный ИМ, но не ИБС. Врачам, наблюдающим пациентов с СД2 необходимо быть настороженными в отношении наличия СН, особенно при обследовании пациентов, поступающих в городской стационар скорой помощи.
Используемые источники
- Seferović PM, Petrie MC, Filippatos GS, et al. Type 2 diabetes mellitus and heart failure: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2018;20(5):853-72.
- Dunlay SM, Givertz MM, Aguilar D, et al. Type 2 Diabetes Mellitus and Heart Failure: A Scientific Statement From the American Heart Association and the Heart Failure Society of America. Circulation 2019;140(7):e294-e324.
- Dei Cas A, Khan SS, Butler J, et al. Impact of diabetes on epidemiology, treatment and outcomes of Patients with heart failure. JACC Heart Failure 2015;3:136-45.
- Low Wang CC, Hess CN, Hiatt WR, Goldfine AB. Clinical update: cardiovascular disease in diabetes mellitus: atherosclerotic cardiovascular disease and heart failure in type 2 diabetes mellitus – mechanisms, management, and clinical considerations. Circulation 2016;133(24):2459-502.
- Мареев В.Ю., Фомин И.В., Агеев Ф.Т., и др. Клинические рекомендации ОССН - РКО - РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология 2018;58(6S):8-158. [Mareev VYu, Fomin IV, Ageev FT, et al. Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment. Kardiologiia 2018;58(6S):8-158. (In Russ)].
- Фомин И.В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал 2016;8:7-13 [Fomin IV. Chronic heart failure in Russian Federation: what do we know and what to do. Russian Journal of Cardiology 2016;(8):7-13. (In Russ)].
- Boonman-de Winter LJ, Rutten FH, Cramer MJ, et al. High prevalence of previously unknown heart failure and left ventricular dysfunction in patients with type 2 diabetes. Diabetologia 2012;55(8):2154-62.
- Kievit RF, Gohar A, Hoes AW, et al. Efficient selective screening for heart failure in elderly men and women from the community: A diagnostic individual participant data meta-analysis. Eur J Prev Cardiol 2018;25(4):437-46.
- KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Summary of Recommendation Statements. Kidney Intern Suppl 2013;3(1):5-14.
- WHO. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. Vitamin and Mineral Nutrition Information System. Geneva, World Health Organization [Electronic resource]. 2011. URL: http://www.who.int/ vmnis/indicators/haemoglobin.pdf (accessed: 28.04.2020).
- Ponikowski P, Voors A, Anker S, и др. Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности 2016. Российский кардиологический журнал. 2017;1:7-81 [Ponikowski P, Voors A, Anker S, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Russian Journal of Cardiology 2017;(1):7-81 (In Russ)]
- Einarson TR, Acs A, Ludwig C, Panton UH. Prevalence of cardiovascular disease in type 2 diabetes: a systematic literature review of scientific evidence from across the world in 2007-2017. Cardiovasc Diabetol 2018;17(1):83.
- Bertoni AG, Hundley WG, Massing MW, et al. Heart failure prevalence, incidence, and mortality in the elderly with diabetes. Diabetes Care 2004;27(3):699-703.
- Khan H, Anker SD, Januzzi JL, et al. Heart failure epidemiology in patients with diabetes mellitus without coronary heart disease. J Card Fail 2019;25(2):78-86.
- Yap J, Tay WT, Teng TK, et al. Association of diabetes mellitus on cardiac remodeling, quality of life, and clinical outcomes in heart failure with reduced and preserved ejection fraction. J Am Heart Assoc 2019;8(17):e013114.
- Ritsinger V, Nystr m T, Saleh N, et al. Heart failure is a common complication after acute myocardial infarction in patients with diabetes: A nationwide study in the SWEDEHEART registry. Eur J Prev Cardiol 2020 Feb 4:2047487319901063. Epub ahead of print.
- Fang JC. Heart failure with preserved ejection fraction: a didney disorder? Circulation 2016;134(6):435-7.
- Fitchett D, Butler J, van de Borne P, et al. Effects of empagliflozin on risk for cardiovascular death and heart failure hospitalization across the spectrum of heart failure risk in the EMPA-REG OUTCOME trial. Eur Heart J 2018;39(5):363-70.
- Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019;380(24):2295-306.
- Heerspink HJL, Stef nsson BV, Correa-Rotter R, et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383(15):1436-46.
- Barbieri J, Fontela PC, Winkelmann ER, et al. Anemia in patients with type 2 diabetes mellitus. Anemia 2015;2015:354737.
- Grote Beverborg N, van Veldhuisen DJ, van der Meer P. Anemia in heart failure: still relevant? JACC Heart Fail 2018;6(3):201-8.
- Angelousi A, Larger E. Anaemia, a common but often unrecognized risk in diabetic patients: a review. Diabetes Metab 2015;41(1):18-27.
