Эффективность тоцилизумаба у пациентов с COVID-19, госпитализированных в ОРИТ: ретроспективное когортное исследование
Изучить эффективность более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в отделения реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки.
В ретроспективное когортное исследование включали пациентов с тяжелой COVID-19 пневмонией, госпитализированных в связи с ухудшением оксигенации в ОРИТ российских лечебных учреждений с 16 марта по 5 мая 2020 г. Всем пациентам проводилась стандартная терапия, а часть больных получили также тоцилизумаб внутривенно в дозе 400 мг. Госпитальную летальность от любых причин сравнивали между группами пациентов, которым вводили и не вводили тоцилизумаб, с помощью модели логистической регрессии с поправкой на возраст и пол.
В исследование были включены 328 пациентов (57,0% мужчин, медиана возраста 59 лет), 159 из которых получили по крайней мере одну инфузию тоцилизумаба. Препарат применяли у 83 (60,1%) из 137 больных, находившихся на оксигенотерапии или неинвазивной вентиляции легких (более раннее введение), и 76 (39,8%) из 191 интубированного пациента (позднее введение). Ни более раннее, ни позднее введение тоцилизумаба не привело к снижению риска смерти по сравнению с соответствующими контрольными группами больных, не получавших ингибитор интерлейкина-6 (скорректированные по возКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (4) расту и полу отношения шансов составили 2,370, 95% ДИ 0,969-5,798; р=0,059, и 0,996, 95% ДИ 0,539-1,839; р=0,989, соответственно).
Более раннее введение тоцилизумаба у неинтубированных пациентов с тяжелой COVID-19 пневмонией и поздняя инфузия препарата после начала ИВЛ не привели к снижению летальности от всех причин.
Число пациентов с COVID-19 во многих странах продолжает быстро увеличиваться, а общее число зарегистрированных в мире случаев инфекции в ноября 2020 г. превысило 60 млн. Хотя в большинстве случаев инфекция, вызванная SARSCoV-2, характеризуется благоприятным течением, у 5-10% госпитализированных больных с вирусной пневмонией развивается острый респираторный дистресс синдром (ОРДС), требующий респираторной поддержки в отделении реанимации и интенсивной терапии (ОРИТ) [1-3]. В российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%, а основными предикторами неблагоприятного исхода были пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет 2 типа и коронарная болезнь сердца [4]. Летальность была достаточно низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно уве личивалась у больных, которых приходилось переводить на неинвазивную (36,8%) и особенно искусственную (76,5%) вентиляцию легких.
Причиной развития быстро прогрессирующего поражения легких при COVID-19 считают гипериммунный воспалительный ответ, сопровождающийся выбросом различных цитокинов [5]. Ранее синдром выделения цитокинов, или "цитокиновый шторм", был описан при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-T-клеточной терапии онкологических заболеваний [6]. Хотя "цитокиновый шторм" упоминается практически во всех статьях, посвященных COVID-19, общепринятые критерии его диагностики до сих пор отсутствуют. На практике синдром выброса цитокинов предполагают у пациентов с SARS-CoV-2 пневмонией 3-4 стадии (т.е. с поражением более 50% легочной ткани), сопровождающейся снижением SpO2≤93%, стойкой лихорадкой и повышением содержания лабораторных маркеров воспаления, в том числе С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, интерлейкина (ИЛ)-6, а также Dдимера. R. Caricchio и соавт. при анализе лабораторных показателей и клинических проявлений более чем у 500 пациентов c COVID-19 пришли к выводу, что существующие критерии синдрома выброса цитокинов, такие как HScore и др., не позволяют идентифицировать это осложнение SARS-CoV-2 инфекции, и предложили собственные критерии, отражающие (1) воспаление, (2) гибель клеток и повреждение ткани и (3) преренальные электролитные нарушения (табл. 1). Эти критерии позволяли с достаточной точностью предсказать более длительную госпитализацию и летальность [7]. Следует отметить, что к числу критериев синдрома выброса цитокинов авторы отнесли увеличение абсолютного количества нейтрофилов, которое, по-видимому, указывает на важную роль врожденного иммунитета в развитии "цитокинового шторма" при COVID-19 и во многих случаях не является признаком вторичной бактериальной инфекции, требующим назначения антибиотиков.
| Необходимые критерии (все) | Значения |
| Симптомы COVID-19 | + |
| ПЦР на SARS-CoV-2 | ± |
| Матовые стекла на КТ | + |
| Ферритин | >250 нг/мл |
| СРБ | >46 мг/л |
| И (один показатель из каждого кластера) | |
| Кластер I | |
| Альбумин | <28 г/л |
| Лимфоциты | <10,2% |
| Абсолютное число нейтрофилов | >11400 в мм3 |
| Кластер II | |
| АЛТ | >60 Ед/л |
| АСТ | >87 Ед/л |
| D-димер | >4930 нг/мл |
| ЛДГ | >416 Ед/л |
| Тропонин I | >1,09 нг/мл |
| Кластер III | |
| Анионный разрыв | <6,8 ммоль/л |
| Хлориды | >106 ммоль/л |
| Калий | >4,9 ммоль/л |
| Азот мочевины/креатинин | >29 |
Предполагаемая роль синдрома выброса цитокинов в патогенезе тяжелого поражения легких и других органов при COVID-19 послужила основанием для изучения эффективности различных антицитокиновых средств, в том числе ингибиторов интерлейкина (ИЛ)-6 (тоцилизумаба, сарилумаба, олокизумаба), ИЛ-1 (канакинумаба, анакинры) и янус-киназ (тофацитиниба, барицитиниба). Хотя ни один из перечисленных препаратов официально не зарегистрирован для лечения СOVID-19, во многих странах ингибиторы ИЛ-6 применяют в клинической практике (off-label) у больных с наиболее тяжелым течением этого заболевания. Дополнительным доводом в пользу возможной эффективности ингибиторов ИЛ-6 при COVID-19 послужил и тот факт, что в 2017 г. тоцилизумаб был зарегистрирован для лечения угрожающего жизни синдрома высвобождения цитокинов, вызванного химерным антигенным рецептором (CAR) T-клеток у пациентов с гемобластозами [8].
ИЛ-6 – это один из основных медиаторов, регулирующих различные биологические процессы, которые связаны с локальным и системным воспалительным ответом [9]. В многочисленных исследованиях у пациентов с COVID-19 выявлено увеличение концентрации ИЛ-6, которое было более выраженным при тяжелом течении заболевании [10]. По данным мета-анализа 10 исследований в целом у 1798 пациентов, повышенные концентрации ИЛ-6 ассоциировались с различными неблагоприятными исходами SARS-CoV-2 инфекции, включая госпитализацию в ОРИТ, ОРДС и смерть [11]. У пациентов с осложненным течением COVID-19 содержание ИЛ-6 было почти в 3 раза выше, чем у больных с неосложненными формами заболевания. Ассоциация между повышением содержания ИЛ-6 и тяжелым течением COVID-19 была продемонстрирована и в других мета-анализах [12,13].
Первые сообщения об успешном опыте применения тоцилизумаба у больных с тяжелым течением COVID19 были опубликованы китайскими исследователями уже вскоре после начала пандемии SARS-CoV-2 инфекции [14,15]. В последующем эффективность препарата была продемонстрирована в многочисленных наблюдательных исследованиях, которые проводились в разных странах, в том числе России [16,17]. По данным недавно опубликованного мета-анализа 10 исследований (n=1358), введение тоцилизумаба у пациентов с тяжелым течением COVID-19 ассоциировалось со снижением смертности по сравнению с таковой в контрольной группе больных, которым не вводили ингибитор ИЛ-6 [18]. В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 не была подтверждена в нескольких недавно завершенных рандомизированных контролируемых исследованиях [19].
Результаты терапии у пациентов с COVID-19 могут зависеть от сроков введения противовоспалительных препаратов [20]. Соответственно, целью ретроспективного когортного исследования было изучение эффективности более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в ОРИТ для респираторной поддержки.
Материал и методы
Дизайн исследования и критерии отбора пациентов. Ретро спективное когортное исследование проводилось в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых, созданном по приказу Минздрава РФ 16.03.2020 на базе Первого МГМУ им. И.М. Сеченова (Сеченовский Университет). В центр по интернет поступают заявки на консультацию больных с тяжелым течением COVID-19, госпитализированных в ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В ретроспективное исследование включали пациентов, которым консультанты центра рекомендовали введение тоцилизумаба, учитывая наличие двусторонней пневмонии, поражающей более 50% легочной ткани (т.е. 3-4 стадии) и требующей респираторной поддержки, особенно при наличии повышенной концентрации СРБ. Окончательное решение о введении тоцилизумаба принимали лечащие врачи. Следует отметить, что консультанты центра не имели информации о доступности ингибиторов ИЛ-6 в соответствующих регионах Российской Федерации и лечебных учреждениях и, соответственно, не могли предсказать, будет ли пациенту введен тоцилизумаб или нет.
Пациенты, включенные в исследование, были распределены на две когорты с учетом уровня респираторной поддержки (оксигенотерапия/неинвазивная вентиляция легких или ИВЛ) на момент инфузии тоцилизумаба или получения заявки на консультацию, если ИЛ-6 в конечном итоге не вводился.
Все пациенты подписывали информированное согласие на применение тоцилизумаба и других "экспериментальных" препаратов для лечения COVID-19 в лечебном учреждении.
Процедуры и исходы. На основании полученных заявок на консультацию регистрировали демографические показатели и сопутствующие заболевания, диагностированные до развития COVID-19 (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт в анамнезе, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аортокоронарное шунтирование) в анамнезе. Ожирение диагностировали на основании индекса массы тела: <25,0 кг/м2 – нормальная масса тела, 25,0-29,9 кг/м2 – избыточная масса тела, ≥30,0 кг/м2 – ожирение. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты.
Лечение COVID-19 проводилось в соответствии с временными рекомендациями Минздрава РФ. С марта по май 2020 г. в качестве противовирусных препаратов чаще всего применяли гидроксихлорохин/хлорохин, азитромицин и лопинавир/ритонавир, реже – интерферон-β, в то время как глюкокортикостероиды в начала вспышки инфекции не рекомендовались. Доза тоцилизумаба составляла 400 мг внутривенно. Допускалось введение второй дозы препарата по решению лечащих врачей.
Пациентов наблюдали до смерти или выписки из стационара. Первичной конечной точкой была смерть от любых причин во время госпитализации. Исходы (смерть или выздоровление) определяли с помощью базы данных COVID-19, которая создана в Российской Федерации по решению Министерства здравоохранения. В этой базе данных содержится информация о всех пациентах с диагнозом COVID-19, включая данные о проводимом лечении. Если исход заболевания в базе данных не был зафиксирован, то запрашивали соответствующее лечебное учреждение.
Статистический анализ. Описательный статистический анализ проводился с использованием программы IBM SPSS Statistics 22 (IBM Corporation, США). Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Данные для количественных показателей представлены в виде медианы и межквартильного размаха (при отклонении распределения от нормального). Данные для качественных переменных представлены в виде абсолютных значений и доли в процентах. Медианы количественных показателей сравнивали с помощью U-критерия Манна-Уитни (при сравнении двух групп). Сравнение групп по качественным признакам проводилось с помощью критерия χ2-Пирсона (при количестве наблюдений в группе ≥10) и точного критерия Фишера (при количестве наблюдений в группе <10). Расчет отношения шансов (ОШ) для факторов, ассоциированных с развитием летального исхода, проводили с помощью логистической регрессионной модели. Исходную однофакторную модель корректировали по возрасту и полу. Регрессионную модель Кокса не использовали из-за опровержения гипотезы пропорциональности рисков путем анализа распределения частных остатков Шенфельда (Schoenfeld residuals). Различия считали достоверными при величине p<0,05. Все результаты приведены с двусторонним уровнем значимости.
Результаты
C 16 марта по 5 мая 2020 г. были получены заявки на консультацию 2066 пациентов с COVID-19, которые были госпитализированы в ОРИТ в связи с ухудшением оксигенации (рис. 1). В этой выборке 328 больным (57,0% мужчин, медиана возраста 59 лет) было рекомендовано введение тоцилизумаба. Относительно невысокая частота назначения ингибитора ИЛ-6 объяснялась тем, что в начале вспышки SARS-CoV-2 инфекции в Российской Федерации данных о возможной эффективности препарата было недостаточно.
159 из 328 пациентов получили по крайней мере одну дозу препарата 400 мг (у 21 была выполнена вторая инфузия в той же дозе с интервалом около 24 ч), в то время как оставшимся 169 больных не вводили ингибитор ИЛ-6, как правило, из-за отсутствия препарата в лечебном учреждении. Тоцилизумаб был введен 83 (60,1%) из 137 больных, которым проводились оксигенотерапия или неинвазивная вентиляция легких (НИВЛ) на момент инфузии или отправки заявки лечебным учреждением (более раннее введение тоцили зумаба), и 76 (39,8%) из 191 интубированного пациента (позднее введение тоцилизумаба) (рис. 1). В первой когорте тоцилизумаб был введен через 6 дней (интерквартильный размах 3-9) после госпитализации, а во второй – через 2 дня (интерквартильный размах 1-4) после начала ИВЛ.
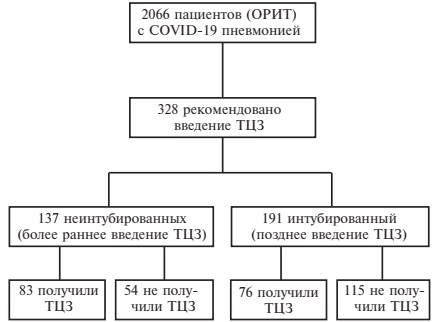
Группы больных, получивших или не получивших ингибитор ИЛ-6 на фоне оксигенотерапии или НИВЛ, были сопоставимы по возрасту и полу. У больных, которым вводили тоцилизумаб, частота некоторых заболеваний, которые могут ухудшить течение COVID-19, в том числе коронарной болезни сердца, инсульта в анамнезе и сахарного диабета 2 типа, была несколько выше, чем в группе сравнения, хотя разница не достигла статистической значимости (табл. 1). В когорте интубированных пациентов группы сравнения были сопоставимы как по демографическим показателям, так и по частоте всех сопутствующих заболеваний.
| Показатели | Более раннее введение ТЦЗ | Позднее введение ТЦЗ | ||||
|---|---|---|---|---|---|---|
| ТЦЗ+ (n=83) | ТЦЗ– (n=54) | р | ТЦЗ+ (n=76) | ТЦЗ– (n=115) | р | |
| Примечание: ХОБЛ – хроническая обструктивная болезнь легких, СРБ – С-реактивный белок, ВИЧ – вирус иммунодефицита человека, Me (IQR) – медиана (интерквартильный размах), ТЦЗ - тоцилизумаб | ||||||
| Возраст, лет; Me (IQR) | 56 (48; 63) | 58 (46; 65) | 0,484 | 60 (53; 67) | 64 (50; 74) | 0,084 |
| Мужчины, n (%) | 56 (67,5) | 30 (55,6) | 0,159 | 42 (55,3) | 59 (51,3) | 0,592 |
| Исход. респираторная поддержка, n (%) | ||||||
| Кислород | 58 (69,9) | 43 (79,6) | 0,205 | 0 | 0 | - |
| НИВЛ | 25 (30,1) | 11 (20,4) | 0,237 | 0 | 0 | - |
| ИВЛ | 0 | 0 | - | 76 (100) | 115 (100) | - |
| Сердечно-сосудистые заболевания, n (%) | 45 (54,2) | 28 (51,9) | 0,786 | 49 (64,5) | 78 (67,8) | 0,631 |
| Артериальная гипертония | 43 (51,8) | 26 (48,1) | 0,676 | 46 (60,5) | 77 (67,0) | 0,364 |
| Коронарная болезнь сердца | 12 (14,5) | 5 (9,3) | 0,435 | 8 (10,5) | 13 (11,3) | 1,000 |
| Инсульт в анамнезе | 6 (7,2) | 2 (3,7) | 0,479 | 2 (2,6) | 10 (8,7) | 0,129 |
| Фибрилляция предсердий | 3 (3,6) | 3 (5,6) | 0,680 | 11 (14,5) | 13 (11,3) | 0,518 |
| Сахарный диабет 2 типа, n (%) | 19 (22,9) | 5 (9,3) | 0,064 | 28 (36,8) | 40 (34,8) | 0,771 |
| Ожирение, n (%) | 23 (27,7) | 12 (22,2) | 0,472 | 31 (40,8) | 45 (39,1) | 0,819 |
| Бронхиальная астма, n (%) | 1 (1,2) | 2 (3,7) | 0,562 | 3 (3,9) | 3 (2,6) | 0,684 |
| ХОБЛ, n (%) | 3 (3,6) | 3 (5,6) | 0,680 | 4 (5,3) | 6 (5,2) | 1,000 |
| Солидные опухоли, n (%) | 0 | 1 (1,9) | 0,394 | 1 (1,3 | 8 (7,0) | 0,089 |
| Гемобластозы, n (%) | 0 | 1 (1,9) | 0,394 | 0 | 1 (0,9) | 1,000 |
| Аутоиммунные заболевания, n (%) | 0 | 0 | - | 0 | 2 (1,7) | 0,518 |
| ВИЧ-инфекция, n (%) | 0 | 1 (1,9) | 0,394 | 0 | 0 | - |
| ПЦР на SARS-CoV-2 +, n (%) | 57 (68,7) | 40 (74,1 | 0,112 | 85 (73,9) | 58 (76,3) | 0,066 |
| Максимальный СРБ, мг/л; Me (IQR) | 111 (48; 155) n=31 | 99,5 (32; 179) n=8 | 1,000 | 115 (93; 227) n=38 | 179 (111; 250) n=32 | 0,072 |
| Лейкоциты, ×109/л | 7,4 (4,6; 9,9) n=77 | 6,8 (5,1; 8,2) n=31 | 0,589 | 7,5 (5,9; 11,3) n=74 | 8,6 (5,8; 11,4) n=74 | 0,539 |
| Смерть, n (%) | 27 (32,5) | 12 (22,2) | 0,191 | 47 (61,8) | 73 (63,5) | 0,819 |
| Перевод на ИВЛ, n (%) | 42 (50,6) | 17 (31,5) | 0,027 | - | - | - |
Во всей выборке летальность больных, получивших и не получивших тоцилизумаб, достоверно не отличалась (46,5% и 50,3%, соответственно, p=0,509). В обеих когортах основными причинами смерти были ОРДС (91,9% и 77,6%, соответственно), сердечно-сосудистые осложнения (5,4% и 12,9%) и тромбоэмболия легочной артерии (1,4% и 2,4%). Среди неинтубированных пациентов летальность была примерно в два раза ниже, чем среди больных, находившихся на ИВЛ (32,5% и 61,8%, соответственно; p<0,001). Однако ни более раннее (до интубации), ни позднее (после начала ИВЛ) введение тоцилизумаба не привело к снижению риска смерти по сравнению с таковым в соответствующих группах сравнения у больных, которым не проводилась инфузия тоцилизумаба. Значения ОШ смерти с поправкой на возраст и пол у пациентов, получивших более раннюю или позднюю инфузию тоцилизумаба, составили 2,370 (95% доверительный интервал [ДИ] 0,969-5,798; р=0,059) и 0,996 (95% ДИ 0,539-1,839; р=0,989), соответственно, по сравнению с пациентами, которым ингибитор ИЛ-6 не был введен. Более того, введение тоцилизумаба у пациентов, находившихся на оксигенотерапии или НИВЛ, ассоциировалось с увеличением вероятности перевода на ИВЛ, которое оставалось статистически значимым после внесения поправки на возраст и пол (ОШ 2,507; 95% ДИ 1,1845,310; р=0,016).
Обсуждение
В наблюдательном когортном исследовании у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ, внутривенное введение тоцилизумаба в фиксированной дозе 400 мг не сопровождалось снижением летальности. Тоцилизумаб не увеличивал выживаемость ни у больных, находившихся на оксигенотерапии или НИВЛ, ни у пациентов, которым ингибитор ИЛ-6 вводили после начала ИВЛ. Более того, введение тоцилизумаба у неинтубированных пациентов ассоциировалось с увеличением потребности в ИВЛ. Последний результат мог частично объясняться несколько более высокой частотой некоторых сопутствующих заболеваний, ухудшающих течение COVID-19, в группе тоцилизумаба. В то же время группы интубированных пациентов, получивших и не получивших тоцилизумаб, были сопоставимы по демографическим показателям и частоте сопутствующих заболеваний. Соответственно, различия между группами не могли объяснить негативные результаты исследования в этой выборке.
Наши данные контрастируют с результатами многочисленных наблюдательных исследований, которые показали, что введение тоцилизумаба может привести к снижению потребности в ИВЛ и летальности больных с тяжелым течением COVID-19 ассоциированной пневмонии [21-23]. В ретроспективном исследовании, проводившемся в 13 американских больницах, эффективность тоцилизумаба изучали у 630 больных с COVID-19, госпитализированных в ОРИТ для респираторной поддержки [24]. Основную группу составили 210 пациентов, которым вводили тоцилизумаб в дозе 400 мг внутривенно, контрольную – 420 больных, не получавших ингибитор ИЛ-6 и подобранных по демографическим и клиническим показателям. Во всей когорте, как и в нашем исследовании, преобладали люди пожилого возраста (в основном мужчины), страдавшие различными сопутствующими заболеваниями. Около 45% больных получали глюкокортикостероиды. Летальность в целом составила 57%, в том числе 49% в группе тоцилизумаба и 61% в контрольной группе. По данным регрессионного анализа Кокса, введение тоцилизумаба ассоциировалось с достоверным снижением риска смерти (отношение рисков 0,64, 95% ДИ 0,47-0,87; p=0,0040). Сходная ассоциация была выявлена также в подгруппах больных, находившихся на ИВЛ, и пациентов с исходным уровнем СРБ ≥150 мг/л.
В другом крупном ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [25]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Больные группы тоцилизумаба были моложе пациентов группы сравнения (медианы 58 и 63 года, соответственно), чаще получали глюкокортикостероиды (18,7% и 12,6%) и чаще находились на ИВЛ (47,3% и 37,9%). Летальность во всей выборке составила 39,3%, в том числе 28,9% в группе тоцилизумаба и 40,6% в группе сравнения. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92).
Статистически значимая ассоциация между введением тоцилизумаба (внутривенно в дозе 8 мг/кг в виде двух инфузий с интервалом 12 ч или подкожно в дозе 324 мг) и снижением риска перевода на ИВЛ или смерти (скорректированное отношение рисков 0,61, 95% ДИ 0,40–0,92; p=0,020) была выявлена и в итальянском исследовании у 544 больных с тяжелой COVID-19 ассоциированной пневмонией, 179 из которых получили ингибитор ИЛ-6 [21]. В этом исследовании доля больных, нуждавшихся в ИВЛ (18% и 16% в группах тоцилизумаба и сравнения, соответственно) и летальность (7% и 20%) были значительно ниже, чем в нашем исследовании, в том числе у пациентов, получивших более раннюю инфузию тоцилизумаба, и в описанных выше исследованиях. Таким образом, данные итальянских авторов позволяют судить об эффективности тоцилизумаба у пациентов с менее тяжелым течением COVID-19.
В то же время в нескольких рандомизированных контролируемых исследованиях не была подтверждена эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 ассоциированной пневмонии. В итальянское открытое рандомизированное исследование были включены 126 больных с COVID-19 пневмонией и индексом PaO2/FIO2 от 200 до 300 мм рт. ст., нуждавшихся в оксигенотерапии через маску или канюлю (пациентов, которым проводились НИВЛ или ИВЛ, исключали) [26]. Тоцилизумаб вводили в дозе 8 мг/кг (не более 800 мг) дважды с интервалом 12 ч в течение ≤8 ч после рандомизации. Исследование было завершено досрочно, так как частота первичной конечной точки, включавшей в себя смерть, госпитализацию в ОРИТ для ИВЛ или снижение индекса оксигенации <150 мм рт. ст., не отличалась между группой тоцилизумаба и группой сравнения (28,3% и 27,0%, соответственно). Следует отметить, что 23,3% больных группы сравнения во время госпитализации также получили инфузию тоцилизумаба в связи с ухудшением состояния, что несколько затрудняет интерпретацию результатов исследования. Во всей выборке летальность в течение 30 дней составила всего 2,4%, т.е. была значительно ниже, чем в нашем исследовании у пациентов, получавших более раннюю инфузию тоцилизумаба. При этом доза тоцилизумаба в итальянском исследовании была в несколько раз выше. Авторы предположили, что низкая летальность могла объясняться исключением пациентов пожилого возраста, страдавших сопутствующими заболеваниями. Однако в нашем и итальянском исследованиях медианы возраста пациен тов были сопоставимыми, как и частота некоторых сопутствующих заболеваний, таких как сахарный диабет (17,5% и 15,1%, соответственно) или ожирение (25,5% и 32,2%). Скорее, полученные данные указывают на трудность прогнозирования течения COVID-19 пневмонии. Ранее мы показали, что примерно у четверти пациентов, поступающих в ОРИТ для респираторной поддержки, отсутствуют какие-либо сопутствующие заболевания, которые могут ухудшить прогноз у таких больных [3].
В рандомизированное открытое исследование CORIMUNO-19-TOCI-1, проводившееся во Франции, были включены 130 больных COVID-19 пневмонией, нуждавшихся в оксигенотерапии [27]. При этом необходимость в НИВЛ или ИВЛ была критерием исключения. Больным основной группы вводили тоцилизумаб внутривенно в дозе 8 мг/кг (при необходимости через 3 дня допускалось введение второй дозы), в то время как пациенты контрольной группы получали обычную терапию. В этом исследовании летальность в целом составила 11,5%. Введение тоцилизумаба не привело к снижению доли пациентов, переведенных на НИВЛ или ИВЛ, на 4-й день, но сопровождалось снижением доли больных, которые были переведены на НИВЛ или ИВЛ или умерли, на 14-й день (24% и 36%). Однако на 28-й день смертность не отличалась между группами сравнения, что ставит под сомнение пользу достигнутого ранее умеренного эффекта.
В двойное слепое, рандомизированное, плацебоконтролируемое исследование, проводившееся в США, были включены 243 больных средне-тяжелой COVID19 пневмонией (медиана возраста 59,8 лет), у которых имелись по крайней мере два из трех критериев: лихорадка, легочные инфильтраты или необходимость в оксигенотерапии [28]. 161 из них получили тоцилизумаб в дозе 8 мг/кг внутривенно (не более 800 мг), а 81 – плацебо. У 84% больных исходно проводилась оксигенотерапия. В течение 28 дней умерли или были интубированы 10,6% пациентов в группе тоцилизумаба и 12,5% больных в группе сравнения (разница недостоверная). Лечение тоцилизумабом не привело также к уменьшению риска ухудшения состояния больных или сокращению длительности оксигенотерапии.
Во все три рандомизированных исследования включали относительно нетяжелых пациентов, которые получали оксигенотерапию и, соответственно, не нуждались в пребывании в ОРИТ. Это подтверждалось невысокой летальностью, которая не превышала 11,5% и примерно соответствовала таковой в российских ОРИТ у больных, находившихся на оксигенотерапии [4]. В нашем исследовании в первой когорте (более раннее введение тоцилизумаба) у четверти больных проводилась НИВЛ, а летальность был существенно выше (32,5%), что указывает на более тяжелое течение COVID-19 пневмонии. В связи с этим было бы некорректно сравнивать результаты нашего исследования и опубликованных рандомизированных контролируемых исследований.
Эффективность и безопасность тоцилизумаба изучались также в международном рандомизированном, двойном слепом, плацебо-контролируемом исследовании COVACTA у 450 больных тяжелой COVID-19 пневмонией, сопровождавшейся снижением SpO2≤93% или PaO2/FiO2 <300 мм рт. ст. Пациентов рандомизировали на две группы (1:1) и вводили тоцилизумаб в дозе 8 мг/кг внутривенно (до 800 мг; допускалось введение второй дозы) или плацебо. Окончательные результаты этого исследования не опубликованы, однако в июле 2020 г. компания F. Hoffmann-La Roche, производитель тоцилизумаба, заявила, что первичная конечная точка не была достигнута [29]. Введение тоцилизумаба не привело к улучшению состояния больных, которое оценивали по шкале от 1 (выписан) до 7 (смерть), через 28 дней. Летальность через 28 дней также не отличалась между группами тоцилизумаба и плацебо (19,7% и 19,4%, соответственно).
Недавно было завершено еще одно крупное международное двойное слепое, рандомизированное, плацебо-контролируемое исследование EMPACTA, результаты которого также пока не опубликованы. В исследование планировалось включить 379 больных COVID-19 пневмонией, сопровождавшейся снижением SpO2<94%, которым вводили тоцилизумаб в дозе 8 мг/кг внутривенно или плацебо. В пресс-релизе компании F. Hoffmann-La Roche заявлено, что первичная конечная точка исследования была достигнута: в группе тоцилизумаба было отмечено снижение риска перевода пациентов на ИВЛ или смерти на 44% по сравнению с группой плацебо (12,2% и 19,4%, соответственно; отношение рисков 0,56, 95% ДИ 0,32-0,97). Тем не менее, летальность через 28 дней существенно не отличалась между группами (10,4% и 8,6%, соответственно) [30]. Таким образом, это исследование показало, что тоцилизумаб позволяет избежать перевода на ИВЛ у определенной части больных с COVID-19 пневмонией, но при этом не снижает летальность.
Еще в одном двойном слепом, плацебо-контролируемом, рандомизированном исследовании у 420 больных COVID-19 пневмонией, находившихся в тяжелом или критическом состоянии, не была подтверждена эффективность другого ингибитора ИЛ-6 сарилумаба, который вводили внутривенно в дозе 200 или 400 мг (результаты исследования пока не опубликованы). В этом исследовании в группах сарилумаба были отмечены недостоверное снижение длительности госпитализации и более быстрое улучшение состояния больных, а также тенденция к снижению летальности у пациентов в критическом состоянии. Тем не менее, по первичным и вторичным показателям эффективности сарилумаб не имел преимуществ перед плацебо [31].
Основанием для применения ингибиторов ИЛ-6 при COVID-19 пневмонии послужили повышение концентраций этого цитокина и неблагоприятное его прогностическое значение у пациентов с этим заболеванием. Однако нельзя исключить, что повышение содержания ИЛ-6, по крайней мере в части случаев, может быть проявлением ответа хозяина на вирусную инфекцию, а не нарастающих иммуновоспалительных изменений, приводящих к прогрессированию поражения легких [28]. D. Leisman и соавт. провели мета-анализ 25 исследований, в которых изучали содержание ИЛ-6 и других цитокинов у 1245 больных с COVID-19 [32]. Полу чен ные данные сравнивали с результатами исследований у больных сепсисом (n=5320), синдром выброса цитокинов, вызванным T-CAR терапией (n=72), и ОРДС, не связанным с COVID-19 (n=2767). Средняя сывороточная концентрация ИЛ-6 у больных с тяжелым или крайне тяжелым течением COVID составила 36,7 пг/мл и была в десятки раз ниже, чем у больных с синдромом выброса цитокинов (3110,5 пг/мл; p<0,0001), сепсисом (983,6 пг/мл; p<0,0001) и ОРДС другой этиологии (460 пг/мл; p<0,0001). Сходные результаты были получены при анализе содержания многих других цитокинов, в том числе ИЛ-8, фактора некроза опухоли α и интерферона g. В то же время содержание неспецифических лабораторных маркеров воспаления, таких как СРБ, было значительно повышено у пациентов с COVID-19 и оказалось сопоставимым с таковым у больных с другими заболеваниями. По мнению авторов, термин "цитокиновый шторм" не позволяет адекватно описать спектр изменений, лежащих в основе нарушенного воспалительного ответа и дисфункции органов при COVID-19. Альтернативными моделями дисфункции органов при этом заболевании могут быть эндоваскулит, прямое повреждающее действие вируса и подавление функции лимфоцитов, а также иммуносупрессия, индуцированная вирусом [32].
Приведенные данные не позволяют опровергнуть как концепцию "цитокинового шторма", так и эффективность тоцилизумаба и других ингибиторов ИЛ-6 в лечении COVID-19 пневмонии. Клинический опыт свидетельствует о том, что в части случаев препараты этой группы позволяют достичь быстрого улучшения состояния больных и подавить прогрессирование поражения легких. Более того, эффективность противовоспалительной терапии была установлена в контролируемом рандомизированном открытом исследовании RECOVERY, в котором сравнивали результаты применения дексаметазона внутрь или внутривенно в дозе 6 мг один раз в сутки в течение 9 дней (n=2104) и стандартной терапии (n=4321) у госпитализированных пациентов с COVID-19 [33]. По данным предварительного анализа, лечение дексаметазоном привело к снижению 28-дневной летальности (22,9% и 25,7%; р<0,001). Эффективность дексаметазона зависела от уровня респираторной поддержки на момент рандомизации. Достоверное снижение летальности было отмечено у пациентов, находившихся на ИВЛ (29,3% и 41,4% в группах дексаметазона и сравнения, соответственно) или получавших оксигенотерапию (23,3% и 26,2%), в то время как у больных, не нуждавшихся в респираторной поддержке, летальность не изменилась. Более того, она оказалась даже несколько выше в группе дексаметазона (17,8% и 14,0%). Кроме того, увеличение выживаемости при введении дексаметазона было выявлено только у больных, у которых симптомы сохранялись более 7 дней. Последний результат, вероятно, отражает неблагоприятный эффект иммуносупрессии на фоне продолжающейся репликации вируса.
Наше исследование имеет определенные ограничения. Во-первых, оно было ретроспективным и нерандомизированным, поэтому мы не могли учесть все факторы, способные повлиять на течение COVID-19 пневмонии. Тем не менее, в обеих когортах пациентов группы сравнения были сопоставимы по возрасту, полу и частоте различных сопутствующих заболеваний. Вовторых, пациенты находились в ОРИТ различных лечебных учреждений Российской Федерации с отличающимися протоколами ведения пациентов в критическом состоянии. В-третьих, мы не имели полной информации о сопутствующей терапии COVID-19 и, соответственно, не учитывали ее влияние на исходы заболевания. В начале пандемии в России для лечения COVID-19 чаще всего применяли аминохинолиновые производные, лопинавир/ритонавир и интерферон-β1, эффективность которых не была подтверждена в исследовании SOLIDARITY (n=11266) [34]. В этом исследовании все перечисленные препараты не снижали летальность, частоту интубации или длительность госпитализации. Соответственно, мало вероятно, что они могли повлиять на результаты лечения пациентов с COVID-19 пневмонией в нашем исследовании. В то же время общие результаты лечения могли зависеть от адекватности антибиотикотерапии, особенно у интубированных пациентов. В-четвертых, мы не анализировали динамику клинических и лабораторных показателей после введения тоцилизумаба. Применение этого препарата обычно приводит к быстрому снижению температуры тела и содержания СРБ, однако нам представлялось, что изучение летальности от общих причин имеет большее значение для оценки эффективности тоцилизумаба, особенно с учетом результатов рандомизированных контролируемых исследований. Несмотря на перечисленные ограничения, мы сопоставили эффективность тоцилизумаба в сочетании со стандартной терапией или только стандартной терапии в сопоставимых группах у достаточно большого количества пациентов с тяжелой COVID-19 пневмонией.
Заключение
В ретроспективном когортном исследовании у пациентов с тяжелой COVID-19 пневмонией, нуждавшихся в респираторной поддержке в ОРИТ, мы не выявили снижения летальности как при более раннем (до интубации), так и позднем (после начала ИВЛ) внутривенном введении тоцилизумаба в дозе 400 мг по сравнению с контрольными группами больных, получавших только стандартную терапию. Хотя полученные данные не позволяют отвергнуть эффективность тоцилизумаба, они согласуются с результатами нескольких рандомизированных клинических исследований, в которых изучался ингибитор ИЛ-6. В настоящее время продолжаются еще несколько рандомизированных контролируемых исследований, в частности RECOVERY, которые позволят оценить эффективность тоцилизумаба у пациентов с COVID-19 и возможные показания к его применению. Если по мнению врача больной с тяжелой COVID-19 пневмонией нуждается в противовоспалительной терапии, то лечение целесообразно начинать с дексаметазона, в то время как введение тоцилизумаба может обсуждаться при неэффективности глюкокортикостероидов.
Используемые источники
- Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA 2020;323:1574–81.
- Gottlieb M, Sansom S, Frankenberger C, et al. Clinical course and factors asso- ciated with hospitalization and critical illness among COVID-19 patients in Chicago, Illinois. Acad Emerg Med 2020;27(10):963-73.
- Глыбочко П.В., Фомин В.В., Авдеев С.Н. и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке. Клин фармакол тер 2020;29(2):21-9 [Glybochko P, Fomin V, Avdeev S, et al. Clinical characteristics of 1007 intensive care unit pati- ents with SARS-CoV-2 pneumonia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):21-9 (In Russ.)].
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии. Клин фармакол тер 2020;29(3):25-36 [Glybochko P, Fomin V, Moiseev S, et al. Clinical outco- mes of patients with COVID-19 admitted for respiratory support to the intensive care units in Russia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(3):25-36 (In Russ.)].
- Mehta P, McAuley DF, Brown M, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020;395:1033–4.
- Насонов ЕЛ. Иммунопатология и иммунофармакотерапия коронавирусной болезни 2019 (COVID-19): фокус на интерлейкин 6. Научно-практическая ревматология 2020;58(3):245-61 [Nasonov EL. Immunopathology and immu- nopharmacotherapy of coronavirus disease 2019 (COVID-19): focus on interleu- kin-6. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice 2020;58(3):245-61 (In Russ.)].
- Caricchio R, Gallucci M, Dass C, et al. Preliminary predictive criteria for COVID-19 cytokine storm. Ann Rheum Dis 2020; published online ahead of print, 2020 Sep 25, annrheumdis-2020-218323.
- Le RQ, Li L, Yuan W, et al. FDA Approval Summary: Tocilizumab for treatment of chimeric antigen receptor T cell-induced severe or life-threatening cytokine release syndrome. Oncologist 2018;23:943-7.
- Насонов ЕЛ, Лила АМ. Ингибиция интерлейкина 6 при иммуновоспалительных ревматических заболеваниях: достижения, перспективы и надежды. Научно-практическая ревматология. 2017;55(6):590-9. [Nasonov EL, Lila AM. Inhibition of interleukin 6 in immune inflammatory rheumatic diseases: achievements, prospects, and hopes. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2017;55(6):590-9 (In Russ.)].
- McGonagle D, Sharif K, O’Regan A, et al. The role of cytokines including inter- leukin-6 in COVID-19 induced pneumonia and macrophage activation syndrome- like disease. Autoimmun Rev 2020;19:102537.
- Coomes EA, Haghbayan H. Interleukin-6 in Covid-19: A systematic review and meta-analysis [published online ahead of print, 2020 Aug 26]. Rev Med Virol. 2020;e2141. doi:10.1002/rmv.2141
- Zhu J, Pang J, Ji P, et al. Elevated interleukin-6 is associated with severity of COVID-19: a meta-analysis. J Med Virol 2020;10.1002/jmv.26085. doi:10.1002/ jmv.26085.
- Aziz M, Fatima R, Assaly R. Elevated interleukin-6 and severe COVID-19: A meta-analysis. J Med Virol 2020;10.1002/jmv.25948.
- Luo P, Liu Y, Qiu L, et al. Tocilizumab treatment in COVID-19: a single center experience. J Med Virol 2020;92(7):814-8.
- Xu X, Han M, Li T, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A 2020;117:10970–5.
- Фомина Д.С., Потешкина Н.Г., Белоглазова И.П. и др. Сравнительный анализ применения тоцилизумаба при тяжелых COVID-19-ассоциированных пневмониях у пациентов разных возрастных групп. Пульмонология 2020;30(2):164-72 [Fomina DS, Poteshkina NG, Beloglazova IP, et al. Comparative analysis of tocilizumab in severe COVID-19-associated pneumonia in patients of different age groups. Pulmonologiya 2020;30(2):164-72 (In Russ.)].
- Fomina DS, Lysenko MA, Beloglazova IP, et al. Temporal clinical and laborato- ry response to interleukin-6 receptor blockade with tocilizumab in 89 hospitalized patients with COVID-19 pneumonia. Pathog Immun 2020;5(1):327-41.
- Malgie J, Schoones JW, Pijls BG. Decreased mortality in COVID-19 patients treated with Tocilizumab: a rapid systematic review and meta-analysis of observa- tional studies. Clin Infect Dis 2020 Sep 23:ciaa1445.
- Parr JB. Time to reassess tocilizumab's role in COVID-19 pneumonia. JAMA Intern Med 2020 Oct 20. doi: 10.1001/jamainternmed.2020.6557.
- Winthrop KL, Mariette X. To immunosuppress: whom, when and how? That is the question with COVID-19. Ann Rheum Dis 2020;79:1129-1131.
- Guaraldi G, Meschiari M, Cozzi-Lepri A, et al. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol 2020;2: e474–8.
- Menzella F, Fontana M, Salvarani C, et al. Efficacy of tocilizumab in patients with COVID-19 ARDS undergoing noninvasive ventilation. Crit Care 2020;24: 589.
- Potere N, Di Nisio M, Cibelli D, et al Interleukin-6 receptor blockade with sub- cutaneous tocilizumab in severe COVID-19 pneumonia and hyperinflammation: a case–control study Ann Rheum Dis 2020; 09 July. doi: 10.1136/annrheumdis- 2020-218243.
- Biran N, Ip A, Ahn J, et al. Tocilizumab among patients with COVID-19 in the intensive care unit: a multicentre observational study. Lancet Rheumatol 2020;2:e603–12.
- Gupta S, Wang W, Hayek SS, et al. Association between early treatment with tocilizumab and mortality among critically ill patients with COVID-19. JAMA Intern Med Oct 20. 2020;10.1001/jamainternmed.2020.6252.
- Salvarani C, Dolci G, Massari M, et al; for the RCT-TCZ-COVID-19 Study Group. Effect of tocilizumab vs standard of care on clinical worsening in patients hospitalized with COVID-19 pneumonia: a randomized clinical trial. JAMA Intern Med. Published online October 20, 2020. doi:10. 1001/jamaintern- med.2020.6615.
- Hermine O, Mariette X, Tharaux P-L, et al; for the CORIMUNO-19 Collaborative Group. Effect of tocilizumab vs usual care in adults hospitalized with COVID-19 and moderate or severe pneumonia: a randomized clinical trial. JAMA Intern Med 2020; October 20. doi:10.1001/ jamainternmed.2020.6820.
- Stone JH, Frigault MJ, Serling-Boyd NJ, et al. Efficacy of tocilizumab in patients hospitalized with Covid-19. N Engl J Med 2020;10.1056/NEJMoa2028836. doi:10.1056/NEJMoa2028836.
- F Hoffman-La Roche Ltd. Roche provides an update on the phase III COVAC- TA trial of Actemra/RoActemra in hospitalised patients with severe COVID-19 associated pneumonia. Published July 29, 2020. Accessed September 19, 2020. https://www.roche.com/investors/updates/invupdate-2020-07-29.htm.
- F Hoffman-La Roche Ltd. Roche’s phase III EMPACTA study showed Actemra/RoActemra reduced the likelihood of needing mechanical ventilation in hospitalised patients with COVID-19 associated pneumonia. Published September 18, 2020. Accessed September 19, 2020. https://www.roche.com/investors/upda- tes/inv-update-2020-09-18.htm.
- https://www.sanofi.com/en/media-room/press-releases/2020/2020-09-01-07-00- 00.
- Leisman DE, Ronner L, Pinotti R, et al. Cytokine elevation in severe and critical COVID-19: a rapid systematic review, meta-analysis, and comparison with other inflammatory syndromes. Lancet Respir Med 2020 Published Online October 16, 2020 https://doi.org/10.1016/S2213-2600(20)30404-5.
- Horby P, Lim WS, Emberson JR, et al; RECOVERY Collaborative Group. Dexamethasone in hospitalized patients with COVID-19—preliminary Research Original Investigation Early Treatment With Tocilizumab and Mortality Among Critically Ill Patients With COVID-19. N Engl J Med. doi:10.1101/2020.06.22. 20137273.
- WHO Solidarity trial consortium, Pan H, Peto R, Karim QA, et al. Repurposed antiviral drugs for COVID-19 – interim WHO SOLIDARITY trial results. medRxiv 2020.10.15.20209817; doi: https://doi.org/10.1101/2020.10.15.20209817.
