Какие шкалы должен использовать кардиолог у пациентов с фибрилляцией предсердий? Что нового?
Современный алгоритм лечения больных с неклапанной фибрилляцией предсердий (ФП) предполагает антикоагуляцию с целью профилактики инсульта и системных эмболий, улучшение контроля симптомов ФП путем урежения частоты сердечных сокращений или восстановления и удержания синусового ритма и лечение сердечно-сосудистых и других сопутствующих заболеваний. Обследование пациентов с ФП должно быть структурированным и включать в себя оценку риска инсульта, выраженности симптомов, тяжести нагрузки ФП (тип аритмии, число и длительность эпизодов и т.п.) и предрасполагающего состояния. Важное значение имеет использование шкал CHA 2 DS 2 -VASc (риск инсульта), HAS-BLED (риск кровотечения), EHRA (выраженность симптомов ФП) и 2MACE (риск сердечно-сосудистых исходов), которые помогают оценить вероятность неблагоприятных исходов и выбрать оптимальное лечение, обеспечивающее защиту не только от инсульта, но и от сердечно-сосудистых событий. Следует отметить, что шкала HAS-BLED в первую очередь необходима для идентификации факторов риска кровотечений, модификация которых позволяет повысить безопасность антикоагулянтной терапии, а высокое значение индекса по этой шкале не может служить основанием для отказа от антикоагуляции у пациента с ФП. Предложены новые шкалы оценки риска инсульта и геморрагических осложнений у больных с ФП на основе клинических показателей и лабораторных биомаркеров, однако их возможные преимущества перед существующими индексами нуждаются в подтверждении в специальных исследованиях.
Частота фибрилляции предсердий (ФП) у взрослых людей в популяции составляет 2-4% [1]. Она увеличивается с возрастом, в том числе под действием различных сопутствующих заболеваний и факторов риска, таких как артериальная гипертония, сахарный диабет, коронарная болезнь сердца, хроническая болезнь почек, ожирение, употребление алкоголя, курение и т.д. В ближайшие годы можно ожидать дальнейшего роста распространенности ФП не только за счет увеличения продолжительности жизни и постарения населения, но и внедрения новых систем скрининга нарушений ритма с помощью мобильных технологий (смартфонов), позволяющих зарегистрировать малосимптомные или бессимптомные нарушения ритма [2]. Например, в исследовании REHEARSE-AF регистрация ЭКГ в одном отведении с помощью смартфона/ планшета два раза в неделю в течение 12 мес у пациентов в возрасте ≥65 лет привела к увеличению частоты диагностики ФП в 3,9 раза по сравнению с обычной тактикой ведения [3]. Использование подобных устройств для скрининга ФП наиболее обосновано у людей пожилого и старческого возраста, а также пациентов с высоким риском инсульта [4].
ФП ассоциируется более чем с 3-кратным увеличением риска смерти [5] и является одной из основных причин инсульта (20-30% и 10% случаев ишемического и криптогенного инсульта, соответственно), который характеризуется тяжелым и рецидивирующим течением и часто приводит к смерти или инвалидизации [1]. ФП сопровождается нарушением функции сердца и развитием сердечной недостаточности, как со сниженной, так и сохраненной фракцией выброса левого желудочка, которая наблюдается у 20-30% таких больных и вызывает дополнительное ухудшение прогноза для жизни [6]. Неблагоприятные последствия ФП включают в себя также снижение качества жизни, особенно у женщин [7], когнитивные расстройства вплоть до деменции [8] и частые госпитализации, ассоциирующиеся с увеличением затрат для системы здравоохранения [9]. По данным мета-анализа 35 исследований в целом более чем у 300000 больных с ФП частота госпитализаций составила в среднем 43,7 на 100 пациентов в год, а одним из основных факторов, ассоциировавшихся с увеличением вероятности поступления в стационар, был пожилой возраст [10].
Ведение больных с ФП
Современные подходы к обследованию, ведению и лечению больных с ФП подробно описаны в соответствующих рекомендациях Европейского общества кардиологов, которые были подготовлены совместно с Европейской ассоциацией кардиоторакальной хирургии и опубликованы в 2020 г. [11]. В этих рекомендациях содержатся некоторые важные нововведения, в частности предложено использовать структурированную схему обследования пациентов (4S-AF), предполагающую анализ 4 доменов (рис. 1): риск инсульта, выраженность симптомов, тяжесть нагрузки ФП и предрасполагающее состояние (субстрат ФП) [12]. Оценка указанных факторов, в том числе с использованием специальных шкал, таких как CHA2DS2-VASc, HAS-BLED, EHRA, 2MACE и др., имеет прогностическое значение и помогает выбрать оптимальное лечение, цель которого – не только обеспечить адекватный контроль симптомов и улучшить качество жизни, но и предупредить неблагоприятные клинические исходы, в том числе смерть. Необходимо учитывать, что тип ФП (впервые выявленная, пароксизмальная, персистирующая, длительно персистирующая или постоянная) сам по себе не имеет решающего значения для выбора тактики лечения (исключая вопрос о необходимости восстановления синусого ритма), например, для оценки целесообразности применения пероральных антикоагулянтов для профилактики ишемического инсульта.
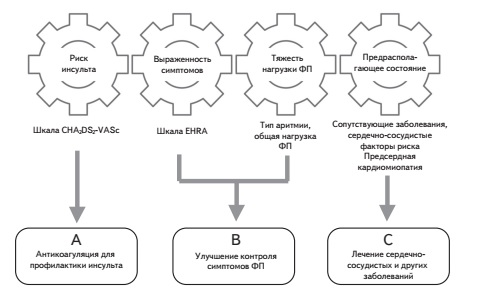
С целью улучшения результатов лечения ФП эксперты Европейского общества кардиологов рекомендовали использовать алгоритм АВС, где А – Anticoagulation/ Avoid stroke (антикоагуляция для профилактики инсульта), В – Better symptom management (улучшение контроля симптомов) и C – Cardiovascular and Comorbidity optimization (оптимизация лечения сердечно-сосудистых и других сопутствующих заболеваний) (рис. 1) [13]. Результаты клинических исследований показали, что внедрение указанного алгоритма ассоциируется со снижением риска смерти от любых причин, сердечно-сосудистых событий, комбинированной конечной точки, включающей в себя инсульт, большое кровотечение и сердечно-сосудистую смерть, а также затрат на лечение [14-16]. D. Pastori и соавт. в проспективном исследовании у 907 пациентов изучили эффективность лечения в соответствии с алгоритмом АВС в профилактике сердечно-сосудистых осложнений [17]. В группе из 198 пациентов, получавших оптимальное лечение, в течение около 3 лет было отмечено достоверное снижение риска любых сердечно-сосудистых событий на 60% (p=0,003) по сравнению с таковым у больных, у которых по крайней мере один компонент лечения не соответствовал оптимальному.
Антикоагулянтная терапия
Для оценки риска инсульта у больных с ФП и, соответственно, необходимости в применении антикоагулянтов используют шкалу CHA2DS2-VASc (табл. 1), которая включает в себя хроническую сердечную недостаточность (ХСН), артериальную гипертонию, возраст ≥75 лет, сахарный диабет, инсульт/транзиторную ишемическую атаку (ТИА)/системную эмболию в анамнезе, сердечно-сосудистое заболевание, в том числе стенозирующий коронарный атеросклероз, подтвержденный при ангиографии, перенесенный инфаркт миокарда, атеросклероз периферических артерий или бляшку в аорте, возраст 65-74 года и женский пол [18]. Необ ходимо отметить, что женский пол скорее модифицирует общий риск развития инсульта, чем является фактором риска сам по себе [19], так как при отсутствии дополнительных факторов риска у женщин вероятность развития инсульта такая же низкая как у мужчин с индексом по шкале CHA2DS2-VASc, равным 0. В то же время при наличии по крайней мере одного дополнительного фактора риска у женщин вероятность инсульта увеличивается в большей степени, чем у мужчин [20].
| Факторы риска | Определение | Балл |
|---|---|---|
| С | Клинические симптомы ХСН, умеренная и тяжелая систолическая дисфункция левого желудочка (в том числе бессимптомная), гипертрофическая кардиомиопатия | 1 |
| H | Артериальная гипертония (систолическое АД ≥140 мм рт. ст., диастолическое АД ≥90 мм рт. ст) или прием антигипертензивных препаратов (целевое АД при ФП 120-129/<80 мм рт. ст.) | 1 |
| A | Возраст более 75 лет | 2 |
| D | Сахарный диабет 1 и 2 типа (гликемия натощак более 7 ммоль/л или прием сахароснижающих препаратов или инсулинотерапия) | 1 |
| S | Инсульт/ТИА/тромбоэмболии в анамнезе | 2 |
| V | Сердечно-сосудистые заболевания в анамнезе (ангиографически подтвержденная ИБС, перенесенный инфаркт миокарда, клинически значимый периферический атеросклероз, атеросклеротическая бляшка в аорте) | 1 |
| A | Возраст 65-74 года | 1 |
| Sс | Женский пол | 1 |
В последние годы большой интерес у исследователей вызывает изучение роли различных биомаркеров, в том числе отражающих повреждение миокарда (тропонин), дисфункцию сердца (натрийуретические пептиды), фиброз миокарда (галектин-3), нарушение функции почек (креатинин, цистатин С), воспаление (С-реактивный белок, цитокины) и активность коагуляции (Ддимер), которые могут ассоциироваться с патогенезом тромбообразования, клиническими исходами и эффектами лечения [21]. Предложены шкалы оценки риска инсульта у пациентов с ФП на основании не только клинических факторов риска, но и некоторых лабораторных показателей, например, шкала ABC учитывает возраст больного, наличие инсульта/ТИА в анамнезе и уровни высокочувствительного тропонина и NTproBNP [22]. Применение некоторых новых шкал позволяло улучшить точность предсказания риска инсульта у пациентов с ФП, хотя практическое значение их возможных преимуществ перед общепринятой шкалой CHA2DS2-VASc вызывает сомнение, в том числе в связи с необходимостью дополнительных затрат на определение биомаркеров. Однако нельзя исключить, что последние могут найти применение для более точной оценки вероятности инсульта у пациентов, у которых риск его расценивается как низкий [23].
Перед назначением пероральных антикоагулянтов пациентам с ФП необходимо оценить риск развития кровотечений. Для этого обычно используют шкалу HAS-BLED (табл. 2). Эта шкала сохраняет свое значение несмотря на появление новых индексов, в том числе учитывающих не только клинические и демографические показатели, но и уровни лабораторных биомаркеров. Например, индекс по шкале ABC рассчитывается с учетом возраста, кровотечения в анамнезе и лабораторных биомаркеров, в том числе GDF-15, высокочувствительного тропонина и гемоглобина [24]. В рекомендациях Европейского общества кардиологов специально подчеркивается, что высокий риск кровотечения при отсутствии абсолютных противопоказаний не может служить основанием для отказа от антикоагулянтной терапии, так как "чистая" клиническая польза антикоагуляции даже выше у таких пациентов. Оценка риска геморрагических осложнений в первую очередь необходима для идентификации пациентов, которые нуждаются в более тщательном наблюдении (например, каждые 4 недели, а не 4-6 мес) и модификации факторов риска. Некоторые факторы риска кровотечений (возраст старше 65 лет, кровотечение в анамнезе, почечная заместительная терапия, злокачественные опухоли, генетические факторы и др.) являются немодифицируемыми, однако многие другие могут быть устранены или уменьшены (артериальная гипертония, сопутствующий прием антитромбоцитарных препаратов, злоупотребление алкоголем, анемия, тромбоцитопения, опасные хобби и т.п.). Следует также учитывать, что изменение профиля риска кровотечений в динамике имеет большее значение для предсказания больших кровотечений, чем исходное его значение. В клиническом исследовании было выявлено значительное (в 3,5 раза) увеличение риска большого кровотечения в течение ближайших 3 мес у пациентов, у которых наблюдалось изменение индекса по шкале HAS-BLED [25].
| Факторы риска | Определение | Балл |
|---|---|---|
| Примечание: *за каждый фактор. НПВП - нестероидные противовоспалительные препараты | ||
| H | Неконтролируемая артериальная гипертония (САД>160 мм рт. ст.) | 1 |
| A | Нарушение функции почек и/или печени (диализ, трансплантация почки, сывороточный креатинин >200 ммоль/л, цирроз, увеличение уровня билирубин более чем в2раза по сравнению с верхней границей нормы, повышение АСТ/АЛТ/щелочной фосфатазы более чем в 3 раза по сравнению с верхней границей нормы | 1* |
| S | Инсульт (перенесенный ишемический или геморрагический инсульт) | 1 |
| B | Кровотечения в анамнезе или предрасположенность к ним (предшествующее большое кровотечение, анемия, тяжелая тромбоцитопения) | 1 |
| L | Лабильное МНО у больных, получающих антагонисты витамина К | 1 |
| E | Пожилой возраст (>65 лет или "хрупкий" пациент) | 1 |
| D | Сопутствующий прием препаратов (антиагреганты и НПВП) и/или алкоголя (запои или более 14 единиц в неделю) | 1* |
Склонность к падениям сама по себе не является независимым фактором риска кровотечения на фоне антикоагулянтной терапии, однако травма при падении у пожилого пациента, принимающего пероральные антикоагулянты, может привести к более тяжелому кровотечению, например, внутричерепному. Любопытные данные были получены в одном исследовании, в котором моделировались эффекты падений у пациентов, получающих пероральные антикоагулянты. Авторы показали, что пациенты, принимающие варфарин, должны падать примерно 295 раз в год, чтобы угроза серьезного кровотечений перевесила пользу снижения риска ишемического инсульта [26]. Тем не менее, приведенные данные не отменяют необходимость профилактики падений с помощью простых мер, таких как использование вспомогательных устройств при ходьбе, ношение соответствующей обуви, устранение препятствий для пожилого человека в квартире (ковры, лишняя мебель) и т.д.
Показания к назначению пероральных антикоагулянтов в новых рекомендациях Европейского общества кардиологов не изменились. Их применение необходимо, если значение индекса по шкале CHA2DS2-VASc составляет по крайней мере 2 у мужчин и 3 у женщин. Это означает, что пероральные антикоагулянты следует назначать всем больным с ФП (независимо от пола), достигшим возраста 75 лет, и пациентам в возрасте 6574 года при наличии по крайней мере одного дополнительного фактора риска инсульта, например, артериальной гипертонии или сахарного диабета, в то время как в более молодом возрасте основанием для антикоагуляции служит наличие по крайней мере двух факторов риска как у мужчин, так и у женщин (рис. 2). Если индекс по шкале CHA2DS2-VASc составляет 1 у мужчин или 2 у женщин, то антикоагулянтную терапию считают возможной, хотя четкие показания к ее назначению в таких случаях в рекомендациях не приводятся. ФП обычно развивается у людей пожилого и старческого возраста, страдающих различными заболеваниями, поэтому индекс по шкале CHA2DS2-VASc у большинства больных с этой аритмией превышает указанные значения, обосновывая применение антикоагулянтов. Кроме того, индекс CHA2DS2-VASc имеет тенденцию к увеличению как за счет возраста, так и присоединения новых заболеваний, повышающих риск инсульта. Необходимо еще раз подчеркнуть, что тип ФП (пароксизмальная/персистирующая или постоянная) не имеет значения для решения вопроса об антикоагулянтной терапии и не учитывается при расчете индекса по шкале CHA2DS2-VASc.
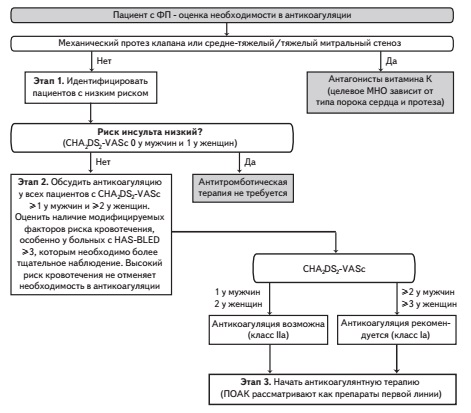
Для профилактики инсульта у пациентов с неклапанной ФП применяют антагонисты витамина К, прежде всего варфарин, или прямые оральные антикоагулянты (ПОАК), в том числе ривароксабан, апиксабан, дабигатрин и эдоксабан (последний не зарегистрирован в Российской Федерации). Комбинированная терапия ацетилсалициловой кислотой и клопидогрелом у таких пациентов по эффективности уступала варфарину и сопровождалась сопоставимым риском кровотечений [27], а монотерапия ацетилсалициловой кислотой оказалась неэффективной и ассоциировалась с более высоким риском ишемического инсульта у пожилых людей с ФП [28]. Таким образом, антитромбоцитарные препараты не следует рассматривать как более безопасную альтернативу пероральным антикоагулянтам у пациентов с ФП, нуждающихся в эффективной профилактике инсульта.
В настоящее время ПОАК считают препаратами первой линии в профилактике инсульта у пациентов с неклапанной ФП [11]. В регистрационных клинических исследованиях все препараты этой группы по эффективности по крайне мере не уступали варфарину. Однако при мета-анализе клинических исследований у больных, получавших ПОАК, было выявлено снижение риска инсульта и системных эмболий на 19% по сравнению с таковым при лечении варфарином, снижение риска геморрагического инсульта на 51% и риска смерти от любых причин на 10%. Кроме того, при применении ПОАК было отмечено недостоверное снижение риска больших кровотечений на 14% и статистически значимое снижение риска внутричерепного кровотечения на 52%, в то время как частота желудочно-кишечных кровотечений увеличилась на 25% [29]. Эти данные позволяют рассматривать ПОАК в целом как более эффективную и безопасную альтернативу непрямым антикоагулянтам.
В отличие от ПОАК, варфарин может взаимодействовать с различными лекарственными препаратами, которые могут усилить или, наоборот, ослабить его антикоагулянтное действие. При лечении непрямыми антикоагулянтами необходимо регулярно контролировать международное нормализованное отношение (МНО) и при необходимости корректировать их дозы. В целом антагонисты витамина К считают эффективными и относительно безопасными препаратами, если МНО удается поддерживать в терапевтическом диапазоне более 70% времени, хотя добиться этого удается не всегда. Предложена шкала SAMe-TT2R2 (женский пол, возраст менее 60 лет, наличие по крайней мере двух сопутствующих заболеваний, таких как артериальная гипертония, сахарный диабет, ИБС, атеросклероз периферических артерий, сердечная недостаточность, инсульт в анамнезе, заболевание легких и поражение печени или почек, лечение некоторыми препаратами, курение, неевропеоидная раса), которая позволяет выделить пациентов с ФП, у которых труднее обеспечить адекватный антикоагулянтный эффект варфарина [30]. Величина индекса по этой шкале >2 служит дополнительным доводом в пользу выбора ПОАК. Если больному все же приходится назначить варфарин или другой антагонист витамина К (обычно по экономическим причинам), то необходимо принимать дополнительные меры, чтобы повысить эффективность и безопасность терапии, например, более частое мониторирование МНО, повторные консультации и т.п.
Профиль эффективности ПОАК в профилактике инсульта у пациентов с неклапанной ФП подтвержден также в пострегистрационных исследованиях, результаты которых соответствовали таковым рандомизированных контролируемых исследований [31-33]. P. Kirchhof и соавт. обобщили результаты применения ривароксабана у 11121 пациента с неклапанной ФП (средний возраст 70,5±10,5 лет; 42,9% женщин), включенных в исследования, которые проводились в обычной клинической практике в 47 странах в рамках программы XANTUS (Xarelto for Prevention of Stroke in Patients With Atrial Fibrillation) [34]. Проспективный дизайн исследований повышает клиническую ценность полученных данных. Пациентов с ФП, начавших прием ривароксабана, наблюдали в течение 1 года. Частота больших кровотечений составила в среднем 1,7 на 100-пациентолет, смерти от любых причин – 1,9 на 100 пациентолет, инсульта и системных эмболий – 1,0 на 100 пациенто-лет. Для сравнения, частота первичной конечной точки, включавшей в себя инсульт и системные эмболии, в рандомизированном исследовании ROCKET AF, подтвердившем эффективность ривароксабана в профилактике инсульта у пациентов с неклапанной ФП, составила 1,7 на 100 пациенто-лет [35]. Частота как кровотечений, так и инсульта была низкой во всех странах, принимавших участие в программе XANTUS, а доля пациентов, продолжавших прием ривароксабана в течение года, равнялась 77,4% (от 66,4% в странах Восточной Азии до 84,4% в Западной Европе). Высокая приверженность к приему антикоагулянтной терапии отражает удобство применения ривароксабана, в том числе отсутствие необходимости в титровании дозы и регулярном мониторировании МНО, низкий риск взаимодействия с другими лекарственными средствами, стабильность антикоагулянтного эффекта и возможность назначения один раз в день [36].
Все ПОАК частично выводятся почками – в большей степени дабигатран и в меньшей степени ривароксабан и апиксабан, поэтому при выборе препарата и его дозы следует учитывать функцию почек. Например, дозу ривароксабана у пациентов с клиренсом креатинина 1549 мл/мин следует снизить с 20 до 15 мг один раз в день. Чтобы обеспечить безопасность антикоагулянтной терапии у больных с ФП, необходимо регулярно контролировать функцию почек с помощью клиренса креатитина, рассчитанного по формуле Кокрофта-Гоулта, так как именно этот показатель использовался в регистрационных клинических исследованиях. Оценивать функцию почек следует по крайней мере один раз в год или чаще у пациентов, относящихся к группе риска, например, при наличии исходного снижения функции почек. У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно рассмотреть применение ПОАК, которые в меньшей степени выводятся почками (ривароксабан или апиксабан). В практическом руководстве Европейской ассоциации аритмологов клиренс креатинина рекомендовано измерять каждые 6 мес у больных в возрасте ≥75 лет (особенно при лечении дабигатраном) и "хрупких" пациентов [37]. Чтобы оценить минимальный интервал определения клиренса креатинина у пациентов с исходно сниженной функцией почек клиренс креатинина следует разделить на 10. Например, у пациентов с его значением 40 мл/мин, клиренс креатинина следует измерять по крайней мере каждые 4 мес. Необходимо учитывать, что функция почек может быстро ухудшиться под влиянием различных интеркуррентных заболеваний, например, инфекций или острой сердечной недостаточности. Соответственно, в таких случаях необходимо также измерить клиренс креатинина.
ФП примерно в трети случаев сочетается с хронической болезнью почек (ХБП) III-V стадии, т.е. снижением расчетной скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2, что отражает общность факторов риска двух состояний, таких как пожилой возраст, артериальная гипертония, сахарный диабет и др. [38]. Более того, примерно у каждого четвертого пожилого пациента с неклапанной ФП в течение года можно ожидать прогрессирования ХБП. Например, в исследовании ORBIT-AF II у 6682 пациентов с ФП (медиана возраста 72 года), получавших ПОАК или варфарин, частота снижения клиренса креатинина более чем на 20% и 30% в течение 1 года после начала наблюдения составила 23,1% и 10,6%, соответственно [39]. Cочетание неклапанной ФП с ХБП ассоциируется с дополнительным увеличением риска развития ишемического инсульта, кровотечений и других неблагоприятных исходов. В регистрационных исследованиях ПОАК более чем у половины пациентов имелись признаки нарушения функции почек. По данным мета-анализа 4 рандомизированных клинических исследований ROCKET-AF, RE-LY, ARISTOTLE и ENGAGE AF-TIMI 48, в которых изучались ривароксабан, дабигатран, апиксабан и эдоксабан (последний не зарегистрирован в России), соответственно, при лечении ПОАК у пациентов с ФП и нарушенной функцией почек было отмечено достоверное снижение относительного риска развития инсульта и системных эмболий на 20% (p<0,01), больших кровотечений на 21% (р=0,017) и смерти от любых причин на 9% (р=0,031) по сравнению с таковым при применении варфарина [40]. Более того, "чистая" польза ПОАК, которую оценивали с учетом риска не только инсульта/системных эмболий, но и кровотечений, возрастала по мере ухудшения функции почек и была выше всего у пациентов с клиренсом креатинина 30-50 мл/мин. В исследовании ROCKET AF прогрессирование ХБП, критерием которого считали снижение клиренса креатинина более чем на 20% по сравнению с исходным, выявили у 26,3% больных [41]. Ухудшение функции почек ассоциировалось с увеличением риска смерти от сосудистых причин, комбинированной конечной точки, включавшей в себя инсульт, системные эмболии, сердечно-сосудистую смерть и инфаркт миокарда, и смерти от любых причин по сравнению с таковым у таковым у пациентов со стабильной функцией почек. Лечение ривароксабаном по сравнению варфарином у больных с прогрессирующей ХБП привело к снижению риска инсульта и системных эмболий и не вызывало увеличения риска больших и клинически значимых небольших кровотечений.
Результаты ретроспективных исследований показали, что лечение ПОАК у пациентов с неклапанной ФП может сопровождаться улучшением почечных исходов по сравнению с варфарином, в том числе снижением частоты острого почечного повреждения (ОПП), связанного с развитием нефропатии в результате чрезмерной антикоагуляции и кровоизлияний в клубочки почек [42]. В ретроспективном исследовании частота ОПП, предположительно ассоциированного с варфарином, составила 33,0% у больных с ХБП и 16,5% у пациентов с нормальной функцией почек [43]. При лечении ПОАК можно ожидать снижения риска развития ОПП за счет более предсказуемого антикоагулянтного действия по сравнению с варфарином. C. Coleman и соавт. проанализировали почечные исходы в ретроспективном исследовании у 72000 пациентов с ФП, начавших лечение ривароксабаном или варфарином в течение по крайней мере 12 мес [44]. Терапия ривароксабаном ассоциировалась со снижением риска развития ОПП на 19% и ХБП 5 стадии на 18% по сравнению с варфарином. В другом ретроспективном исследования почечные исходы оценивали у 9769 пациентов с неклапанной ФП, получавших различные ПОАК или варфарин [45]. Лечение ПОАК в течение 2 лет ассоциировалось с достоверным снижением риска развития или прогрессирования ХБП, в частности, вероятности снижения СКФ по крайней мере на 30% (отношение шансов 0,77; 95% ДИ 0,66-0,89; p<0,001) и удвоения сывороточного креатинина (0,62; 0,40-0,95; p=0,03) по сравнению с таковой при лечении варфарином. Улучшение почечного прогноза было выявлено при применении ривароксабана и дабигатрана, но не апиксабана. Такое преимущество ривароксабана может свидетельствовать в пользу его применения у пациентов с ухудшающейся функцией почек.
Улучшение контроля симптомов
Для оценки симптомов (сердцебиение, одышка, утомляемость, дискомфорт в груди и др.) ФП используют шкалу, предложенную Европейской ассоциацией аритмологов (EHRA) и отражающую влияние проявлений аритмии на обычную повседневную активность пациентов (табл. 3) [46,47]. Необходимо учитывать, что все указанные симптомы неспецифичны и могут быть следствием сопутствующих заболеваний, а подтвердить их связь с ФП иногда удается только ретроспективно. В рекомендациях Европейского общества кардиологов предлагается также оценивать тяжесть нагрузки ФП, которая отражает ее тип, общую длительность сохранения нарушения ритма при мониторировании ЭКГ, например, в течение 24 ч, число эпизодов аритмии, их максимальную длительность и т.п. [11]. Следует отметить, что в рекомендациях отсутствуют четкие критерии интепретации полученных данных. В некоторых исследованиях была выявлена ассоциация между параметрами нагрузки ФП и неблагоприятными клиническими исходами. A. Ganesan и соавт. при мета-анализе 12 исследований примерно у 100000 больных с непароксизмальной неклапанной ФП выявили увеличение риска тромбоэмболий и смерти (относительный риск 1,384; p<0,001, и 1,217, p<0,001, соответственно) по сравнению с таковым у пациентов с пароксизмальной ФП [48]. Нагрузка ФП может оказать определенное влияние на эффективность контроля ритма у пациентов с ФП [49]. Тем не менее, по мнению экспертов, имеющиеся данные о связи нагрузки ФП с клиническими исходами недостаточны для того, чтобы придавать им решающее значение при выборе стратегии лечения.
| Класс EHRA | Симптомы | Описание |
|---|---|---|
| 1 | Нет | ФН не сопровождается какимилибо симптомами |
| 2а | Легкие | Симптомы ФП не влияют на обычную повседневную активность |
| 2b | Умеренные | Симптомы ФП не влияют на обычная повседневную активность, но вызывают беспокойство у больног |
| 3 | Выраженные | Симптомы ФП нарушают обычную повседневную активность |
| 4 | Инвалидизирующие | Обычная повседневная активность невозможна |
Стратегия контроля частоты сердечных сокращений (ЧСС) у пациентов с неклапанной ФП по эффективности в профилактике неблагоприятных исходов не уступала стратегии контроля синусового ритма и часто оказывается достаточной для уменьшения симптомов, особенно у больных пожилого возраста [11]. Результаты исследования RACE II показали, что более "жесткий" контроль ЧСС, предполагавший снижение ее <80 в минуту в покое и <110 в минуту при умеренной физической нагрузке, не приводит к снижению суммарного риска клинических исходов [50]. В связи с этим целевое значение ЧСС в покое при выборе стратегии контроля частоты сердечного ритма может составлять <110 в минуту, хотя цель терапии может быть пересмотрена при сохранении симптомов или ухудшении функции левого желудочка [11].
Для контроля ЧСС у пациентов с неклапанной ФП обычно применяют b-адреноблокаторы, а также дигоксин, дилтиазем и верапамил или комбинацию этих препаратов, в то время как антиаритмические средства, такие как амиодарон или соталол, лучше назначать для контроля синусового ритма. Лечение обычно начинают с b-адреноблокаторов, хотя при наличии хронической обструктивной болезни легких или бронхиальной астмы очевидны преимущества недигидропиридиновых антагонистов кальция. В то же время последние не следует назначать пациентам с фракцией выброса левого желудочка <40%. При неэффективности комбинированной терапии препаратами, урежающими сердечный ритм, может быть выполнена абляция атриовентрикулярного узла в сочетании с имплантацией искусственного водителя ритма [51].
Как указано выше, стратегия контроля ритма, предполагающая восстановление и удержание синусового ритма, не улучшает клинические исходы у пациентов с ФП, поэтому первичная цель ее – уменьшение симптомов и улучшение качества жизни больных. Восста новление синусового ритма не означает отсутствие необходимости в приеме препаратов, урежающих ЧСС, антикоагуляции и коррекции сердечно-сосудистых факторов риска. Контроль синусового ритма может препятствовать прогрессированию ФП, т.е. ее переходу в более устойчивую форму, например, трансформации пароксизмальной ФП в персистирующую или постоянную или персистирующей ФП в постоянную форму. В американском когортном исследовании у 955 пациентов с недавно выявленной неклапанной ФП частота прогрессирования аритмии в течение 12 мес на фоне контроля синусового ритма была достоверно ниже, чем на фоне контроля ЧСС (5,8% и 27,6%, соответственно; p<0,001). Прогрес сирование ФП ассоциировалось также с пожилым возрастом, наличием персистирующей ФП и инсультом/ТИА в анамнезе [52].
Доводами в пользу выбора стратегии контроля синусового ритма могут быть следующие:- более молодой возраст пациента;
- первый эпизод ФП или короткий анамнез;
- кардиомиопатия, вызванная тахикардией;
- отсутствие выраженной дилатации левого предсердия;
- отсутствие заболевания сердца или сопутствующих заболеваний;
- трудности контроля ЧСС;
- преходящая причина ФП, например, острое заболевание;
- желание пациента.
Методы контроля синусового ритма после его восстановления путем электрической или медикаментозной кардиоверсии у пациентов с пароксизмальной или персистирующей ФП включают в себя применение антиаритмических препаратов и катетерную абляцию. Последнюю считают эффективным и безопасным методом, хотя в исследовании CABANA катетерная абляция не привела к достоверному снижению риска комбинированной конечной точки, включавшей в себя смерть, инвалидизирующий инсульт, серьезное кровотечение и остановку сердца, по сравнению с медикаментозной терапией, но сопровождалась значительным улучшением качества жизни [53]. Катетерную абляцию обычно проводят при неэффективности или плохой переносимости по крайней мере одного антиаритмического препарата I или III класса, хотя она может рассматриваться и как метод первой линии у пациентов с пароксзимальной ФП или больных с персистирующей ФП, у которых отсутствуют основные факторы рецидива аритмии после вмешательства (такие как возраст, дилатация левого предсердия, длительность ФП, нарушение функции почек и др.) [11]. Кроме того, катетерную абляцию рекомендуют выполнять для восстановления функции левого желудочка у пациентов с кардиомиопатией, индуцированной тахикардией, и для увеличения выживаемости и снижения частоты госпитализаций у пациентов с сердечной недостаточностью и сниженной функцией левого желудочка. По крайней мере у трети больных, перенесших катетерную абляцию, в различные сроки после вмешательства возникают рецидивы ФП. В настоящее время предложены различные шкалы для оценки риска рецидива аритмии после катетерной абляции, в том числе ALARMEc (тип аритмии, размер левого предсердия, почечная недостаточность, метаболический синдром и кардиомиопатия), BASE-AF2 (индекс массы тела >28 кг/м2, дилатация левого предсердия >40 мм, ранний рецидив ФП после абляции, длительность ФП >6 лет и непароксизмальная форма аритмии), APPLE (возраст ≥65 лет, персистирующая ФП, снижение скорости клубочковой фильтрации <60 мл/мин/1,73 м2, диаметр левого предсердия ≥43 мм и фракция выброса левого желудочка <50%), CAAP-AF (коронарная болезнь сердца, диаметр левого предсердия, возраст, персистирующая или длительная ФП, неэффективность антиаритмических препаратов и женский пол), ATLAS (возраст старше 60 лет, непароксизмальная ФП, дилатация левого предсердия, женский пол и курение), однако ни одна из них не имела существенных преимуществ перед другими [54]. Моди фи кация различных факторов риска, в том числе курения, употребления алкоголя, артериальной гипертонии, ожирения и т.д., может способствовать улучшению результатов катетерной абляции у пациентов с неклапанной ФП.
В рекомендациях Европейского общества кардиологов выделены следующие принципы антиаритмической терапии у больных с неклапанной ФП:- Цель антиаритмической терапии – уменьшение симптомов, связанных с ФП.
- Антиаритмическая терапия характеризуется умеренной эффективностью в профилактике рецидивов ФП.
- Антиаритмическая терапия скорее уменьшает число рецидивов аритмии, а не полностью их предупреж дает.
- Если один антиаритмический препарат оказывается неэффективным, то приемлемого клинического эффекта можно добиться с помощью другого препарата.
- Антиаритмическая терапия часто сопровождается аритмогенным эффектом и экстракардиальными побочными явлениями.
- Выбор антиаритмического препарата в первую очередь диктуется безопасностью, а не эффективностью.
Амиодарон остается самым эффективным антиаритмическим препаратом у больных с ФП, в том числе с сердечной недостаточностью и низкой фракцией выброса левого желудочка. В рекомендациях указано, что с учетом экстракардиальной токсичности амиодарона для длительного контроля синусового ритма у пациентов с ФП желательно по возможности применять другие антиаритмические препараты [11]. Тем не менее, как и в предыдущих версиях рекомендаций, другие антиаритмические средства, такие как пропафенон и соталол, рекомендовано использовать только при отсутствии признаков значительного структурного поражения сердца. Соталол может применяться у пациентов с ишемической болезнью сердца под тщательным контролем интервала QT, сывороточных уровней калия, клиренса креатинина и других факторов риска аритмогенного действия. К последним относят пожилой возраст, женский пол, нарушение функции почек и/или печени, коронарную болезнь сердца, гипокалиемию, случаи внезапной смерти у родственников. Анти арит мическую терапию не следует назначать пациентам с постоянной формой ФП, которые получают урежающие ритм препараты, а также больным с выраженными нарушениями проводимости, если им не установлен водитель ритма.
Лечение сердечно-сосудистых и других сопутствующих заболеваний
Сердечно-сосудистые заболевания и факторы риска, с одной стороны, способствуют развитию и рецидированию ФП, а, с другой стороны, сами могут быть причиной неблагоприятных исходов, в том числе инсульта, инфаркта и смерти. A. Gómez-Outes и соавт. провели мета-анализ 4 клинических исследований, в которых ПОАК сравнивали с варфарином в целом у 71683 больных с неклапанной ФП [55]. Во время периода наблюдения умерли 9% из них, а скорректированная смертность составила 4,72% в год. Доля сердечных причин в структуре общей смертности составила 46%. Основными факторами риска смерти от любых причин были сердечная недостаточность, постоянная/персистирующая ФП, сахарный диабет, мужской пол, пожилой возраст и сниженный клиренс креатинина. Сходные данные были получены в одном из исследований, включенных в мета-анализ, – ROCKET AF, в котором изучался ривароксабан [56]. Приведенные данные указывают на важность модификации сердечнососудистых факторов риска для улучшения прогноза у больных с неклапанной ФП.
Предложены шкалы, позволяющие стратифицировать больных с неклапанной ФП по риску основных сердечно-сосудистых событий, в том числе смертель ного и несмертельного инфаркта миокарда, реваску ляризации коронарных артерий и смерти от сердечно-сосудистых причин. Например, на основании проспективного когортного исследования у 1019 пациентов с ФП разработан индекс 2MACE, который рассчитывается с учетом возраста и наличия метаболического синдрома, застойной сердечной недоста точности и инфаркта миокарда/реваскуляризации коронарных артерий и тромбоэмболий в анамнезе (табл. 4) [57]. Величина индекса 2MACE варьируется от 0 до 7, а его значение ≥3 позволяло с высокой чувствительностью и специфичностью предсказать развитие неблагоприятных исходов у пациентов с неклапанной ФП (отношение рисков 3,92, 95% ДИ 2,41-6,40, p<0,001).
| Акроним | Факторы риска | Балл |
|---|---|---|
| 2М | Инфаркт миокарда/реваскуляризация коронарных артерий в анамнезе | 1 |
| Метаболический синдром | 2 | |
| А | Возраст ≥75 лет | 2 |
| С | Застойная сердечная недостаточность (фракция выброса<40%) | 1 |
| E | Тромбоэмболии | 1 |
Лечение сопутствующих заболеваний и модификация сердечно-сосудистых факторов риска рассматриваются как один из ключевых компонентов современной стратегии ведения пациентов с ФП [11]. В рандомизированном исследовании RACE 3 более "агрессивное" лечение сопутствующих сердечно-сосудистых заболеваний привело к достоверному увеличению частоты удержания синусового ритма по сравнению с обычной терапией (75% и 63%, соответственно, р=0,042) [58]. В некоторых исследованиях изучалось влияние модификации отдельных факторов риска на течение ФП. В рандомизированном исследовании у 184 пациентов с ФП, перенесших катетерную абляцию, более "агрессивная" антигипертензивная терапия не вызывала снижение риска развития рецидивов аритмии после вмешательства, но сопровождалась увеличением частоты эпизодов артериальной гипотонии [59]. В то же время оптимальный контроль гликемии в течение 12 мес до катетерной абляции ассоциировался со снижением риска развития рецидивов аритмии [60]. В другом рандомизированном клиническом исследовании абстиненция вызывала снижение частоты эпизодов ФП у пациентов, регулярно употреблявших алкоголь [61]. С другой стороны, кофеин, вероятно, существенно не влияет на риск развития ФП, хотя употребление кофе может сопровождаться сердцебиением, не связанным с аритмией [62]. Регулярные умеренные физические нагрузки могут оказать благоприятное влияние на течение ФП, в то время как интенсивная физическая активность, наоборот, ассоциируется с увеличением риска ее развития [63]. Снижение массы тела у пациентов с ожирением и ФП вызывало уменьшение симптомов и частоты приступов аритмии [64]. В целом результаты модификации отдельных факторов риска в клинических исследованиях у пациентов с ФП оказались неоднозначными. Вероятно, это объясняется тем, что развитие ФП является следствием взаимодействия различных сердечно-сосудистых и других факторов риска и заболеваний.
ФП нередко наблюдается у пациентов с острым и хроническим коронарным синдромом, а примерно у 10-15% больных с ФП проводятся чрескожные вмешательства на коронарных артериях (ЧКВ) [65]. Лекарственные средства, которые используются для лечения коронарной болезни сердца, в том числе ингибиторы АПФ, блокаторы рецепторов ангиотензина II, антагонисты минералокортикоидных рецепторов, статины, могут препятствовать развитию ФП или оказывают благоприятное влияние на ее течение, в то время как b-адреноблокаторы или недигидропиридиновые антагонисты кальция широко применяются у больных с ФП для контроля ЧСС. Однако возможность и целесообразность комбинированной терапии пероральными антикоагулянтами и антитромбоцитарными препаратами у пациентов с коронарной болезнью сердца и ФП заслуживает отдельного обсуждения, учитывая значительное увеличение риска кровотечения на фоне такого лечения. В рекомендациях Европейского общества кардиологов указано, что при выборе антитромботических препаратов и длительности антитромботической терапии у пациентов с неклапанной ФП, перенесших острый коронарный синдром (ОКС) и/или ЧКВ, необходимо тщательно взвешивать риск ишемического инсульта/системных эмболий, коронарных ишемических осложнений и кровотечений, связанных с приемом антитромботических препаратов [11]. В целом терапия двумя антитромботическими препаратами, в том числе ПОАК и ингибитором P2Y12 рецепторов (предпочительно клопидогрелом), сопровождалась значительным снижением риска кровотечений по сравнению с тройной антитромботической терапией. Например, в исследование PIONEER AF-PCI были включены 2124 больных с неклапанной ФП, которым было выполнено стентирование коронарной артерии (в половине случаев по поводу ОКС). Терапия ривароксабаном в сниженной дозе 15 мг один раз в сутки (у пациентов с нарушенной функцией почек ее снижали до 10 мг/сут) в комбинации с ингибитором P2Y12 рецепторов (преимущественно клопидогрелом) в течение 12 мес по эффективности в профилактике неблагоприятных исходов, в том числе инфаркта миокарда, инсульта, тромбоза стента и смерти от сердечно-сосудистых причин, не уступала терапии антагонистом витамина К в комбинации с двумя антитромбоцитарными препаратами, но сопровождалась значительным снижением риска развития клинически значимых кровотечений на 41% [66]. Тем не менее, эксперты Европейского общества кардиологов считают желательным короткий курс тройной антитромботической терапии пероральным антикоагулянтом, аспирином и клопидогрелом (например, в течение ≤1 недели) у части пациентов с ФП, перенесших ОКС или ЧКВ, у которых имеется высокий риск ишемических осложнений [11]. Длительность тройной терапии может быть увеличена до ≤1 мес, если угроза тромбоза стента перевешивает риск кровотечений. К факторам риска тромботических осложнений относят сахарный диабет, ОКС в анамнезе, поражение нескольких коронарных артерий, атеросклероз периферических артерий, развитие коронарной болезни в возрасте до 45 лет или быстрое ее прогрессирование, ХБП 3 стадии [11].
Двойную терапию ПОАК и клопидогрелом после неосложненного стентирования коронарных артерий у пациентов с ОКС обычно продолжают в течение 1 года, а у пациентов со стабильной хронической ИБС, перенесших ЧКВ, – в течение 6 мес. Если в течение указанного срока не было зарегистрировано ишемических осложнений, то в дальнейшем целесообразно проводить монотерапию пероральным антикоагулянтом. Моноте рапия рекомендуется также пациентам с неклапанной ФП и стабильной ИБС.
Доводами в пользу монотерапии пероральными антикоагулянтами являются, с одной стороны, их предполагаемая эффективность в профилактике сердечнососудистых событий, а, с другой стороны, более низкий риск кровотечений, который неизбежно увеличивается при присоединении дополнительных антитромботических препаратов. P. Kupó и соавт. провели мета-анализ 28 рандомизированных клинических исследований, в которых ПОАК сравнивали с антагонистами витамина К, антитромбоцитарными препаратами и/или плацебо по различным показаниям в целом у 196761 больного [67]. Лечение ривароксабаном ассоциировалось со снижением относительного риска инфаркта миокарда на 21% по сравнению с плацебо и на 31% по сравнению с дабигатраном. Сходные данные ранее были получены другими авторами. Например, Y. Loke и соавт. при мета-анализе 27 рандомизированных контролируемых клинических исследований выявили снижение риска коронарных осложнений при применении ривароксабана по сравнению с таковым при лечении дабигатраном [68]. При интерпретации полученных данных необходимо учитывать, что они были получены не в прямых сравнительных исследованиях ПОАК, а показания к их применению включали не только неклапанную ФП, но и другие состояния.
Заключение
Современная стратегия лечения больных с неклапанной ФП, которая подробно рассматривается в рекомендациях Европейского общества кардиологов 2020 г., предполагает антикоагуляцию с целью профилактики инсульта и системных эмболий, улучшение контроля симптомов ФП путем урежения ЧСС или восстановления и удержания синусового ритма и оптимальное лечение сердечно-сосудистых и других сопутствующих заболеваний, которые в структуре смертности паци ентов с ФП занимают даже более важное место, чем ишемический инсульт. Накапливаются данные, демонстрирующие дополнительные преимущества ПОАК перед непрямыми антикоагулянтами. Например, в мета-анализах рандомизированных клинических исследованиях показано снижение риска развития инфаркта миокарда/ОКС при лечении ривароксабаном по срав нению с контролем. В ретроспективных исследованиях лечение ривароксабаном улучшало почечные исходы у пациентов с неклапанной ФП. Пациентам с ФП следует проводить структурированное обследование, включающее в себя оценку риска инсульта, выраженности симптомов, тяжести нагрузки ФП (тип аритмии, число и длительность эпизодов и т.п.) и предрасполагающего состояния. Важное значение имеет использование различных шкал, в том числе CHA2DS2-VASc (риск инсульта), HAS-BLED (риск кровотечения), EHRA (выраженность симптомов ФП) и 2MACE (риск сердечно-сосудистых исходов), которые помогают выбрать оптимальное лечение. Для более точной оценки риска инсульта и кровотечений у пациентов с ФП предложены новые шкалы на основе не только клинических показателей, но и лабораторных маркеров, однако их потенциальные преимущества перед существующими общепринятыми индексами нуждаются в подтверждении.
Используемые источники
- Benjamin EJ, Muntner P, Alonso A, American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics 2019 update: a report from the American Heart Association. Circulation 2019;139:e56-528.
- Li KHC, White FA, Tipoe T, et al. The current state of mobile phone apps for monitoring heart rate, heart rate variability, and atrial fibrillation: narrative review. JMIR Mhealth Uhealth 2019;7:e11606.
- Halcox JPJ, Wareham K, Cardew A, Gilmore M, et al. Assessment of remote heart rhythm sampling using the AliveCor heart monitor to screen for atrial fibrillation: the REHEARSE-AF Study. Circulation 2017;136:1784-94.
- Freedman B, Camm J, Calkins H, et al, SCREEN CollaboratorsAF. Screening for atrial fibrillation: a report of the AF-SCREEN International Collaboration. Circulation 2017;135:1851-67.
- Magnussen C, Niiranen TJ, Ojeda FM, et al, BiomarCaRE Consortium. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe). Circulation 2017;136: 1588-97.
- Kotecha D, Lam CS, Van Veldhuisen DJ, et al. Heart failure with preserved ejection fraction and atrial fibrillation: vicious twins. J Am Coll Cardiol 2016;68:221728.
- Blum S, Muff C, Aeschbacher S, et al. Prospective assessment of sex-related differences in symptom status and health perception among patients with atrial fibrillation. J Am Heart Assoc 2017;6:e005401.
- Kalantarian S, Stern TA, Mansour M, Ruskin JN. Cognitive impairment associated with atrial fibrillation: a meta-analysis. Ann Intern Med 2013;158:338-46.
- Kim MH, Johnston SS, Chu BC, Dalal MR, Schulman KL. Estimation of total incremental health care costs in patients with atrial fibrillation in the United States. Circ Cardiovasc Qual Outcomes 2011;4:313-20.
- Meyre P, Blum S, Berger S, et al. Risk of hospital admissions in patients with atrial fibrillation: a systematic review and meta-analysis. Can J Cardiol 2019;35:133243.
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020;ehaa612. doi:10.1093/eurheartj/ ehaa612.
- Potpara TS, Lip GYH, Blomstrom-Lundqvist C, et al. The 4S-AF scheme (Stroke Risk; Symptoms; Severity of Burden; Substrate): A novel approach to in-depth characterization (rather than Classification) of atrial fibrillation. Thromb Haemost 2020; doi: 10.1055/s-0040-1716408.
- Lip GYH. The ABC pathway: an integrated approach to improve AF management. Nat Rev Cardiol 2017;14:627-28.
- Proietti M, Romiti GF, Olshansky B, et al. Improved outcomes by integrated care of anticoagulated patients with atrial fibrillation using the simple ABC (Atrial Fibrillation Better Care) Pathway. Am J Med 2018;131:1359-1366.
- Yoon M, Yang PS, Jang E, et al. Improved population-based clinical outcomes of patients with atrial fibrillation by compliance with the simple ABC (Atrial Fibrillation Better Care) pathway for integrated care management: a nationwide cohort study. Thromb Haemost 2019;19:1695-703.
- Pastori D, Farcomeni A, Pignatelli P, et al. ABC (Atrial fibrillation Better Care) pathway and healthcare costs in atrial fibrillation: the ATHEROAF study. Am J Med 2019;132:856-61.
- Pastori D, Pignatelli P, Menichelli D, et al. Integrated care management of patients with atrial fibrillation and risk of cardiovascular events: the ABC (Atrial fibrillation Better Care) pathway in the ATHERO-AF study cohort. Mayo Clin Proc 2019;94:1261-67.
- Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factorbased approach: the Euro Heart Survey on atrial fibrillation. Chest 2010;137: 263-72.
- Wu VC, Wu M, Aboyans V, et al. Female sex as a risk factor for ischaemic stroke varies with age in patients with atrial fibrillation. Heart 2020;106:534-40.
- Nielsen PB, Skjoth F, Overvad TF, et al. Female sex is a risk modifier rather than a risk factor for stroke in atrial fibrillation: should we use a CHA2DS2-VA score rather than CHA2DS2-VASc? Circulation 2018;137:832-40.
- Hijazi Z, Oldgren J, Siegbahn A, Wallentin L. Application of biomarkers for risk stratification in patients with atrial fibrillation. Clin Chem 2017;63:152-64.
- Hijazi Z, Lindback J, Alexander JH, et al.; ARISTOTLE and STABILITY Inves tigators. The ABC (age, biomarkers, clinical history) stroke risk score: a biomarker-based risk score for predicting stroke in atrial fibrillation. Eur Heart J 2016; 37:1582-90.
- Shin SY, Han SJ, Kim JS, et al. Identification of markers associated with development of stroke in ‘clinically low-risk’ atrial fibrillation patients. J Am Heart Assoc 2019;8:e012697.
- Borre ED, Goode A, Raitz G, et al. Predicting thromboembolic and bleeding event risk in patients with non-valvular atrial fibrillation: a systematic review. Thromb Haemost 2018;118:2171-87.
- Chao TF, Lip GYH, Lin YJ, et al. Incident risk factors and major bleeding in patients with atrial fibrillation treated with oral anticoagulants: a comparison of baseline, follow-up and Delta HAS-BLED scores with an approach focused on modifiable bleeding risk factors. Thromb Haemost 2018;118:768-77.
- Man-Son-Hing M, Nichol G, Lau A, Laupacis A. Choosing antithrombotic therapy for elderly patients with atrial fibrillation who are at risk for falls. Arch Intern Med 1999;159:677-85.
- ACTIVE Writing Group of the ACTIVE Investigators, Connolly S, Pogue J, Hart R, et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of VascularEvents (ACTIVE W): a randomised controlled trial. Lancet 2006;367: 1903-12.
- Sjalander S, Sjalander A, Svensson PJ, Friberg L. Atrial fibrillation patients do not benefit from acetylsalicylic acid. Europace 2014;16:631-8.
- Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955-62.
- Apostolakis S, Sullivan RM, Olshansky B, Lip GYH. Factors affecting quality of anticoagulation control among patients with atrial fibrillation on warfarin: the SAMe-TT(2)R(2) score. Chest 2013;144:1555-63.
- Camm AJ, Amarenco P, Haas S, et al; XANTUS Investigators. XANTUS: a realworld, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation. Eur Heart J 2016;37:1145-53.
- Martinez CAA, Lanas F, Radaideh G, et al; XANTUS Investigators. XANTUSEL: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation in Eastern Europe, Middle East, Africa and Latin America. Egypt Heart J 2018;70:307-13.
- Li XS, Deitelzweig S, Keshishian A, et al. Effectiveness and safety of apixaban versus warfarin in non-valvular atrial fibrillation patients in ‘real-world’ clinical practice. A propensity-matched analysis of 76,940 patients. Thromb Haemost 2017;117:1072-82.
- Kirchhof P, Radaideh G, Kim Y-H, et al. Global prospective safety analysis of rivaroxaban. J Am Coll Cardiol 2018;72:141-53.
- Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883-91.
- Ingrasciotta Y, Crisafulli S, Pizzimenti V, Marciano I, Mancuso A, Ando G, Corrao S, Capranzano P, Trifiro G. Pharmacokinetics of new oral anticoagulants: implications for use in routine care. Expert Opin Drug Metab Toxicol 2018;14:1057-69.
- Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018;39:1330-93.
- Моисеев С.В., Киякбаев Г.Г., Фомин В.В. Новые пероральные антикоагулянты в профилактике инсульта у больных с фибрилляцией предсердий и хронической болезнью почек. Клин фармакол тер 2015;3:5-11. [Moiseev S, Kiyakbaev GG, Fomin VV. Novel oral anticoagulants in prevention of stroke in patients with atrial fibrillationa and chronic kidney disease. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2015;3:5-11 (In Russ.)].
- Inohara T, Holmes DN, Pieper K, et al. Decline in renal function and oral anticoagulation dose reduction among patients with atrial fibrillation. Heart 2020;106(5):358-64.
- Gu ZC, Kong LC, Yang SF, et al. Net clinical benefit of non-vitamin K antagonist oral anticoagulants in atrial fibrillation and chronic kidney disease: a trade-off analysis from four phase III clinical trials. Cardiovasc Diagn Ther 2019;9:410-9.
- Fordyce CB, Hellkamp AS, Lokhnygina Y, et al. On-treatment outcomes in patients with worsening renal function with rivaroxaban comparedwith warfarin: insights from ROCKET AF. Circulation 2016;134:37–47.
- Моисеев С.В. Применение прямых оральных антикоагулянтов у пациентов с фибрилляцией предсердий и ухудшающейся функцией почек. Клин фармакол тер 2020;29(2):12-20 [Moiseev S. Novel oral anticoagulants for atrial fibrillation in patients with worsening renal function. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):12-20 (In Russ.)].
- Brodsky SV, Nadasdy T, Rovin BH, et al. Warfarin-related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney Int 2011;80(2):181-9.
- Coleman CI, Kreutz R, Sood N, et al. Rivaroxaban's impact on renal decline in patients with nonvalvular atrial fibrillation: A US MarketScan claims database analysis. Clin Appl Thromb Hemost 2019;25:1076029619868535.
- Yao X, Tangri N, Gersh BJ, et al. Renal outcomes in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol 2017;70:2621-32.
- Kirchhof P, Auricchio A, Bax J, et al. Outcome parameters for trials in atrial fibrillation: recommendations from a consensus conference organized by the German Atrial Fibrillation Competence NETwork and the European Heart Rhythm Association. Europace 2007;9:1006–23.
- Wynn GJ, Todd DM, Webber M, et al. The European Heart Rhythm Association symptom classification for atrial fibrillation: validation and improvement through a simple modification. Europace 2014;16:965–72
- Ganesan AN, Chew DP, Hartshorne T, et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis. Eur Heart J 2016;37:1591-602.
- Ecker V, Knoery C, Rushworth G, et al. A review of factors associated with maintenance of sinus rhythm after elective electrical cardioversion for atrial fibrillation. Clin Cardiol 2018;41:862-70.
- Van Gelder IC, Groenveld HF, Crijns HJ, et al.; RACE II Investigators. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010;362:1363-73.
- Lim KT, Davis MJ, Powell A, et al. Ablate and pace strategy for atrial fibrillation: long-term outcome of AIRCRAFT trial. Europace 2007;9:498-505.
- Zhang YY, Qiu C, Davis PJ, et al. Predictors of progression of recently diagnosed atrial fibrillation in REgistry on Cardiac Rhythm DisORDers Assessing the Control of Atrial Fibrillation (RecordAF) – United States cohort. Am J Cardiol 2013;112:79-84.
- Mark DB, Anstrom KJ, Sheng S, et al. Effect of catheter ablation vs medical therapy on quality of life among patients with atrial fibrillation: the CABANA randomized clinical trial. JAMA 2019;321:1275-85.
- Kosich F, Schumacher K, Potpara T, et al. Clinical scores used for the prediction of negative events in patients undergoing catheter ablation for atrial fibrillation. Clin Cardiol 2019;42:320-9.
- Gómez-Outes A, Lagunar-Ruíz J, Terleira-Fernández AI, et al. Causes of death in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol 2016;68:250821.
- Pokorney SD, Piccini JP, Stevens SR, et al. Cause of death and predictors of allcause mortality in anticoagulated patients with nonvalvular atrial fibrillation: data from ROCKET AF. J Am Heart Assoc 2016;5:e002197
- Pastori D, Farcomeni A, Poli D, et al. Cardiovascular risk stratification in patients with non-valvular atrial fibrillation: the 2MACE score. Intern Emerg Med 2016; 11:199-204.
- Rienstra M, Hobbelt AH, Alings M, et al. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J 2018;39:2987-96.
- Parkash R, Wells GA, Sapp JL, et al. Effect of aggressive blood pressure control on the recurrence of atrial fibrillation after catheter ablation: a randomized, openlabel clinical trial (SMAC-AF [Substrate Modification With Aggressive Blood Pressure Control]). Circulation 2017;135:1788-98.
- Donnellan E, Aagaard P, Kanj M, et al. Association between pre-ablation glycemic control and outcomes among patients with diabetes undergoing atrial fibrillation ablation. JACC Clin Electrophysiol 2019;5:897-903.
- Voskoboinik A, Kalman JM, De Silva A, et al. Alcohol abstinence in drinkers with atrial fibrillation. N Engl J Med 2020;382:20-8.
- Cheng M, Hu Z, Lu X, Huang J, Gu D. Caffeine intake and atrial fibrillation incidence: dose response meta-analysis of prospective cohort studies. Can J Cardiol 2014;30:448-54.
- Molina L, Mont L, Marrugat J, et al. Long-term endurance sport practice increases the incidence of lone atrial fibrillation in men: a follow-up study. Europace 2008;10:618-23.
- Abed HS, Wittert GA, Leong DP, et al. Effect of weight reduction and cardiometabolic risk factor management on symptom burden and severity in patients with atrial fibrillation: a randomized clinical trial. JAMA 2013;310:2050-60.
- Kralev S, Schneider K, Lang S, et al. Incidence and severity of coronary artery disease in patients with atrial fibrillation undergoing first-time coronary angiography. PLoS One 2011;6:e24964.
- Gibson CM, Mehran R, Bode C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016;375(25):2423-34.
- Kupó P, Szakács Z, Solymár M, et al. Direct anticoagulants and risk of myocardial infarction, a multiple treatment network meta-analysis. Angiology 2020;71: 27-37.
- Loke YK, Pradhan S, Yeong JK, Kwok CS. Comparative coronary risks of apixaban, rivaroxaban and dabigatran: a meta-analysis and adjusted indirect comparison. Br J Clin Pharmacol 2014;78:707-17.
