Влияние носительства полиморфного маркера G1846A гена CYP2D6 на гемодинамический эффект пропранолола у больных циррозом печени
Изучение влияния носительства полиморфного маркера G1846A гена CYP2D6 на гемодинамический эффект пропранолола у больных циррозом печени и портальной гипертензией.
В исследование были включены 60 пациентов с циррозом печени, которые получали терапию пропранололом в дозе 30 мг/сут в течение 14 дней. Эффективность лечения оценивали ультрасонографически с помощью измерения линейной скорости кровотока воротной вены исходно и через 14 дней. Полиморфный маркер G1846A гена CYP2D6 определяли методом полимеразной цепной реакции в режиме реального времени. Для оценки активности CYP2D6 измеряли отношение концентрации пинолина и его метаболита в утренней моче методом высокоэффективной жидкостной хроматографии с масс-спектрометрией.
Любое увеличение средней линейной скорости кровотока воротной вены по сравнению с исходной было отмечено у 41 (68,3%) пациента, в том числе по крайней мере на 20% – у 29. У пациентов, ответивших на лечение, средняя линейная скорость кровотока воротной вены увеличилась с 10,4±3,9 до 14,7±4,3 см/с (р<0,001). При регрессионном анализе выявлено статистически значимое влияние носительства полиморфного маркера G1846A гена CYP2D6 на терапевтический эффект пропранолола (p<0,05). У носителей гомозиготного генотипа CYP2D6 G/G1846 наблюдалось более значимое увеличение средней линейной скорости кровотока воротной вены на фоне терапии пропранололом, чем КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (4) у пациентов с гетерозиготным генотипом G/A1846. Активность CYP2D6 достоверно не зависела от тяжести цирроза печени (p>0,05).
Носительство полиморфного маркера G1846A гена CYP2D6 ассоциировалось с гемодинамическим эффектом пропранолола у пациентов с циррозом печени в российской популяции. Предложен алгоритм персонализации лечения пациентов с циррозом печени неселективными b-адреноблокаторами с использованием метода генотипирования по CYP2D6.
Многие годы неселективные b-адреноблокаторы, прежде всего пропранолол, снижающий давление в системе воротной вены, применяются для лечения портальной гипертензии и предотвращения развития кровотечения из варикозно-расширенных вен пищевода (ВРВП) у пациентов с декомпенсированным циррозом печени [1]. В крупных плацебо-контролируемых исследованиях b-адреноблокаторы снижали риск развития первого кровотечения из ВРВП на 30–40% [2-5].
Однако, в ряде случаев b-адреноблокаторы оказываются неэффективными. Недоста точная чувствительность к неселективным b-адреноблокаторам может наблюдаться у пациентов с кровотечением из ВРВП в анамнезе или с нарушением функции печени. В отдаленном периоде уменьшение лечебного эффекта пропранолола отмечено у 50–70% больных [6]. Кроме того, блокада b-адренорецепторов может привести к ряду осложнений, включая бронхоспазм и нарушение атрио-вентрикулярной проводимости [7]. В связи с этим необходимо иметь предикторы положительного гемодинамического действия неселективных b-адреноблокаторов для прогнозирования эффективности лечения.
Цитохром 2D6 (CYP2D6) играет важную роль в метаболизме пропранолола, в большей степени за счет реакции 4-гидроксилирования [8]. Одна из основных особенностей CYP2D6 – значительная вариабельность его активности в популяции. Основная причина вариабельности – генетический полиморфизм, т.е. существование различных аллелей гена CYP2D6 в результате мутаций. Некоторые из этих аллелей функционально полноценны, активность других значительно снижена. Для носителей полиморфизма, снижающего активность фермента CYP2D6, необходим индивидуальный подбор дозировок лекарственных средств. Воздействие ингибирующих веществ на CYP2D6 приводит к повышению концентрации лекарственных средств в организме и их длительной циркуляции, пролонгированию фармакологического эффекта и развитию побочного действия. У "медленных" метаболизаторов концентрация пропранолола в крови выше, чем у "экстенсивных", что может быть связано с носительством полиморфного маркера G1846A гена CYP2D6 (CYP2D6*4). Следовательно, изучение влияния полиморфизма гена CYP2D6 на гемодинамический ответ при применении пропранолола может быть основой для прогнозирования эффективности данного препарата и персонализации применения b-адреноблокаторов у пациентов с циррозом печени. В российской популяции подобные исследования не проводились.
Для оценки активности изоферментов цитохрома Р450 используют методы фенотипирования. Для фенотипирования изофермента CYP2D6 были разработаны и валидизированы различные методики. Применение экзогенных "маркеров" для фенотипирования может привести к развитию нежелательных лекарственных реакций, поэтому лучше использовать эндогенные "маркеры", такие как пинолин, который подвергается О-деметилированию только под действием CYP2D6 с образованием метаболита 6-гидрокси-1,2,3,4-тетрагидро-b-карболина [9]. Около 99% метаболита пинолина выводится из организма с мочой [10].
В настоящее время отсутствует четкая схема назначения неселективных b-адреноблокаторов при синдроме портальной гипертензии у больных циррозом печени. Препарат назначают в дозе, снижающей частоту сердечной сокращений (ЧСС) в покое на 25% либо до 55 в минуту (при исходно невысокой ЧСС). Суточная доза назначаемого пропранолола варьируется от 30 (начальная) до 320 (максимальная) мг [11]. В клинических рекомендациях Европейской ассоциации по изучению печени (EASL) 2018 г. отсутствует алгоритм дозирования пропранолола. Авторы рекомендаций указывают, что применение неселективных b-адреноблокаторов у пациентов с циррозом печени должно основываться на оценке соотношения возможных риска и пользы и показателей центральной гемодинамики [12].
Целью исследования было изучение влияния носительства полиморфного маркера G1846A гена CYP2D6 на гемодинамический эффект пропранолола у больных циррозом печени и портальной гипертензией.
Материал и методы
В проспективное исследование, выполненное на клинической базе кафедры гастроэнтерологии РМАНПО (терапевтическое отделение ГКБ им. братьев Бахрушиных ДЗМ г. Москва) в 2017-2020 гг., включали пациентов в возрасте до 75 лет с подтвержденным диагнозом цирроза печени различной этиологии класса А, В и С по Чайлд-Пью. Все больные подписали информированное добровольное согласие на участие в исследовании и обработку персональных данных. Протокол исследования был одобрен Локальным этическим комитетом Российской медицинской академии непрерывного профессионального образования Минздрава России.
Критериями невключения служили наличие противопоказаний к применению пропранолола, указанных в инструкции по медицинскому применению препарата; одновременный прием ингибиторов изофермента CYP2D6 (дезипрамин, пароксетин, ритонавир, сертралин, хинидин, тербинафин, флуоксетин, целекоксиб, пропафенон и дифенгидрамин), лекарственных средств, метаболизм которых осуществляется CYP2D6 (амитриптилин, кодеин, галоперидол, имипрамин, метопролол, нортриптилин); кровотечение из ВРВП во время настоящей госпитализации; сопутствующее онкологическое заболевание.
Для верификации диагноза цирроза печени были использованы клинические и лабораторные данные (общие анализы крови и мочи, биохимический анализ крови с определением концентраций общего и прямого билирубина, аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, лактатдегидрогеназы, гамма-глутамилтрансферазы, глюкозы, креатинина и мочевины). Тяжесть цирроза печени оценивали по классификация Чайлд-Пью (с учетом измерения уровня билирубина и альбумина крови, МНО или протромбинового индекса, степени выраженности асцита и печеночной энцефалопатии, определенной методом связи чисел). Для выявления ВРВП, печеночной гастропатии и признаков кровотечения применяли эзофагогастродуоденоскопию.
Исследование состояло из двух визитов с интервалом в 14 дней. На первом визите после установления диагноза и соответствия пациентов критериям отбора проводили ультрасонографическое измерение средней линейной скорости кровотока воротной вены (СЛСКВ) на аппарате Toshiba Aplio 500 и взятие венозной крови и мочи. Всем больным назначали пропранолол в дозе 10 мг три раза в день. На втором визите повторно измеряли СЛСКВ. Референтное значение этого параметра – 22,9±4,2 см/с [13]. С целью оценки влияния носительства полиморфного маркера G1846A гена CYP2D6 на гемодинамический эффект пропранолола в качестве критерия ответа принимали увеличение СЛСКВ на ≥10% и ≥20% по сравнению с исходным.
Генотипирование проводили с использованием венозной крови, собранной в первый день исследования в вакуумные пробирки с ЭДТА-К3 IMPROVACUTER (Guangzhou Improve Medical Instruments Co., Ltd, Китай). Для изучения генетического полиморфизма CYP2D6*4 применяли метод полимеразной цепной реакции в режиме реального времени (амплификатор CFX96 Touch Real-Time System с ПО CFX Manager компании BioRad, США, 2014 года выпуска и наборы SNP-Скрин ЗАО "Синтол", Россия). Пациентов распределяли на подгруппы с учетом наличия генотипов GG и GA.
Для оценки активности CYP2D6 измеряли отношение концентрации 6-гидрокси-1,2,3,4-тетрагидро-b-карболина к концентрации пинолина в утренней моче методом высокоэффективной жидкостной хроматографии с масс-спектрометрией (хроматограф Agilent 1100 series).
В зависимости от используемого метода, объема исследуемых групп, а также математического вида регистрируемого показателя использовали различные методы вариационной статистики, рекомендованные для анализа результатов клинических исследований [14]. При сравнении количественных и качественных признаков оценивали нормальность распределения с помощью теста Колмогорова-Смирнова и Шапиро-Уилка и использовали критерий Манна-Уитни. Достоверность различий качественных признаков оценивали с помощью непараметрического критерия согласия Пирсона (Хи-квадрат). Для проверки различий между двумя выборками парных или независимых измерений использовали непараметрический критерий Вилкоксона. С целью оценки влияния носительства полиморфного маркера G1846A гена CYP2D6 на эффективность терапии пропранололом у пациентов с циррозом печени была построена унивариативная логистическая регрессионная модель. Вычисления осуществлялись с использованием программного продукта STATISTICA 10.0 ("StatSoft Inc.", США).
Результаты
В исследование были включены 60 пациентов с циррозом печени, в том числе 34 мужчины и 26 женщин. Основными этиологическими факторами цирроза были злоупотребление алкоголем (у 36) и его комбинация с вирусным гепатитом С (у 14). Клинические и лабораторные проявления цирроза печени приведены в табл. 1. У 40 (66,7%) больных при эзофагогастродуоденоскопии выявили ВРВП, преимущественно второй степени (у 21), у 12 (20,0%) – признаки печеночной гастропатии. При ультрасонографии у 46 (76,6%) больных определялась спленомегалия, которая сопровождалась гиперспленизмом у 37 пациентов.
| Проявления | n (%) |
|---|---|
| Спленомегалия | 46(77) |
| Гиперспленизм | 37 (62) |
| Анемия | |
| Легкая | 18 (30) |
| Средняя | 14 (23) |
| Тяжелая | 6 (10) |
| ВРВП, степень | |
| 1 | 11 (18) |
| 2 | 21 (35) |
| 3 | 8 (13) |
| Печеночная гастропатия | 12 (20) |
| Асцит, степень | |
| 1 | 6 (10) |
| 2 | 38 (63) |
| 3 | 1 (2) |
| Отеки нижних конечностей | 40 (67) |
| Гидроторакс | 2 (3) |
| Печеночная энцефалопатия, степень | |
| 1 | 23 (38) |
| 2 | 19 (32) |
| 3 | 0 |
| Желтуха | 35 (58) |
| Синдром холестаза | 50 (83) |
| Гипоальбуминемия | 43 (72) |
| Гепаторенальный синдром | 2 (3) |
Активность CYP2D6, которую оценивали на основании отношения концентрации пинолина и его метаболита в моче, не зависела от активности цирроза печени и его класса по Чайлд-Пью (p>0,05).
Через 14 дней после начала лечения пропранололом СЛСКВ увеличилась у 41 (68,3%) из 60 больных, в том числе по крайней мере на 10% (в среднем на 4,8 м/с) – у 36 (60,0%) и по крайней мере на 20% (в среднем на 5,5 м/с) – у 29 (48,3%). У пациентов, ответивших на лечение, ЧСС снизилась в среднем на 11,4 в минуту (р<0,001), систолическое и диастолическое АД – на 8,05 мм рт. ст. (р=0,006) и 4,51 мм рт. ст. (р=0,037), соответственно (табл. 2).
| Показатели | Ответили на терапию (n=41) | Не ответили на терапию (n=19) | ||
|---|---|---|---|---|
| До лечения | Через 14 дней | До лечения | Через 14 дней | |
| Примечание: *p<0,05 по сравнению с исходным, **p<0,05 по сравнению с аналогичным показателем у пациентов, ответивших на терапию. САД и ДАД – систолическое и диастолическое АД | ||||
| СЛСКВ, см/с | 10,4±3,9 | 14,7±4,3* | 14,1±5,3** | 10,5±3,9** |
| ЧСС в минуту | 88,3±16,1 | 76,1±8,0* | 86,7±15,1 | 75,7±9,1 |
| САД, мм рт. ст. | 122,1±17,7 | 114,3±10,9* | 130,0±16,5 | 115,0±8,2 |
| ДАД, мм рт. ст. | 76,1±9,5 | 71,6±8,2* | 79,5±12,6 | 73,4±5,0 |
У 47 из 60 пациентов при генетическом исследовании полиморфного маркера G1846A гена CYP2D6 выявлен гомозиготный генотип G/G1846, у 13 – гетерозиготный генотип G/A1846, в то время как гомозигот A/A1846 в исследуемой выборке не наблюдалось.
| Ответили | Не ответили | Всего | χ2 | p | |
|---|---|---|---|---|---|
| Генотип | 0,006 | 0,937 | |||
| G/G1846 | 32 | 15 | 47 | ||
| G/A1846 | 9 | 4 | 13 | ||
| Пол | 0,184 | 0,668 | |||
| Мужчины | 24 | 10 | 34 | ||
| Женщины | 17 | 9 | 26 | ||
| Класс по Чайлд-Пью | 4,266 | 0,119 | |||
| A | 1 | 3 | 4 | ||
| B | 18 | 9 | 27 | ||
| C | 22 | 7 | 29 | ||
| Активность цирроза | 0,642 | 0,423 | |||
| Минимальная | 32 | 13 | 45 | ||
| Умеренная | 9 | 6 | 15 | ||
| ВРВП | 9,839 | 0,019 | |||
| Нет | 16 | 4 | 20 | ||
| 1 степень | 9 | 2 | 11 | ||
| 2 степень | 9 | 12 | 21 | ||
| 3 степень | 7 | 1 | 8 |
Результаты анализа зависимости изменения СЛСКВ от генотипа, пола пациентов, класса цирроза печени по Чайлд-Пью, активности, а также степени ВРВП приведены в табл. 3. Среди 40 пациентов с ВРВП выраженная положительная динамика наблюдалась у больных с 3 степенью ВРВП: 7 (87,5) из 8 (p<0,05). В то же время пол и другие клинические показатели не оказывали существенного влияния на гемодинамический эффект пропранолола. Изменения СЛСКВ, ЧСС, систолического и диастолического АД после лечения пропранололом не отличались у носителей гомозиготного и гетерозиготного генотипов (табл. 4).
| Генотип | Ответили/ не ответили |
СЛСКВ, см/с | ЧСС в минуту | САД, мм рт. ст. | ДАД, мм рт. ст. | ||||
|---|---|---|---|---|---|---|---|---|---|
| Исходно | 14 дней | Исходно | 14 дней | Исходно | 14 дней | Исходно | 14 дней | ||
| Примечание: *p<0,05 в сравнении с аналогичными показателем у носителей G/G1846 | |||||||||
| G/G1846 | 32/15 | 11,09±4,46 | 12,94±4,44 | 85,94±15,57 | 75,91±9,11 | 127,34±18,9 | 114,26±10,7 | 77,98±11,45 | 71,81±7,90 |
| G/A1846 | 9/4 | 13,30±5,10 | 14,90±4,93 | 94,46±14,79 | 76,23±4,69 | 114,62±9,89* | 115,38±9,46 | 74,23±5,72 | 73,46±4,74 |
С целью оценки влияния носительства полиморфного маркера G1846A гена CYP2D6 на эффективность терапии пропранололом у пациентов с циррозом печени были построены три варианта унивариативной логистической регрессионной модели. В качестве зависимой переменной выступал показатель ответа пациента на пропранолол (увеличение СЛСКВ), а в качестве независимой переменной – генотип по полиморфному маркеру CYP2D6. При использовании в качестве зависимой переменной любого увеличения СЛСКВ или увеличения этого показателя ≥10% статистически значимого влияния носительства полиморфизма гена CYP2D6 на терапевтический эффект пропранолола выявлено не было (табл. 5). В то же время при регрессионном анализе увеличения СЛСКВ ≥20% наблюдалось статистически значимое влияние носительства генотипа CYP2D6 (1846G>A) на терапевтическое действие пропранолола (p=0,049).
| Значение | Стандартная ошибка | z | p | |
|---|---|---|---|---|
| Любое увеличение СЛСКВ | ||||
| Точка пересечения прямой с осью координат (intercept) | 0,810 | 0,600 | 1,349 | 0,177 |
| CYP2D6*4 (1846G>A) | -0,053 | 0,677 | -0,078 | 0,937 |
| Увеличение СЛСКВ≥10% | ||||
| Точка пересечения прямой с осью координат (intercept) | -0,154 | 0,556 | -0,277 | 0,781 |
| CYP2D6*4 (1846G>A) | 0,722 | 0,633 | 1,139 | 0,254 |
| Увеличение СЛСКВ≥20% | ||||
| Точка пересечения прямой с осью координат (intercept) | -1,203 | 0,658 | -1,828 | 0,067 |
| CYP2D6*4 (1846G>A) | 1,417 | 0,720 | 1,966 | 0,049 |
Обсуждение
Результаты исследования продемонстировали, что в российской популяции у носителей гомозиготного генотипа CYP2D6 G/G1846 наблюдается более значимое увеличение СЛСКВ на фоне терапии пропранололом, чем у пациентов с гетерозиготным генотипом G/A1846. В ранее проведенном подобном исследовании F. Zhang и соавт. также выявили взаимосвязь между фармакокинетическими параметрами, эффективностью пропранолола и полиморфизмом гена CYP2D6. В исследовании приняли участие 30 пациентов с портальной гипертензией, которые принимали пропранолол в суточной дозе 120 мг в течение 7 дней. У всех больных измеряли градиент печеночного венозного давления до и на фоне лечения. Двадцать пациентов ответили на лечение пропранололом. В среднем градиент печеночного венозного давления снизился на 6,6±3,6 мм рт. ст. (диапазон от 3 до 19). При генотипировании по CYP2D6*4 у 20 пациентов выявили гомозиготный генотип C/C188, у 10 – гетерозиготный генотип C/T188, у 8 – гомозиготный генотип G/G4268 и у 22 – гетерозиготный генотип G/C4268. Многофакторный логистический регрессионный анализ показал, что носительство полиморфного маркера C188T гена CYP2D6 позволяло прогнозировать изменение градиента печеночного венозного давления в ответ на действие пропранолола (p= 0,033). Полученные данные свидетельствовали о том, что полиморфизм гена цитохрома CYP2D6 влияет на гемодинамический эффект пропранолола в китайской популяции. Следует отметить, что в данном исследовании был использован другой полиморфный маркер гена CYP2D6, а также инвазивный метод оценки эффективности пропранолола. Тем не менее, как и в нашем исследовании более значимая положительная гемодинамика наблюдалась у носителей гомозиготного генотипа [15].
Д.А. Сычев и соавт. изучали зависимость эффективности и безопасности терапии галоперидолом от активности CYP2D6 у больных алкоголизмом. Галоперидол – антипсихотический препарат, метаболизм которого осуществляется за счет цитохрома CYP2D6. Активность CYP2D6 оценивали по отношению концентрации эндогенного пинолина и его метаболита (6-гидрокси1,2,3,4-тетрагидро-b-карболин) в моче. Было установлено, что высокая активность CYP2D6 снижает эффективность и повышает безопасность терапии галоперидолом у больных алкоголизмом [16]. Мы анализировали зависимость активности CYP2D6 от степени тяжести цирроза печени. Активность CYP2D6 оценивалась на основании метаболизма пинолина. Достоверной зависимости активности CYP2D6 от тяжести цирроза печени выявлено не было.
В нашем исследовании пол больных, степень активности цирроза печени и его класс по Чайлд-Пью не оказывали влияния на гемодинамический эффект пропранолола. В то же время он зависел от степени ВРПВ. Самой высокой частота ответа на лечение была у пациентов с ВРВП 3 степени.
Результаты проведенного исследования позволили разработать алгоритм персонализации лечения пациентов с циррозом печени неселективными b-адреноблокаторами. Мы предлагаем подбирать дозу пропранолола в зависимости от генотипа по полиморфному маркеру G1846A гена CYP2D6 с учетом определения динамики СЛСКВ. Для этого необходимо проводить измерение этого показателя с помощью ультразвуковой допплерографии до начала лечения b-адреноблокаторами и через 14 дней на фоне терапии. Критерием положительного гемодинамического ответа на пропранолол следует считать увеличение СЛСКВ на ≥20%. Пациентам с гомозиготным генотипом G/G1846 целесообразно начинать терапию пропранололом в дозе 10 мг 3 раза в день, а
носителям гетерозиготного генотипа G/A1846 назначать дозу выше 30 мг/сут. При наличии положительного гемодинамического эффекта по изменению СЛСКВ продолжить прием пропранолола в прежней дозе, в противном случае необходимо увеличивать дозу индивидуально, учитывая показатели центральной гемодинамики (рис. 1).
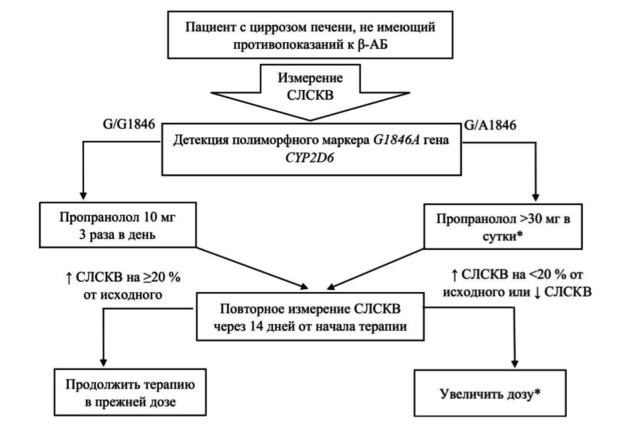
Соблюдение предложенного алгоритма персонализации лечения пациентов с циррозом печени неселективными b-адреноблокаторами может быть актуальным для профилактики развития кровотечения из ВРВП, как одного из наиболее грозных осложнений портальной гипертензии.
Используемые источники
- Andreu V, Perello A, Moitinho E, et al. Total effective vascular compliance in patients with cirrhosis. Effects of propranolol. J Hepatol 2002;36(3):356-61.
- Лапшин А.В., Павлов Ч.С. Желудочно-кишечные кровотечения у больных циррозом печени. Лечение циррозов печени: методические рекомендации (под ред. В.Т.Ивашкина). Москва, 2003, 40-8.
- Огурцов П.П., Мазурчик Н.В. Курс клинической гепатологии: Учебное пособие. Москва: РУДН, 2008, с. 178 [Ogurtsov PP, Mazurchik NV. Clinical Hepatology Course: Textbook. Moscow: RUDN, 2008, 178 (In Russ.)].
- Прибылов С.А. Коррекция дисфункции эндотелия и портальной гипертензии при циррозах печени бета-блокаторами и ингибиторами ангиотензинпревращающего фермента. Вестник новых медицинских технологий 2007;10(1):1-7 [Pribulov SA. Correction of endothelial dysfunction and portal hypertension in liver cirrhosis with beta-blockers and angiotensin-converting enzyme inhibitors. Vestnik novich medicinskich technologii 2007;10(1):1-7 (In Russ.)].
- Ющук Н.Д., Климова Е.А., Знойко О.О. и др. Протокол диагностики и лечения пациентов с вирусными гепатитами В и С. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2010;20(6):4-60 [Ushuk ND, Klimova EA, Znoiko OO et al. Protocol for the diagnosis and treatment of patients with viral hepatitis B and C. Rossiiskiy jurnal gastroenterologii, gepatologii, koloproktologii 2010;20(6):4-60. (In Russ).].
- Гарбузенко Д.В. Экспериментальные методы изучения портальной гипер-тензии. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2010;2:4-12 [ [Garbuzenko DV. Experimental methods for studying portal hypertension. Rossiiskiy jurnal gastroenterologii, gepatologii, koloproktologii 2010;2:4-12 (In Russ.)].
- D’Amico G. The role of vasoactive drugs in the treatment of oesophageal varices. Expert Opin Pharmacother 2004;2:349-60
- Turnes J, Hernandez-Guerra M, Abraldes JG, et al. Influence of beta-2 adrenergic receptor gene polymorphism on the hemodynamic response to propranolol in patients with cirrhosis. Hepatology 2006;43(1):34-41.
- Yu A, Idle JR, Herraiz T, et al. Screening for endogenous substrates reveals that CYP2D6 is a 5-methoxyindolethylamine O-demethylase. Pharmacogenetics 2003;13:307-19.
- Jiang XL, Shen HW, Yu AM. Pinoline may be used as a probe for CYP2D6 activity. Drug Metab Dispos 2009;37(3):443-6.
- Федосьина Е.А., Маевская М.В., Ивашкин В.Т. Принципы терапии портальной гипертензии у больных циррозом печени. Российский журнал гастроэнтерологии, гепатологии и колопроктологии 2012;22(5):46-55
- [Fedosiena EA, Meavskaya MV, Ivashkin VT. Principles of therapy for portal hypertension in patients with liver cirrhosis. Rossiiskiy jurnal gastroenterologii, gepatologii, koloproktologii 2012;22(5):46-55 (In Russ.)].
- EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018;69(2):406-60.
- Митьков В.В. Допплерография в диагностике заболеваний печени, желчного пузыря, поджелудочной железы и их сосудов. М.: Издательский лом Видар-М, 2000, с. 41 [Mitkov VV. Doppler ultrasonography in the diagnosis of diseases of the liver, gallbladder, pancreas and their vessels. Moscow, Izdatelskii dom Vidar-M, 2000, 41 (In Russ.)].
- Гланц С. Медико-биологическая статистика. Практика, 1999, с. 467 Zhang F, Duan X, Zhang M, et al. Influence of CYP2D6 and b2-adrenergic receptor gene polymorphisms on the hemodynamic response to propranolol in Chinese Han patients with cirrhosis. J Gastroenterol Hepatol 2016;31:829-33.
- Сычев Д.А., Застрожин М.С., Смирнов В.В. и др. Ассоциация активности изофермента CYP2D6 с профилем эффективности и безопасности галоперидола у пациентов, страдающих патологическим влечением к алкоголю. Вестник РГМУ 2015;4:36-9 [Sychev DA, Zastrozhin MS, Smirnov VV, et al. The correlation between CYP2D6 isoenzyme activity and haloperidol efficacy and safety profile in patients with alcohol addiction during the exacerbation of the addiction. Vestnik RGMU 2015;4: 36-9 (In Russ.)].
