Клинико-фармакологическое обоснование тройной терапии двумя длительно действующими бронходилататорами и ингаляционным глюкокортикостероидом у пациентов с ХОБЛ
Основой лечения хронической обструктивной болезни легких является регулярное применение длительно действующих β 2 -агонистов (ДДБА) и/или антагонистов холинергических рецепторов (ДДАХ). При неэффективности комбинированной терапии препаратами двух групп, особенно при наличии частых обострений, в том числе требующих госпитализации, эозинофилии крови и/или сопутствующей бронхиальной астмы, к лечению добавляют ингаляционный глюкокортикостероид (ИГКС). В экспериментальных исследованиях показано, что ДДБА, ДДАХ и ИГКС усиливают действие друг друга на бронхи среднего и малого диаметра, что может быть следствием более значительного повышения концентрации цАМФ – ключевого медиатора, опосредующего расслабление гладких мышц бронхов. Признаки синергизма действия ДДБА и ДДАХ были выявлены и в небольших клинических исследованиях, а в рандомизированных контролируемых исследованиях тройная комбинированная терапия двумя бронходилататорами и ИГКС по эффективности достоверно превосходила различные схемы двойной комбинированной терапии (ДДБА/ДДАХ или ИГКС/ДДБА). Приведенные данные обосновывают целесообразность тройной комбинированной терапии у пациентов с тяжелым течением ХОБЛ, характеризующимся выраженной бронхиальной обструкцией и частыми обострениями, при отсутствии ответа на лечение двумя препаратами. В настоящее время разработаны фиксированные комбинированные препараты, содержающие ИГКС/ДДБА/ ДДАХ в одном ингаляторе. Их применение позволяет сделать лечение более удобным для пациента.
Хроническая обструктивная болезнь легких (ХОБЛ) – это ведущая причина заболеваемости, нетрудоспособности и смертности в общей популяции [1]. Общее число больных с ХОБЛ в мире приближается к 400 млн, а в 2010 г. распространенность заболевания составляла 14,3% среди мужчин в возрасте старше 30 лет и 7,6% среди женщин [2]. Хронические заболевания системы дыхания, прежде всего ХОБЛ, находятся на третьем месте среди причин смертности, уступая только сердечно-сосудистым заболеваниям и злокачественным опухолям [1]. В 2015 г. от ХОБЛ умерли 3,2 млн человек (в 8 раз больше, чем от бронхиальной астмы) [3]. Следует отметить, что за последние 25 лет стандартизированные по возрасту показатели распространенности ХОБЛ и смертности от этого заболевания снизились на 14,7% и 41,9%, соответственно, однако эти позитивные сдвиги нивелируются ростом численности и постарением населения, поэтому общее число больных и смертность от ХОБЛ продолжают увеличиваться [3]. Основными факторами риска развития ХОБЛ остаются курение, в том числе пассивное, и загрязнение окружающей среды.
Основой лечения ХОБЛ является применение ингаляционных бронходилататоров – длительно действующих β2-агонистов (ДДБА) и длительно действующих антихолинергических препаратов (ДДХА), которые назначают на регулярной основе для уменьшения симптомов, увеличения толерантности к физической нагрузке и улучшения качества жизни [4]. ДДБА применяют два (формотерол, салметерол) или один (индакатерол, олодатерол, вилантерол) раз в день. ДДАХ также оказывают действие в течение около 12 ч (аклидиний) или 24 ч (гликопирроний, тиотропий, умеклидиний) [5].
В двух прямых сравнительных исследованиях тиотропий, обладающий антихолинергической активностью, превосходил ДДБА по эффективности в профилактике обострений ХОБЛ [6,7]. Соответственно, на первом этапе терапии предпочтение следует отдавать ДДАХ. Лечение стабильной ХОБЛ обычно начинают с монотерапии ДДАХ или ДДБА, хотя при наличии выраженных симптомов и повторных обострений возможна и стартовая комбинированная терапия препаратами двух групп. Альтернативой длительно действующему бронходилататору в составе комбинированной терапии может быть ингаляционный глюкокортикостероид (ИГКС; беклометазон, будесонид, флутиказон, мометазон). Следует подчеркнуть, что длительная монотерапия ИГКС пациентам с ХОБЛ не рекомендуется.
В последних рекомендациях GOLD к основным показаниям к включению противовоспалительного препарата в схему терапии отнесены следующие [4]:- госпитализации по поводу обострений ХОБЛ несмотря на адекватную терапию длительно действующим бронходилататором;
- по крайней мере два средне-тяжелых обострения ХОБЛ за предыдущий год несмотря на лечение длительно действующим бронходилататором;
- эозинофилия крови >300 в мкл;
- сопутствующая бронхиальная астма.
Лечение ИГКС возможно также при наличии одного средне-тяжелого обострения ХОБЛ за год и/или эозинофилии крови 100-300 в мкл, но нецелесообразно у пациентов с повторными пневмониями или микобактериальной инфекцией в анамнезе или количеством эозинофилов в крови <100 в мкл.
При неэффективности терапии двумя препаратами, в том числе ДДБА/ДДАХ или ДДБА/ИГКС, пациенты с ХОБЛ могут быть переведены на лечение двумя длительно действующими бронходилататорами в комбинации с ИГКС [4]. Помимо комбинированных ингаляционных препаратов, в состав которых входят ДДБА/ИГКС или ДДБА/ДДАХ, разработаны тройные комбинированные препараты, содержащие ДДБА/ ДДАХ/ИГКС, в том числе беклометазона дипропионат/формотерола фумарат/гликопиррония бромид, флутиказона фуроат/вилантерол/умеклидиний и будесонид/формотерола фумарат/гликопиррония бромид [5]. Первый представляет собой экстрамелкодисперсный аэрозоль, средний аэродинамический диаметр частиц которого составляет 1,1 мкм. Ингаляция частиц малого размера позволяет увеличить отложение лекарственного вещества в легких и уменьшить его депозицию в ротоглотке. Благодаря этому содержание ИГКС в составе комбинированного препарата уменьшено в 2,5 раза (до 100 мкг) по сравнению со стандартными дозированными аэрозольными ингаляторами.
Фармакологическое обоснование тройной комбинированной терапии
В контролируемых клинических исследованиях ус тановлено, что комбинированная терапия двумя длительно действующими бронходилататорами по эффективности достоверно превосходит монотерапию и вызывает более значительное улучшение качества жизни, увеличение толерантности к физической нагрузки, уменьшение одышки и риска обострений ХОБЛ [8]. ДДБА и ДДАХ оказывают действие на два основных механизма регуляции тонуса гладких мышц дыхательных путей, поэтому комбинированная терапия может оказывать не только аддитивное действие, но и обеспечивать синергизм эффектов двух препаратов. Активация β2-адренорецепторов приводит к стимуляции аденилатциклазы и увеличению внутриклеточного содержания циклоаденозинмонофосфата (цАМФ) – ключевого внутриклеточного медиатора, опосредующего расслабление гладких мышц бронхов. ДДАХ блокируют в основном М3-ацетилхолиновые рецепторы, экспрессирующиеся на поверхности гладкомышечных клеток дыхательных путей и блокируют их сокращение под действием ацетилхолина.
Синергизм действия различных ДДБА и ДДАХ, в том числе гликопиррония/индакатерола, аклидиния/формотерола и тиотропия/олодатерола, был продемонстрирован в исследованиях ex vivo на изолированных бронхах человека [9-11]. В одном из таких исследований как гликопирроний, так и индакатерол вызывали дозозависимое подавление бронхоконстрикции, вызванной ацетилхолином. Комбинация двух препаратов в низких концентрациях (гликопирроний: 0,4-3,4 нмоль/л, индакатерол: 0,1-40,0 нмоль/л) индуцировала более выраженное расслабление средних (+32,51± 7,86%) и мелких (+28,46±5,35%) бронхов, чем можно было ожидать при аддитивном действии двух препаратов, которое оценивали с помощью математической модели независимости Блисса (p<0,05) [9]. В других исследованиях также была выявлена достоверная разница между фактическим эффектом комбинации ДДБА и ДДАХ и рассчетным эффектом при аддитивном их действии.
Синергизм бронхорасширяющего действия ДДБА и ДДАХ был продемонстрирован и в небольших клинических исследованиях. M. Cazzola и соавт. изучали бронхорасширяющие эффекты однократного применения индакатерола 150 мкг и гликопиррония 50 мкг по отдельности и в комбинации друг с другом у 16 больных с ХОБЛ [12]. Полученные данные свидетельствовали об аддитивном действии двух препаратов в течение 180 мин после ингаляции, однако через 15 мин был выявлены признаки синергизма в виде более выраженного увеличения ОФВ1 по сравнению с ожидаемым. Сходные данные были получены теми же авторами при изучении взаимодействия аклидиния и формотерола у больных с ХОБЛ [13]. В этом исследовании динамика ОФВ1 после ингаляции двух препаратов указывала на их синергизм через 5 мин и 120-240 мин и аддитивное действие через 30-60 мин. Синергизм, вероятно, свойственен всем ДДБА и ДДАХ и не является специфичным для какойто определенной комбинации препаратов двух групп [14].
Приведенные данные следует интерпретировать осторожно, так как результаты экспериментальных исследований не всегда позволяют предсказать действие лекарственных средств у человека, в то время как в указанных выше клинических исследованиях изучались эффекты однократной ингаляции длительно действующих бронходилататоров, а не длительного регулярного их применения. В недавно проведенном исследовании, опубликованном в виде тезисов, было показано, что различные комбинации ДДБА и ДДАХ уменьшали индекс одышки по сравнению с монотерапией. При применении всех комбинаций двух длительно действующих бронходилататоров был выявлен синергизм, хотя степень его была небольшой и существенно не отличалась при назначении различных схем терапии (в среднем +4,6% по сравнению с расчетным аддитивным эффектом; p<0,05) [15]. По мнению авторов, это могло свидетельствовать о том, что дозы отдельных компонентов фиксированных комбинированных препаратов могут превышать оптимальные значения.
Молекулярные механизмы взаимодействия ДДБА и ДДАХ сложные и недостаточно изучены [14]. Экс периментальные данные свидетельствуют о том, что ключевое значение имеет повышение концентрации цАМФ, участвующего в расслаблении бронхов. В опытах на изолированных бронхах человека ДДБА (индакатерол) вызывал увеличение концентрации цАМФ примерно в 3 раза, в то время как ДДАХ (гликопирроний) не оказывал влияния на содержание этого медиатора [9]. В то же время применение комбинации двух препаратов привело к увеличению концентрации цАМФ примерно в 7 раз. Агонисты β2-адренорецепторов вызывает активацию кальций-зависимых калиевых каналов (KСa++), что приводит к гиперполяризации клеточной мембраны и расслаблению гладких мышц бронхов. В экспериментах показано, что не только цАМФ может влиять на активность КCa++ каналов, но и сами они модулируют увеличение концентрации цАМФ при одновременной активации β2-адренорецепторов и ингибировании мускариновых рецепторов [9]. Бета2-ад ренорецепторы и мускариновые рецепторы экспрессируются не только в гладкомышечных клетках, но и в эпителии бронхов [16]. В исследовании ex vivo ДДБА и ДДАХ в низких концентрациях не оказывали существенного влияния на содержание цАМФ в эпителиальных клетках бронхов, в то время как их комбинация вызывала увеличение концентрации этого медиатора [9]. Эти данные свидетельствуют о том, что взаимодействие ДДБА и ДДАХ на уровне эпителия бронхов может вносить вклад в синергизм эффектов препаратов двух групп. Следует отметить, что ацетилхолин, выделяющийся эпителиальными клетками бронхов, играет важную роль в регуляции тонуса терминальных бронхиол в отличие от бронхов среднего диаметра, тонус которых регулируется в основном волокнами парасимпатической нервной системы.
ИГКС обладают противовоспалительной активностью, но сами по себе не оказывают расширяющее действие на бронхи. Тем не менее, в ряде экспериментальных исследований ИГКС усиливали бронхорасширяющий эффект как ДДБА, так и ДДАХ. В этих исследованиях изучали ex vivo бронходилатирующее действие комбинаций беклометазона дипропионата/ формотерола и беклометазона дипропионата/гликопиррония [17,18]. Полагают, что глюкокортикостероиды увеличивают экспрессию β2-адренорецепторов, в частности путем восстановления сцепления G-белка с рецепторами и подавления их десенситизации [19]. В исследованиях in vitro глюкокортикостероиды препятствовали снижению количества и функции β2-адренорецепторов в гладких мышцах бронхов при длительной их инкубации с β2-агонистами [20]. Кроме того, глюкокортикостероиды увеличивали синтез β2-адренорецепторов в клетках легких, нейтрофилах и лимфоцитах [21]. В свою очередь, ДДБА могут оказывать действие на ядерную локализацию глюкокортикостероидных рецепторов и усиливать действие ИГКС [19].
Недавно было опубликовано интересное исследование, целью которого было изучение ex vivo возможного синергизма действия беклометазона дипропионата, формотерола фумарата и гликопиррония бромида, которые входят в состав экстрамелкодисперсного комбинированного препарата, предназначенного для лечения ХОБЛ и бронхиальной астмы [22]. Авторы использовали бронхи человека, которые выделяли из образцов ткани легкого, полученной во время лобэктомии по поводу рака у больных с ХОБЛ. Контролем служили бронхи, взятые у больных, которые не страдали ХОБЛ. Ткань бронхов инкубировали с беклометазоном, а затем обрабатывали формотеролом и гликопирронием по отдельности или в комбинации друг с другом. Соотношение концентраций трех лекарственных средств составляло 100:6:12,5 и соответствовало таковому в составе комбинированного препарата. Определяли влияние трех лекарственных средств на бронхоконстрикцию, вызванную карбахолом (в процентах от максимального расслабления бронхов, индуцированного папаверином и атропином). Взаимодействие трех препаратов оценивали с помощью математических моделей и рассчитывали индекс, отражающий синергизм (<1), аддитивное действие (1) или антагонизм (>1) лекарственных средств [23]. Значение этого индекса позволяет также количественно оценить степень возможного синергизма действия лекарственных веществ: небольшой (+) – 0,85-0,90, умеренный (++) – 0,700,85, средний (+++) – 0,30–0,70, выраженный (+++) – 0,10–0,30, резко выраженный (+++++) – <0,10.
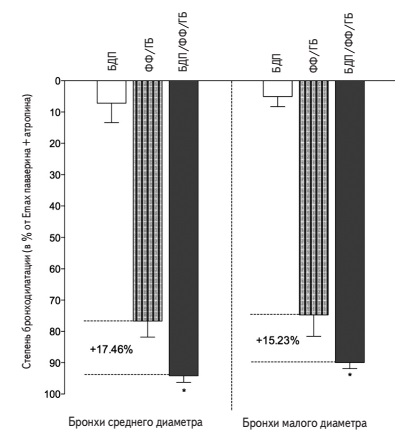
Как формотерол, так и гликопирроний оказывали выраженное расширяющее действие на бронхи, выделенные у пациентов с ХОБЛ, в то время как беклометазона дипропионат практически не обладал такой активностью. При этом бронхорасширяющее действие комбинации беклометазона/формотерола/гликопиррония значительно превосходило расчетный аддитивный эффект трех препаратов. Наиболее выраженный синергизм на уровне бронхов среднего диаметра был достигнут при применении комбинации трех препаратов в концентрациях 1,0/0,06/0,125 нг/мл (+51,6% по сравнению с аддитивным действием), а на уровне бронхов малого диаметра – в концентрациях 3,0/0,18/0,375 нг/мл (+28,9%) (рис. 1). Степень синергизма на уровне бронхов среднего диаметра была очень высокой при всех концентрациях трех препаратов, в то время как на уровне бронхов малого калибра она увеличивалась от средней до очень высокой по мере роста концентраций изученных лекарственных средств. В целом общая концентрация трех препаратов, необходимая для субмаксимального расширения бронхов среднего и малого диаметра, была очень низкой. Хотя беклометазона дипропионат сам по себе не вызывал существенного расширения бронхов, его включение в состав комбинации приводило к значительному усилению бронхорасширяющего эффекта примерно на 15% (рис. 2). В дополнительном эксперименте блокада внутриклеточных глюкокортикостероидных рецепторов путем инкубации бронхов с RU486 нивелировала синергизм действия трех препаратов. При этом достигнутый бронхорасширяющий эффект не отличался от расчетного аддитивного действия формотерола/гликопиррония.
В целом результаты этого исследования показали, что комбинация беклометазона дипропионата/формотерола фумарата/гликопиррония бромида (100:6:12,5) обладает синергизмом расширяющего действия на бронхи как среднего, так и малого диаметра. В бронхах малого диаметра синергизм трех препаратов достигал максимума при более высоких концентрациях лекарственных средств. Приведенные данные указывают на важность увеличения доставки ингаляционных препаратов в терминальные бронхиолы (диаметром менее 2 мм), дисфункция которых ассоциируется с тяжестью течения ХОБЛ [24]. Обструкция бронхов малого диаметра не определяется с помощью стандартной спирометрии. При этом она тесно коррелирует с более быстрым снижением ОФВ1 у пациентов с ХОБЛ [25]. Кроме того, дисфункция бронхов малого диаметра предшествует развитию эмфиземы, поэтому восстановление проходимости терминальных бронхиол потенциально может препятствовать прогрессированию эмфиземы легких [26].
Одним из основных факторов, определяющих распределение ингаляционного препарата в легких, является размер частиц дисперсии лекарственного вещества [27]. Мелкие частицы (средний аэродинамический диаметр менее 2 мкм) лучше проникают в периферические отделы легких и в меньшей степени откладываются в ротоглотке [28], что позволяет уменьшить риск локальных побочных эффектов и системного всасывания. O. Usmani и соавт. сравнивали отложение ИГКС, ДДБА и ДДАХ в легких при применении двух комбинированных ингаляционных препаратов – экстрамелкодисперсного аэрозоля беклометазона дипропионата/ формотерола фумарата/гликопиррония бромида в виде дозированного ингалятора и неэкстрамелкодисперсного флутиказона фуроата/вилантерола/умеклидиния в виде ингалятора сухого порошка [29]. Для анализа распределения лекарственных веществ использовали функциональную визуализацию дыхательных путей (Functional respiratory imaging) – новый метод исследования на основе компьютерной томографии высокого разрешения и 3D-моделирования [30]. При применении экстрамелкодисперсного препарата отложение всех трех компонентов, особенно ИГКС, в периферических отделах легких достоверно превышало таковое при использовании препарата сравнения (рис. 3). Увеличение поступления ингаляционных лекарственных средств в бронхи малого диаметра может способствовать повышению эффективности лечения у пациентов с ХОБЛ, однако для подтверждения преимуществ экстрамелкодисперсного комбинированного препарата перед другими комбинированными ингаляционными препаратами необходимы прямые сравнительные клинические исследования.
Клинические исследования тройной комбинированной терапии у пациентов с ХОБЛ
При переходе на тройную комбинированную терапию пациенты вынуждены пользоваться по крайней мере двумя ингаляторами – ИГКС/ДДБА + ДДАХ или ДДБА/ДДАХ + ИГКС. Чтобы сделать лечение более удобным, разработаны ингаляторы, в состав которого входят все три препарата. Их эффективность и безопасность изучались в рандомизированных контролируемых исследованиях, целью которых было подтвердить преимущество фиксированных тройных комбинаций перед комбинированной терапией двумя препаратами (ДДБА/ДДАХ или ИГКС/ДДБА) и по крайней мере сопоставимую эффективность с тремя препаратами в виде отдельных ингаляторов (табл. 1).
| Авторы | Название исследования |
n | Тройной комбинированный препарат | Препараты сравнения | Длит., нед |
|---|---|---|---|---|---|
| Примечание: *Исследование ETHOS не вошло в мета-анализ, **будесонид изучали в двух дозах 160 и 320 мкг | |||||
| Singh et al [31] | TRILOGY | 1368 | Беклометазон/формотерол/ гликопирроний |
Беклометазон/формотерол | 52 |
| Lipson et al [35] | FULFIL | 1810 | Флутиказон/умеклидиний/вилантерол | Будесонид/формотерол | 24 |
| Vestbo et al [36] | TRINITY | 2691 | Беклометазон/формотерол/гликопирроний | Беклометазон/формотерол + тиотропиум или тиотропиум | 52 |
| Papi et al [32] | TRIBUTE | 1532 | Беклометазон/формотерол/гликопирроний | Индакатерол/гликопирроний | 52 |
| Lipson et al [33] | IMPACT | 10355 | Флутиказон/умеклидиний/вилантерол | Флутиказон/вилантерол или умеклидиний/вилантерол | 52 |
| Bremner et al [37] | NCT02729051 | 1055 | Флутиказон/умеклидиний/вилантерол | Флутиказон/вилантерол + умеклидиний | 24 |
| Ferguson et al [38] | KRONOS | 3047 | Будесонид/формотерол/гликопирроний | Гликопирроний/формотерол или будесонид/формотерол | 24 |
| Rabe et al [39] | ETHOS* | 8509 | Будесонид**/формотерол/гликопирроний | Гликопирроний/формотерол или будесонид/формотерол | 52 |
В одном из первых таких исследований (TRILOGY) были сопоставлены эффективность и безопасность фиксированных комбинаций ИГКС/ДДБА/ДДАХ и ИГКС/ДДБА у 1368 пациентов с тяжелой ХОБЛ, которую не удавалось контролировать бронходилататорами ± ИГКС [31]. Пациенты двух групп в течение 52 недель получали комбинацию беклометазона дипропионата/ формотерола фумарата/гликопиррония бромида или комбинацию беклометазона дипропионата/формотерола фумарата. Через 26 недель тройная терапия по сравнению с применением двух препаратов привела к значительному увеличению ОФВ1 до ингаляции (p<0,001) и через 2 ч после ингаляции (p<0,001). Достигнутое преимущество сохранялось через 52 недели. Выраженность одышки уменьшилась в обеих группах в сопоставимой степени, однако через 26 недель вероятность ответа на лечение была выше при проведении тройной комбинированной терапии (отношение шансов 1,28, р=0,027). У больных, получавших фиксированную комбинацию трех препаратов, было также отмечено достоверное снижение частоты средне-тяжелых и тяжелых обострений ХОБЛ на 23% (р=0,005) и увеличение времени до первого обострения (р=0,020). Эффективность тройной комбинированной терапии в профилактике обострений ХОБЛ была выше всего у пациентов, перенесших по крайней мере два обострения ХОБЛ в течение предыдущего года.
В другом рандомизированном исследовании TRI BUTE были сопоставлены эффективность и безопасность терапии фиксированными комбинациями ИГКС/ ДДБА/ДДАХ и двумя длительно действующими бронходилататорами у 1532 пациентов с ХОБЛ тяжелого или очень тяжелого течения, перенесших по крайней мере одно средне-тяжелое или тяжелое обострение в течение предыдущего года несмотря на ингаляционную терапию [32]. Пациенты двух групп получали терапию беклометазона дипропионатом/формотерола фуроатом/гликопиррония бромидом или индакатеролом/гликопиррония бромидом. В целом риск развития обострения ХОБЛ при тройной комбинированной терапии снизился на 15% (p=0,043) по сравнению с таковым при лечении ДДБА/ДДАХ. Риск средне-тяжелых и тяжелых обострений снизился на 13% и 21%, соответственно, хотя разница между группами не достигла статистической значимости. Более выраженное снижение частоты обострений (на 25%) наблюдалось у пациентов с преобладающим хроническим бронхитом, а также у пациентов с числом эозинофилов в крови ≥2% (на 19%). В обеих группах было отмечено снижение ОФВ1, хотя негативная динамика этого показателя была менее выраженной на фоне тройной комбинированная терапии терапии. Последняя привела также к достоверному улучшению среднего индекса качества жизни (SGRQ) при всех визитах.
Сходные результаты были получены в рандомизированное клиническом исследовании IMPACT, в котором у 10355 больных с ХОБЛ сравнивали эффективность и безопасность фиксированных комбинаций трех (ИГКС/ДДБА/ДДАХ) и двух (ИГКС/ДДБА и ДДБА/ДДАХ) препаратов [33]. Пациенты основной группы получали флутиказона фуроат/умеклидиний/вилантерол, а больные двух групп сравнения – флутиказона фуроат/вилантерол или умеклидиний/вилантерол. Частота средне-тяжелых и тяжелых обострений ХОБЛ при тройной комбинированной терапии снизилась на 15% и 25% по сравнению с таковой при лечении ИГКС/ДДБА и ДДБА/ДДАХ, соответственно (р<0,001 в обоих случаях). Ежегодная частота тяжелых обострений, потребовавших госпитализации, в основной группе снизилась на 34% по сравнению с таковой при применении ДДБА/ДДАХ (р<0,001). Кроме того, тройная комбинированная терапия оказывала более выраженное благоприятное влияние на функцию легких (ОФВ1) и качество жизни, но ассоциировалась с увеличением риска развития пневмонии по сравнению с терапией ДДБА/ДДАХ.

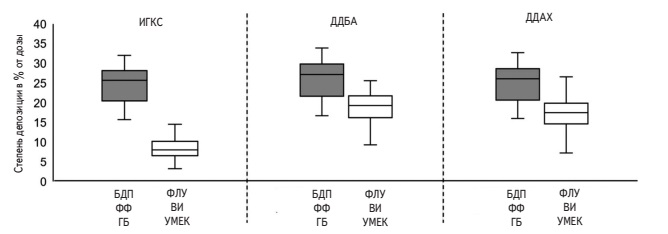
C-C. Lai и соавт. провели мета-анализ 7 рандомизированных контролируемых исследований, в которых изучались эффективность и безопасность фиксированных комбинаций ИГКС/ДДБА/ДДАХ у больных ХОБЛ (рис. 4) [34]. В трех исследованиях применяли экстрамелкодисперсную комбинацию беклометазона дипропионата/формотерола фумарата/гликопиррония бромида, в трех – комбинацию флутиказона фуроата/умеклидиния/ вилантерола, в одном – будесонида/формотерола фумарата/гликопиррония бромида. В пяти исследованиях пациенты групп сравнения получали терапию двумя препаратами (ИГКС/ДДБА или ДДБА/ДДАХ), в двух – тремя препаратами в виде двух ингаляторов (ИГКС/ДДБА + ДДАХ). Тройная комбинированная терапия привела к достоверному снижению риска развития обострений ХОБЛ на 31% по сравнению с терапией ДДБА/ДДАХ (отношение рисков 0,69; 95% доверительный интервал 0,55-0,87) и на 19% по сравнению с терапией ИГКС/ДДБА (0,81; 0,73-0,89). При тройной комбинированной терапии было отмечено также значительное снижение риска госпитализаций по поводу ХОБЛ на 32% и 13%, соответственно, по сравнению с группами сравнения. В то же время частота обострений ХОБЛ, в том числе потребовавших госпитализации, существенно не отличалась у больных, получавших два бронходилататора и ИГКС с помощью одного ингалятора или отдельных ингаляторов. Тройная комбинированная терапия привела также к более выраженному улучшению функции легких и индекса качества жизни по сравнению с терапией ИГКС/ДДБА или ДДБА/ДДАХ. Риск развития пневмонии при тройной комбинированной терапии был выше, чем при лечении ДДБА/ДДАХ (отношение рисков 1,38, 95% доверительный интервал 1,14-1,67), но сопоставимым с таковым при лечении ИГКС/ДДБА или тремя препаратами по отдельности. Общая смертность достоверно не отличалась между группами сравнения.
Следует отметить, что в двух крупных рандомизированных исследованиях IMPACT и ETHOS (последнее было опубликовано недавно и не вошло в описанный выше мета-анализ) было выявлено снижение смертности на фоне тройной комбинированной терапии ИГКС/ДДБА/ДДАХ по сравнению с терапией двумя длительно действующими бронходилататорами [39,40]. В исследовании IMPACT (n=10355) риск смерти при лечении флутиказона фуроатом/умеклидинием/вилантеролом снизился на 28% по сравнению с таковым при лечении умеклидинием/вилантеролом [40], в то время как в исследовании ETHOS (n=8509) снижение риска смерти при лечении будесонидом (в более высокой дозе)/гликопиррония бромидом/формотерола фумаратом составило 46% по сравнению с таковым при применении гликопиррония бромида/формотерола фумарата [39]. При этом в обоих исследованиях не было выявлено достоверных различий смертности между группами больных, получавших ИГКС в комбинации с двумя или одним длительно действующим бронходилататором.
Заключение
Результаты экспериментальных исследований ex vivo продемонстрировали синергизм действия ДДБА, ДДАХ и ИГКС на бронхи среднего и малого диаметра. Хотя ИГКС не обладают существенной бронхорасширяющей активностью, тем не менее, их включение в состав комбинации приводило к усилению эффекта двух бронходилататоров, что может быть связано с увеличением экспрессии β2-адренорецепторов. Результаты рандомизированных клинических исследований и их мета-анализа показали, что у больных с тяжелым течением ХОБЛ с выраженной бронхообструкцией и частыми обострениями терапия двумя длительно действующими бронходилататорами и ИГКС в виде фиксированной комбинации вызывает достоверное снижение риска развития обострений ХОБЛ и улучшение функции легких и качества жизни по сравнению с терапией ИГКС/ДДБА или ДДБА/ДДАХ и по эффективности не отличается от терапии тремя препаратами в виде отдельных ингаляторов. В двух рандомизированных контролируемых исследованиях тройная комбинированная терапия сопровождалась снижением смертности больных с ХОБЛ по сравнению с терапией ДДБА/ ДДАХ.
Используемые источники
- GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Respir Med 2020;8(6):585-96.
- Adeloye D, Chua S, Lee C, et al. Global and regional estimates of COPD prevalence: Systematic review and meta-analysis. J Global Health 2015;5(2):020415.
- GBD 2015 Chronic Respiratory Disease Collaborators. Global, regional, and national deaths, prevalence, disability-adjusted life years, and years lived with disability for chronic obstructive pulmonary disease and asthma, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet Respir Med 2017;5(9):691-706.
- Global Strategy for Diagnosis, Management and Prevention of COPD. 2021 Report. www.goldcopd.org.
- Авдеев С.Н., Трушенко Н.В. Тройная терапия в лечении хронической обструктивной болезни легких. Пульмонология 2019;29(2):199-206 [Avdeev SN, Trushenko NV. Triple therapy in chronic obstructive pulmonary disease. Pulmonlogiya 2019;29(2):199-206 (In Russ.)].
- Vogelmeier C, Hederer B, Glaab T, et al. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med 2011;364(12):1093-103.
- Decramer ML, Chapman KR, Dahl R, et al. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Мed 2013;1(7):524-33.
- Calzetta L, Rogliani P, Matera MG, Cazzola M: A systematic review with metaanalysis of dual bronchodilation with LAMA/LABA for the treatment of stable COPD. Chest 2016;149:1181-96.
- Cazzola M, Calzetta L, Puxeddu E, et al. Pharmacological characterisation of the interaction between glycopyrronium bromide and indacaterol fumarate in human isolated bronchi, small airways and bronchial epithelial cells. Respir Res 2016;17:70.
- Cazzola M, Calzetta L, Page CP, et al. Pharmacological characterization of the interaction between aclidinium bromide and formoterol fumarate on human isolated bronchi. Eur J Pharmacol 2014;745:135-43.
- Calzetta L, Rogliani P, Facciolo F, et al. Interaction between tiotropium bromide and olodaterol in human bronchial smooth muscle. Am J Respir Crit Care Med 2017;195:A6274.
- Cazzola M, Calzetta L, Segreti A, et al. Translational study searching for synergy between glycopyrronium and indacaterol. COPD 2015;12(2):175-81.
- Cazzola M, Calzetta L, Ora J, et al. Searching for the synergistic effect between aclidinium and formoterol: From bench to bedside. Respir Med 2015;109(10):1305-11.
- Calzetta L, Matera MG, Cazzola M. Pharmacological mechanisms leading to synergy in fixed-dose dual bronchodilator therapy. Curr Opin Pharmacol 2018, 40:95–103
- Rogliani P, Calzetta L, Ora J, et al. Clinical synergism of LABA/LAMA combinations in COPD patients. Eur Respir J 2017;50:PA1814.
- Barnes PJ. Distribution of receptor targets in the lung. Proc Am Thorac Soc 2004;1(4):345–51.
- Calzetta L, Matera MG, Facciolo F, et al. Beclomethasone dipropionate and formoterol fumarate synergistically interact in hyperresponsive medium bronchi and small airways. Respir Res 2018;19(1):65.
- Cazzola M, Calzetta L, Rogliani P, et al. Interaction between corticosteroids and muscarinic antagonists in human airways. Pulm Pharmacol Ther 2016;36:1–9.
- Adcock IM, Maneechotesuwan K, Usmani O. Molecular interactions between glucocorticoids and long-acting beta2-agonists. J Allergy Clin Immunol 2002;110(6 Suppl):S261-8.].
- Hauck RW, Harth M, Schulz C, et al. Effects of beta 2-agonistand dexamethasone-treatment on relaxation and regulation of beta-adrenoceptors in human bronchi and lung tissue. Br J Pharmacol 1997;121:1523-30.
- Davies AO, Lefkowitz RJ. Regulation of β-adrenergic receptors by steroid hormones. Ann Rev Physiol 1984;46:119-30.
- Rogliani P, Matera MG, Facciolo F, et al. Beclomethasone dipropionate, formoterol fumarate and glycopyrronium bromide: Synergy of triple combination therapy on human airway smooth muscle ex vivo. Br J Pharmacol 2020;177: 1150–63.
- Chou TC. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacol Rev 2006;58(3):621–81.
- Timmins SC, Diba C, Farrow CE, et al. The relationship between airflow obstruction, emphysema extent, and small airways function in COPD. Chest 2012;142(2):312–9.
- Bhatt SP, Soler X, Wang X, et al. Association between functional small airway disease and FEV1 decline in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2016;194(2):178–84.
- Higham A, Quinn AM, Cançado JED, Singh D. The pathology of small airways disease in COPD: historical aspects and future directions. Respir Res 2019;20(1):49.
- Lipworth B, Manoharan A, Anderson W. Unlocking the quiet zone: the small airway asthma phenotype. Lancet Respir Med. 2014;2(6):497–506.
- Lavorini F, Pedersen S, Usmani OS. Aerosol Drug Management Improvement Team (ADMIT). Dilemmas, confusion, and misconceptions related to small airways directed therapy. Chest 2017;151(6):1345–55.
- Usmani OS, Scichilone N, Mignot B, et al. Airway deposition of extrafine inhaled triple therapy in patients with COPD: A model approach based on functional respiratory imaging computer simulations. Int J COPD 2020;15:2433-40.
- De Backer JW, Vos WG, Vinchurkar SC, et al. Validation of computational fluid dynamics in CT-based airway models with SPECT/CT. Radiology 2010;257(3):854–62.
- Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet 2016;388:963–73.
- Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet 2018;391: 1076–84.
- Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med 2018;378:1671–80.
- Lai С-С, Chen C-H, Lin C, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Intern J COPD 2019;14:1539–48.
- Lipson DA, Barnacle H, Birk R, et al. FULFIL trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2017;196:438–46.
- Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet 2017;389:1919–29.
- Bremner PR, Birk R, Brealey N, et al. Single-inhaler fluticasone furoate/umeclidinium/vilanterol versus fluticasone furoate/vilanterol plus umeclidinium using two inhalers for chronic obstructive pulmonary disease: a randomized non-inferority study. Respir Res 2018;19:19.
- Ferguson GT, Rabe KF, Martinez FJ, et al. Triple therapy with budesonide/glycopyrrolate/formoterol fumarate with co-suspension delivery technology versus dual therapies in chronic obstructive pulmonary disease (KRONOS): a doubleblind, parallel-group, multicentre, phase 3 randomised controlled trial. Lancet Respir Med 2018;6:747–58.
- Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med 2020;383(1):3548.
- Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2020;201(12):1508-16.
