Эффективность и безопасность тофацитиниба у пациентов с COVID-19: многоцентровое нерандомизированное контролируемое исследование
Изучить эффективность и безопасность тофацитиниба у госпитализированных пациентов с COVID-19 ассоциированной пневмонией.
В многоцентровое нерандомизированное контролируемое исследование включали пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся снижением сатурации крови кислородом в покое (SpO 2 ), повышенным уровнем С-реактивного белка (≥50 мг/л) и/или персистирующей лихорадкой. Пациентам основной группы назначали тофацитиниб в дополнение к стандартной терапии, в то время как больные контрольной группы получали только стандартную терапию. Суммарную частоту перевода на инвазивную вентиляцию легких (ИВЛ) и смерти во время госпитализации (первичная конечная точка) анализировали отдельно в двух когортах пациентов, выделенных в зависимости от исходной SpO 2 (≤93% и >93%). Отношения рисков (ОР) и доверительные интервалы (95% ДИ) рассчитывали с использованием регрессии Кокса и поправкой на взвешенный propensity matching score.
В исследование были включены 384 пациента с COVID-19 (212 мужчин, медиана возраста 60 лет); 131 из них получали тофацитиниб, 253 – только стандартную терапию. Среди больных со сниженной SpO 2 частота комбинированной первичной конечной точки в группе тофацитиниба и контрольной группе составила 12,5% (9/72) и 14,1% (26/185), соответственно (ОР 0,92, 95% ДИ 0,33-2,56), а среди больных с нормальной SpO 2 – 1,7% (1/59) и 4,4% (3/68), соответственно (ОР 0,83, 95% ДИ 0,07-9,44).
Присоединение тофацитиниба к стандартной терапии у пациентов с COVID-19 как со сниженной, так и нормальной SpO 2 не привело к достоверному снижению риска перевода на ИВЛ или смерти, хотя отмечена тенденция к улучшению прогноза при назначении ингибитора янус-киназ, особенно у больных со сниженной SpO 2 , получавших глюкокортикостероиды.-
Патогенез тяжелого течения COVID-19 предполагает развитие чрезмерного воспалительного ответа, вызванного SARS-CoV-2 и характеризующегося значительным повышением содержания различных цитокинов и воспалительных биомаркеров, в частности С-реактивного белка (СРБ). Эти изменения сходны с “цитокиновым штормом", который наблюдается при синдроме активации макрофагов или после CAR-T-клеточной терапии [1,2]. Факторы риска тяжелого течения COVID-19 включают в себя пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет и коронарную болезнь сердца [3,4]. Эф фективные противовирусные препараты, которые могли бы предотвратить развитие избыточного иммунного ответа при COVID-19, по прежнему отсутствуют. В открытом рандомизированном клиническом исследовании у 168 пациентов с COVID-19 легкого или средне-тяжелого течения применение фавипиравира привело к более быстрому улучшению состояния пациентов по сравнению со стандартной терапией (умифеновир + интраназальный интерферон a2b или гидроксихлорохин), хотя медиана времени до элиминации вируса достоверно не отличалась между группами, а эффективность препарата в профилактике неблагоприятных исходов COVID-19 остается недоказанной [5].
На практике для лечения COVID-19 средней тяжести и тяжелого течения широко применяют глюкокортикостероиды и различные антицитокиновые препараты (в частности, ингибиторы интерлейкина-6), которые изучались в многочисленных наблюдательных и ран домизированных клинических исследованиях [6]. В исследовании RECOVERY применение глюкокортикостероида дексаметазона, обладающего широким спектром противовоспалительной активности, привело к снижению 28-дневной летальности у госпитализированных пациентов с COVID-19, нуждавшихся в респираторной поддержке, причем наиболее выраженный эффект был достигнут у больных, находившихся на ИВЛ [7]. Благоприятное влияние тоцилизумаба на летальность больных с COVID-19 было показано в многочисленных сериях наблюдений и нерандомизированных клинических исследованиях [8], но не подтверждено в нескольких рандомизированных клинических исследованиях [9,10]. В ретроспективном когортном исследовании у 328 пациентов с тяжелой COVID-19 пневмонией, госпитализированных в российские отделения реанимации и интенсивной терапии (ОРИТ), как более раннее, так и позднее введение тоцилизумаба, т.е. до или после интубации, не сопровождалось снижением летальности от всех причин [11]. В то же время в крупном рандомизированном исследовании RECOVERY у неинтубированных больных с гипоксией и признаками системного воспаления введение тоцилизумаба в дополнение к стандартной терапии привело к достоверному снижению риска перевода на ИВЛ или смерти на 16% (p<0,0001) [12].
Янус-киназы (JAK) – это цитоплазматические тирозинкиназы (JAK1, JAK2, JAK3 и тирозинкиназа 2 – TYK2), которые являются компонентом внутриклеточной системы JAK/STAT, опосредующей эффекты различных цитокинов, в том числе интерлейкина-6, а также факторов роста гемопоэза и некоторых гормонов. Янус-киназы при взаимодействии цитокинов с рецепторами I и II типов фосфорилируют белки STAT (signal transducer and activator of transcription), которые индуцируют транскрипцию генов, опосредующих действие цитокинов. Ингибиторы янус-киназ, в том числе тофацитиниб, барицитиниб и упадацитиниб, применяют для лечения ревматоидного артрита и некоторых других заболеваний, в том числе псориатического артрита,язвенного колита и анкилозирующего спондилита [13]. Ингибирование янус-киназ было предложено в качестве возможного подхода к лечению тяжелого COVID-19 [14]. Кроме того, барицитиниб, ингибирующий JAK 1/2, может обладать прямой противовирусной активностью, связанной с нарушением проникновения SARS-CoV-2 внутрь клеток [15]. В двойном слепом рандомизированном плацебо-контролируемом исследовании ACTT-2 комбинация барицитиниба и ремдесивира вызывала более быстрое улучшение состояния госпитализированных пациентов с COVID-19 по сравнению с монотерапией ремдесивиром [16]. Анализ выживаемости также свидетельствовал в пользу большей эффективности комбинированной терапии, в частности у пациентов, получавших высокопоточную оксигенотерапию или неинвазивную вентиляцию легких. Риск смерти или перевода на ИВЛ в основной группе снизился на 31% по сравнению с контролем, хотя разница между группами не достигла статистической значимости.
Тофацитиниб – это пероральный неселективный ингибитор JAK-киназ, который в России одобрен для лечения ревматоидного артрита, псориатического артрита и язвенного колита. На сайте ClinicalTrials.gov зарегистрированы несколько исследований тофацитиниба у пациентов с COVID-19, однако их результаты не опубликованы. Целью нерандомизированного контролируемого исследования TOFA-COV-2 была оценка эффективности тофацитиниба в профилактике перевода на ИВЛ и смерти у госпитализированных пациентов со среднетяжелым течением COVID-19.
Материал и методы
Дизайн исследования. Многоцентровое нерандомизированное контролируемое исследование TOFA-COV-2 проводилось в трех клиниках Сеченовского университета, перепрофилированных в инфекционные госпитали. В исследование включали взрослых (≥18 лет) пациентов со среднетяжелым течением COVID-19, госпитализированных в университетские клиники с 17 апреля по 1 августа 2020 г. Диагноз COVID-19 был подтвержден при помощи полимеразной цепной реакции (ПЦР) и/или компьютерной томографии (КТ) органов грудной клетки. У пациентов с сомнительным или отрицательным результатом ПЦР назофарингеального мазка наличие пневмонии, вызванной вирусом SARS-CoV-2, устанавливали при наличии симптомов острой респираторной инфекции, типичных КТ-признаков (4 или 5 по шкале CO-RADS) и исключении других явных причин заболевания [17]. Объем поражения легочной паренхимы (0-24%, 25-49%, 50-74%, ≥75%) оценивали в пяти областях в соответствии с анатомическим строением легких: левая верхняя доля, левая нижняя доля, правая верхняя доля, правая средняя доля и правая нижняя доля.
Исследование было одобрено Этическим комитетом Сеченовского университета. Все пациенты подписали добровольное информированное согласие на использование экспериментальной терапии в соответствии с Временными методическими рекомендациями Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Протокол исследования зарегистрирован на сайте clinicaltrials.gov (NCT04750317).
Критерии отбора. Критериями включения в исследование были наличие КТ-признаков двустороннего поражения легких ≥25% в сочетании со снижением SpO2 ≤93%, повышением уровня СРБ ≥50 мг/л и/или стойкой лихорадкой (≥38,0°С) в течение 2 и более дней на фоне приема нестероидных противовоспалительных препаратов или парацетамола. Критериями исключения служили другие инфекционные заболевания, потребность в ИВЛ, расчетная скорость клубочковой фильтрации (рСКФ) по формуле CKD-EPI ≤30 мл/мин/1,73м2, повышение активности АЛТ и/или АСТ более чем 3 раза по сравнению с верхней гра ницей нормы, длительная предшествовавшая терапия глюкокортикостероидами или иммуносупрессивными препаратами, введение ингибиторов интерлейкина-6 и/или терапия глюкокортикостероидами в высоких дозах (≥250 мг в пересчете на эквивалентную внутривенную дозу преднизолона) в связи с COVID-19. Контрольная группа была сформирована случайным образом из той же выборки пациентов с использованием вышеуказанных критериев.
Медикаментозная терапия. Тофацитиниб применяли в течение 5 дней в дозе 10 мг два раза в сутки в первый день, а затем по 5 мг два раза в сутки. У пациентов с рСКФ <60 мл/мин/1,73м2 дозу снижали до 5 мг один раз в сутки. Доза препарата и длительность терапии были выбраны на основе доз, рекомендуемых для лечения ревматоидного артрита. Мы предполагали, что большая интенсивность иммуносупрессии, в частности прием тофацитиниба в более высокой дозе и в течение более продолжительного времени, не является необходимой и может быть опасной у пациентов с активной вирусной инфекцией. Кроме того, у госпитализированных пациентов с COVID-19 возможно увеличение риска развития некоторых побочных эффектов тофацитиниба, таких как вторичные инфекции, вызванные бактериальными или вирусными агентами, лимфопения и венозные тромбоэмболические осложнения [18].
Все пациенты во время госпитализации получали стандартную терапию в соответствии с Временными методическими рекомендациями Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Необходимое лечение определялось лечащим врачом и могло включать в себя введение увлажненного кислорода (целевой уровень сатурации крови кислородом ≥93% в покое), применение гидроксихлорохина (400 мг два раза в сутки в первый день, затем по 200 мг два раза в сутки), азитромицина, лопинавира/ ритонавира (400/100 мг два раза в сутки) и низкомолекулярного гепарина в соответствии с массой тела и фильтрационной способностью почек. Внутривенное введение дексаметазона допускалось в дозе не более 16 мг/сут.
Показатели эффективности и безопасности. Первичной комбинированной конечной точкой была частота смерти от всех причин во время госпитализации или перевода на ИВЛ, вторичными – два компонента первичной конечной точки по отдельности. Риск смерти у пациентов с COVID-19 зависит от необходимости в респираторной поддержке и от ее типа (введение увлажненного кислорода, неинвазивная вентиляция легких или ИВЛ), который отражает тяжесть острого респираторного дистресс синдрома (ОРДС). По данным нашего предыдущего исследования, в российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%. У пациентов, находившихся на оксигенотерапии она равнялась 10,1%, а при переводе на неинвазивную вентиляцию легких и ИВЛ увеличивалась до 36,8% и 76,5%, соответственно [19]. В связи с этим, все больные, принимавшие участие в исследование TOFA-COV-2, были разделены на две когорты в зависимости от SpO2 и необходимости в респираторной поддержке на момент включения в исследование: ≤93% (когорта 1) и >93% (когорта 2). Исходы оценивали раздельно в двух когортах. Первичные и вторичные конечные точки анализировали проспективно в группе тофацитиниба и ретроспективно на основании медицинской документации в контрольной группе.
Статистический анализ. Нормальность распределения данных оценивали с помощью теста Шапиро-Уилка. Демографические и исходные клинические показатели представлены в виде медианы и межквартильного интервала (IQR) для непрерывных переменных и в виде процентов для категориальных переменных. Сравнение непрерывных переменных в группе тофацитиниба и контрольной группе проводилось с использованием U-критерия Манна-Уитни для двух групп и критерия Краскелла-Уоллеса для трех групп. Категориальные переменные между группами сравнивали при помощи точного теста Фишера или критерия χ2 Пирсона.
Все участники находились под наблюдением с момента включения в исследование до выписки или смерти. Выживаемость и время до интубации или смерти сравнивали между двумя группами с помощью невзвешенных кривых Каплана-Мейера и однофакторной и многофакторной модели регрессии Кокса c фиксированными ковариатами. Рассчитывали отношения рисков (ОР) и 95% доверительные интервалы (ДИ). В базовую модель была внесена поправка на обратно взвешенные коэффициенты предрасположенности (propensity matching). Валидность регрессионной модели проверяли путем оценки пропорциональных рисков с использованием метода остатков Шонфельда.
Различия считали статистически значимыми при p менее 0,05. Статистическая обработка данных осуществлялась с использованием программного обеспечения IBM SPSS Statistics, version 22 (IBM Corporation, USA).
Результаты
Общая характеристика пациентов. В исследование были включены 384 пациента с COVID-19 средней тяжести, в том числе 212 (55,2%) мужчин. Медиана возраста составила 60 лет (IQR 48-70). Диагноз COVID-19 был подтвержден исследованием мазка из носоглотки методом ПЦР у 180 (46,9%) пациентов, однако у всех пациентов имелись типичные КТ-признаки COVID-19 ассоциированной пневмонии, а балл по шкале CO-RADS составлял 4 или 5. CO-RADS представляет собой стандартизированную систему классификации пациентов с подозрением на COVID-19 и позволяет оценить вероятность наличия заболевания на основании КТ органов грудной клетки – от очень низкой (CO-RADS 1) до очень высокой (CO-RADS 5) [17]. Медиана продолжительности пребывания в больнице до смерти или выписки составила 16 дней (IQR 14-20). 131 (34,1%) пациент получали тофацитиниб в дополнение к стандартному лечению, а 253 (65,9%) – только стандартную терапию. Исходные клинические и демографические показатели пациентов с низкой и нормальной SpO2, получавших тофацитиниб или стандартную терапию, представлены в табл. 1 и 2.
| Параметр | Группа тофацитиниба,
n=72 |
Контрольная группа,
n=185 |
р |
|---|---|---|---|
| Примечание: * ИБС без перенесенного инфаркта миокарда, хроническая сердечная недостаточность I-II класса, фибрилляция предсердий, заболевание периферических артерий, хронический гастрит, гастроэзофагеальная рефлюксная болезнь, желчнокаменная болезнь, мочекаменная болезнь, подагра, хронические ЛОР-инфекции, гипотиреоз, болезнь Альцгеймера, эпилепсия, бронхиальная астма. ИМТ - индекс массы тела; ХОБЛ - хроническая обструктивная болезнь легких; СРБ - C-реактивный белок; ЛДГ- лактатдегидрогеназа, НИВЛ - неинвазивная вентиляция легких | |||
| Возраст, годы | 61 (50-68) | 61 (52-71) | 0,95 |
| Мужской пол, n (%) | 39 (54,2) | 102 (55,1) | 0,89 |
| ИМТ, кг/м2 | 29,7 (26,9-33,0) | 30,8 (26,3-33,9) | 0,57 |
| Время от начала заболевания до госпитализации, дни | 10 (7-12) | 8 (6-10) | <0,01 |
| Положительная ПЦР на COVID-19, n (%) | 35 (48,6) | 77 (41,6) | 0,33 |
| Персистирующая лихорадка, n (%) | 60 (83,3) | 133 (71,9) | 0,08 |
| СРБ>50 мг/л, n (%) | 60 (83,3) | 182 (98,4) | <0,01 |
| Сопутствующие заболевания, n (%) | |||
| Артериальная гипертония | 41 (56,9) | 111 (60,0) | 0,67 |
| Сахарный диабет | 13 (18,1) | 40 (21,6) | 0,61 |
| Ожирение | 29/61 (47,5) | 77/150 (51,3) | 0,65 |
| Инсульт в анамнезе | 2 (2,8) | 11 (5,9) | 0,53 |
| Инфаркт миокарда в анамнезе | 3 (4,2) | 16 (8,6) | 0,29 |
| Злокачественное новообразование | 2 (2,8) | 7 (3,8) | 1,00 |
| ХОБЛ | 2 (2,8) | 7 (3,8) | 1,00 |
| Другое* | 34 (47,2) | 91 (49,2) | 0,78 |
| Кислородная поддержка на момент госпитализации, n (%) | |||
| Оксигенотерапия через носовые канюли | 71 (98,6) | 184 (99,5) | 0,48 |
| НИВЛ | 1 (1,4) | 1 (0,5) | 0,48 |
| SpO2, % | 90 (87-92) | 90 (88-92) | 0,93 |
| Степень поражения легких по КТ, n (%) | |||
| 0-24% | 2 (2,8) | 3 (1,6) | 0,62 |
| 25-49% | 37 (51,4) | 55 (29,7) | <0,01 |
| 50-74% | 26 (36,1) | 105 (56,7) | <0,01 |
| ≥75 | 7 (9,7) | 17 (9,2) | 1,00 |
| Температура тела (подмышечная), °C | 38,0 (38,5-38,7) | 37,6 (37,2-38,1) | <0,01 |
| Показатели анализов крови | |||
| Лейкоциты, ×109/л | 5,9 (4,2-7,5) | 6,1 (4,8-8,1) | 0,70 |
| Нейтрофилы, ×109/л | 4,1 (2,9-5,6) | 4,6 (3,4-6,3) | 0,19 |
| Лимфоциты, ×109/л | 1,0 (0,7-1,3) | 0,9 (0,7-1,3) | 0,45 |
| СРБ, мг/л | 89,4 (62,6-154,2) | 106,5 (79,0-148,5) | 0,02 |
| ЛДГ, ед/л | 654,5 (532,5-871,3) | 732,0 (566,5-894,0) | 0,46 |
| Креатинин сыворотки, ммоль/л | 93,4 (87,0-115,0) | 95,5 (84,7-115,9) | 0,81 |
| Сопутствующая терапия, n (%) | |||
| Противомалярийные препараты | 63 (87,5) | 173 (93,5) | 0,13 |
| Лопинавир+ритонавир | 10 (13,9) | 80 (43,2) | <0,01 |
| Глюкокортикостероиды | 31 (43,7) | 39 (21,1) | <0,01 |
| Азитромицин | 54 (75,0) | 157 (84,9) | 0,07 |
| Другие антибиотики | 47 (65,3) | 145 (78,4) | 0,04 |
| Низкомолекулярные гепарины | 69 (95,8) | 160 (86,5) | 0,04 |
Пациенты со сниженной сатурацией кислорода. На момент включения в исследование SpO2 в состоянии покоя на воздухе составляла ≤93% у 257 пациентов (когорта 1), 72 из которых получали тофацитиниб в дополнение к стандартному лечению. Пациенты в группе тофацитиниба и контрольной группе были сопоставимы по возрасту, полу, индексу массы тела, сопутствующим заболеваниям, SpO2 и различным лабораторным параметрам, включая количество лейкоцитов, нейтрофилов, лимфоцитов, активность лактатдегидрогеназы (ЛДГ) сыворотки и рСКФ. Медианы содержания СРБ были высокими в обеих группах. Пациенты, получавшие тофацитиниб, имели меньший объем зон “матового стекла" по данным КТ по сравнению с контрольной группой, хотя практически у всех пациентов целевой уровень SpO2 удавалось поддерживать путем введения увлажненного кислорода через носовые канюли, т.е. они не нуждались в высокопоточной оксигенотерапии или неинвазивной вентиляции легких. В то же время при анализе проводимой терапии были выявлены достоверные различия между двумя группами. В частности, в группе тофацитиниба доля пациентов, получавших глюкокортикостероиды, была в два раза больше, чем в контрольной группе (43,7% и 21,1% соответственно; p=0,001).
| Параметр | Группа тофацитиниба,
n=59 |
Контрольная группа,
n=68 |
р |
|---|---|---|---|
| Примечание: * ИБС без перенесенного инфаркта миокарда, хроническая сердечная недостаточность I-II класса, фибрилляция предсердий, заболевание периферических артерий, хронический гастрит, гастроэзофагеальная рефлюксная болезнь, желчнокаменная болезнь, мочекаменная болезнь, подагра, хронические ЛОР-инфекции, гипотиреоз, болезнь Альцгеймера, эпилепсия, бронхиальная астма. ИМТ - индекс массы тела; ХОБЛ - хроническая обструктивная болезнь легких; СРБ - C-реактивный белок; ЛДГ- лактатдегидрогеназа | |||
| Возраст, годы | 52 (45-62) | 57 (44-65) | 0,38 |
| Мужской пол, n (%) | 33 (55,9) | 38 (55,9) | 1,00 |
| ИМТ, кг/м2 | 29,2 (27,2-32,8) | 28,7 (26,5-33,5) | 0,76 |
| Время от начала заболевания до госпитализации, дни | 9 (7-12) | 8 (5-11) | 0,12 |
| Положительная ПЦР на COVID-19, n (%) | 37 (62,7) | 31 (45,6) | 0,07 |
| Персистирующая лихорадка, n (%) | 48 (81,4) | 43 (63,2) | 0,03 |
| СРБ>50 мг/л, n (%) | 30 (50,8) | 65 (95,6) | &lr;0,01 |
| Сопутствующие заболевания, n (%) | |||
| Артериальная гипертония | 27 (45,8) | 32 (47,1) | 1,00 |
| Сахарный диабет | 11 (18,6) | 11 (16,2) | 0,82 |
| Ожирение | 16/42 (38,1) | 22/49 (44,9) | 0,53 |
| Инсульт в анамнезе | 2 (3,4) | 1 (1,5) | 0,60 |
| Инфаркт миокарда в анамнезе | 3 (5,1) | 2 (2,9) | 0,66 |
| Злокачественное новообразование | 3 (5,1) | 2 (2,9) | 0,66 |
| ХОБЛ | 1 (1,7) | 2 (2,9) | 1,00 |
| Другое* | 26 (44,1) | 32 (47,1) | 0,86 |
| SpO2, % | 95 (94-96) | 94 (94-95) | <0,01 |
| Степень поражения легких по КТ, n (%) | |||
| 0-24% | 10 (16,9) | 2 (2,9) | 0,01 |
| 25-49% | 41 (69,5) | 22 (32,4) | <0,01 |
| 50-74% | 8 (13,6) | 32 (47,1) | <0,01 |
| ≥75 | 0 | 6 (8,8) | 0,03 |
| Нет данных | 0 | 6 (8,8) | 0,03 |
| Температура тела (подмышечная), °C | 38,0 (37,5-38,5) | 37,4 (37,0-38,3) | <0,01 |
| Показатели анализов крови | |||
| Лейкоциты, ×109/л | 5,3 (4,3; 6,5) | 6,1 (4,8; 8,1) | 0,05 |
| Нейтрофилы, ×109/л | 3,5 (2,7; 4,8) | 4,3 (3,2; 6,2) | 0,27 |
| Лимфоциты, ×109/л | 1,1 (0,8; 1,6) | 1,2 (0,8; 1,5) | 0,71 |
| СРБ, мг/л | 53,0 (35,6; 87,6) | 79,2 (60,3; 155,0) | <0,01 |
| ЛДГ, ед/л | 96,5 (84,5; 110,0) | 98,9 (84,8; 110,1) | 0,58 |
| Креатинин сыворотки, ммоль/л | 93,4 (87,0-115,0) | 95,5 (84,7-115,9) | 0,81 |
| Сопутствующая терапия, n (%) | |||
| Противомалярийные препараты | 45 (76,3) | 60 (88,2) | 0,10 |
| Лопинавир+ритонавир | 5 (8,5) | 9 (13,2) | 0,57 |
| Глюкокортикостероиды | 33 (57,9) | 15 (22,1) | <0,01 |
| Азитромицин | 38 (64,4) | 53 (77,9) | 0,12 |
| Другие антибиотики | 35 (59,3) | 50 (73,5) | 0,13 |
| Низкомолекулярные гепарины | 56 (94,9) | 43 (63,2) | <0,01 |
Во время госпитализации умерли или были интубированы 9 (12,5%) из 72 пациентов, получавших тофацитиниб, и 26 (14,1%) из 185 пациентов, получавших только стандартную терапию (ОР 0,92; 95% ДИ 0,33–2,56). На ИВЛ были переведены 5 (6,9%) пациентов в группе тофацитиниба и 24 (13,0%) пациента в контрольной группе (ОР 0,46; 95% ДИ 0,11-1,99), а 8 (11,1%) и 21 (11,4%) пациентов в двух группах, соответственно, умерли в стационаре (ОР 1,25; 95% ДИ 0,44–3,54).
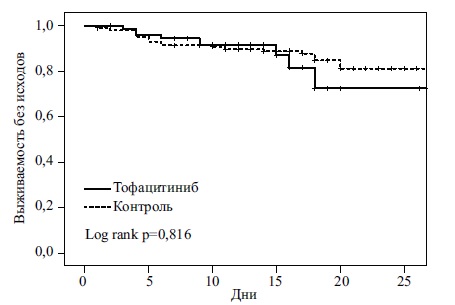
С помощью метода Каплана-Мейера мы не выявили различий кумулятивной частоты первичной или вторичных конечных точек между двумя группами (рис. 1). По данным регрессионного анализа Кокса, добавление тофацитиниба к стандартному лечению не привело к снижению риска развития первичной или вторичных исходов (табл. 3).
| Когорты/конечные точки | Нескорректированное ОР (95% ДИ) | p | Скорректированное ОР (95% ДИ) | p |
|---|---|---|---|---|
| Пациенты со сниженной SpO2 | ||||
| Смерть или перевод на ИВЛ | 0,91 (0,42–1,97) | 0,82 | 0,92 (0,33-2,56) | 0,87 |
| Перевод на ИВЛ | 0,67 (0,25–1,78) | 0,42 | 0,46 (0,11-1,99) | 0,30 |
| Смерть | 1,24 (0,54–2,84) | 0,62 | 1,25 (0,44-3,54) | 0,67 |
| Пациенты со нормальной SpO2 | ||||
| Смерть или перевод на ИВЛ | 0,76 (0,07–8,57) | 0,83 | 0,83 (0,07-9,44) | 0,88 |
| Смерть | - | - | - | - |
| Перевод на ИВЛ | 0,99 (0,09–11,08) | 0,99 | 1,10 (0,10 – 12,46) | 0,94 |
Пациенты с нормальной сатурацией кислорода. Исходно SpO2 в покое была нормальной (>93%) у 127 пациентов. 59 из них получали тофацитиниб в дополнение к стандартному лечению, а 68 – только стандартную терапию. Две группы были сопоставимы по различным параметрам, включая возраст, пол, индекс массы тела, сопутствующие заболевания, SpO2, количество лейкоцитов, нейтрофилов и лимфоцитов, сывороточный уровень креатинина. Как и в когорте 1, пациенты в группе тофацитиниба имели меньший объем зон “матового стекла" и более низкую медиану СРБ по сравнению с контрольной группой. Доля пациентов, получавших лечение глюкокортикостероидами и низкомолекулярными гепаринами, в группе тофацитиниба была значительно выше, чем в контрольной группе.
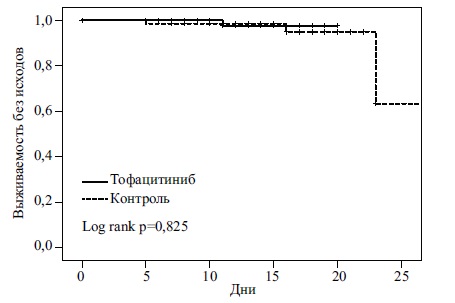
Первичная комбинированная конечная точка (смерть или перевод на ИВЛ) была достигнута у 1 (1,7%) из 59 пациентов, получавших тофацитиниб со стандартной терапией, и у 3 (4,4%) из 68 пациентов, получавших только стандартное лечение (ОР 0,83; 95% ДИ 0,07-9,44). Ни одному пациенту в группе тофацитиниба не потребовалась ИВЛ, тогда как 3 (4,4%) пациента в контрольной группе были интубированы во время пребывания в больнице (p=0,25). В группе тофацитиниба во время госпитализации умер 1 (1,7%) пациент, а в контрольной группе – 3 (4,4%) больных (ОР 1,10; 95 ДИ 0,10–12,46).
По данным анализа Каплана-Мейера, комбинированная терапия не имела преимуществ перед стандартной терапией по эффективности (рис. 2). При регрессионном анализе Кокса добавление тофацитиниба к стандартному лечению также не привело к снижению риска комбинированной первичной или вторичных конечных точек по сравнению со стандартной терапией (табл. 3).
Пациенты, получавшие глюкокортикоиды. Во время госпитализации 118 пациентов, включенных в исследование TOFA-COV-2, получали дексаметазон внутривенно (табл. 4). Среди 70 пациентов со сниженной SpO2, которым вводили глюкокортикостероиды, первичная конечная точка (смерть или перевод на ИВЛ) была достигнута у 4 (12,9%) из 31 пациента в группе тофацитиниба и у 11 (28,2%) из 39 пациентов в контрольной группе. ИВЛ потребовалась 1 (3,2%) и 10 (25,6%) пациентам, соответственно, а 4 (12,9%) пациента, получавших тофацитиниб и глюкокортикостероиды, и 9 (23,1%) пациентов, получавших только глюкокортикостероиды, умерли. Все различия частоты конечных точек между двумя группами не достигли статистической значимости в однофакторной модели регрессии Кокса.
| Конечные точки | Глюкокортикостероиды
и тофацитиниб |
Глюкокортикостероиды без тофацитиниба | ОР (95% ДИ) | p |
|---|---|---|---|---|
| Пациенты со сниженной SpO2 | ||||
| Число больных | 31 | 39 | ||
| Смерть или перевод на ИВЛ | 4 (12,9) | 9 (23,1) | 0,722 (0,219-2,385) | 0,593 |
| Перевод на ИВЛ | 1 (3,2) | 10 (25,6) | 0,135 (0,017-1,065) | 0,057 |
| Смерть | 4 (12,9) | 11 (28,2) | 0,517 (0,162-1,651) | 0,266 |
| Пациенты со нормальной SpO2 | ||||
| Число больных | 33 | 15 | ||
| Смерть или перевод на ИВЛ | 1 (3,0) | 2 (13,3) | 0,791 (0,046-13,597) | 0,871 |
| Перевод на ИВЛ | 0 | 2 (13,3) | не применимо | 0,631 |
| Смерть | 1 (3,0) | 2 (13,3) | 0,791 (0,046-13,597) | 0,871 |
Среди 48 пациентов с нормальной SpO2, получавших глюкокортикостероиды, комбинированная первичная конечная точка была достигнута у 1 (3,0%) из 31 пациента группы тофацитиниба, и у 2 (13,3%) из 15 пациентов контрольной группы. Различия частоты первичной и вторичных конечных точек между двумя группами в этой когорте также не достигли статистической значимости в однофакторной модели регрессии Кокса.
| Нежелательные явления | n (%) |
|---|---|
| Повышение активности печеночных ферментов | 14 (10,7) |
| Бактериальная пневмония | 6 (4,6) |
| Инфекция мочевыводящих путей | 2 (1,5) |
| Бактериальный сепсис | 2 (1,5) |
| Бактериальный колит | 1 (0,8) |
| Анемия | 2 (1,5) |
| Лейкопения | 1 (0,8) |
| Тромбоз яремной вены | 1 (0,8) |
| Кожные высыпания | 1 (0,8) |
| Пародонтит | 1 (0,8) |
| Инфаркт миокарда с подъемом сегмента ST | 1 (0,8) |
| Острое повреждение почек, потребовавшее диализа | 1 (0,8) |
| Желудочно-кишечное кровотечение | 1 (0,8) |
Безопасность. Побочные эффекты были выявлены у 34 (26,0%) из 131 пациента, получавшего тофацитиниб (табл. 5). Лечение тофацитинибом было прекращено у 7 (5,3%) пациентов из-за быстрого нарастания гипоксии (n=2) или серьезных побочных эффектов (n=5), которые включали инфаркт миокарда с подъемом сегмента ST (n=1), бактериальный сепсис (n=2), тромбоз яремной вены (n=1) и бактериальный колит (n=1).
Обсуждение
В нашем исследовании терапия тофацитинибом в дополнение к стандартному лечению не уменьшала риск наступления комбинированной первичной конечной точки, включавшей в себя смерть или перевод на ИВЛ, у пациентов, госпитализированных с COVID-19 средней тяжести. У большинства пациентов наблюдались признаки системного воспаления, т.е. персистирующая лихорадка и/или повышенный уровень СРБ. Улучшения исходов не было отмечено ни у пациентов, которым требовалась кислородная поддержка на момент начала приема тофацитиниба, ни у пациентов с нормальной SpO2. В скорректированной многофакторной модели регрессии Кокса в обеих когортах больных добавление тофацитиниба к стандартной терапии не привело к снижению риска смерти или интубации или двух конечных точек по отдельности.
Тем не менее, у больных со сниженной и нормальной SpO2 тофацитиниб по эффективности в профилактике неблагоприятных исходов COVID-19 имел недостоверные преимущества перед контролем. Среди пациентов, нуждавшихся в респираторной поддержке на момент включения в исследования, частота смерти или интубации составила 12,5% и 14,1% в группе тофацитиниба и контрольной группе, соответственно, а среди пациентов с нормальной SpO2 – 1,7% и 4,4%. Эти различия могли быть связаны с более частым применением глюкокортикостероидов в группе тофацитиниба. В исследовании RECOVERY дексаметазон снижал летальность только у госпитализированных пациентов с более тяжелым COVID-19 [7]. Однако благоприятное влияние терапии глюкокортикостероидами на течение COVID-19 нельзя исключить и у пациентов с выраженной воспалительной реакцией даже при отсутствии гипоксии.
Использование глюкокортикостероидов было запрещено протоколом исследования ACTT-2, хотя эти препараты можно было применять по стандартным показаниям, включая септический шок и ОРДС. В исследовании ACTT-2 дексаметазон использовался только у 6,0% пациентов в группе барицитиниба. Напротив, системные глюкокортикостероиды применяли у 82% пациентов, которые были включены в группу тоцилизумаба в исследовании RECOVERY. Добавление тоцилизумаба к глюкокортикостероидам привело к снижению риска смерти от любых причин на 21%, тогда как этого преимущества не наблюдалось у пациентов, не получавших глюкокортикостероиды [12]. Приве денные данные свидетельствуют о том, что у пациентов с COVID-19 тоцилизумаб и, возможно, другие иммуномосупрессивные препараты следует назначать в дополнение к терапии глюкокортикостероидами. В нашем исследовании 31,2% пациентов получали дексаметазон внутривенно. Следует отметить, что набор в исследование TOFA-COV-2 проводился в начале пандемии COVID-19 в России, когда эффективность глюкокортикостероидов еще вызывала сомнение. В выборке больных со сниженной SpO2, которым вводили дексаметазон, добавление тофацитиниба к стандартной терапии сопровождалось более чем двукратным снижением частоты комбинированной конечной точки (смерти или ИВЛ) по сравнению с контрольной группой (12,9% против 28,2%). Как частота интубации, так и общая летальность также были ниже в группе тофацитиниба. Однако различия между двумя группами не достигли статистической значимости, вероятно, из-за ограниченного числа пациентов. Частота первичной и вторичных конечных точек была низкой у пациентов с нормальной SpO2 и не различалась между двумя группами. Терапия тофацитинибом хорошо переносилась пациентами исследуемой когорты и была отменена только у 5,4% пациентов.
Наше исследование имеет несколько ограничений. Во-первых, оно было нерандомизированном, а набор пациентов в контрольную группу осуществлялся ретроспективно на основании медицинской документации. Это не позволяло исключить возможность системной ошибки, связанной с отбором пациентов (selection bias). Чтобы исключить эффект различных факторов, способных повлиять на результаты лечения, в многофакторную модель Кокса была внесена поправка на propensity matching score. Следует отметить, что в обеих выборках в группах тофацитиниба объем поражения легочной ткани был ниже, а частота применения глюкокортикостероидов, наоборот, оказалась выше, чем в контрольных группах. Во-вторых, статистическая сила нашего исследования была ограниченной, особенно среди пациентов с нормальной SpO2, учитывая низкую частоту событий. Тем не менее, мы провели первое достаточно крупное контролируемое исследование с целью изучения эффективности тофацитиниба в профилактике неблагоприятных исходов у госпитализированных пациентов с COVID-19.
Заключение
Применение тофацитиниба в дополнение к стандартной терапии не привело к снижению риска смерти или перевода на ИВЛ у пациентов с COVID-19 средне-тяжелого течения как с пониженной, так и нормальной SpO2. У пациентов группы тофацитиниба, особенно получавших глюкокортикостероиды, частота комбинированной первичной конечной точки (смерть или интубация) и вторичных конечных точек была ниже, чем в контрольной группе, однако все различия между группами сравнения не достигли статистической значимости.
Используемые источники
- Fajgenbaum DC, June CH. Cytokine storm. N Engl J Med 2020;383(23):2255-73.
- Kim JS, Lee JY, Yang JW, et al. Immunopathogenesis and treatment of cytokine storm in COVID-19. Theranostics 2021;11(1):316-29.
- Глыбочко П.В., Фомин В.В., Авдеев С.Н. и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке. Клин фармакол тер 2020;29(2):21-9 [Glybochko P, Fomin V, Avdeev S, et al. Clinical characteristics of 1007 intensive care unit patients with SARS-CoV-2 pneumonia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):21-9 (In Russ.)].
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии. Клин фармакол тер 2020;29(3):25-36 [Glybochko P, Fomin V, Moiseev S, et al. Clinical outcomes of patients with COVID-19 admitted for respiratory support to the intensive care units in Russia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020; 29(3):25-36 (In Russ.)].
- Руженцова Т.А., Чухляев П.В., Хавкина Д.А. и др. Эффективность и безопасность применения фавипиравира в комплексной терапии COVID-19 легкого и среднетяжелого течения. Инфекционные болезни: новости, мнения, обучение 2020;9(4):26-38 [Ruzhentsova TA, Chukhlyaev PV, Khavkina DA, et al. Efficacy and safety of favipiravir in a complex therapy of mild to moderate COVID-19. Infektsionnye bolezni: novosti, mneniya, obuchenie 2020;9(4): 26-38(In Russ.)].
- Cavalli G, Farina N, Campochiaro C, et al. Repurposing of biologic and targeted synthetic anti-rheumatic drugs in COVID-19 and hyper-inflammation: A comprehensive review of available and emerging evidence at the peak of the pandemic. Front Pharmacol 2020;11:598308.
- Horby P, Lim WS, Emberson JR, et al. Dexamethasone in hospitalized patients with Covid-19. N Engl J Med 2021;384(8):693-704.
- Malgie J, Schoones JW, Pijls BG. Decreased mortality in COVID-19 patients treated with Tocilizumab: a rapid systematic review and meta-analysis of observational studies. Clin Infect Dis 2020 Sep 23:ciaa1445
- Hermine O, Mariette X, Tharaux PL, et al. Effect of tocilizumab vs usual care in adults hospitalized with COVID-19 and moderate or severe pneumonia: A randomized clinical trial. JAMA Intern Med 2021;181(1):32-40.
- Stone JH, Frigault MJ, Serling-Boyd NJ, et al. Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. N Engl J Med 2020;383(24):2333-44.
- Моисеев С.В., Авдеев С.Н., Тао Е.А. и др. Эффективность тоцилизумаба у пациентов с COVID-19, госпитализированных в ОРИТ: ретроспективное когортное исследование. Клин фармакол тер 2020; 29(4):17-25 [Moiseev S, Avdeev S, Tao E, et al. Efficacy of tocilizumab in the intensive care unit patients with COVID-19: a retrospective cohort study. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(4):17-25 (In Russ.)].
- RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet 2021;397(10285):1637-45.
- Новиков П.И., Шевцова Т.П., Щеголева Е.М., Моисеев С.В. Ингибиторы янус-киназ: фармакологические свойства и сравнительные клиническая эффективность и безопасность. Клин фармакол тер 2021;30(1):51-60
- [Novikov P, Shevtsova T, Shchegoleva E, Moiseev S. JAK-inhibitors: pharmacological properties and comparative clinical efficacy and safety. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(1):51-60 (In Russ.)].
- Rizk JG, Kalantar-Zadeh K, Mehra MR, et al. Pharmaco-immunomodulatory therapy in COVID-19. Drugs 2020;80(13):1267-92.
- Richardson P, Griffin I, Tucker C, et al. Baricitinib as potential treatment for 2019-nCoV acute respiratory disease. Lancet 2020;395(10223):e30-e1.
- Kalil AC, Patterson TF, Mehta AK, et al. Baricitinib plus remdesivir for hospitalized adults with Covid-19. N Engl J Med 2021;384(9): 95-807.
- Prokop M, van Everdingen W, van Rees Vellinga T, et al. CO-RADS: A categorical CT assessment scheme for patients suspected of having COVID-19 definition and evaluation. Radiology 2020;296(2):E97-104.
- Dhillon S. Tofacitinib: a review in rheumatoid arthritis. Drugs 2017;77(18):19872001.
- Moiseev S, Avdeev S, Brovko M, et al. Outcomes of intensive care unit patients with COVID-19: a nationwide analysis in Russia. Anaesthesia 2021;76 Suppl 3:11-2.
