Тафамидис в лечении транстиретинового амилоидоза сердца
ATTR-амилоид образуется из транстиретина, который обеспечивает транспорт тироксина и витамина А. Выделяют наследственный ATTRамилоидоз, обусловленный мутациями гена TTR, и ненаследственную (старческую) форму заболевания. Амилоидная кардиомиопатия наблюдается при обоих типах ATTR-амилоидоза, развивается в пожилом или старческом возрасте и сопровождается прогрессирующей сердечной недостаточностью, которая обычно приводит к смерти в течение нескольких лет после установления диагноза. Тафамидис – это пероральный препарат, который связывается с транстиретином, стабилизирует его четвертичную структуру и препятствует образованию амилоидогенных мономеров. Эффективность и безопасность препарата установлены у пациентов с наследственной ATTR-полиневропатией. Целью двойного слепого, рандомизированного, плацебо-контролируемого исследования ATTR-ACT было изучение эффективности применения тафамидиса в дозах 20 и 80 мг/сут в течение 30 мес в профилактике прогрессирования амилоидной кардиомиопатии у 441 пациента с наследственным и ненаследственным ATTR-амилоидозом сердца (медиана возраста 75 лет, около 90% мужчин). Лечение тафамидисом по сравнению с плацебо привело к снижению риска смерти от любых причин на 30% и риска госпитализаций по поводу сердечно-сосудистых заболеваний на 32%, а также замедляло снижение толерантности к физической нагрузке и индекса качества жизни. По данным открытого исследования, в которое включали пациентов, завершивших участие в ATTR-ACT, оптимальная доза препарата составляет 80 мг/сут (четырем капсулам тафамидиса меглумина по 20 мг биоэквивалентна одна капсула свободного тафамидиса 61 мг).
Амилоидоз – это неоднородная группа заболеваний, в основе которых лежит синтез большого количества нестабильных белков-предшественников, агрегирующихся с образованием амилоидных фибрилл [1]. Сегодня известно более 30 белков, являющихся предшественниками амилоида, однако их истинное число может быть намного больше [2]. Чаще всего встречаются AL-амилоидоз, обусловленный формированием клона плазматических или В-клеток в костном мозге, которые продуцируют аномальные иммуноглобулины, и АА-амилоидоз (вторичный), развивающийся при ревматоидном артрите, периодической болезни (семейной средиземноморской лихорадке), хронических нагноениях, туберкулезе [3]. Причиной наследственного ATTR-амилоидоза являются мутации гена TTR, сопровождающиеся синтезом транстиретина, который не способен образовывать тетрамеры и обладает очень высокой амилоидогенностью. В настоящее время известно около 130 мутаций гена TTR, некоторые из которых, например, Val122Ile, ассоциируются с преимущественным поражением сердца. Ненаследственный (старческий) ATTR-амилоидоз развивается в результате возрастного снижения активности ферментных систем гепатоцитов, что приводит к преимущественной секреции нестабильных мономеров транстиретина, которые агрегируют в тканях с образованием амилоида.
За последние 25 лет удельный вес различных типов системного амилоидоза в структуре этого заболевания существенно изменился. В Национальном центре амилоидоза в Великобритании с 1987 по 2012 г. были обследованы около 5100 пациентов с амилоидозом. На протяжении указанного срока доля AL-амилоидоза оставалась стабильной (67% случаев), в то время как доля AA-амилоидоза снизилась с 32% в 1987-1995 гг. до 6,8% в 2009-2012 г., что, вероятно, отражало увеличение эффективности лечения иммуновоспалительных ревматологических заболеваний, в том числе с применением генно-инженерных биологических препаратов [4]. В то же время доля старческого ATTR-амилоидоза увеличилась с 0,2% в 1988-1999 гг. до 6,4% в 2009-2012 гг. За весь 25-летний период наследственный и ненаследственный ATTR-амилоидоз был диагностирован у 9,9% из 5100 пациентов с системным амилоидозом.
ATTR-амилоидоз, вероятно, является не столь редким заболеванием, как принято считать. Например, отложения амилоида в сердце на аутопсии обнаруживали примерно у четверти пациентов в возрасте старше 80 лет [4]. Ненаследственный ATTR-амилоидоз является одной из достаточно частых причин хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка у пожилых людей [6,7]. Частота мутаций гена TTR, которые сопровождаются развитием наследственного ATTR-амилоидоза, в Европе составляет менее 1:100000 населения, однако она значительно выше в отдельных популяциях [8]. Например, частота мутации Val30Met, ассоциирующейся с развитием наследственной амилоидной полиневропатией, составила 1:538 в северной Португалии и 4% в северной Швеции [9,10], в то время как мутация Val122Ile, вызывающая развитие наследственной амилоидной кардиомиопатии, встречается у 3-4% афроамериканцев [11]. Мутации передаются по аутосомно-доминантному типу с неполной пенетрантностью, поэтому клинические проявления заболевания у пациентов с мутантным геном могут отсутствовать.
Основные проявления ATTR-амилоидоза – периферическая полиневропатия и поражение сердца по типу рестриктивной кардиомиопатии. Поражение нервной системы при этом заболевании характеризуется развитием прогрессирующей симметричной дистальной полиневропатии, которая начинается с сенсорных расстройств (снижение чувствительности, парестезии) с последующим присоединением двигательных нарушений. Часто встречаются синдром запястного канала, проявляющийся болями и парестезиями в I-III пальцах кисти с постепенной атрофией мышц тенара, и ортостатическая гипотензия, связанная с дисфункцией автономной нервной системы. При амилоидозе сердца обычно развивается тяжелая сердечная недостаточность, которая плохо поддается лечению, хотя единственными клиническими проявлениями заболевания могут быть нарушения ритма и проводимости, в частности фибрилляция предсердий. При эхокардиографии обнаруживают симметричное утолщение стенок левого желудочка без признаков обструкции выносящего тракта левого желудочка и дилатацию левого предсердия, в то время как объем левого желудочка обычно не увеличен, а фракция выброса левого желудочка остается нормальной или снижена умеренно. В отличие от гипертрофии левого желудочка, при амилоидозе сердца на ЭКГ отмечается низкий вольтаж комплексов QRS, а также могут быть выявлены патологические зубцы Q. Важное значение в диагностике амилоидной кардиомиопатии имеет сцинтиграфия миокарда с пирофосфатом технеция, интенсивное накопление которого в миокарде (2+/3+) в сочетании с утолщением миокарда неясной этиологии указывает на высоко вероятный ATTR-амилоидоз, если у пациента исключен диагноз AL-амилоидоза [1].
Клиническая картина ATTR-амилоидоза зависит от его типа. По данным регистра Transthyretin Amyloidosis Outcomes Survey (THAOS), среди 611 больных наследственным ATTR-амилоидозом, обследованных в разных странах, у 86% наблюдалась сенсорная полиневропатия, у 42% – признаки поражения сердца, У 66% – желудочно-кишечные нарушения, у 50% – автономная невропатия [12]. Медиана возраста, в котором появлялись первые симптомы заболевания, составила 39 лет. Как указано выше, некоторые мутации гена TTR, такие как Leu111Met и Val122Ile, ассоциируются с преимущественным поражением сердца, которое отмечается в более позднем возрасте. Практически у всех пациентов с ненаследственным ATTR-амилоидозом ведущим в клинической картине является поражение сердца, которое развивается в пожилом или старческом возрасте, чаще у мужчин. Следует отметить, что у таких пациентов также могут наблюдаться системные проявления, в том числе сенсорная полиневропатия и желудочно-кишечные расстройства [12], что указывает на нецелесообразность выделения нейропатического и кардиального вариантов ATTR-амилоидоза. Среди больных ATTR-амилоидозом, обследованных в клинике им. Е.М. Тареева, генерализованное поражение разных органов наблюдалось в 40% случаев [13]. Прогноз для жизни у пациентов с амилоидной кардиомиопатией неблагоприятный. По данным крупного исследования, у 869 пациентов с ATTR-амилоидозом сердца (ненаследственным у 553 и наследственным у 316) медиана выживаемости составила 57 мес [14]. Одним из неблагоприятных прогностических факторов является высокий уровень NT-proBNP.
Исторически единственным эффективным методом лечения наследственного ATTR-амилоидоза была ортотопическая трансплантация печени, позволяющая восстановить синтез неизмененного транстиретина [15]. Изучение патогенеза ATTR-амилоидоза, основным этапом которого является диссоциация тетрамера транстиретина на мономеры, позволило разработать новый подход к лечению этого заболевания. Тафамидис – это пероральный препарат, который связывается с транстиретином, стабилизирует его четвертичную структуру и препятствует образованию амилоидогенных мономеров. Эффективность и безопасность этого препарата были первоначально установлены у больных ATTR-полиневропатией [16]. Результаты двойного слепого рандомизированного плацебо-контролируемого исследования [17] и длительных открытых исследований показали, что лечение тафамидисом в дозе 20 мг/сут позволяет затормозить прогрессирование неврологических нарушений у пациентов с наследственной ATTR-полиневропатией. Соответственно, тафамидис сегодня считают препаратом первой линии в лечении наследственного ATTR-амилоидоза с поражением нервной системы [15]. Эффективность патогенетической терапии выше у пациентов с более коротким анамнезом и меньшей выраженностью неврологических расстройств.
Дизайн исследования ATTR-ACT (The Transthyretin Amyloidosis Cardiomyopathy Clinical Trial)
В небольшом неконтролируемом исследовании 2 фазы лечение тафамидисом в дозе 20 мг/сут привело к стабилизации транстиретина, которую оценивали с помощью валидированного иммунотурбидиметрического метода, у 30 (96,8%) из 31 пациента с ненаследственным ATTR-амилоидозом сердца (медиана возраста 76,7 лет, 93,5% мужчин). Через 6 и 12 мес частота стабилизации транстиретина у пациентов, продолжавших лечение исследуемым препаратом, составила 90,0% и 89,3%, соответственно [18]. В ретроспективном исследовании было изучение влияние стабилизаторов транстиретина на течение ATTR-амилоидоза сердца у 120 пациентов в возрасте в среднем 75±8 лет [19]. 29 из них получали тафамидис или дифлюнизал, а 96 больных составили контрольную группу. По данным многофакторного анализа, лечение стабилизаторами транстиретина в течение около 2 лет привело к снижению риска смерти или ортотопической трансплантации печени на 63% по сравнению с контролем (p=0,003). Результаты этих исследований и эффективность тафамидиса у пациентов с ATTR-полиневропатией послужили основанием для проведения международного многоцентрового, двойного слепого, рандомизированного, плацебо-контpолируемого исследования ATTR-ACT с целью изучения эффективности и безопасности тафамидиса в дозах 20 или 80 мг/сут у пациентов с ATTR-амилоидозом сердца [20].
В это исследование включали пациентов c наследственным или ненаследственным ATTR-амилоидозом сердца, подтвержденным при биопсии миокарда или других тканей. Критериями включения были утолщение межжелудочковой перегородки более 12 мм, сердечная недостаточность I-III функциональных классов по NYHA, содержание NT-proBNP ≥600 пг/мл и пройденная за 6 мин дистанция более 100 м. Эффективность терапии оценивали на основании двух первичных конечных точек – смертности от любых причин и частоты госпитализаций по поводу сердечно-сосудистых заболеваний в течение 30 мес. Кроме того, оценивали влияние тафамидиса на пройденную за 6 минут дистанцию и качество жизни, которое определяли с помощью вопросника Kansas City Cardiomyopathy Questionnaire–Overall Summary (KCCQ-OS).
Основные результаты исследования ATTR-ACT
В исследование ATTR-ACT были включены 441 пациент с ATTR-амилоидозом сердца (медиана возраста 75 лет, около 90% мужчин) [21]. У 106 (24%) из них был диагностирован наследственный ATTR-амилоидоз (основные мутации – Val122Ile, Thr60Ala и Ile68Leu). Более чем у 90% пациентов наблюдалась хроническая сердечная недостаточность II-III функционального класса по NYHA. Больные были рандомизированы на три группы в соотношении 2:1:2 и получали тафамидис в дозах 80 или 20 мг/сут (n=264) или плацебо (n=177) в течение 30 мес. При проведении первичного анализа пациенты, принимавшие тафамидис в разных дозах, были объединены в одну группу.
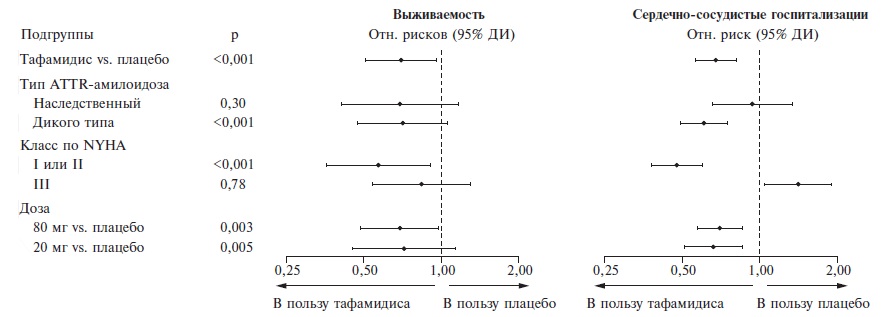
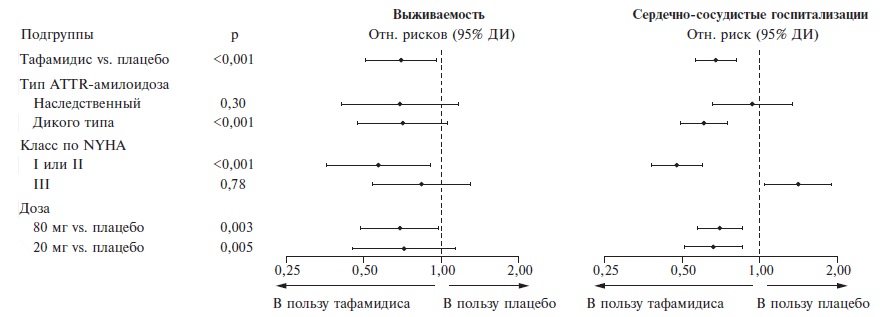
По обоим первичным показателям эффективности тафамидис достоверно превосходил плацебо. Во время исследования смертность от любых причин в группах тафамидиса и плацебо составила 29,5% и 42,9%, соответственно, а частота госпитализаций по поводу сердечно-сосудистых заболеваний – 0,48 и 0,70 в год. По данным регрессионного анализа, лечение тафамидисом привело к снижению риска смерти на 30% (0,70, 95% ДИ 0,51-0,96) (рис. 1) и риска госпитализации – на 32% (0,68, 95% ДИ 0,56-0,81). Расхождение кривых выживаемости Каплана-Мейера было отмечено примерно через 18 мес после начала лечения. Тафамидис имел преимущество перед плацебо в большинстве подгрупп больных, выделенных с учетом типа ATTR-амилоидоза (ненаследственный или наследственный), функционального класса по NYHA (I-II или III) и дозы препарата (80 или 20 мг) (рис. 2).
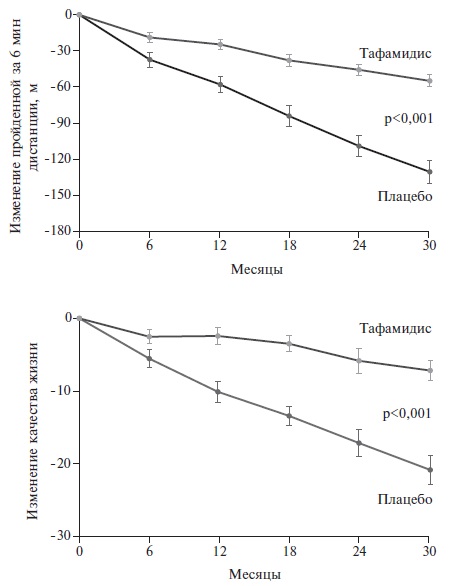
Тафамидис оказывал благоприятное влияние на толерантность к физической нагрузке и качество жизни пациентов с амилоидной кардиомиопатией. При лечении этим препаратом степень снижения пройденной за 6 минут дистанции и индекса качества жизни по шкале KCCQ-OS была достоверно меньше (p<0,001), чем в группе плацебо (рис. 3). Положительный эффект тафамидиса был продемонстрирован также при анализе содержания NT-proBNP и эхокардиографических показателей.
Эффективность тафамидиса у пациентов с наследственным и ненаследственным ATTR-амилоидозом
В отдельной публикации были представлены результаты анализа эффективности тафамидиса у 335 пациентов с ненаследственным ATTR-амилоидозом (тафамидис – 201, плацебо – 134) и 106 больных наследственным ATTR-амилоидозом (тафамидис – 63, плацебо – 43) [22]. Пациенты с ATTR-амилоидозом двух типов отличались по демографическим и клиническим показателям. Больные ненаследственным ATTR-амилоидозом были старше пациентов с наследственной амилоидной кардиомиопатией (75,2±6,4 и 71,5±8,0 лет, соответственно, p<0,0001), а среди первых была достоверно выше доля мужчин (96,1% и 71,7%, соответственно, p<0,0001). У пациентов с ненаследственным ATTR-амилоидозом наблюдалось менее тяжелое поражение сердца, чем у больных с наследственным ATTR-амилоидозом, в частности в первой когорте была ниже частота хронической сердечной недостаточности III функционального класса (27,8% против 45,3%) и выше пройденная за 6 минут дистанция (367 против 302 м). Эти данные были подтверждены и при анализе естественного течения амилоидоза сердца у пациентов, получавших плацебо. Так, в этой выборке во время исследования умерли 36,6% больных ненаследственным ATTR-амилоидозом и 62,8% больных наследственным ATTR-амилоидозом, причем указанные различия между двумя когортами были сопоставимыми у пациентов с различными функциональными классами хронической сердечной недостаточности (I-II функциональный класс: 27,8% и 50,0%, соответственно; III функциональный класс: 54,5% и 78,9%).
| Ненаследственный ATTR-амилоидоз |
Наследственный ATTR-амилоидоз |
|
|---|---|---|
| Примечание: *p=0,0445. ДИ - доверительный интервал | ||
| Все больные | ||
| n | 335 | 106 |
| Отношение рисков | 0,706 | 0,690 |
| (95% ДИ) | (0,474–1,052) | (0,408–1,167) |
| Снижение риска, % | 29,4 | 31,0 |
| Класс I/II по NYHA | ||
| n | 242 | 58 |
| Отношение рисков | 0,566 | 0,584 |
| (95% ДИ) | (0,325–0,986)* | (0,252–1,354) |
| Снижение риска, % | 43,4 | 41,6 |
| Класс III по NYHA | ||
| n | 93 | 48 |
| Отношение рисков | 0,884 | 0,795 |
| (95% ДИ) | (0,501–1,558) | (0,403–1,567) |
| Снижение риска, % | 11,6 | 20,5 |
Исследование ATTR-ACT не обладало статистической силой, достаточной для анализа первичных конечных точек в отдельных подгруппах пациентов, поэтому большинство выявленных различий не достигли статистической значимости. Тем не менее, лечение тафамидисом привело к сопоставимому снижению риска смерти от любых причин у пациентов с ненаследственным и наследственным ATTR-амилоидозом (на 29,4% и 31,0%, соответственно; табл. 1). В обеих когортах более выраженного эффекта в профилактике смерти при лечении тафамидисом удалось добиться у пациентов с менее тяжелой хронической сердечной недостаточностью. Так, у больных с I-II функциональным классом по NYHA риск смерти от любых причин снизился на 41,6-43,4%, а у пациентов с III функциональным классом – всего на 11,6-20,5%. Приведенные данные указывают на важность более ранней диагностики ATTR-амилоидоза с целью своевременного назначения патогенетической терапии. Риск госпитализации по поводу сердечно-сосудистых заболеваний при лечении тафамидисом у пациентов с ненаследственным ATTR-амилоидозом снизился в большей степени (на 39,3%), чем у больных наследственным ATTR-амилоидозом (на 6,2%). В то же время патогенетическая терапия оказывала сопоставимое влияние на толерантность к физической нагрузке и качество жизни пациентов с двумя типами ATTR-амилоидоза. Хотя пройденная за 6 минут дистанция и индекс качества жизни во время исследования ухудшились как в контрольной, так и основной группах, тем не менее, степень их изменения при лечении тафамидисом была меньше, чем при приеме плацебо. Так, разница динамики пройденной за 6 минут дистанции между группами тафамидиса и плацебо в пользу активного препарата составила 77,14 м у больных ненаследственным ATTR-амилоидозом и 79,61 м у пациентов с наследственным ATTR-амилоидозом, а разница динамики индекса качества жизни КCCQ-OS – 12,72 и 18,18 баллов, соответственно. Благоприятный эффект препарата на указанные показатели проявлялся в течение первых 12 мес после начала лечения. Тафамидис подавлял также увеличение среднего уровня NT-proBNP у больных с обоими типами ATTR-амилоидоза.
Эффективность тафамидиса в дозах 80 и 20 мг/сут
В исследовании ATTR-ACT тафамидис применяли в дозах 20 и 80 мг/сут. Выбор последней дозы определялся тем, что в предыдущих исследованиях она обеспечивала практически полную стабилизацию транстиретина [23]. Тем не менее, дизайн исследования не предполагал прямое сравнение эффективности двух доз тафамидиса, а при проведении первичного анализа всех больных, получавших активный препарат, объединяли в одну группу. После завершения двойного слепого исследования пациенты могли продолжить лечение в течение еще 60 мес в рамках открытого исследования. При этом больные основных групп продолжали прием тафамидиса в прежних дозах, а пациентов группы плацебо повторно рандомизировали (2:1) и проводили лечение тафамидисом в дозах 80 или 20 мг/сут. В июле 2018 г. в соответствии с поправкой к протоколу открытого исследования все пациенты были переведены с тафамидиса меглумина в дозах 20 и 80 мг/сут на свободный тафамидис в дозе 61 мг/сут (одна капсула в день). Указанная доза свободного тафамидиса биоэквивалентна 4 капсулам тафамидиса меглумина 20 мг [24].
T. Damy и соавт. сопоставили эффективность двух доз тафамидиса (20 и 80 мг/сут) на основании результатов двойного слепого и открытого исследований [25]. Средняя длительность наблюдения составила 51 мес. При этом 230 больных получали тафамидис 80 мг/свободный тафамидис 61 мг, а 116 пациентов – тафамидис 20 мг/свободный тафамидис 61 мг. В двойном слепом исследовании ATTR-ACT лечение тафамидисом в дозах как 80 мг/сут, так и 20 мг/сут вызывало достоверное снижение смертности от любых причин и частоты госпитализации по поводу сердечно-сосудистых заболеваний, а также замедяло ухудшение толерантности к физической нагрузке и качества жизни больных. При лечении тафамидисом в дозе 80 мг/сут была выявлена тенденция к снижению риска смерти от любых причин по сравнению с таковым в группе тафамидиса в дозе 20 мг/сут (рис. 4). Эта тенденция была более выраженной при внесении поправки на некоторы кофакторы, однако различия не достигли статистической значимости. По влиянию на толерантность к физической нагрузке и качество жизни две дозы тафамидиса существенно не отличались, в то время как содержание NT-proBNP при лечении препаратом в дозе 80 мг/сут через 30 мес увеличилось в меньшей степени, чем при приеме дозы 20 мг/сут (р=0,0468).
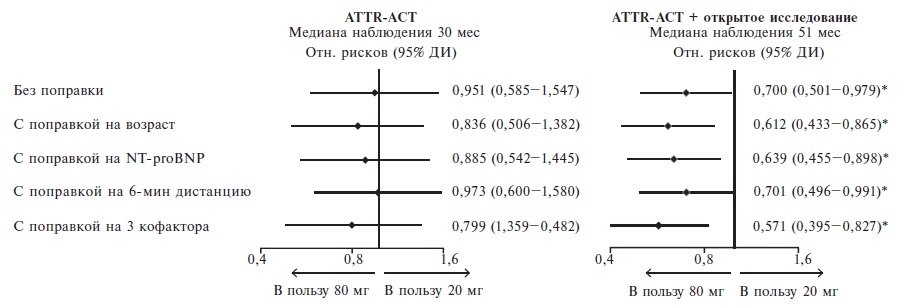
При более длительном лечении (медиана 51 мес) риск смерти от любых причин в группе тафамидиса 80 мг/сут достоверно снизился на 30% (р=0,0374) по сравнению с группой тафамидиса 20 мг. Преимущество более высокой дозы препарата по влиянию на выживаемость больных ATTR-амилоидозом сердца оставалось достоверным после внесения поправки на возраст (снижение риска на 39%), исходное содержание NT-proBNP (на 36%), пройденную за 6 минут дистанцию (на 30%) и все три кофактора (на 43%) (рис. 4).
Безопасность и переносимость тафамидиса
Переносимость тафамидиса в обеих дозах в исследовании ATTR-ACT была хорошей, а профиль безопасности препарата существенно не отличался от плацебо. Самым частым нежелательным явлением была диарея, частота которой составила 8,0% и 2,3% при лечении тафамидисом в дозах 80 и 20 мг/сут, соответственно, и 10,2% в группе плацебо. Только двум пациентам, принимавшим тафамидис в дозе 80 мг, потребовалось снижение дозы. При продолжении терапии в открытом исследовании профиль безопасности препарата существенно не изменился, а частота серьезных и тяжелых нежелательных явлений была сходной в группах больных, получавших тафамидис в дозах 20 и 80 мг/сут.
Заключение
Результаты наблюдения пациентов, включенных в исследование ATTR-ACT, подтвердили неблагоприятность прогноза у больных транстиретиновой амилоидной кардиомиопатией. При естественном течении заболевания на фоне приема плацебо от любых причин в течение 2,5 лет умерли 37% больных ненаследственным ATTR-амилоидозом и 63% больных наследственным ATTR-амилоидозом. Выживаемость была ниже всего у пациентов с более тяжелым поражением сердца, сопровождавшимся хронической сердечной недостаточностью III функционального класса по NYHA. В этой выборке смертность во время исследования достигла 55% и 79% у больных ненаследственным и наследственным ATTR-амилоидозом, соответственно. Во всей выборке лечение тафамидисом привело к достоверному снижению риска смерти от любых причин (на 30%) и риска госпитализаций по поводу сердечно-сосудистых заболеваний (на 32%). Эффективность препарата в профилактике смерти не зависела от типа ATTR-амилоидоза и была сходной у пациентов со старческим и наследственным ATTR-амилоидозом. Тафамидис стабилизирует четвертичную структуру транстиретина и предупреждает его диссоциацию на мономеры, обладающие высокой амилоидогенностью. Соответственно, целью терапии этим препаратом у больных ATTR-амилоидозом является профилактика прогрессирования амилоидной кардиомиопатии, а не обратное развитие амилоидоза сердца. В связи с этим эффективность лечения тафамидисом была ожидаемо выше у пациентов с менее тяжелым поражением миокарда, в частности у больных с I-II функциональным классом по NYHA риск смерти от любых причин при приеме препарата снизился более чем на 40%, а у пациентов с III функциональным классом – только на 12-21%. Эффек тив ность тафамидиса у пациентов с ATTR-амилоидозом сердца была подтверждена также при анализе динамики толерантности к физической нагрузке, показателя качества жизни, концентрации NT-proBNP и эхокардиографических параметров. Дизайн исследования ATTR-ACT не предполагал сравнение эффективности двух доз тафамидиса. Тем не менее, более надежная стабилизация транстиретина при применении тафамидиса в дозе 80 мг/сут, анализ динамики содержания NT-proBNP и сопоставимая безопасность двух доз препарата обосновывали выбор более высокой дозы для лечения ATTR-амилоидной кардиомиопатии. При более длительном лечении тафамидисом в дозе 80 мг/сут в открытом исследовании было выявлено достоверное снижение риска смерти от любых причин на 30% по сравнению с таковым при приеме дозы 20 мг/сут. Эти данные подтверждают, что оптимальная доза препарата у пациентов с ненаследственным и наследственным ATTR- амилоидозом сердца составляет 80 мг/сут. Для удобства приема была разработана альтернативная лекарственная форма – капсулы, содержащие тафамидис в виде свободной кислоты в дозе 61 мг. Исследование биоэквивалентности лекарственных форм – четырех капсул тафамидиса меглюмина по 20 мг и одной капсулы тафамидиса 61 мг – подтвердило их сходный фармакокинетический профиль в отношении значения площади под кривой зависимости “концентрация—время" и максимальной концентрации тафамидиса в плазме крови [24].
Используемые источники
- Лысенко (Козловская) Л.В., Рамеев В.В., Моисеев С.В. и др. Клинические рекомендации по диагностике и лечению системного амилоидоза. Клин фармакол тер 2020;29(1):13-24 [Lysenko (Kozlovskaya) LV, Rameev VV, Moiseev S, et al. Clinical guidelinesfor diagnosis and treatment of systemic amyloidosis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Therapy 2020;29(1):13-24 (In Russ.)].
- Sipe JD, Benson MD, Buxbaum JN, et al. Nomenclature 2014: Amyloid fibril proteins and clinical classification of the amyloidosis. Amyloid 2014;21:221–24.
- Моисеев С.В., Привалова Е.В., Рамеев В.В. и др. Гипертрофия левогожелудочка неясной этиологии. Клин фармакол тер 2019;28(2):77-83 [Moiseev SV, Privalova EV, Rameev VV, et al. Unexplained left ventricular hypertrophy. Klinicheskaya farmakologiya i terapiya = Clin PharmacolTher 2019;28(2):77-83 (In Russ.)].
- Wechalekar AD, Gillmore JD, Foard D, et al. 25 years of systemic amyloidosis. In: Hazenberg PB, ed. International amyloidosis symposium. Groningen: Netherlands, 2012.
- Tanskanen M, Peuralinna T, Polvikoski T, et al. Senile systemic amyloidosis affects 25% of the very aged and associates with genetic variation in alpha2-macroglobulin and tau: a population-based autopsy study. Ann Med 2008;40:232–39.
- Bennani Smires Y, Victor G, Ribes D, et al. Pilot study for left ventricular imaging phenotype of patients over 65 years old with heart failure and preserved ejection fraction: the high prevalence of amyloid cardiomyopathy. Int J Cardiovasc Imaging 2016;32:1403–13.
- Gonzаlez-Lopez E, Gallego-Delgado M, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J 2015;36:2585–94.
- Wechalekar AD, Gillmore JD, Hawkins PN. Systemic amyloidosis. Lancet 2016; 387(10038):2641-54.
- Sousa A, Coelho T, Barros J, Sequeiros J. Genetic epidemiology of familial loidotic polyneuropathy (FAP)-type I in Póvoa do Varzim and Vila do Conde (north of Portugal). Am J Med Genet 1995;60:512–21.
- Holmgren G, Costa PM, Andersson C, et al. Geographical distribution of TTR met30 carriers in northern Sweden: discrepancy between carrier frequency and prevalence rate. J Med Genet 1994;31:351–54.
- Jacobson DR, Alexander AA, Tagoe C, Buxbaum JN. Prevalence of the amyloidogenic transthyretin (TTR) V122I allele in 14,333 African-Americans. Amyloid 2015;22:171–4.
- Coelho T, Maurer MS, Suhr OB. THAOS The Transthyretin Amyloidosis Outcomes Survey: initial report on clinical manifestations in patients with hereditary and wild-type transthyretin amyloidosis. Curr Med Res Opin 2013;29(1):6376.
- Рамеев В.В., Мясников Р.П., Виноградов П.П. и др. Системный ATTR-амилоидоз, редкая форма поражения внутренних органов. Рациональная Фармакотерапия в Кардиологии. 2019;15(3):349-58 [Rameev VV, Myasnikov RP, Vinogradov PP, и др. Systemic ATTR-amyloidosis, a rare form of internal organ damage. Rational Pharmacotherapy in Cardiology 2019;15(3):349-58 (In Russ.)].
- Gillmore JD, Damy T, Fontana M, et al. A new staging system for cardiac transthyretin amyloidosis. Eur Heart J 2018;39(30):2799-806.
- Adams D, Suhr OB, Hund E, et al. First European consensus for diagnosis, management, and treatment of transthyretin familial amyloid polyneuropathy. Curr Opin Neurol. 2016;29(Suppl 1):S14–26.
- Lamb YN, Deeks ED. Tafamidis: A review in transthyretin amyloidosis with polyneuropathy. Drugs 2019;79:863–74.
- Coelho T, Maia LF, Martins da Silva A, et al. Tafamidis for transthyretin familial amyloid polyneuropathy: a randomized, controlled trial. Neurology 2012;79(8): 785–92.
- Maurer MS, Grogan DR, Judge DP, et al. Tafamidis in transthyretin amyloid cardiomyopathy: effects on transthyretin stabilization and clinical outcomes. Circ Heart Fail 2015;8:519-26.
- Rosenblum H, Castano A, Alvarez J, Goldsmith J, Helmke S, Maurer MS. TTR (transthyretin) stabilizers are associated with improved survival in patients with TTR cardiac amyloidosis. Circ Heart Fail 2018;11(4):e004769.
- Maurer MS, Elliott P, Merlini G, et al. Design and rationale of the phase 3 ATTR-ACT clinical trial (Tafamidis in Transthyretin Cardiomyopathy Clinical Trial). Circ Heart Fail 2017;10(6):e003815.
- Maurer MS, Schwartz JH, Gundapaneni B, et al. Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med 2018;379:1007-16.
- Rapezzi C, Elliott P, Damy T, et al. Efficacy of tafamidis in patients with hereditary and wild-type transthyretin amyloid cardiomyopathy. Further analyses from ATTR-ACT. JACC Heart Failure 2021;9(2):115-23.
- Coelho T, Merlini G, Bulawa CE, et al. Mechanism of action and clinical application of tafamidis in hereditary transthyretin amyloidosis. Neurol Ther 2016;5:1– 25.
- Lockwood PA, Le VH, O’Gorman MT. The bioequivalence of tafamidis 61-mg free acid capsules and tafamidis meglumine 4 × 20-mg capsules in healthy volunteers. Clin Pharmacol Drug Develop 2020;9(7):849–54.
- Damy T, Garcia-Pavia P, Hanna M, et al. Efficacy and safety of tafamidis doses in the Tafamidis in Transthyretin Cardiomyopathy Clinical Trial (ATTR-ACT) and long-term extension study. Europ J Heart Fail 2021;23:277–85.
