Клиническая роль ультразвуковой оценки венозного печеночного застоя (VExUS) у пациента с декомпенсацией хронической сердечной недостаточности и сердечно-печеночным синдромом
VExUS (оценка венозного застоя с помощью ультразвука) – протокол, разработанный для оценки тяжести венозного печеночного застоя с помощью ультразвукового исследования. В статье представлено описание клинического случая применения протокола VExUS в динамике в дополнение к традиционному физическому осмотру у пациентки с декомпенсацией хронической сердечной недостаточности и сердечно-печеночным синдромом.
Хроническая сердечная недостаточность (ХСН) – важная медицинская, социальная и экономическая проблема, что определяется ее высокой распространенностью, большими затратами, в том числе связанными с повторными госпитализациями, и неблагоприятным прогнозом [1]. Несмотря на современные достижения в области лечения этого состояния, наблюдается неуклонный рост распространенности ХСН [2]. Прогрессирование заболевания ведет к повреждению внутренних органов за счет их гипоперфузии и системного застоя, что позволяет рассматривать ХСН как полиорганную патологию [3]. ХСН может сопровождаться печеночной дисфункцией, которую в настоящее время обозначают термином "сердечно-печеночный синдром" (СПС) [4]. Длительное течение ХСН сопровождается прогрессирующим развитием фиброза печени с нарушением ее синтетической функции и ассоциируется с ухудшением прогноза [5]. Ретроспективный анализ клинических исследований показал, что СПС при декомпенсации ХСН наблюдается в среднем у 85,1% больных [6,7]. Основными механизмами развития СПС при декомпенсации ХСН считают снижение печеночного кровотока с развитием цитолиза при левожелудочковой недостаточности и повышение венозного внутрипеченочного давления при правожелудочковой недостаточности.
Точная оценка венозного застоя играет ключевую роль как в диагностике, так и в оценке эффективности терапии у пациентов с ХСН. Характерной особенностью СПС является нарастание венозного застоя, проявляющееся расширением печеночных и портальной вен и изменением формы кровотока, которые могут быть оценены при ультразвуковом исследовании. Одним из перспективных и информативных методов является комплексная последовательная ультразвуковая оценка венозного застоя по протоколу VExUS, позволяющая объективно оценить наличие и выраженность застоя с изучением порто-печеночных допплеровских волн в дополнение к измерению диаметра нижней полой вены [8].
В качестве иллюстрации использования комплексной ультразвуковой оценки венозного застоя на фоне стандартной терапии ХСН приводим наблюдение пациентки с декомпенсацией ХСН и СПС.
Пациентка 57 лет с избыточной массой тела, длительным анамнезом гипертонической болезни, постоянной формой фибрилляции предсердий и хронической железодефицитной анемией госпитализирована в январе 2021 г. в Центр сердечной недостаточности РУДН на базе ГКБ им. В.В. Виноградова ДЗ г. Москвы с жалобами на нарастающую слабость, одышку и отеки нижних конечностей. С 2018 г. у пациентки появились и начали нарастать симптомы ХСН.
При поступлении состояние средней тяжести. В сознании, положение активное, симметричные отеки голеней и стоп, набухание яремных вен в положении сидя. Окружность талии 126 см, индекс массы тела 46,6 кг/м2. При аускультации легких определялись жесткое дыхание, ослабленное в нижних отделах, влажные незвучные мелкопузырчатые хрипы. Частота дыхательных движений 26 в минуту. Сатурация кислорода на воздухе 95%. Живот увеличен за счет подкожно-жировой клетчатки, не вздут, безболезненный. При пальпации край печени выступает из-под края реберной дуги на 2 см, край печени ровный, мягкоэластичный. Тоны сердца приглушены, аритмичные, выслушивается акцент 2 тона на легочной артерии, шумы отсутствуют. АД 140/80 мм рт. ст., частота сердечных сокращений 140 в минуту, дефицит пульса отсутствует.
На ЭКГ – тахисистолическая форма фибрилляции предсердий. На рентгенограмме органов грудной клетки выявлены признаки застоя по малому кругу кровообращения. В общем анализе крови при поступлении отмечалась гипохромная микроцитарная анемия (Hb 110 г/л). В биохимическом анализе крови обращали на себя внимание гипопротеинемия (62,5 г/л), синдром цитолиза (АЛТ 250,6 Ед/л, АСТ 273,1 Ед/л), повышение уровней ЛДГ (270,67 Ед/л), креатинина (112 мкмоль/л) и NT-proBNP (1070 пг/мл).
При выполнении теста с 6-минутной ходьбой прошла 130 м, что соответствует ХСН IV функционального класса. При эхокардиографии выявлены снижение фракции выброса левого желудочка до 35%, расширение левых отделов сердца, умеренная митральная и трикуспидальная регургитация, незначительный гидроперикард.
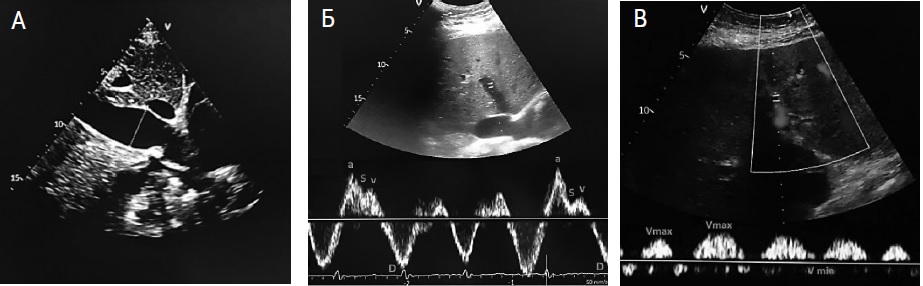
При ультразвуковом исследовании по протоколу VExUS наблюдались расширение нижней полой вены до 2,8 см с отсутствием коллабирования на вдохе (рис. 1А), расширение печеночных вен с обратным венозным кровотоком, реверсия систолического компонента (рис. 1Б) и пульсирующий кровоток в портальной вене, индекс пульсации – 65% (рис. 1В), что соответствовало выраженному венозному застою.
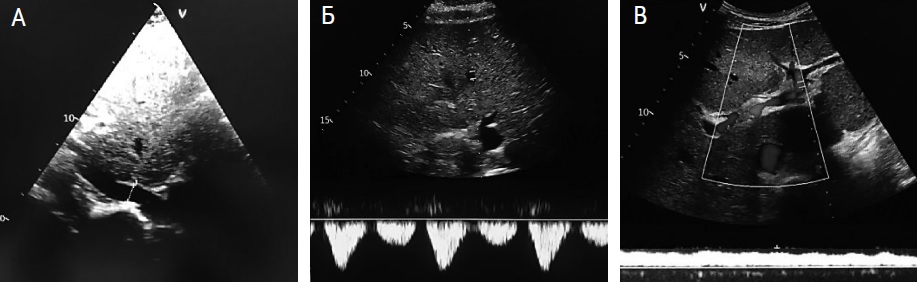
На фоне стандартной терапии у пациентки регрессировали симптомы ХСН: уменьшилась одышка, разрешились отеки, отмечался положительный диурез, увеличилась пройденная за 6 мин дистанция до 330 м. Через 6 дней проведено повторное ультразвуковое исследование по протоколу VExUS, который продемонстрировало разрешение венозного застоя – диаметр нижней полой вены составлял 1,9 см с коллабированием на вдохе более 50% (рис. 2А), отсутствовало расширение порто-печеночных вен (рис. 2Б,В). В анализах крови отмечено снижение активности печеночных ферментов, уровней креатинина и NT-proBNP.
Обсуждение
Ведущим в клинической картине был синдром ХСН со сниженной фракцией выброса левого желудочка в сочетании с лабораторными признаками синдрома цитолиза. Поражение сердце было обусловлено длительной артериальной гипертонией и фибрилляцией предсердий. При ультразвуковом исследовании по протоколу VExUS был выявлен выраженный порто-печеночный венозный застой, который разрешился на фоне стандартной терапии, что подтверждало связь печеночной дисфункции с декомпенсацией ХСН.
Некоторые авторы предлагают выделять 5 типов СПС [6]:
- 1-й тип (острый сердечно-печеночный синдром) – острое кардиогенное повреждение печени (гипоксический/ишемический гепатит, шоковая печень) при быстром ухудшении функции сердца (острая декомпенсированная сердечная недостаточность, тромбоэмболия легочной артерии, острый коронарный синдром).
- 2-й тип (хронический сердечно-печеночный синдром) – хроническое повреждение печени (кардиальный фиброз/цирроз печени, застойная гепатопатия) при ХСН.
- 3-й тип (острый печеночно-сердечный синдром) – острая сердечная недостаточность, развивающаяся при быстром ухудшении функции печени.
- 4-й тип (хронический печеночно-сердечный синдром) – цирротическая кардиопатия.
- 5-й тип (вторичный сердечно-печеночный синдром) – сочетанная дисфункция сердца и печени, вызванная острыми или хроническими системными заболеваниями.
Типичными лабораторными признаками СПС при декомпенсации ХСН является быстрое и выраженное (более чем 10-кратное) повышение активности аминотрансфераз и ЛДГ, как правило, спустя 1-3 дня после нарастания гемодинамических нарушений. Характерная черта кардиогенного поражения печени, отличающая его заболеваний печени другой этиологии, – отношение активности АЛТ/ЛДГ <1,5 на ранней стадии повреждения печени [9]. Учитывая клинико-лабораторные данные, у представленной пациентки развился СПС 2 типа.
Поскольку печень окружена капсулой, венозный застой приводит к увеличению ее плотности. Особенностью застойной гепатопатии является обратимость венозного полнокровия, а иногда и фиброза при условии адекватного лечения ХСН.
В настоящее время отсутствуют общепринятые методы объективной оценки венозного застоя у пациентов с СПС и декомпенсацией ХСН. Клинически декомпенсация ХСН проявляется нарастанием одышки при физической нагрузке, набуханием яремных вен, появлением отеков и асцита, увеличением размеров печени, однако указанные симптомы обычно возникают в поздней стадии ХСН. Для оценки венозного застоя измеряют центральное венозное давление с помощью центрального катетера и давление заклинивания легочных артерий с помощью катетеризации правых отделов сердца. Однако инвазивность данных методик и возможные серьезные осложнения исключают их рутинное применение в обычной клинической практике. В то же время ультразвуковое исследование по протоколу VexUS поз-воляет неинвазивно оценить венозный застой на основании диаметра нижней полой вены и изменения формы венозной волны в портальной и печеночных венах.
Протокол VExUS был разработан W. BeaubienSouligny и соавт. для пациентов, перенесших операции на сердце, у которых была продемонстрирована связь между выраженностью венозного застоя и развитием острого повреждения почек (ОПП) [8]. Результаты исследования V. Bhardwaj и соавт. подтвердили корреляцию допплеровской оценки порто-печеночных вен с развитием ОПП у пациентов с кардиоренальным синдромом: у 67% пациентов улучшение функции почек коррелировало с уменьшением венозного застоя [10].
Методика оценки выраженности венозного застоя по протоколу VExUS представлена на рис. 3. Первый шаг – измерение диаметра нижней полой вены, величина которого и изменения его во время дыхания отражают давление в правом предсердии. У пациентов с самостоятельным дыханием диаметр нижней полой вены менее 2,1 см и ее спадение более чем на 50% при вдохе за счет отрицательного внутригрудного давления указывают на нормальное давление в правом предсердии (3-5 мм рт. ст.) [11]. Хотя измерение диаметра нижней полой вены часто проводится в клинической практике, использование этого показателя для выявления застоя имеет многочисленные ограничения [12]. Нужно учитывать факторы, приводящие к ложному коллапсу, такие как высокое стояние диафрагмы, повышение внутрибрюшного давления (при напряженном асците) и внутригрудного давления [13]. Расширение нижней полой вены может отмечаться при тяжелой трикуспидальной регургитации, что приводит к ошибочной оценке выраженности застоя крови [14].
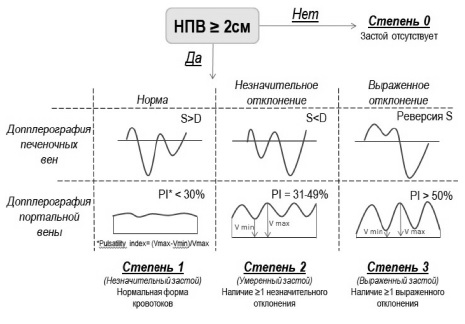
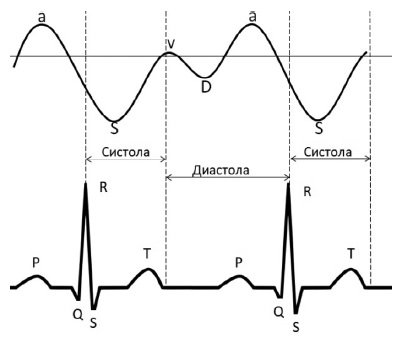
Если диаметр нижней полой вены составляет ≥2 см, необходимо перейти к следующему шагу – оценке формы венозного кровотока в печеночных и портальной венах. В норме венозный печеночный кровоток имеет сложную форму, которая характеризуется наличием нескольких пиков и волн, отражающих изменение давления в правом предсердии во все фазы сердечного цикла. Большая часть кровотока в печеночной вене идет к сердцу (антеградно) и состоит из волн S (систолической) и D (диастолической) – ниже базовой линии. В норме скорость S волны больше D волны. Ретроградный кровоток отображается пиками a и v, возникающими в результате сокращения предсердий в конце диастолы и раскрытия трикуспидального клапана в конце систолы и начале диастолы, соответственно (рис. 4). При выраженном печеночном застое форма венозного кровотока в печеночной вене может отклоняться от нормы в виде уменьшения систолической волны или полной ее реверсии [15]. В режиме цветового допплеровского картирования можно визуализировать движение тока крови из печеночных вен в нижнюю полую вену и обратно – симптом "to-and-from" ("тудаобратно") [16].
Портальная вена в норме отличается непрерывным гепатопетальным кровотоком (к печени). При повышении центрального венозного давления давление в правом предсердии может передаваться в портальную вену и сопровождаться пульсирующим потоком крови. Пульсацию портальной вены можно оценить по формуле индекса пульсации (PI) = ((Vmax-Vmin)/Vmax) 100%, который в норме должен быть менее 30%. При выраженном отклонении от нормы отмечается усиление пульсации портального кровотока, а индекс пульсации превышает 50%.
Заключение
Таким образом, комплексная ульразвуковая оценка венозного печеночного застоя по протоколу VExUS может дополнить традиционные инструментальные и клинические методы диагностики и оценить динамику повышенного венозного застоя у пациента с декомпенсацией ХСН и СПС на фоне диуретической терапии.
Используемые источники
- Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation 2014;129:e28- 292.
- Heidenreich PA, Albert NM, Allen LA, et al. Forecasting the impact of heart failure in the United States: a policy statement from the American Heart Association. Circulation Heart Failure 2013;6:606-19.
- Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология 2018;58(6S):8-158 [Mareev VYu, Fomin IV, Ageev FT, et al. Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment. Kardiologiia 2018;58(6S):8-158 (In Russ.)].
- Poelzl G, Auer J. Cardiohepatic syndrome. Curr Heart Failure Rep 2015;12(1):68–78.
- Nikolaou M, Parissis J, Yilmaz M, et al. Liver function abnormalities, clinicalprofile, and outcome in acute decompensated heart failure. Eur Heart J 2012;34(10):742-9.
- Кобалава Ж.Д., Виллевальде С.В., Соловьева А.Е. Сердечно-печеночный синдром при сердечной недостаточности: распространенность, патогенез, прогностическое значение. Кардиология 2016;56:63-71 [Kobalava ZD, Villevalde SV, Soloveva AE. Cardio-hepatic syndrome in heart failure: prevalence, pathogenesis and prognostic significance. Kardiologiia 2016;56:63-71 (In Russ.)].
- Виллевальде С.В., Кобалава Ж.Д., Соловьева А.Е., Моисеев В.С. Сочетание нарушений функции почек и печени при декомпенсации сердечной недостаточности. Терапевтический архив 2016;6:40-4 [Villevalde SV, Kobalava ZD, Soloveva AE, Moiseev VS. The concurrence of kidney and liver dysfunctions in decompensated heart failure. Terapevticheskii arkhiv 2016;6:40-4 (In Russ.)].
- Beaubien-Souligny W, Rola P, Haycock K, et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J 2020;12(1):16.
- Cassidy WM. Serum lactic dehydrogenase in the differential diagnosis of acute hepatocellular injury. J Clin Gastroenterol 1994;19:118–121.
- Bhardwaj V, Vikneswaran G, Rola P, et al. Combination of inferior vena cava diameter, hepatic venous flow, and portal vein pulsatility index: Venous Excess Ultrasound Score (VEXUS Score) in predicting acute kidney injury in patients with cardiorenal syndrome: A prospective cohort study. Indian J Crit Care Med 2020;24(9):783–9.
- Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the american society of echocardiography and the European association of cardiovascular imaging. J Am Soc Echocardiogr 2015;28:1-39 e14.
- Via G, Tavazzi G, Price S. Ten situations where inferior vena cava ultrasound may fail to accurately predict fluid responsiveness: a physiologically based point of view. Intensive Care Med 2016;42(7):1164–7.
- Vieillard-Baron A, Evrard B, Repesse X, et al. Limited value of end-expiratory inferior vena cava diameter to predict fluid responsiveness impact of intra- abdominal pressure. Intensive Care Med 2018;44(2):197–203.
- Scheinfeld MH, Bilali A, Koenigsberg M. Understanding the spectral Doppler waveform of the hepatic veins in health and disease. Radiographics 2009;29:2081–98.
- Moller S, Dumcke C, Krag A. The heart and the liver. Expert Rev. Gastroenterol Hepatol 2009;3(1):51–64.
- Federle MP, Jeffrey RB, Woodward PJ, et al. Diagnostic Imaging: Abdomen. Second edition. Lippincott Williams &Wilkins, 2009. 1288 p.
